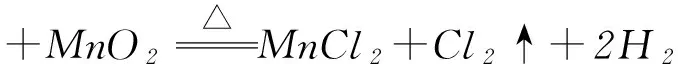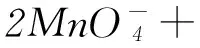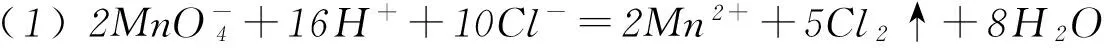饱和食盐水在高中化学中的应用
2017-01-03江苏刁晓娟
◇ 江苏 刁晓娟
饱和食盐水在高中化学中的应用
◇ 江苏 刁晓娟
氯化钠的饱和溶液俗称饱和食盐水,在实验室和工业生产中有着很广泛的作用.高中化学教材中主要提及了饱和食盐水以下4个方面的应用.
1 氯碱工业
工业上,采用电解饱和食盐水的方法来制备氯气和氢氧化钠溶液,如图1为氯碱工业生产示意.
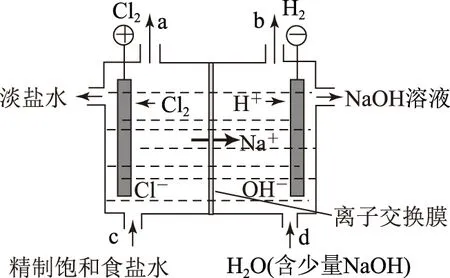
图1
阳极反应:2Cl--2e-=Cl2↑(氧化反应);
阴极反应:2H++2e-=H2↑ (还原反应);
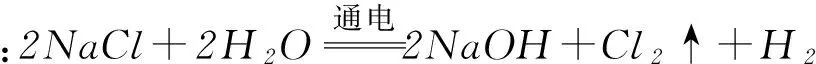
阳极产物:Cl2;
阴极产物: H2和NaOH.
例1将氯碱工业与燃料电池联合能够有效降低能源消耗,如图2是该工艺的图示(电源及电极未标出),请回答下列问题:
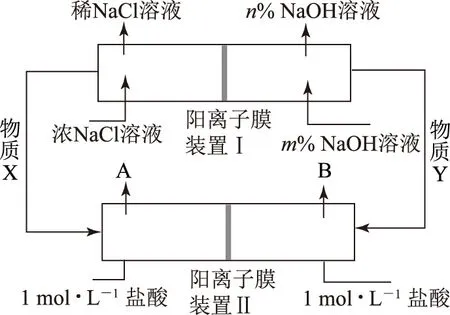
图2
(1) 电解饱和食盐水(氯碱工业)的化学方程式为________.
(2) 物质X为________,装置Ⅰ和Ⅱ中属于燃料电池的是________.
(3) 装置Ⅰ中,NaOH溶液体积分数m% ____n% (填“>”或“<”).
(4) 利用装置Ⅱ可获得10 mol·L-1盐酸,该产品出口为 ____(填“A”或“B”),请说明理由____.
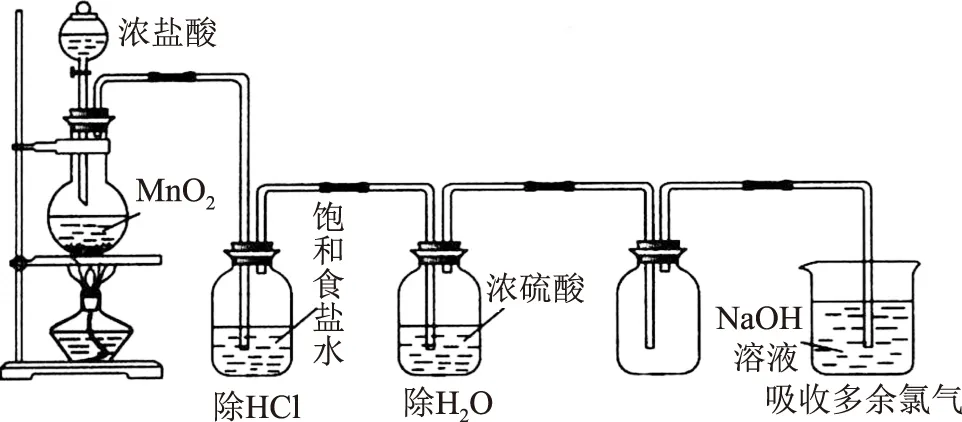
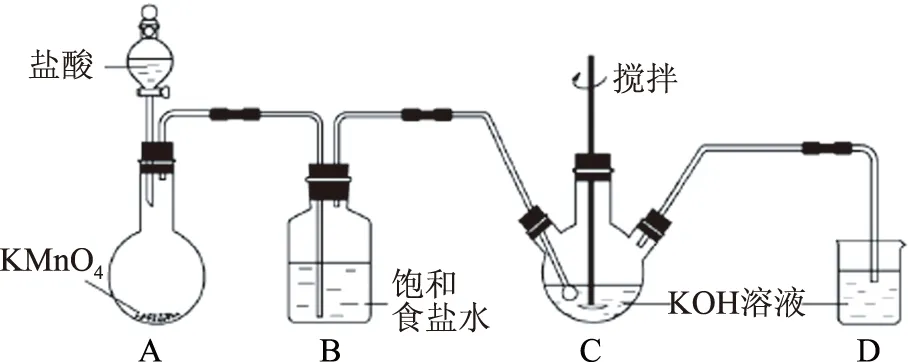
解析(2) 装置Ⅰ为电解食盐水,装置Ⅱ为燃料电池,可知装置Ⅰ左侧为阳极,右侧为阴极,X为氯气,物质Y为氢气.(3) 装置Ⅰ右侧是水放电生成氢气与氢氧化钠,电解过程中氢氧化钠溶液体积分数增大,即NaOH溶液体积分数m% 侯德榜制碱法又称联合制碱法,用于在工业上制取纯碱(Na2CO3),由侯德榜于1943年发明,是世界上广泛采用的制纯碱法. 操作步骤: 第1步,向饱和NaCl溶液中先通入过量的NH3,使食盐水呈碱性,再向其中通入过量的CO2,以制得高浓度的NaHCO3,便于NaHCO3晶体的析出.第2步,过滤,加热所得晶体. 反应原理: NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl; 例2根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO34个步骤,下列图示装置和原理能达到实验目的的是( ). 解析NH4Cl不稳定,加热易分解,温度稍低又可生成NH4Cl,因此制备氨气,应用NH4Cl和Ca(OH)2为反应物,选项A错误. 制取NaHCO3应将CO2从长导管进入,否则会将液体排出,选项B错误.从溶液中分离NaHCO3固体,可用过滤的方法,选项C正确.NaHCO3不稳定,不能直接加热干燥,可烘干,选项D错误.答案为C. 反应原理:电石与水反应 CaC2+2H2O=C2H2↑+Ca(OH)2. 该反应非常剧烈,很难控制反应速率,为了减缓电石与水的反应速率,得到平稳的乙炔气流,用饱和食盐水代替水来制备.这是因为乙炔与水反应时,饱和食盐水中有部分氯化钠会析出,覆盖在电石表面,使电石与水的接触减少,从而降低反应速率. 例3实验室用如图3装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空: 图3 (1) 实验室制乙炔反应的化学方程式是____;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用________来代替水. (2) 装置B中盛放有足量的NaOH溶液的作用是________,反应的离子方程式是________. (3) 装置C中观察到的现象是________,反应的方程式是________,该反应的类型是________. (4) 装置D中观察到的现象是________,该反应的类型是________. 解析(2) H2S气体具有还原性,能与Br2的CCl4溶液、酸性KMnO4溶液反应,装置B中NaOH溶液的作用是除去乙炔中的硫化氢,离子反应为H2S+2OH-=S2-+2H2O,以防干扰后续实验. (3) 乙炔气体通过溴的四氯化碳溶液,会发生加成反应,装置C中观察到的现象是溴的颜色(橙红色)逐渐褪去. (4) 乙炔通过高锰酸钾溶液,因为乙炔含有不饱和键,会被高锰酸钾溶液氧化成二氧化碳,因此装置D中观察到紫色逐渐褪去. 答案(1) CaC2+2H2O=Ca(OH)2+CH≡CH↑ (或C2H2);饱和食盐水. (2) 除去H2S,否则H2S也能与Br2的CCl4溶液、酸性KMnO4溶液反应; H2S+2OH-=S2-+2H2O. (3) 溴的颜色(橙红色)逐渐褪去; CH≡CH+Br2→ CHBr=CHBr, 或 CH≡CH+2Br2→ CHBr2CHBr2; 加成反应. (4) 紫色逐渐褪去;氧化反应. 制备原理: 图4为实验室制备Cl2装置图,发生装置中制得的Cl2不纯,会混有HCl气体和水蒸气,所以想要制得纯净的Cl2,必须先除去这2种杂质.为了防止混合气体通过溶液时引进水蒸气,所以要先除去HCl气体. 图4 由于HCl气体在水中的溶解度非常大,可以选择用水除去HCl气体.但是,Cl2会与H2O发生可逆反应,根据勒夏特列原理,增大溶液中Cl-浓度,可使平衡逆向移动,抑制Cl2与H2O的反应.因此,我们选择采用饱和食盐水除杂,从而达到除去HCl而保留Cl2的效果.同样,在图4中,我们也可以选择将收集装置中的排空气法改为排饱和食盐水的方法. 例4实验室用图5所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4. 图5 已知K2FeO4具有下列性质:①可溶于水、微溶于浓KOH溶液; ② 在0℃~-5℃、强碱性溶液中比较稳定; ③ 在Fe3+和Fe(OH)3催化作用下发生分解; ④ 在酸性至弱碱性条件下,能与水发生反应生成Fe(OH)3和O2. (1) 装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为________.将制备的Cl2通过装置B可除去________(填化学式). (2) Cl2和KOH在较高温度下反应生成KClO3.在不改变KOH溶液浓度和体积的条件下,控制反应在0~5℃进行,实验中可采取的措施是____. (3) 制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液的混合方式为________. (4) 提纯K2FeO4粗产品(含有Fe(OH)3、KCl等杂质)的实验方案为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,________(实验中须使用的试剂有饱和KOH溶液、乙醇;除常用仪器外须使用的仪器有砂芯漏斗、真空干燥箱). (2) 缓慢滴加盐酸、装置C加冰水浴. (3) 在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中. (4) 用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2或3次后,在真空干燥箱中干燥. 江苏省泰兴市第三高级中学)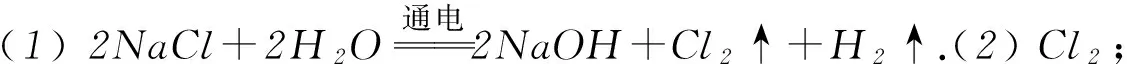
2 侯德榜制碱法
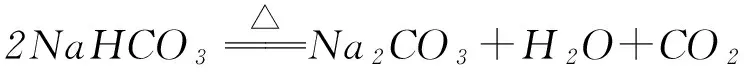
3 实验室制备乙炔气体
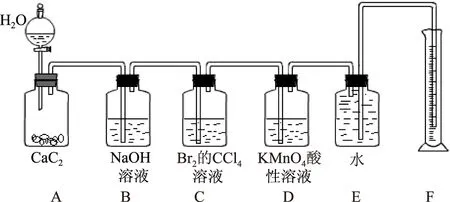
4 实验室制备氯气