贵州三叶木通遗传多样性及亲缘关系分析
2017-01-03马玉华仲伟敏
张 雪,马玉华,仲伟敏
(贵州省果树科学研究所, 贵阳 550006)
贵州三叶木通遗传多样性及亲缘关系分析
张 雪,马玉华*,仲伟敏
(贵州省果树科学研究所, 贵阳 550006)
为科学保存和利用贵州三叶木通资源,采用AFLP和ISSR分子标记技术对贵州省部分县(市)的31份三叶木通资源进行遗传多样性及亲缘关系分析。结果显示:(1)两种标记方法分别通过8对引物扩增出9 252条、11 643条DNA谱带,多态性条带分别为8 818、11 643,扩增多态率分别为95.31%和100%,说明供试种质资源遗传多样性较丰富。(2)AFLP和ISSR方法所得遗传相似系数区间分别为0.762 3~0.893 5和0.828 9~0.917 1,说明不同种质间存在一定的遗传差异。(3)聚类分析表明,在遗传相似系数0.85处,31份三叶木通种质资源分别被聚为5组(AFLP)和3组(ISSR),其中26号(7-4-中1)、27号(8-1-1)、28号(8-3-中)和30号(9-3-中1)4个资源及31号(9-4-1)和29号(9-2-S1)2个资源在两组分析方法中分别处于同一亚组内,说明其为亲缘关系较近的样本,且样本4号(2-2-N1)、8号(3-1-S1)和样本26号(7-4-中1)、27号(8-1-1)两两相似系数最大,可能是同一来源的种质。
三叶木通;遗传多样性;亲缘关系;AFLP;ISSR
三叶木通[Akebiatrifoliata( Thunb.) Koidz.]是木通科木通属一种营养价值较高的半落叶藤本野生果树[1],又称八月瓜、八月炸,是木通属植物中最具果用价值的一类,其果实、种子、茎藤及根系有上千年的应用历史[2-3]。中国野生三叶木通资源丰富,主要分布在河北、山西、山东、河南、陕西南部、甘肃东南部至长江流域各省区。贵州省自然条件优越,独特的立体气候孕育了丰富的植物种质资源,同时也是木通的重要产地之一[4]。据报道,该类野生果树资源在贵州共有4属9种、1新种、2新记录种、3变种[5],其分布面广、种类多且零星分散[6]。调查显示省内各地将该种野生果树通称为‘八月瓜’,但其实际为木通科中木通属和八月瓜属的多个种[7],这就造成了品种资源类型多,但资源本身命名不科学的问题,给资源保存和利用带来了诸多不便。至今,对于三叶木通的研究多数都集中在化学成分、药用价值、生物学特性、栽培技术和资源分布等方面,而对其分子水平上的遗传多样性研究及亲缘关系分析还鲜有报道。
分子标记是植物遗传多样性研究方法中的一种,是以多态性为基础的遗传标记,较形态标记和生化标记等具有不受组织类别、发育阶段、环境等因素影响的优点。扩增片段长度多态性(amplified fragment length polymorphism,AFLP)是Vos创立的一项检测DNA多态性的分子标记技术[8],具有多态性丰富、稳定性好、DNA用量少等优点。AFLP标记技术是一种能较全面展示种质资源遗传特征的分子学工具,非常适合用于构建遗传连锁图谱,对亲缘关系相近的材料进行遗传多样性研究[9]。ISSR(Inter-Simple Sequence Repeat)标记是基于简单序列而设计的寡核苷酸序列引物,是一种以PCR扩增为基础的分子标记技术,谱带丰富,可以检测到基因组中多个位点的差异。ISSR标记具有操作简单、可靠性、重复性高等特点,已成功应用于李[10-13]、桃[14]、杏[15-16]和樱桃[17]等核果类果树种质资源的鉴定分析。本研究以贵州省内三叶木通种质资源为试材,通过AFLP和ISSR分子标记技术分析31份野生资源的遗传多样性及亲缘关系,以期为贵州省三叶木通种质资源的科学保存和利用提供依据。
1 材料和方法
1.1 试验材料
试验材料取自贵州省园艺研究所种质资源圃,资源来源地包括贵州西部水城县、中部的瓮安县、北部的湄潭县和仁怀市以及东北部的沿河县(实际采收地点已属于重庆市的酉阳县境内)等地。每个供试样本选取树体中部不同方位的大小均匀、叶色一致的成熟健康叶片10片放入冰盒带回试验室,洗净、吸水纸吸干后置于-80℃冰箱中保存。样品名称根据资源圃中定植位置来命名(表1)。
1.2 试验方法
试验采用AFLP和ISSR两种标记方法进行分析,基因组提取参照陈大明等[18]的CTAB法并加以修改。
1.2.1 AFLP 1)试剂。限制性内切酶MseI和PstI(NEB 公司),T4连接酶(NEB 公司),Taq酶、dNTP、引物、B002-1marker、DGL2000 marker均购于北京鼎国昌盛生物技术有限责任公司。
2)酶切及连接体系总体积20 μL,其中DNA模板4 μL, PstI/MseI 2 μL,T4连接酶1 μL,adapter 1 μL,10×reaction buffer 2.5 μL,10 mmol/L ATP 2.5 μL,ddH2O补齐20 μL。
3)预扩增体系总体积为25 μL,PCR扩增程序:94 ℃预变性2 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸80 s,72 ℃后延伸5 mim,30个循环。
4)根据预扩增体系对于64对引物组合的初步筛选,从中选出条带相对丰富且稳定的引物组合8对,预扩增产物做1∶20稀释后作为选择扩增模板,体系总体积为25 μL;第一轮扩增参数:94 ℃变性30 S,65 ℃退火30 S,72 ℃延伸80 S,以后每轮循环温度递减0.7 ℃,扩增12轮;接着按下列参数扩增23轮,94℃变性30 s,55 ℃退火30 s,72 ℃延伸80 s,72 ℃后延伸5 min。

表1 样本序号及命名
1.2.2 ISSR 1)试剂。Taq酶(2 U/μL)、dNTP (10 mmol/L)、引物(10 mmol/L)、DNA marker均购于北京鼎国昌盛生物技术有限责任公司。
2)ISSR扩增反应总体积为25 μL,PCR扩增反应程序为:95 ℃预变性5 min,95 ℃变性30 s,50 ℃退火45 s,72 ℃延伸2 min,72 ℃后延伸10 min,扩增45个循环。
1.3 数据统计与分析
使用GENESCAN3.1软件对胶图进行数据提取,每2个碱基读1次数,AFLP分析方法marker片段范围为 70~500 bp,这样在70~500 bp之间一共读取216个数,ISSR分析方法marker片段范围为50~1 000 bp,这样在该区间一共读取475个数。AFLP和ISSR为显性标记,有带记为“1”,无带记为“0”,所用引物对31份样品的读带记录结果形成“1~0”矩阵。对扩增产物的总条带数和多态性条带数进行数据统计,计算多态性条带所占比例。
用GENESCAN3.1软件对胶图进行分析,通过Binthere软件提取样品的各片段大小,用Excel进行0,1数据转换,通过NTSYSpc-2.11F软件进行数据分析。对原始矩阵用SimQual程序求DICE相似系数矩阵,并获得相似系数矩阵。用 SHAN程序中的 UPGMA方法进行聚类分析,并通过 Tree plot模块生成聚类图。
2 结果与分析
2.1 多态性分析
通过体系优化分别筛选出扩增条带清晰、多态性及稳定性好的8对引物进行AFLP和ISSR扩增。结果(表2)表明,相同的引物数量进行不同方法的PCR扩增,其中AFLP扩增总条带数为9 252,多态性条带数为8 818条,平均多态率达95.31%;而ISSR扩增总条带数为11 643,多态性条带也为11 643,其多态性比例达到了100%。2种扩增方法获得的部分DNA图谱(图1)显示,引物A-1和807扩增条带数分别达到了1 304和1 572,多态性条带占到了98%和100%。从分析方法可知,ISSR较AFLP具有扩增条带丰富,多态性条带检出率高的特点。综合两种分析方法,供试材料的平均多态率达到了97.6%,说明供试的样品遗传多样性比较丰富。
2.2 遗传多样性分析
用NTSYSpc-2.11F软件进行数据分析,得到31个样本间的遗传距离和遗传相似系数。基于AFLP的DNA图谱,所得31个样本的遗传相似系数位于区间0.762 3~0.893 5之间,其中样本4和样本8的遗传相似系数值0.893 5最大,说明该两个样本之间亲缘关系最近;22号和29号样本的遗传相似系数值0.762 3为最小,说明这两个样本间亲缘关系最远;ISSR遗传距离和遗传相似系数分析显示,31个样本间的遗传距离范围在0.553 2~1.840 8之间,其中遗传距离最大来自9号和27号之间,遗传距离最小为26号和27号之间。31个样本的遗传相似系数区间为0.828 9~0.917 1之间,其中遗传相似系数值最小为0.828 9,来自样本30号和15号之间,最大值为0.917 1,来自样本26号和27号之间。遗传相似系数和遗传距离在一定程度上显示的亲缘关系是一致的,26号和27号之间遗传距离最近,遗传相似系数也最高。

A. AFLP(引物A-1); B. ISSR(引物807); 1~31. 样品;M. Marker.图1 两种标记方法的DNA图谱A . AFLP marker (primer A-1); B. ISSR (primer 807);1-31. Samples ; M . MarkerFig.1 The DNA maps of two markers
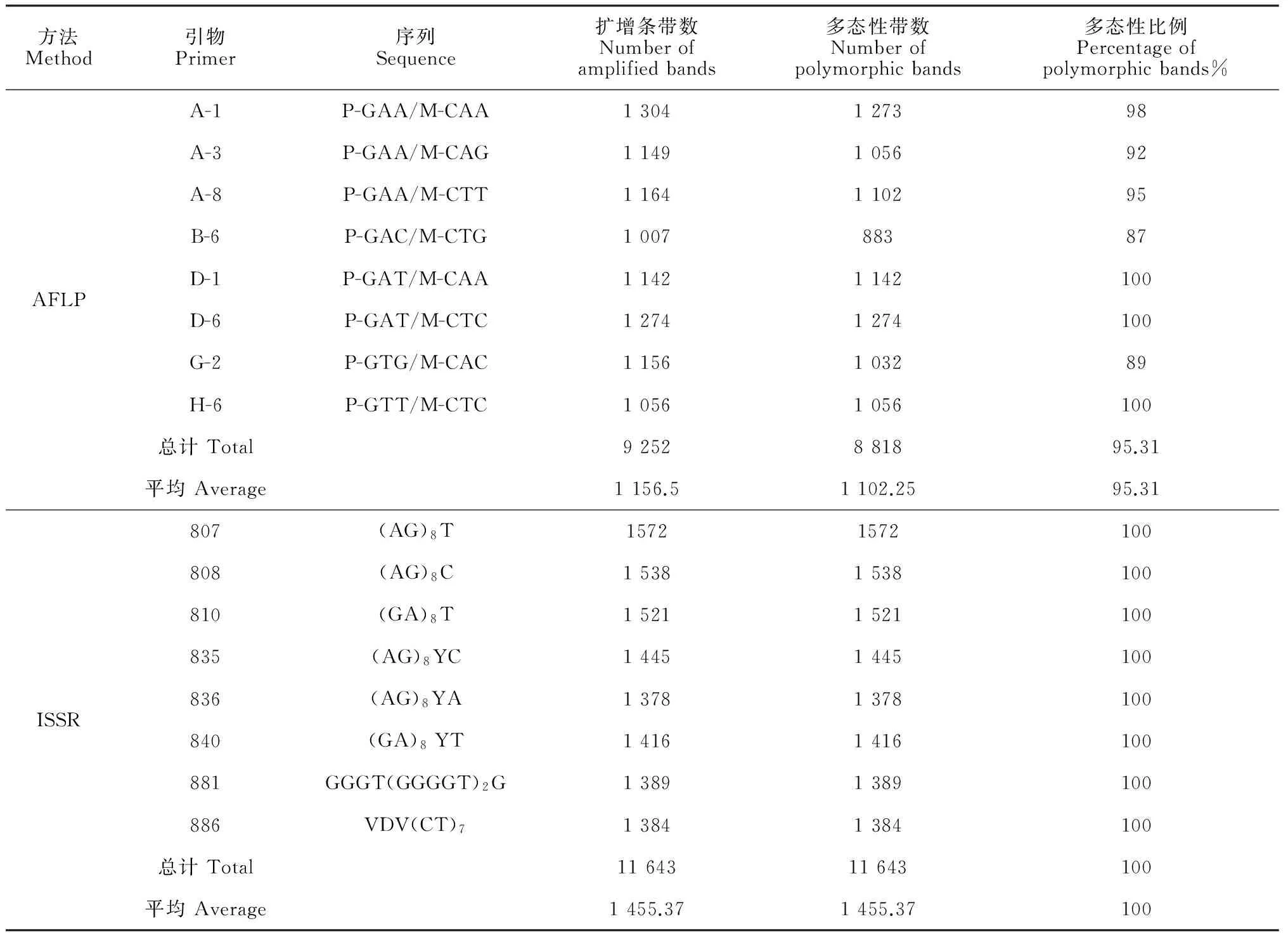
表2 AFLP和ISSR扩增结果统计
2.3 聚类分析
用NTSYSpc-2.11F软件进行数据分析,用 SHAN程序中的 UPGMA方法进行聚类分析,并通过 Tree plot模块生成聚类图。(图2,A)结果显示,当相似系数在0.85时,可将供试的三叶木通资源分为5个组:第1组包含22个资源,分别为1、2、3、4、5、6、7、8、9、11、12、13、14、15、16、17、18、19、20、23、24、25号;第2组包含21号和22号2个资源;第3组仅为10号1个资源;第4组包含26号、27号、28号和30号4个资源;第5组包含29号和31号2个资源。
ISSR分析所得31个资源的聚类图(图2,B)显示,当遗传相似系数为0.85时,供试资源分为3个组:第1组包含1号到25号;第2组26号、27号、28号和30号4个资源;第3组包含29号和31号2个资源。从以上结果可知,两组分析方法所得的分组数虽然不一致,但是26号、27号、28号和30号4个资源及29号和31号2个资源在两组分析方法中分别处于同一亚组内,说明26号(7-4-中1)、27号(8-1-1)、28号(8-3-中)和30号(9-3-中1)4个资源亲缘关系较近,29号(9-2-S1)和31号(9-4-1)2个资源亲缘关系较近。同时结果还表明,同一地区的资源大多能聚集在一起,体现一定的地域性,这种区域性聚集体现在两种分析方法的第1组资源中,来自于贵州省内的大部分资源聚为一组。
3 讨 论
本研究利用AFLP技术对三叶木通31个资源进行了标记分析,从研究结果来看,8对引物共获得多态性标记条带8 818条,多态性检出率为95.31%,较黄佩蓓等[19-20]研究中多态性比例90.65%稍高,说明本研究中AFLP的反应体系已达到最优,同时也说明了AFLP技术对于三叶木通种质资源遗传多样性的分析是适用的。由于AFLP技术包括了DNA提取、酶切、连接、预扩增、选择性扩增、染色、检测、识别等一系列步骤,涉及的技术操作面广且步骤较繁琐,所以同一资源不同的研究者所得到的结果也会有差异,这样就限制了AFLP的横向比较。为了提高数据的准确性,本试验同时选取了ISSR标记技术对三叶木通31个资源进行了遗传多样性分析,与 AFLP分析方法结果相互印证。从研究结果来看,ISSR标记筛选出的8对引物对31个资源的扩增多态率均为100%,说明供试资源遗传多样性较丰富。

图中样品编号同表1图2 31个资源的AFLP(A)和ISSR(B)聚类图The sample code with Table 1Fig.2 Clustering figure of AFLP(A) and ISSR(B) markers
试验分析中供试种质资源多为三叶木通,结合两种标记方法首先从遗传多样性参数分析来看,AFLP和ISSR遗传相似系数区间分别为0.762 3~0.893 5、0.828 9~0.917 1,说明不同的三叶木通种质存在一定的遗传差异;AFLP分析方法平均遗传相似系数为0.827 9,而ISSR分析方法的平均遗传相似系数为0.872 5,二者相近;聚类分析结果表明,当遗传相似系数为0.85时,两种分析方法分别被聚为5组和3组。虽然两种方法所得的分组数不一致,但是从分组的资源来看,26号(7-4-中1)、27号(8-1-1)、28号(8-3-中)和30号(9-3-中1)4个资源及29号(9-2-S1)和31号(9-4-1)2个资源在两组分析方法中分别处于同一亚组内,说明对于亲缘关系较近的资源来说两种分析方法的结果是一致的。同时,被聚为同一组的样本其形态性状具有相似性,如样本26、27、28和30号其叶片颜色均为深绿色,果皮颜色为紫红或浅紫红。这也表明通过两种标记方法所得的遗传相似系数及聚类分析结果与样本形态性状分类一致,从而验证了两种分析方法的数据可靠性。表明两种分析方法均能揭示三叶木通资源的遗传多样性,且两种分析方法的分析结果相近。
一般情况下,植物资源表型差异越大,可能存在的遗传变异越大,陈红等[21]对贵州李资源遗传多样性的研究表明,其聚类结果与形态性状不符合,具有不同性状的材料聚在一起,同时来自不同产地的种质没有明显的界限。本研究中,资源9号(3-3-S1)取自重庆酉阳县,该种质与贵州省内大部分种质资源聚为一类,这可能是因为三叶木通各种质资源在长期的自然选择和杂交育种过程中基因相互渗透,形成了丰富的遗传多样性所致[22-23],这还有待进一步的研究。而28号(8-3-中)和24号(6-3-S1)两个资源虽然同样来自水城县,但是该两个品种在两种分类方法中均不聚于同一组内,说明该两个资源没有明显的地域相关性,同时也表明该地区种质资源遗传多样性丰富。本研究中31份供试样本大致可分为3组,其中样本1号到25号为一组,样本26号(7-4-中1)、27号(8-1-1)、28号(8-3-中)和30号(9-3-中1)为一组,样本29号(9-2-S1)和样本31号(9-4-1)为一组;样本4号(2-2-N1)、8号(3-1-S1)和样本26号(7-4-中1)、27号(8-1-1)两两相似系数最大,可能是同一来源的种质。
[1] 万明长,刘学武,班小重,等.三叶木通栽培条件下果实性状及营养成分分析[J].贵州农业科学,2008,36(3): 121-122.
WAN M C,LIU X W,BAN X Z,etal. The fruit character and nutrition composition ofAkebiatrifoliata(Thunb.) Koidz under the cultivation condition [J].GuizhouAgriculturalSciences, 2008,36(3): 121-122.
[2] 中国医学科学院药物研究所.中药志(3卷)[M].北京:人民卫生出版社,1981:563.
[3] 《中国药物大全》编委会.中国药物大全·中药卷(2 版) [M].北京: 人民卫生出版社,1988:208-209.
[4] 马玉华,王 荔.三叶木通特性研究进展[J]. 江西农业学报,2011,23(5): 71-73.
MA Y H,WANG L.Research advances in characteristics ofAkebiatrifoliate[J].ActaAgriculturaeJiangxi, 2011,23(5): 71-73.
[5] 欧茂华.几种重要木通科野生果树资源及其利用评价[J].西南农业学报, 2004,17(3): 368-370.
OU M H.Wild fruit tree resources and their utilization evaluation of several important Lardizabalaceae[J].SouthwestChinaJournalofAgricultureSciences,2004,17(3): 71-73.
[6] 班小重,万明长,张朝君,等. 野生果树八月管的资源收集与利用评价[J].贵州农业科学,2008,36(4): 17-18.
BAN X C,WAN M C,ZHANG C J,etal.Resource collection of wild Lardizabalaceae and its utilization evaluation in Guizhou[J].GuizhouAgriculturalSciences, 2008,36(4): 17-18.
[7] 中国科学院植物研究所.中国高等植物图鉴(第1册)[M].北京:科学出版社,1998:756.
[8] VOS P, HOGERS R , BLEEKER M ,etal.AFLP: A new trchnique for DNA fingerprinting [J].Nucl.Acid.Res.,1995,23 (21): 4 407-4 414.
[9] 张金池,贺 娜,靳 蓉,等.不同地理漆树种源的遗传多样性AFLP分析[J].中国生漆.2016,35(2): 45-52.
ZHANG J C, HE N, JING R,etal.The genetic diversity of different geographic sumac provenance analysis by AFLP markers[J].JournalofChineseLacquer2016,35(2): 45-52.
[10] 王 进,何 桥,欧 毅.李种质资源ISSR鉴定及亲缘关系分析[J]. 果树学报,2008,25(2): 182-187.
WANG J,HE Q,OU Y,etal. Germplasm identification and phylogenetic analysis of plum using ISSR marker[J].JournalofFruitScience,2008,25(2): 182-187.
[11] 刘威生.李种质资源遗传多样性及主要种间亲缘关系的研究[D].北京: 中国农业大学,2005.
[12] 乔玉山.中国李RAPD、ISSR 和SSR 反应体系的建立及其品种资源遗传多样性分析[D].南京: 南京农业大学,2003.
[13] 冯晨静.李种质资源RAPD、SSR、ISSR亲缘关系鉴定及遗传多样性研究[D].石家庄: 河北农业大学,2005.
[14] 孙淑霞,李 靖,陈 栋,等. ISSR 分子标记技术在桃品种鉴定中的应用[J].中国农学通报,2011,27(4): 173-177.
SUN S X,LI J,CHEN D,etal. Molecular identification of peach germplasm by ISSR markers[J].ChineseAgriculturalScienceBulletin,2011,27(4): 173-177.
[15] 刘威生,冯晨静,杨建民,等.杏ISSR 反应体系的优化和指纹图谱的构建[J].果树学报,2005,22(6): 626-629.
LIU W S,FENG C J,YANG J M,etal.Optimization of ISSR reactionsystem and construction of cultivar fingerprint in apricot[J].JournalofFruitScience,2005,22(6): 626-629.
[16] LI M,ZHAO Z,MIAO X J. Genetic variability of wildapricot (PrunusarmeniacaL.)populations in the Ili Valley as revealedby ISSR markers[J].GenetResour.CropEvol.,2013. DOI: 10.1007/s10722-013-9996-x.
[17] 宋常美,文晓鹏,杨尔泰.贵州樱桃种质资源的ISSR分析[J].园艺学报,2011,38(8): 1 531-1 538.
SONG C M,WEN X P,YANG E T.Cherrygermplasm from Guizhou Province analyzed by ISSR markers[J].ActaHorticulturaeSinica,2011,38(8): 1 531-1 538.
[18] 陈大明,张上隆,金勇丰. 一种木本果树基因组DNA提取方法研究[J]. 浙江农业大学学报,1997,23(6): 621-624.
CHEN D M, ZHANG S L, JIN Y F. An extraction method of genomic DNA research in woody fruit tree[J].JournalofZhejiangAgriculturalUniversity, 1997,23(6): 621-624.
[19] 黄佩蓓,陈世华,曹 岚,等.三叶木通AFLP指纹图谱分析[J].时针国医国药,2014,25(4): 871-873.
HUANG P B, CHEN S H, CAO L,etal.AFLP fingerprinting analysis ofAkebiatrifoliate[J].LiShiZhenMedicineMateriaMedicaResearch, 2014,25(4): 871-873.
[20] 黄佩蓓,陈世华,王飞.3种木通属植物的AFLP研究[J].中药材,2013,36(8): 1 249-1 252.
HUANG P B, CHEN S H, WANG F. AFLP analysis of three species fromAkebiagenus[J].JournalofChineseMedicinalMaterials, 2013,36(8): 1 249-1 252.
[21] 陈 红,杨迤然. 贵州李资源遗传多样性及亲缘关系的ISSR分析[J].果树学报,2014,31(2): 175-180.
CHEN H, YANG Y R.Genetic diversity and relationship of plum resources in Guizhou analysed by ISSR markers[J].JournalofFruitScience, 2014,31(2): 175-180.
[22] 王富荣.桃野生种质资源亲缘关系的AFLP分析[D].南京:南京农业大学,2006.
[23] 张淑青,刘冬成,刘威生,等.普通杏品种SSR遗传多样性分析[J].园艺学报,2010,37(1): 23-30.
ZHANG S Q,LIU D C,LIU W S,etal. Analysis of Genetic Diversities in apricot cultivars (PrunusarmeniacaL.) with Simple Sequence Repeat(SSR)Markers[J].ActaHorticulturaeSinica2010,37(1): 23-30.
(编辑:宋亚珍)
Analysis of Genetic Relationship and Genetic Diversity ofAkebiatrifoliatain Guizhou
ZHANG Xue, MA Yuhua*, ZHONG Weimin
(Guizhou Fruit Institute,Guiyang 550006,China)
For conservation and utilization ofAkebiatrifoliataresources scientifically in Guizhou, we chose two kinds of method called AFLP and ISSR markers to analysis the genetic relationship and genetic diversity aboutA.trifoliatawith total of 31samples. They came from part of the county or city in Guizhou Province. The results showed that: (1) with 8 pairs of primer we gained 9 252 and 11 643 amplification DNA bands, respectively,The polymorphism rates are 95.31% and 100%, respectively, meaning that the germplasm diversity is abundant in tested samples. (2) For AFLP and ISSR, the ranges of similarity coefficient are between 0.762 3 to 0.893 5 and 0.828 9 to 0.917 1 respectively, showing that the resources ofA.trifoliatahas a certain genetic differences between different species in Guizhou. (3) Clustering analysis told us, in the similarity coefficient of 0.85, 31A.trifoliataresources were divided into 5 groups and 3 group, among them the No. 26, No.27, No.28, No.30 samples belong to the same group, as well as No.29 and No.31.Especially No.4, No.8 and No.26, No.27 may be the same source of germplasm,because they got the largest similarity coefficient in each other.
Akebiatrifoliata;genetic diversity;genetic relationship;AFLP;ISSR
1000-4025(2016)11-2192-06
10.7606/j.issn.1000-4025.2016.11.2192
2016-09-08;修改稿收到日期:2016-11-10
贵州省优秀科技教育人才省长专项 [黔省专合字(2012)10号].
张雪(1987-),女,硕士,助理研究员,主要从事果树生理及分子生物学研究。E-mail:zhangxuenl@126.com
*通信作者:马玉华,博士,副研究员,主要从事果树生理及生物技术研究。E-mail:m_yh79@163.com
Q346+.5;Q789
A
