内蒙古西伯利亚杏群体遗传多样性和遗传结构分析
2017-01-03包文泉乌云塔娜杜红岩
包文泉,乌云塔娜*,王 淋,赵 罕,杜红岩
(1 国家林业局泡桐研究开发中心,郑州450003;2 中国林业科学研究院经济林研究开发中心,郑州450003)
内蒙古西伯利亚杏群体遗传多样性和遗传结构分析
包文泉1,2,乌云塔娜1,2*,王 淋1,2,赵 罕1,2,杜红岩1,2
(1 国家林业局泡桐研究开发中心,郑州450003;2 中国林业科学研究院经济林研究开发中心,郑州450003)
利用27对SSR分子标记对内蒙古地区13个西伯利亚杏群体的遗传多样性和遗传结构进行分析,评价其遗传多样性水平和分化程度,为内蒙古西伯利亚杏资源的合理保护与利用提供理论依据。结果显示:(1)27对SSR引物共检测到512个等位基因(Na),各位点平均等位基因数(Na)和多态性信息含量(PIC)分别为19和0.84;物种水平上Shannon’s信息指数(I)和期望杂合度(He)分别为2.25和0.73。(2)群体水平上的等位基因(Na)、有效等位基因(Ne)、Shannon’s信息指数(I)、期望杂合度(He)和观察杂合度(Ho)分别为6.95、4.48、1.60、0.76和0.56;其中科左后旗群体遗传多样性最丰富,克什克腾旗群体遗传多样性最低。(3)基于F统计量分析的遗传分化系数(Fst)为0.12,基因流(Nm)为1.86;分子方差分析显示内蒙古西伯利亚杏群体大部分遗传变异来自群体内(92%),群体间的遗传变异仅占8%。(4)内蒙古西伯利亚杏群体遗传距离为0.04~0.67,遗传相似度为0.33~0.83;遗传相似度的聚类分析、遗传距离的主坐标分析和遗传结构分析(Structure)均将供试13个群体划分为4组。Mantel检测显示,内蒙古西伯利亚杏群体遗传距离与地理距离呈显著相关关系(r=0.453,P<0.01)。研究表明,内蒙古西伯利亚杏资源具有丰富的遗传多样性,这一特性与其群体的大小、悠久的演化历史以及自身生物学特性相关;内蒙古西伯利亚杏群体间存在中等程度的遗传分化,这可能源于自然地理隔离以及近期人类活动引起的生境片段化。
西伯利亚杏;SSR;遗传多样性;遗传结构
遗传多样性是物种鉴别、进化及合理保护利用的核心基础[1]。随着分子生物学技术的快速发展和不断完善,SSR(simple sequence repeat)分子标记已被普遍应用于群体遗传多样性和遗传结构研究中[2-3],它具有共显性、重复性好和遗传信息量大等特点,能够很好地满足遗传多样性和遗传结构等研究要求,是目前大家所用最多并且较为理想的分子标记[4]。
西伯利亚杏(ArmeniacasibiricaL.)又称山杏,属于蔷薇科(Rosaceae)杏属(Armeniaca),多年生落叶小乔木或灌木,自交不亲和,广泛分布于中国北方地区[5]。西伯利亚杏抗寒、抗旱能力极强,其核仁富含蛋白质、脂肪、糖以及微量苦杏仁苷,是食品、化妆品和制药工业等的重要原料[6],具有很高的开发利用前景。然而,目前西伯利亚杏遗传多样性研究多以中国东北、华北地区为研究对象[7-8],对其分布最为集中的内蒙古地区研究较少[9]。内蒙古位于中国北部边疆,地域辽阔,日照充足,土壤肥沃,其独特的自然地理环境为西伯利亚杏的分布演化提供了极有利的生态条件,孕育着丰富的西伯利亚杏资源,可为中国杏资源的改良及其新品种选育提供重要的遗传基础[10]。已有学者基于叶片、果实、果核和核仁等重要性状指标,分析内蒙古西伯利亚杏遗传变异特征[11]。但形态指标易受环境影响,因此,本研究利用27对SSR分子标记,对内蒙古地区野生西伯利亚杏13个群体的141份种质进行研究,揭示内蒙古西伯利亚杏遗传多样性及遗传结构,为西伯利亚杏种质资源的有效保存及合理利用提供理论依据。
1 材料和方法
1.1 材料来源
2013年6~7月期间对内蒙古地区野生西伯利亚杏进行野外调查,采集到13个群体,共141个个体(表1,图1),每个群体随机选择7~16个单株,相邻株间至少相距50 m左右,选取当年生无病虫害的新鲜嫩叶,采集后迅速放入液氮,置于-80 ℃保存。
1.2 SSR分析
采用改良CTAB法[12],提取基因组DNA,用1%琼脂糖凝胶电泳及分光光度计检测含量及纯度后,将浓度调至50 ng·μL-1,保存于-80 ℃度低温冷藏冰箱备用。
根据已报道的桃属植物SSR引物,筛选出多态性高、重复性好的27对用于本研究(表2);PCR扩增反应体系为20 μL混合体系,由1 μL DNA模板(10~20 ng·μL-1),0.2 μL 2×Tab Master Mix,2 μL 10×buffer,0.5 μL dNTP(2.5 mmol·L-1)、DMSO(10%)、荧光正向引物和反向引物(0.8 μmol·L-1),14.8 μL无菌去离子水(ddH2O);反应条件如下:95 ℃预变性5 min,30次循环的95 ℃变性30 s,55 ℃退火30 s和72 ℃延伸30 s,15次循环的95 ℃变性30 s,54 ℃退火30 s和72 ℃延伸30 s,72 ℃终延伸5 min。SSR扩增产物经由DNA分析仪(ABI 3500XL,Applied Biosystems,USA)进行检测,利用Gene-Marker软件(Soft Genetics LLC,USA)读取结果,并记录每个位点的片段大小。

表1 内蒙古13个野生西伯利亚杏群体地理位置及采样信息

图中字母代表居群编号,同表1,下图同图1 内蒙古地区13个西伯利亚杏群体的地理位置Letters in figure one are population codes are consistent with those in Table 1, the same as followsFig.1 Geographic distribution of the thirteen populations of Siberian apricot in Inner Mongolia
1.3 数据分析


表2 SSR引物信息
2 结果与分析
2.1 SSR位点遗传多样性
SSR位点遗传多样性检测(表3)可知,内蒙古西伯利亚杏具有丰富的遗传多样性;27个SSR位点共检测到512个等位基因(Na),各位点从12个(BPPCT023)到28个(BPPCT004和pchgms5),平均每位点为19个;Shannon’s 信息指数(I)在1.29~2.73之间,均值为2.25;期望杂合度(He)在0.31~0.85之间,平均为0.73;观察杂合度(Ho)在0.07~0.88之间,平均为0.56。供试27个SSR位点中,绝大数位点(24)近交系数(Fis)为正值,说明绝大数位点表现杂合子缺失。各位点多态信息含量指数(PIC)为0.53~0.92,平均为0.84;表明所选引物均为高度多态性引物(PIC>0.5),故较适于对供试材料进行遗传多样性等分析。
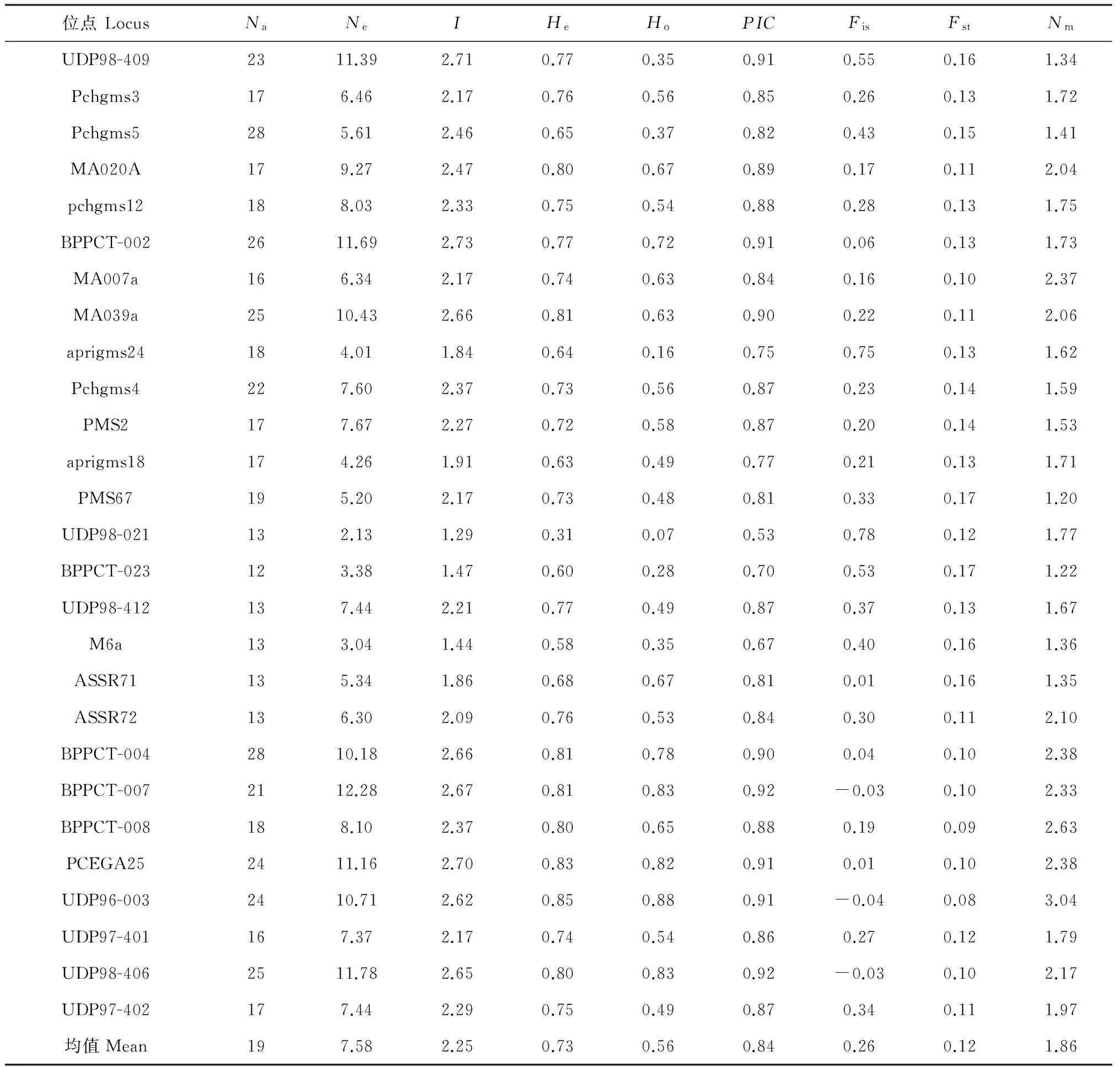
表3 27个SSR位点的遗传分析结果
注:Na. 等位基因;Ne. 有效等位基因;I. Shannon’s 信息指数;He. 期望杂合度;Ho. 观察杂合度;PIC. 多样性信息指数;Fis. 居群内近交系数;Fst. 遗传分化系数;Nm. 基因流
Notes:Na. Number of alleles;Ne. Effective number of alleles;I. Shannon’s information index;He. Expected heterozygosity;Ho. Observed heterozygosity;PIC. Polymorphism information content;Fis. Inbreeding coefficient at the population level;Fst. Proportion of differentiation among populations;Nm. Gene flow
2.2 群体遗传多样性和遗传分化
群体遗传多样性分析结果显示(表4),13个西伯利亚杏群体中的有效等位基因数(Ne)为3.17~5.22,平均为4.48。期望杂合度(He)和观察杂合度(Ho)分别在0.66~0.81和0.48~0.62之间,平均值分别为0.76和0.56。Shannons信息指数(I)在1.24~1.74范围内,平均值为1.60。由Ne、He、I可知,内蒙古西伯利亚杏群体遗传多样性水平较高,其中,科左后旗群体遗传多样性最高,扎鲁特旗次之,克什克腾旗群体遗传多样性最低。除万家沟(WJG)群体外,其余12个群体均有特有等位基因(2~8),其中克什克腾旗(KSK)和呼和浩特(HH)群体较特殊,两个群体遗传多样性最低,然而持有的特有等位基因却最多,分别为6和8。
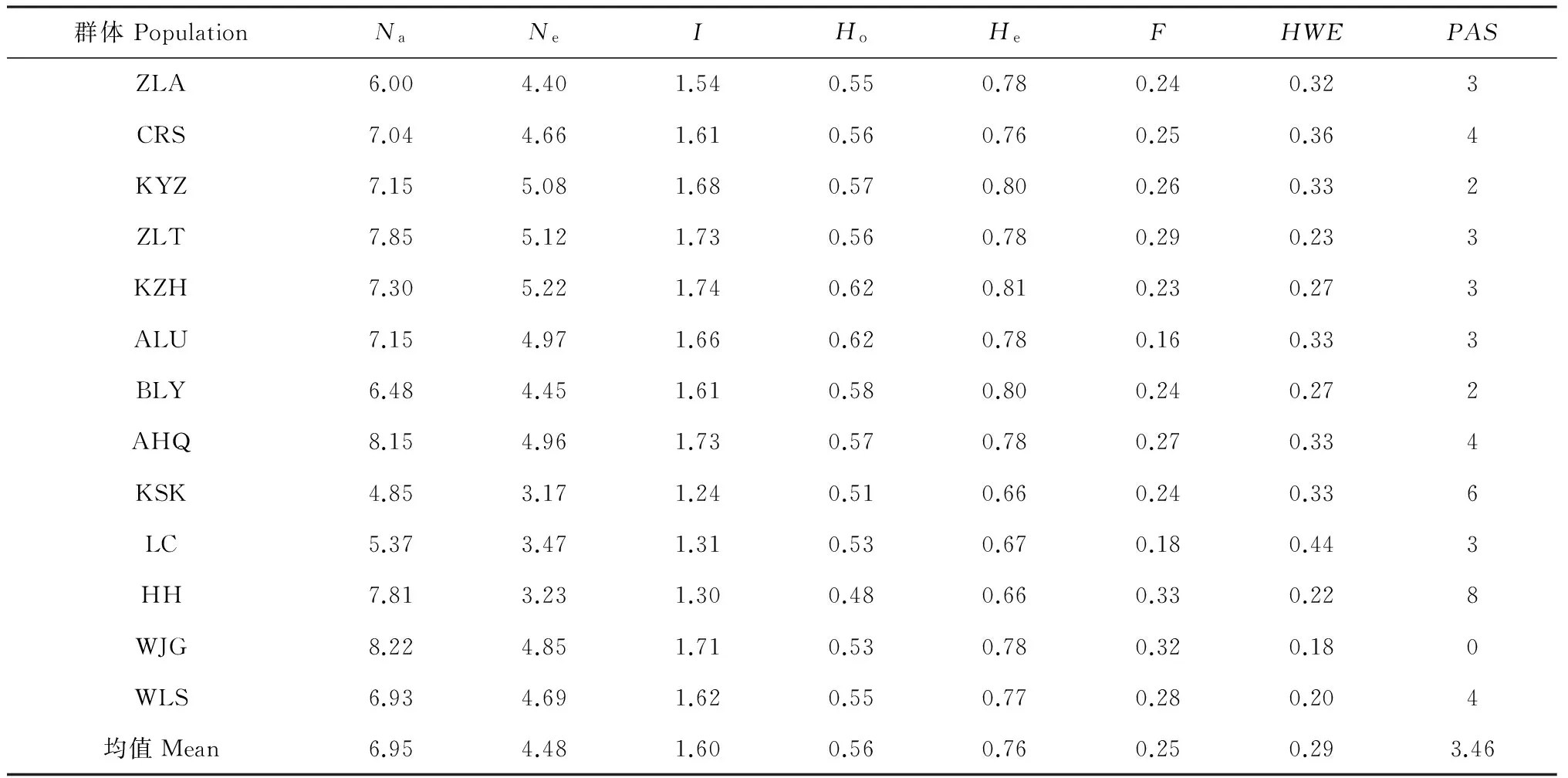
表4 内蒙古13个西伯利亚杏群体的遗传多样性
注:F. 近交系数;HWE. 哈代-温伯格平衡;PAS. 特有等位基因
Notes:F. Inbreeding coefficient;HWE. Hardy-Weinberg Equilibrium;PAS. Private alleles

表5 内蒙古西伯利亚杏群体的分子方差分析
F统计量结果显示,内蒙古西伯利亚杏在不同SSR位点遗传分化(Fst)存在差异(表3),遗传分化系数范围为0.08~0.17,均值为0.12,说明12%的遗传变异存在于群体间,绝大部分遗传变异存在于群体内部。AMOVA分析结果也显示(表5),内蒙古西伯利亚杏遗传变异主要存在于群体内(92%),群体间的遗传变异仅占8%。通过Hardy-Weinbery检测显示,内蒙古13个西伯利亚杏群体均处于平衡状态(表4)。近交系数是评价群体偏离哈迪-温伯格平衡的程度,通过对内蒙古西伯利亚杏近亲繁殖检测可知(表4),13个群体近交系数(F)均大于0(0.16~0.33),平均为0.25,表明内蒙古西伯利杏群体均表现杂合子不足,群体内部存在一定程度的近交。群体总基因流(Nm)为1.86,其中,扎鲁特旗与科左后旗群体间遗传分化最小(Fst=0.01),基因流最大(Nm=24.21);呼和浩特与克什克腾旗群体遗传分化最大(Fst=0.21),基因流最小(Nm=0.97)。表明内蒙古西伯利亚杏群体间存在中等程度的遗传分化,群体间可能通过杂交或基因渗透存在一定的基因交流。
2.3 群体遗传结构
根据Nei’s遗传距离和遗传相似度(表6)可知,内蒙古西伯利亚杏群体遗传距离为0.04~0.67,遗传相似度为0.33~0.83,其中科左后旗群体与呼和浩特群体遗传距离最大,遗传相似度最小;科左后旗与扎鲁特旗群体遗传距离最小,遗传相似度最大。遗传相似系数的UPGMA聚类分析(图2)和遗传距离的主坐标分析(PCoA)(图3),均将供试13个群体划分为4组,其中第Ⅰ组包括扎赉特旗(ZLA)、乌兰浩特察尔森(CRS)、敖汉旗(AHQ)、巴林右旗(BLY)、克什克腾旗(KSK)、万家沟(WJG)和凉城(LC)等7个群体;第Ⅱ组包括科右中旗(KYZ)、扎鲁特旗(ZLT)、阿鲁科尔沁旗(ALU)和科左后旗(KZH)等4个群体;第Ⅲ组包括呼和浩特群体(HH);第Ⅳ组包括乌拉山(WLS)群体。大部分地理位置较近的群体都划分至相同类组中,这与Mantel检测结果相吻合,即遗传距离与地理距离呈显著相关(r=0.453,P<0.01)。
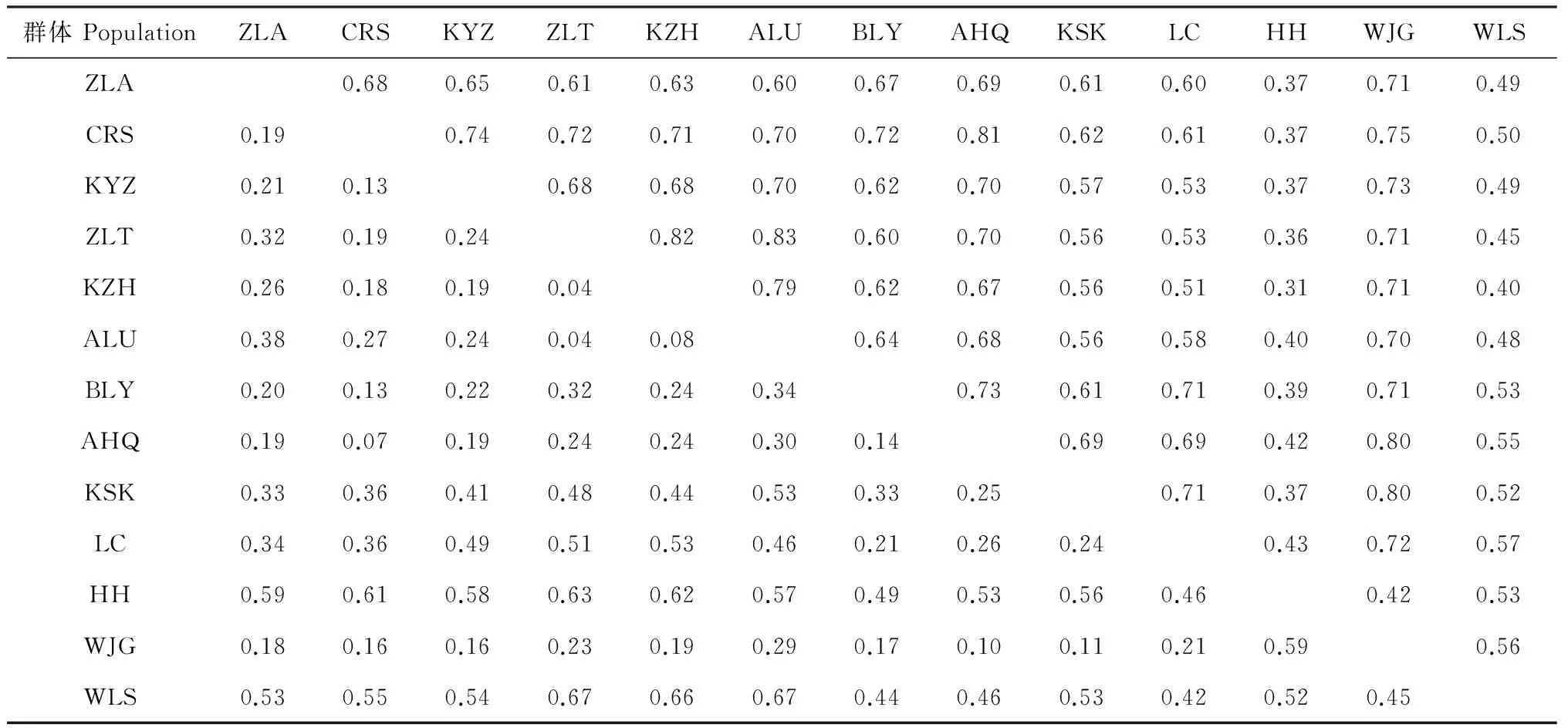
表6 群体间遗传相似度(对角线上方)和遗传距离(对角线下方)
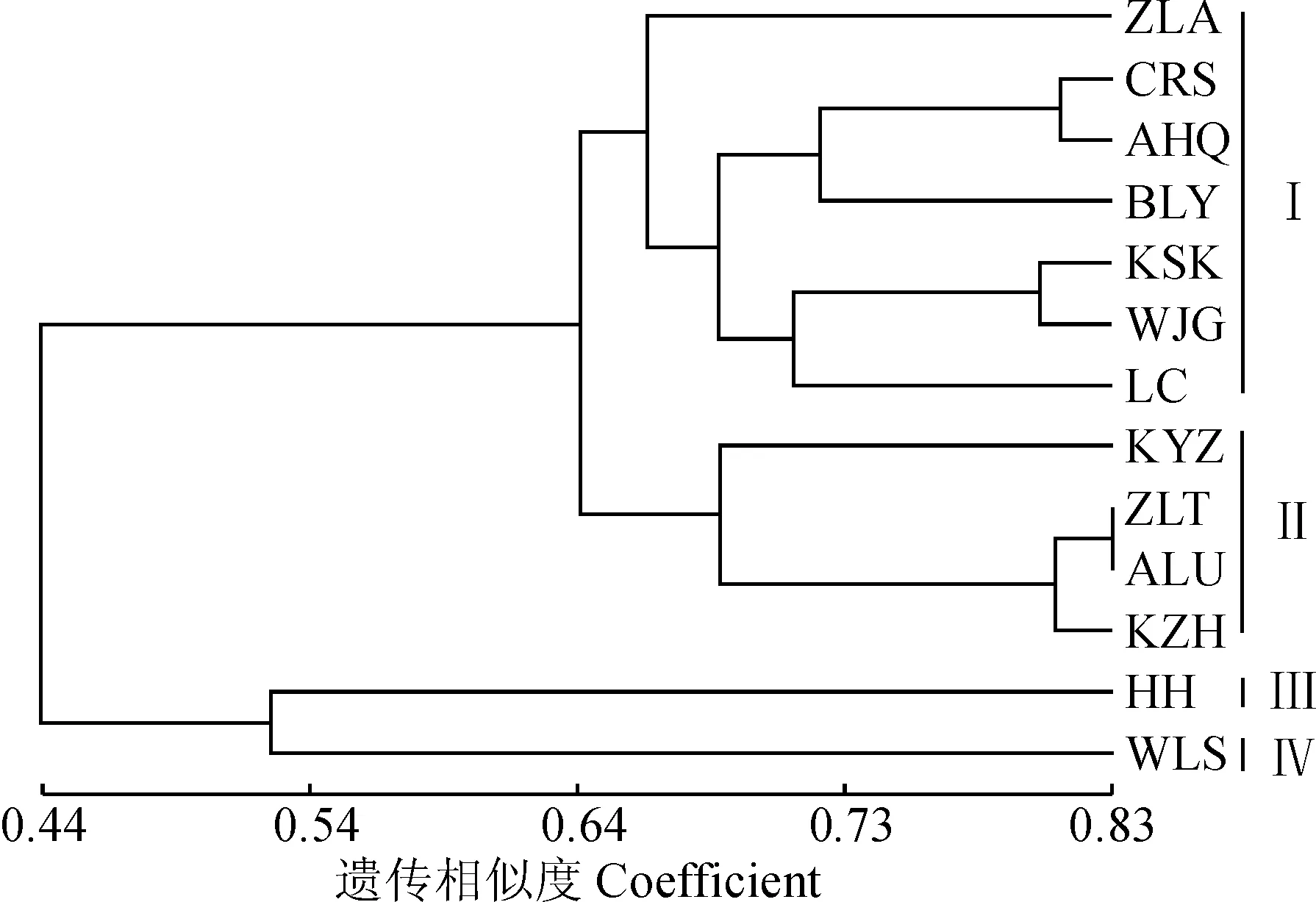
图2 遗传相似度的UPGMA聚类分析Fig.2 UPGMA dendrogram based on genetic identity
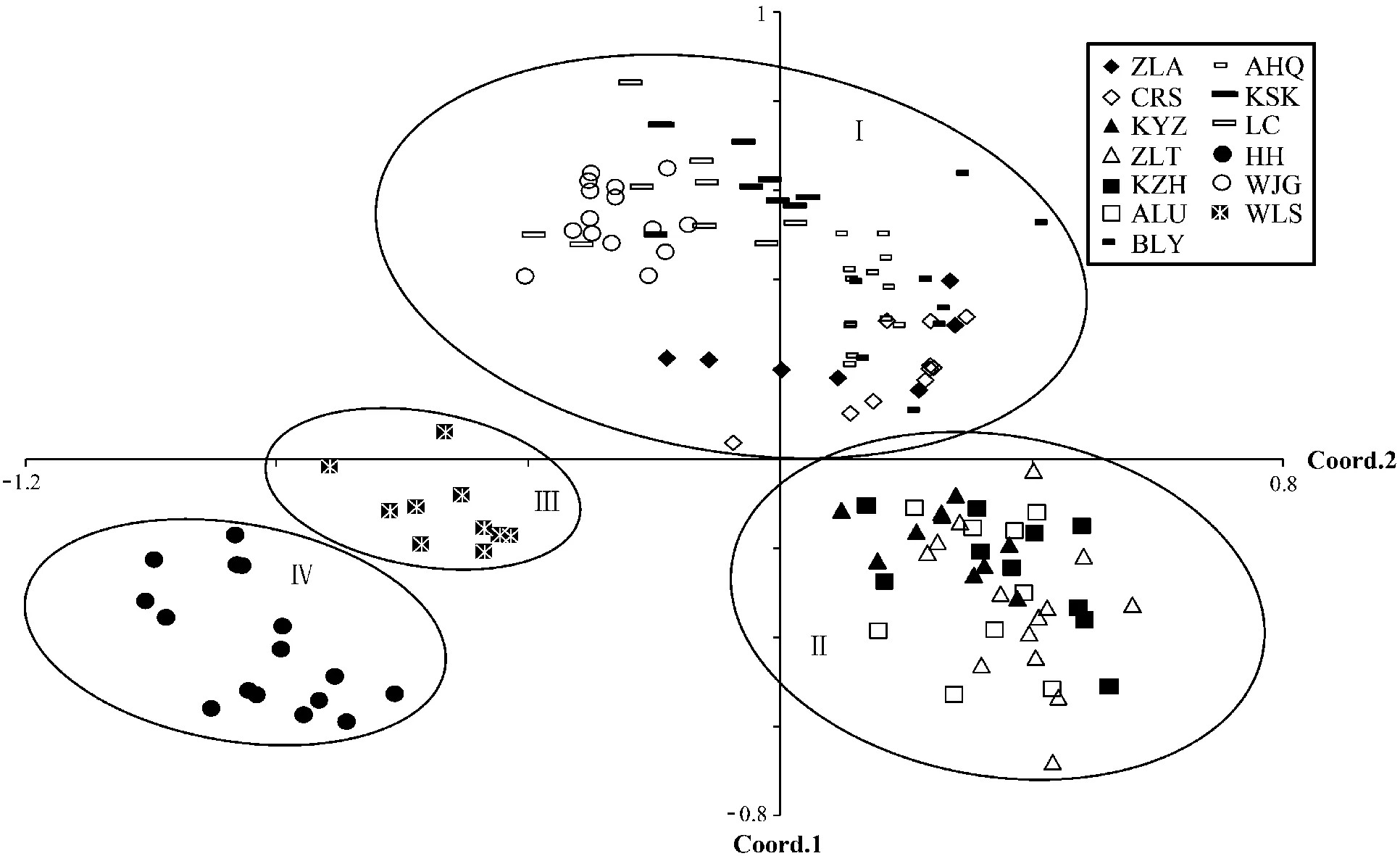
图3 遗传距离的主坐标分析Fig.3 Principal coordinates analysis based on genetic distance
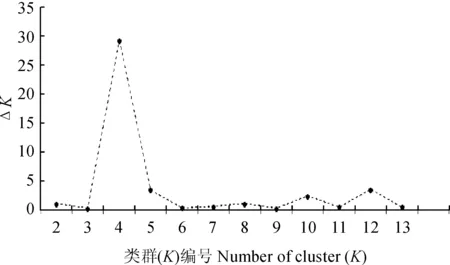
图4 利用 △K值推断参试材料的合理组群数划分Fig.4 Reasonable groups number of tested apricot germplasms infered by △K
为了进一步探讨内蒙古西伯利亚杏群体间的遗传关系,利用Structure软件进行群体遗传结构分析,结果表明,△K在K=4时具有明显的峰值(图4),因此,将内蒙古西伯利亚杏划分为4个类群(图5),划分结果与上述聚类分析和主坐标分析结果一致,第Ⅰ组包括ZLA、CRS、AHQ、BLY、KSK、WJG和LC等7个群体;第Ⅱ组包括KYZ、ZLT、ALU和KZH等4个群体;第Ⅲ组包括HH群体的9个单株;第Ⅳ组包括WLS群体的16个单株。对141份杏个体的Q值进行统计分析,其中有131个(占92.9%)单株遗传组分相对单一(Q>0.6),并被划分到相应的4个类群中。
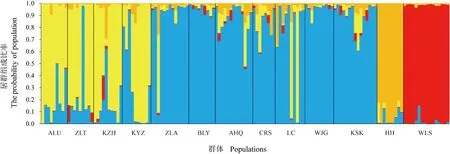
图中蓝、黄、橙和红色分别代表类群Ⅰ、Ⅱ、Ⅲ和Ⅳ;相同的颜色代表一个类群图5 基于 Structure 分析的内蒙古西伯利亚杏13个野生群体的遗传结构Blue, yellow, orange and red color in figure five represent groupⅠ,Ⅱ,Ⅲ and Ⅳ; The same color indicates the same groupFig.5 Genetic structural map of 13 wild populations of Siberian apricot in Inner Mongolia based on structure analysis
3 讨 论
3.1 群体遗传多样性
遗传多样性是物种进化的本质,遗传多样性高的物种,进化潜力大,可更好地适应环境;相反,则更容易受环境影响甚至可能灭绝[27]。本研究结果显示,内蒙古西伯利亚杏在物种水平上的遗传多样性(Ne=7.58,I=2.25,He=0.73,Ho=0.56),高于此前利用SSR分析新疆普通杏的遗传多样性[28](He=0.29,I=0.43)、华北生态区普通杏的遗传多样性[29](He=0.67,I=1.44)以及新疆野杏的遗传多样性[30](He=0.30,I=0.44),表明内蒙古西伯利亚杏具有丰富的遗传多样性,与包文泉等[11]及刘华波等[7]研究中国西伯利亚杏的结果相吻合;相比于其他野生资源,如新疆野生苹果(MaluspumilaMill.)[31](He=0.262,I=0.408)、中国野生核桃(JuglansregiaLinn.)[32](Ne=2.81、He=0.61)及四川野生樱桃(Padusbuergeriana)[33](He=0.695,I=1.526),内蒙古西伯利亚杏仍表现出较高的遗传多样性。究其原因,一方面可能研究的天然群体大小及生态类型不同所致,西伯利亚杏在内蒙古分布广泛,能够适应各种环境,群体面积较大。同时,作为多年生野生资源,长期的演化和扩散,使其累积了丰富的遗传变异。另一方面,西伯利亚杏自交不亲和、虫媒花等繁育特征与物种遗传多样性较高的特点相契合[34-35]。因此,居群面积大、悠久的演化历史以及自身生物学特征是内蒙古西伯利亚杏遗传多样性高的主要原因。
3.2 群体遗传分化和遗传结构
群体遗传分化系数(Fst)是反映群体遗传结构的重要指标[36],Wright[37]指出,Fst值在0~0.05时,群体间的遗传分化很小;Fst为0.05~0.15,群体间存在中等程度的遗传分化;Fst为0.15~0.25,群体间遗传分化较大;Fst大于0.25,群体间有很大的遗传分化。本研究F统计量(Fst=0.12)和AMOVA分析(Fst=0.08)结果显示,内蒙古西伯利亚杏群体间存在中等程度的遗传分化,此结果高于刘华波等[7]利用SSR标记分析燕山山脉西伯利亚杏群体遗传分化(Fst=0.044),相比于其他一些近缘种的豆梨(P.calleryana)[38](Fst=0.088)和秋子梨(P.ussuriensis)[39](Fst=0.072)等,内蒙古西伯利亚杏仍表现较高的遗传分化。造成这一结果的可能原因如下:首先,基因流(Nm)是影响群体遗传分化的重要因素,其强弱对群体遗传分化具有重要影响,Nm大于1时能有效阻止遗传漂变引起的遗传分化,反之,则难以抵制群体内遗传漂变引起的遗传分化[37]。内蒙古西伯利亚杏群体总基因流(Nm)为1.86,表明各个居群间存在一定的基因交流,但Nm强度相对而言不高,并且各群体个体间存在着近交(F>0),因此群体间的基因流程度也有限。一般情况下,自交不亲和植物,会拒绝自花授粉或近亲交配;但因地理隔离或生境片段化,花粉传播被限制,随机交配系统被打破,群体中会发生一定的近亲繁殖[7,39]。内蒙古横跨东北、华北、西北地区,境内高山众多,峡谷深切,地形地貌十分复杂,使得物种区域分布的山脉阻隔特点突出,对物种不同的居群具有天然的隔离作用。本研究中,聚类分析、主坐标分析和群体遗传结构分析结果显示,大部分群体均按地理分布优先聚为一类,这与Mantel检测结果一致,即内蒙古西伯利亚杏群体遗传距离与地理距离呈显著相关(r=0.453,P<0.01)。表明内蒙古西伯利亚杏群体间存在地理隔离效应,削弱了群体间的基因交流机会,引起了居群间遗传分化的加剧。其次,生境片断化是影响生态系统的组成、结构及物种遗传结构的重要因素[40];作者在野外调查研究中发现内蒙古地区西伯利亚杏生活环境差异很大,部分群体形成优势种(如WJG和AHQ群体),而部分群体则遭人为破坏或生境退化,使群体分布呈片段化(如WLS和ALU群体),后者必然会限制群体间和群体内部的基因流,引起遗传分化。因此,内蒙古西伯利亚杏在自然地理隔离、人类活动以及生境片段化等多重因素的共同作用下,表现出中等程度的遗传分化。
本研究利用27对SSR分子标记对内蒙古地区13个西伯利亚杏群体遗传多样性及遗传结构进行分析,结果显示,内蒙古西伯利亚杏具有丰富的遗传多样性,这与内蒙古西伯利亚杏居群面积大、悠久的演化历史以及自身生物学特征等相关。内蒙古西伯利亚杏遗传变异主要来自群体内部,然而,在自然地理隔离、人类活动以及生境片段化等因素的作用下,使其群体之间已呈现中等程度的遗传分化(Fst=0.12)。UPGMA聚类分析、主坐标分析和遗传结构分析均将13个群体划分为4大类,表明内蒙古西伯利亚杏可分为4个保护单元(Ⅰ、Ⅱ、Ⅲ和Ⅳ),因此,对4个保护单元中的少数地区遗传多样性高的群体进行优先就地保护,即可代表大部分地区的遗传变异,但每个群体应采集尽可能多的植株,以涵盖该物种的基因库,如Ⅰ组中的敖汉旗(AHQ),Ⅱ组中的科左后旗(KZH),Ⅲ组的呼和浩特(HH),Ⅳ租的乌拉山(WLS)。另外,乌拉山(WLS)和阿鲁科尔沁(ALU)群体受人为干扰较明显,这些群体在遗传保护中需要给予相应的重视;建议应限制人为活动对其破坏,尽可能地保持其原有的生境,让其自我恢复,恢复其连续分布状态;并在生境破碎区补植幼苗,加强抚育管理。同时也要迁地保护一些特异群体,避免一些特殊基因的消失,如克什克腾(KSK)和呼和浩特(HH)2个群体遗传多样性低却含有较多的特异等位基因,这些特有等位基因的出现可能是西伯利亚杏适应局部环境变化的结果,对维持群体遗传结构和遗传多样性的保持十分重要。并建议在其遗传多样性水平较高的地区建立西伯利亚杏种质资源库,收集各地区的西伯利亚杏个体、花粉等种质材料进行混合繁殖,促进不同居群之间的基因交流,最大限度地保护西伯利亚杏的遗传多样性,对培育或改良新杏品种具有重要意义。
[1] HEDRICK P W. Recent developments in conservation genetics[J].ForestEcologyandManagement, 2004,197(1): 3-19.
[2] CHEN X M, HE Z H, SHI J R,etal. Genetic diversity of high quality winter wheat varieties (lines) based on SSR markers[J].ActaAgronomicaSinica, 2003,29(1): 13-19.
[3] BERTINI C H C, Schuster I, Sediyama T,etal. Characterization and genetic diversity analysis of cotton cultivars using microsatellites[J].GeneticsandMolecularBiology, 2006,29(2): 321-329.
[4] 盛 岩, 郑蔚虹, 裴克全, 等. 微卫星标记在种群生物学研究中的应用[J]. 植物生态学报, 2002,26(增刊): 119-126.
SHENG Y, ZHENG W H, PEI K Q,etal. Applications of microsatellites in population biology[J].ActaPhytoecologicaSinica, 2002,26(Plus): 119-126.
[5] 俞德俊. 落叶果树分类学[M]. 上海: 上海科学技术出版社, 1984.
[6] 刘桂森, 张立彬, 王同坤. 野生山杏的生态、经济和社会效益[J]. 河北农业科技, 1990,7(1): 17-18.
LIU G S, ZHANG L B, WANG T K. The ecological, economic and social benefits of wildArmeniacasibirica[J].HebeiAgriculturalScienceandTechnology, 1990,7(1): 17-18.
[7] 刘华波, 王 哲, 刘 君, 等. 燕山山脉西伯利亚杏的遗传多样性和遗传结构[J]. 林业科学, 2012,48(8): 68-74.
LIU H B, WANG Z, LIU J,etal. Genetic diversity and genetic structure of siberian apricot populations in the Yan Mountains[J].ScientiaSilvaeSinicae, 2012,48(8): 68-74.
[8] 马丽娟, 郭太君, 何丹丹, 等. 东北地区西伯利亚杏2个自然居群遗传多样性[J]. 吉林农业大学学报, 2014,36(3): 300-305.
MA L J, GUO T J, HE D D,etal. Genetic diversity analysis of two naturalA.sibiricapopulations in northeast China[J].JournalofJilinAgriculturalUniversity, 2014,36(3): 300-305.
[9] 王利兵. 我国3种杏的地理分布及其植物学性状[J]. 林业科学研究, 2010,23(3): 435-439.
WANG L B. Geographic distrbution and botanical characters of 3Armeniacaplant in China[J].ForestResearch, 2010,23(3): 435-439.
[10] 王 磊. 新疆野苹果和新疆野杏[J]. 新疆农业科学, 1989,6(1): 33-34.
WANG L. Xinjiang wild apple and Xinjiang wild apricot[J].XinjiangAgriculturalSciences, 1989,6(1): 33-34.
[11] 包文泉. 内蒙古地区山杏重要性状遗传变异评价及优株选择[D]. 呼和浩特:内蒙古农业大学, 2013.
[12] 冯晨静, 张元慧, 徐秀英, 等. 14份杏种质的ISSR分析[J]. 河北农业大学学报, 2007,28(5): 52-62.
FENG C J, ZHANG Y H, XÜ X Y,etal. Genetic diversity revealed by ISSR marker in apricot[J].JournalofAgriculturalUniversityofHebei, 2007,28(5): 52-62.
[13] RAFFAELE TESTOLIN, TERESA MARRAZZO, GUIDO CIPRIANI,etal. Microsatellite DNA in peach (PrunuspersicaL. Batsch) and its use in fingerprinting and testing the genetic origin of cultivars[J].Genome, 2000,43(3): 512-520.
[14] DIRLEWANGER E, COSSON P, TAVAUD M,etal. Development of microsatellite markers in peach [Prunuspersica(L.) Batsch] and their use in genetic diversity analysis in peach and sweet cherry (PrunusaviumL.) [J].TheorApplGenet, 2002,105(6): 127-138.
[15] CLAUDIO CANTINI, AMY F. IEZZONI, WARREN F,etal. DNA fingerprinting of tetraploid cherry germplasm using simple sequence repeats[J].JASHSMarch, 2001,126(2): 205-209.
[16] YAMAMOTO T, MOCHIDA K, IMAI T,etal. Microsatellite markers in peach [Prunuspersica(L.) Batsch] derived from an enriched genomic and cDNA libraries[J].Mol.Ecol.Notes, 2002.2(6): 298-301.
[17] SOSINSKI B, GANNAVARAPU M, HAGER L D,etal. Characterization of microsatellite markers in peach [Prunuspersica(L.) Batsch][J].OriginalArticleTheoreticalandAppliedGenetics, 2000.101(3): 421-428.
[18] WANG,Y, GEORGI, L.L, REIGHARD, G.L,etal. Genetic mapping of the evergrowing gene in peach [Prunuspersica(L.) Batsch][J].J.Hered, 2002.93(5): 352-358.
[19] XU Y, MA R C, XIE H,etal. Development of SSR markers for the phylogenetic analysis of almond trees from China and the mediterranean region[J].Genome, 2004,47(6): 1 091-1 104.
[20] 樊文强, 盖红梅, 孙 鑫, 等. SSR数据格式转换软件DataFormater[J]. 分子植物育种, 2016,14(1): 265-270.
FAN W Q, GAI H M, SUN X,etal. DataFormater, a software for SSR data formatting to develop population genetics analysis[J].MolecularPlantBreeding, 2016,14(1): 265-270.
[21] YEH F C, YANG R C, BOYLE T. POPGENE version 1. 32 ed. Software microsoft window based freeware for population genetic analysis[D]. Edmonton, Alta: University of Alberta Press. 1997.
[22] SOKAL R. Testing statistical significance of geographic variation patterns[J].SystematicZoology, 1979, 28: 227-232.
[23] ROHLF F J. NTSYS-PC: Numerical taxonomy and multivariate analysis system version 1.80[M]. Setauket New York: Distribution by Exeter Soft Ware, 1994.
[24] PEAKALL R, SMOUSE P E. GENALEX 6: genetic analysis in excel population genetic software for teaching and research[J].MolecularEcologyNotes, 2006,6(1): 288-295.
[25] PRITCHARD J K, STEPHENS M, DONNELLY P. Inference of population structure using multilocus genotype data[J].Genetics, 2000,155(2): 945-959.
[26] EVANNO G, REGNAUT S,etal. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study[J].MolecularEcology, 2005,14(2): 2 611-2 620.
[27] 杨 梅, 张 敏, 师守国, 等. 武当木兰种群遗传结构的ISSR分析[J]. 林业科学, 2014,50(1): 76-81.
YANG M, ZHANG M, SHI S G,etal. Analysis of genetic structure ofMagnoliasprengeripopulations based on ISSR markers[J].ScientiaSilvaeSinicae, 2014,50(1): 76-81.
[28] 何天明. 中国普通杏(Prunusarmeniaca)种质资源遗传多样性及紫杏(P.dasycarpa)起源研究[D]. 山东泰安:山东农业大学,2005.
[29] 章秋平, 刘冬成, 等. 华北生态群普通杏遗传多样性与群体结构分析[J]. 中国农业科学, 2013,46(1): 89-98.
ZHANG Q P, LIU D C,etal. Genetic diversity and population structure of the north China populations of apricot (PrunusarmeniacaL.)[J].ScientiaAgriculturaSinica, 2013,46(1): 89-98.
[30] 刘 娟, 廖 康, 赵世荣, 等. 新疆野杏种质资源遗传多样性及亲缘关系的ISSR分析[J]. 新疆农业大学学报, 2015,38(2): 105-113.
LIU J, LIAO K, ZHAO S R,etal. Analysis of genetic diversity and genetic relationship of wild apricot germplasm in Xinjiang by ISSR markers[J].JournalofXinjiangAgriculturalUniversity, 2015,38(2): 105-113.
[31] 张春雨, 陈学森, 林 群, 等. 新疆野苹果居群遗传结构和遗传多样性的SRAP分析[J]. 园艺学报, 2009,36(1): 7-14.
ZHANG C Y, CHEN X S,etal. SRAP markers for population genetic structure and genetic diversity in Malus sieversii from Xinjiang, China[J].ActaHorticulturaeSinica, 2009,36(1):7-14.
[32] 王 滑, 郝俊民, 王宝庆, 等. 中国核桃8个天然居群遗传多样性分析[J]. 林业科学, 2007,43(7): 120-124.
WANG H, HAO J M, WANG B Q,etal. SSR analysis of genetic diversity of eight natural walnut populations in China[J].ScientiaSilvaeSinicae, 2007,43(7): 120-124.
[33] 陈 娇, 王小蓉, 汤浩茹, 等. 基于SSR标记的四川野生中国樱桃遗传多样性和居群遗传结构分析[J]. 园艺学报, 2013,40(2): 333-340.
CHEN J, WANG X R, TANG H R,etal. Assessment of genetic diversity and populations genetic structure in wild Chinese cherry from sichuan province using SSR markers[J].ActaHorticulturaeSinica, 2013,40(2): 333-340.
[34] 刘黎明, 刘 萍, 梁凤丽, 等. 新疆野杏花部综合特征与繁育系统初步研究[J]. 新疆农业科学, 2007,47(4): 750-755.
LIU L M, LIU P, LIANG F L,etal. Primary study on floral syndrome and breeding system ofArmeniacavulgarisLam[J].XinjiangAgriculturalSciences, 2007,47(4): 750-755.
[35] 郑 健, 郑勇奇, 张川红, 等. 花楸树天然群体的遗传多样性研究[J]. 生物多样性, 2008,16(6): 562-569.
ZHENG J, ZHENG Y Q, ZHANG C H,etal. Genetic diversity in natural populations ofSorbuspohuashanensis[J].BiodiversityScience, 2008,16(6): 562-569.
[36] HAMRICK J, GODT M. Effects of life history traits on genetic diversity in plant species[J].PhilosophicalTransactionsoftheRoyalSocietyofLondonSeriesB:BiologicalSciences, 1996, 351: 1 291-1 298.
[37] WRIGHT S. Evolution and the genetics of populations (Vol. 4) [M] // Variability within and among natural populations, Chicago: University of Vhicago Press, 1978.
[38] MITSUI Y, ISAGI Y, SETOGUCHI H. Multi ple spatial scale patterns of genetic diversity in riparian populations of Ainsliaea Faurieana (Asteraceae) on Yakushima Island, Japan[J].Amer.J.Bot., 2010,97: 101-110.
[39] TANA WUYUN, HITOMI AMO, JINGSHI XU,etal. Population structure of and conservation strategies for wildPyrusussuriensisMaxim. in China[J].PLOSone, 2015,7: 1-20.
[40] YOUNG A, BOYLE T, BROWN T. The population genetic consequences of habitat fragmentation for plants[J].TrendsinEcology&Evolution, 1996,11(10): 413-418.
(编辑:宋亚珍)
Genetic Diversity and Population Genetic Structure of Siberian Apricot in Inner Mongolia
BAO Wenquan1,2, WUYUN Tana1,2*, WANG Lin1,2, ZHAO Han1,2, DU Hongyan1,2
(1 China Paulownia Research Center, State Forestry Administration, Zhengzhou 450003, China;2 Non-Timber Forest Research and Development Center, Chinese Academy of Forestry, Zhengzhou 450003, China)
In order to provide theoretical support for reasonable protection and utilization of Siberian apricot resources, we analyzed the genetic diversity and population structure of 13 Siberian apricot populations in Inner Mongolia through twenty-seven pairs of SSR markers. The results showed that: (1) a total of 512 alleles (Na) were identified based on 27 SSR molecular markers, the average number of alleles (Na) per locus and polymorphism information content (PIC) per locus were 19 and 0.84, respectively. A high level of genetic diversity was revealed by Shannon’s information index (I, 2.25) and expected heterozygosity (He, 0.73) at species level. (2) The average number of alleles (Na), number of effective alleles (Ne), Shannon’s information index (I), expected heterozygosity (He) and observed heterozygosity (Ho) were 6.95, 4.48, 1.60, 0.76 and 0.56, respectively at population level. Comprehensive analysis suggested that Kezuohouqi population exhibits the highest level of genetic diversity, whereas the population of Keshiketengqi exhibits the lowest level of genetic diversity. (3) The genetic differentiation coefficient (Fst) based onF-statistic and gene flow (Nm) were 0.12 and 1.86, respectively; Analysis of molecular variance showed that the most of the genetic variation within population (92%), more than that among populations (8%). (4) The genetic distance among populations in Inner Mongolia Siberian apricot ranged from 0.04 to 0.67, the genetic identity among populations in Inner Mongolia Siberian apricot ranged from 0.33 to 0.83. UPGMA cluster analysis, principal coordinates analysis (PCoA) and structure analysis showed that 13 populations could be divided into four clusters. The Mantel test showed that the genetic distance among the populations was significantly correlated with geographic distance (r=0.453,P< 0.01). All the results supported that the genetic diversity of Siberian apricot in Inner Mongolia was relatively abundant, which was related to its size of population, long historical evolution and biological characteristics. There was a moderate genetic differentiation among populations, which resulted from the geographical isolation and fragmented environments caused by current human influences.
Siberian apricot; SSR; genetic diversity; genetic structure
1000-4025(2016)11-2182-10
10.7606/j.issn.1000-4025.2016.11.2182
2016-09-26;修改稿收到日期:2016-11-16
国家十二五课题支撑(2013BAD14B02)
包文泉(1988-),男,在读博士,主要从事经济林育种方面的研究。E-mail: 48369742@qq.com
*通信作者:乌云塔娜,教授,博士生导师。主要从事经济林育种和林业生物技术方面的研究。E-mail:tanatanann@163.com
Q346+.5;Q789
A
