杜仲叶中绿原酸的提取方法与精制工艺研究
2017-01-03周爱存哀建国潘佳佳
周爱存,哀建国,潘佳佳,何 斐
(浙江农林大学 林业与生物技术学院,浙江 临安 311300)
杜仲叶中绿原酸的提取方法与精制工艺研究
周爱存,哀建国*,潘佳佳,何 斐
(浙江农林大学 林业与生物技术学院,浙江 临安 311300)
对杜仲(Eucommia ulmoides)叶片中绿原酸的提取与精制工艺进行研究,比较了酸水提取、40%乙醇提取以及纤维素酶提取对绿原酸提取效果的影响,结果表明,酶提取更有利于后续工艺对绿原酸的精制。通过静态吸附试验,比较HPD-100A、AB-8、HPD-400A、DM-130、HPD-600、HPD-826六种大孔吸附树脂对绿原酸的吸附及脱附性能,筛选出性能较好的HPD-826树脂进行动态试验,结果表明,该树脂在室温下对杜仲叶中绿原酸的动态吸附-脱附最佳工艺参数为:上柱液pH值3.0,上柱流速2 BV/h,上柱体积7 BV;脱附剂为60%乙醇,洗脱流速1BV/h,洗脱剂用量为2 BV。用优化后的工艺进行试验,所得绿原酸粗产品的纯度可达49.85%,且工艺具有良好的稳定性。
杜仲叶;绿原酸;提取;精制
绿原酸,也称作咖啡鞣酸,是通过咖啡酸与奎尼酸缩合而形成的缩酚酸,属于苯丙素类化合物。绿原酸是一种重要的生物活性物质和化学试剂。在我国170种有抗菌消炎作用的中成药中均含有绿原酸的成分,具有利胆、抗菌、抗病毒、降压、增高白血球及兴奋中枢神经系统等多种药理作用[1]。研究发现,杜仲(Eucommia ulmoides)叶中含有大量的绿原酸,而我国的杜仲叶资源蕴藏量丰富,大部分未能充分的开发利用[2]。
本文着重研究了杜仲叶片中绿原酸的提取以及精制工艺,以获得切实可行的工艺参数为开发利用杜仲叶资源提供基础。
1 材料与仪器
1.1 供试材料
2013年5月从浙江农林大学3年生杜仲苗上采集新鲜叶片,清洗干净后,置烘箱内80℃烘干,用手搓碎,常温避光贮藏,备用。
1.2 主要试剂
绿原酸对照品购于上海金穗生物科技有限公司(批号:20130913 质量分数≥ 98%);纤维素酶5 000U/g购于上海金穗生物科技有限公司;HPD100A、AB-8、HPD400A、DM130、HPD600、HPD826大孔树脂购自沧州宝恩化工有限公司;盐酸、NaOH、95%乙醇均购自华东医药股份有限公司,均为分析纯。
1.3 主要仪器
Waters2695 Separations Modul高效液相色谱仪(附Waters 2996 Photodiode Array Detector);色谱柱:Agilent Zorbax SB-C18(4.6×250 mm,5 μm);玻璃层析柱(Φ25×500 mm)(华东医药股份有限公司);AP-01P真空泵(杭州赛析科技有限公司);RE-52A旋转蒸发器(上海亚荣生化仪器厂)。4504MP电子天平(万分之一);SK8200HP-超声波清洗器(上海科导);数显恒温水浴锅(HH-4,江苏环宇科学仪器厂);DZF-0真空干燥箱(上海跃进医疗器械厂)。
2 实验方法
2.1 树脂的预处理
试验用6种树脂先用95%乙醇浸泡24 h,使之充分溶胀,倾去乙醇以及漂浮物后湿法装柱,用95%的乙醇以2 BV/h的流速通过树脂层,洗至流出液加等体积的水不变白色浑浊为止;用蒸馏水以同样流速洗尽乙醇,然后用2BV的5%盐酸溶液以4 ~ 6 BV/h流速通过树脂层,并浸泡2 ~ 4 h,而后用水以同样流速洗至出水pH中性;再用2 BV的4%氢氧化钠溶液以4 ~ 6 BV/h的流速通过树脂层,并浸泡2 ~ 4 h,最后用水以同样流速洗至出水pH中性。将预处理后的树脂过滤并用滤纸吸干表面水分,于室温(25℃)下放置24 h,即得干树脂。
2.2 杜仲叶中绿原酸提取液的制备
2.2.1 纤维素酶提取法[3]酶溶液制备与活化:取1 g 50 000 U/g纤维素酶于50 mL蒸馏水中,在45℃水浴锅中活化10 min,备用;取粉碎后的杜仲叶5.0 g置于具塞锥形瓶中,加入100 mL pH为4.5的HCL水溶液,加入备用酶溶液0.3 mL,于45℃恒温水浴1.5 h;最后将提取液置于100℃的恒温水浴锅中10 min,使纤维素酶灭活;减压抽滤静置后的杜仲叶提取液,定容至250 mL容量瓶中,即为杜仲叶的酶提取液。
2.2.2 40%乙醇提取[4]取粉碎后的杜仲叶5.0 g置于具塞锥形瓶中,加入100 mL40%乙醇水溶液,置于80℃恒温水浴2.0 h,减压抽滤,将滤液定容至250 mL容量瓶中,即为杜仲叶的乙醇提取液。
2.2.3 酸水提取法[4]取粉碎后的杜仲叶5.0 g置于具塞锥形瓶中,加入100 mL pH为4.5的HCL水溶液,置于
50℃恒温水浴3.0 h,减压抽滤,将滤液定容至250 mL容量瓶中,即为杜仲叶的酸水提取液。
2.3 绿原酸的含量测定
2.3.1 色谱条件 色谱柱:Agilent Zorbax SB-C18(4.6×250 mm,5 μm);流动相为乙腈—0.2%磷酸水溶液(15:85)等度洗脱;流速1.0 mL/min;柱温30℃;检测波长325 nm;进样量10 μL。
2.3.2 标准曲线的制备 精密称取干燥恒重的绿原酸对照品5.86 mg,置于10 mL容量瓶中,加50%甲醇溶解并定容至刻度,得到质量浓度为0.568 mg/mL对照品溶液,过0.45 μm微孔滤膜,备用。分别精密吸取混合对照品溶液1、2、5、10、20、40 μL进样,按照“2.3.1”项色谱条件测定峰面积。以混合对照品的进样量(X,μg)为横坐标,峰面积(Y)为纵坐标,进行线性回归,得回归方程。结果表明,绿原酸进样量与色谱峰面积线性关系良好,其回归方程为:
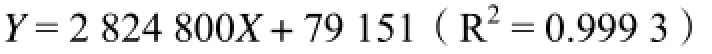
2.3.3 样品中绿原酸含量的测定 液体样品的测定:先将液体样品定容至适当体积,摇匀,用注射器取样品液约1.0 mL过0.45 μm的微孔滤膜,进行液相分析。
固体样品的测定:取烘干至恒重的固体样品适量,用适当溶剂定容至容量瓶中,轻轻振摇使之溶解,用注射器取样品液1.0 mL过0.45 μm的微孔滤膜,进行液相分析。
2.4 静态吸附试验
2.4.1 树脂饱和吸附量的测定 称取经预处理的6种干树脂各2.0 g于具塞磨口三角瓶中,加入松针绿原酸提取液50.0 mL,密封后室温下振荡(180 r/min))12 h至吸附平衡, 吸取上层液体测定绿原酸浓度。试验平行进行三次,取三次试验数据的平均值,并按下式计算饱和吸附量Q(mg/g)和吸附率A(%):

式中:Q为吸附量;C0为吸附前溶液浓度(mg/mL);Cr为吸附后溶液浓度(mg/mL);V为溶液体积(mL);W为干树脂重量(g)。
2.4.2 脱附率的测定 将吸附饱和后的树脂过滤,吸干树脂表面的水分,室温晾干,精密加入80%乙醇20 mL,室温振荡(180 r/min)12 h,使其达到饱和脱附,过滤后滤液定容,测此时溶液中绿原酸的浓度。试验平行进行三次,取三次试验数据的平均值,按照下式计算脱附率和回收率:

式中:D为脱附率(%),R为回收率(%),CD为脱附液浓度(mg/mL),C0为样品中绿原酸浓度(mg/mL),VD为脱附液体积(mL),V0为样品提取液的体积(mL),W为干树脂重量(g),Q为吸附量(mg/g干树脂)。2.4.3 上柱液pH的选择 准确称取5份静态实验所筛选的干树脂2.0 g,于具塞磨口三角瓶中,分别精密加入pH为1,2,3,5,7的杜仲叶提取液50 mL,其余操作同2.4.1。试验平行进行三次,取三次试验数据的平均值,比较提取液PH对树脂吸附性能的影响。
2.5 动态吸附与脱附试验
2.5.1 动态吸附试验 称取静态实验所筛选的干树脂57.0 g,经预处理后湿法装入Φ25×500 mm的层析柱中(1BV约80mL),用蒸馏水洗涤平衡;将杜仲叶绿原酸提取液pH调至最佳范围,以1 h 2 BV的流速上样,每隔0.5 BV收集上样流出液,通过测定流出液中绿原酸浓度,计算流出液中绿原酸的浓度占上样液中绿原酸初始浓度的百分比,制作大孔吸附树脂吸附杜仲叶提取液中绿原酸的穿透曲线,考察适当的上样体积。
2.5.2 动态脱附试验 取吸附至饱和的大孔吸附树脂柱,先用2 BV蒸馏水洗脱,后依次用2 BV的5%、10%、15%、20%、50%、60%、70%、80%乙醇水溶液淋洗树脂柱,淋洗速度为1 BV/h,每隔0.5BV收集洗脱液,测定流出液中绿原酸的含量,计算绿原酸累积洗脱率,以考察乙醇浓度对树脂脱附性能的影响,确定最佳乙醇浓度以及洗脱剂用量。
2.6 工艺验证
取揉碎烘干后的杜仲叶适量,依据上述酶法提取,选用最佳大孔吸附树脂HPD-826,按照优化后的上样吸附和脱附条件精制,收集脱附液,50℃减压浓缩,后将浓缩液转移至真空干燥箱于30℃干燥至恒重,依据2.3.3方法测得粗产品中绿原酸的含量。平行操作3次,考察提取、纯化工艺的稳定性。
3 结果与分析
3.1 不同提取方法对杜仲叶中绿原酸提取效果的影响
不同提取方法对杜仲叶中绿原酸提取效果的影响见表1。

表1 不同提取法所得提取液中绿原酸的得率比较Table 1 Yield of chlorogenic acid extracted from E. ulmoides leaves by different methods
由表1可知,3种提取方式中,水提取绿原酸得率最低,酶法提取和醇提取绿原酸得率相近,考虑到醇提取法比较消耗溶剂,上样之前需回收乙醇,比较耗能且醇提取出来的叶绿素等杂质较多,不利于后续对绿原酸的纯化,综合考虑,选择酶法提取绿原酸。
3.2 各树脂的静态吸附
3.2.1 树脂的初步筛选结果 6种树脂对杜仲叶提取液中绿原酸的吸附-脱附性能结果见表2。
由表2可以看出,HPD-600对杜仲叶中绿原酸的静态饱和吸附量最大,为8.23 mg/g,HPD-826次之,为7.72 mg/g,但是前者的脱附率太低,仅为61.97%,绿原酸的洗脱较为困难,而HPD-826对绿原酸的脱附率较高,为88.73%,这是因为绿原酸是一种含有酚羟基的多酚类化合物,属于极性分子,易与HPD-826型大孔树脂形成氢键,因此吸附效果较好;又因其孔径较大,因此解吸率也较高。综合考虑,选用HPD-826型大孔树脂作为精制杜仲叶中绿原酸的最佳树脂。
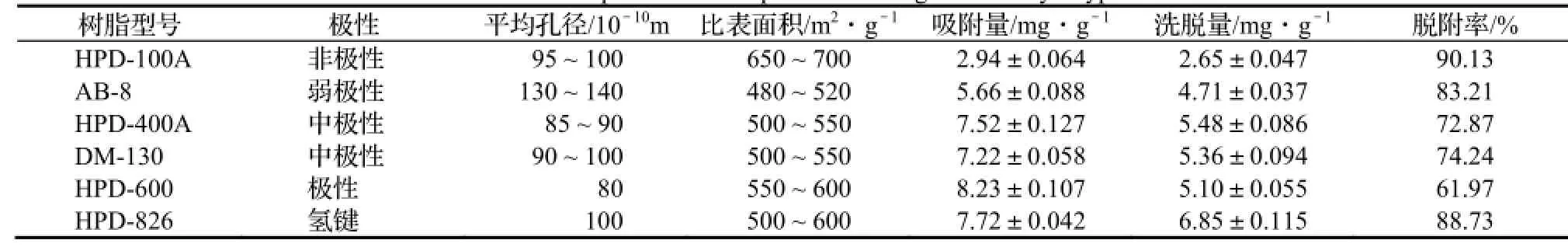
表2 6种树脂对绿原酸静态吸附与解吸性能(n=3)Table 2 Static adsorption and desorption of chlorogenic acid by 6 types of resin
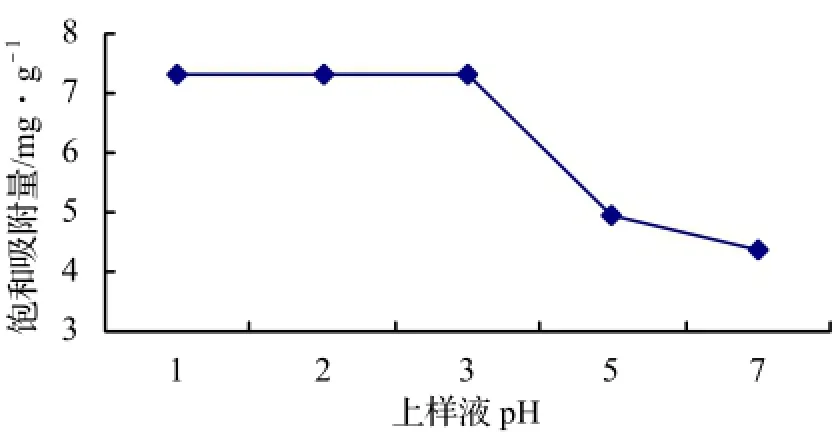
图1 上样液pH值对树脂吸附性能的影响Figure 1 Effect of sample pH on adsorption property of resins
3.2.2 上柱液pH对树脂吸附性能的影响 由图1可看出,上样液pH 1.0 ~ 3.0,树脂对绿原酸的饱和吸附量维持在较高水平,随着pH值的增大,树脂对绿原酸的饱和吸附量呈快递下降趋势。考虑到样品液的酸性太强会对树脂造成损害,因此上样液的pH值定为3.0较为适宜。
3.3 大孔树脂对杜仲叶中绿原酸动态吸附与脱附的影响
3.3.1 大孔吸附树脂吸附杜
仲叶提取液中绿原酸的穿透曲线HPD-826树脂对杜仲叶提取液中绿原酸吸附的穿透曲线如图2。由图2可知,前6倍柱体积上样流出液中绿原酸的浓度很低,都低于上样初始液绿原酸浓度的3%以内,第7倍上样流出液测得的绿原酸浓度约为上样初始液浓度的5%,而第八倍柱体积流出液中的绿原酸的浓度已经占上样初始液绿原酸浓度的25%左右,上样第11 至第 12倍柱体积后,树脂柱已基本吸附饱和。考虑到将绿原酸损失率控制在5%以内,可将上样体积定为7倍柱体积即560 mL较为合适。
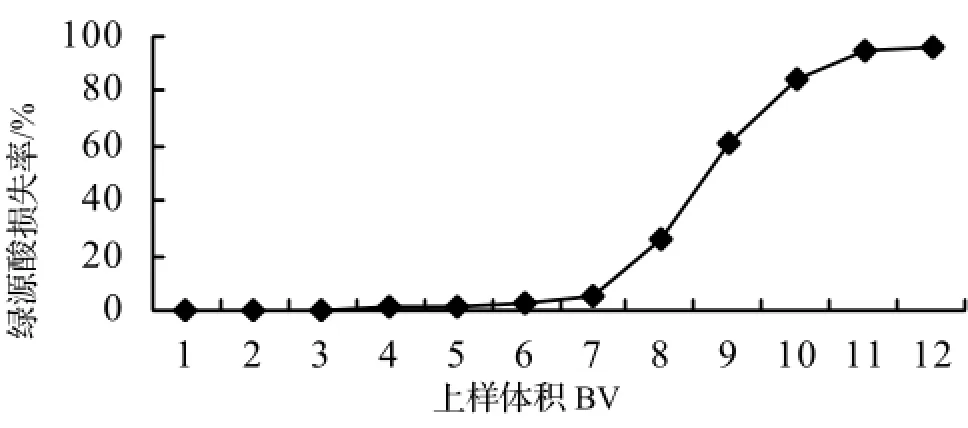
图2 HDP-826对提取液中绿源酸吸附的穿透曲线Figure 2 Breakthrough curve of adsorption of chlorogenic acid from extracted solution by HDP-826
3.3.2 脱附剂浓度对脱附性能的影响 蒸馏水以及不同浓度的乙醇水溶液洗脱绿原酸的效果如图3所示,其中横坐标为脱附液收集序号,纵坐标为绿原酸的累积洗脱率。由图3可以看出,随着乙醇浓度的增加,绿原酸洗脱量不断增加,序号25 ~ 28即乙醇浓度为60%时绿原酸累积洗脱率已占所有能洗脱绿原酸总量的91.82%,与80%乙醇洗脱绿原酸累积洗脱率93.75%相差不大。因此,从节约溶剂和经济成本的角度考虑,洗脱液以选择60%乙醇为佳。此外,为了尽可能地去除杂质,60%乙醇脱附前可考虑先用2倍柱体积5%乙醇洗脱去除杂质。
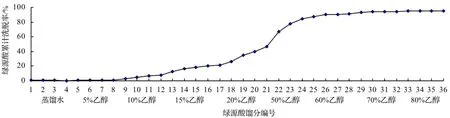
图3 不同浓度乙醇对绿源酸洗脱效果的影响Figure 3 Effect of different concentration of ethanol on desorption rate of chlorogenic acid
3.3.3 工艺验证 3批大孔吸附树脂精制前的酶提取物以及精制后粗产品中绿原酸的质量分数以及RSD值,见表3。从表中可以看出,经过大孔吸附树脂的纯化,绿原酸的含量从精制前的6.53%提高到精制后的49.85%,且工艺稳定。

表3 3批样品中绿原酸的质量分数(n=3)Table 3 Mass fraction of chlorogenic acid in different samples
4 讨论
在酸水提取杜仲叶的过程中,适当加入纤维素酶能够有效提高绿原酸的得率,且提取液较为澄清,提取物中的绿原酸含量也有一定的提高。酶作为一种生物催化剂,在杜仲叶提取中,能够有效分解破坏细胞壁,降低传质阻力,促进绿原酸从细胞内溶出,从而提高绿原酸的得率。酶法提取与乙醇提取法相比,一方面可以减少叶绿素等脂溶性杂质的溶出,另一方面避免了在上大孔吸附树脂前回收乙醇这一工序,既节省了人力又降低了成本。
与现有的文献[5~8]报道相比,本研究在结合绿原酸生产的实际情况基础上,将提取方式、静态吸附与解吸、动态吸附与解吸过程中影响绿原酸纯度各因子进行了较为全面地比较,最终使绿原酸的纯度得到大幅度的提高。
此外,据报道,杜仲叶除含有丰富的绿原酸外, 还含有丰富的京尼平苷酸、桃叶珊瑚苷等活性成分,如何在分离纯化绿原酸的同时,综合开发利用这些活性成分,尚需进一步研究。
[1] 刘颖,郭明晔,白根本. 绿原酸的研究进展[J]. 中药材,2012,35(7):1 180-1 185.
[2] 哀建国,杜江丽,周爱存,等. 双波长HPLC同时测定氮沉降处理下杜仲皮和叶中的5种成分[J]. 浙江农林大学学报,2015,32(1):60-66.
[3] 宋宏新,戴瑜. 酶法提取杜仲叶中绿原酸工艺研究[J]. 西北植物学报,2006,26(11):2 383-2 387.
[4] 尉芹,景谦平,马希汉. 杜仲叶中绿原酸的提取工艺条件研究[J]. 林产化学与产业,2001,21(4):27-32.
[5] 王茜,李智,何琦,等. 杜仲叶中绿原酸提取分离工艺条件的研究[J]. 离子交换与吸附,2008,24(1):73-80.
[6] 杨军宣,尹蓉莉,陈金玉,等. 金银花叶中绿原酸的大孔吸附树脂纯化工艺研究[J]. 中国实验方剂学杂志,2010,16(15):20-23.
[7] 刘军海,裘爱泳. 杜仲叶绿原酸的提取及精制[J]. 山东医药,2004,44(32):7-9.
[8] 熊伟,胡居吾,李雄辉,等. 大孔树脂分离纯化杜仲叶中绿原酸的研究[J]. 江西科学,2010,28(2):178-181.
Extracting Methods and Purification Technology of Chlorogenic Acid from Leaves of Eucommia ulmoides
ZHOU Ai-cun,AI Jian-guo*,PAN Jia-jia,HE Fei
(Zhejiang A & F University, Lin’an 311300, China)
∶Experiments were conducted on extracting of chlorogenic acid from leaves of Eucommia ulmoides by HCL solution, 40% ethanol and cellulose. The results showed that extracted solution by cellulose had better effect for the following purification. Comparison tests were implemented on adsorption and desorption of extracted solution of chlorogenic acid by HPD-100A, AB-8, HPD-400A, DM-130, HPD-600, HPD-826. HPD-826 had better properties and was selected for dynamic experiment. The result demonstrated that the optimal technology was as follows∶ 3.0 of sample pH, 2 BV/h of flow rate, 7 BV of bed volume, 60% alcohol as desorption agent, 1 BV/h of flow rate and 2 BV of desorption agent. Under the conditions above-mentioned, the purity of chlorogenic acid reached 49.85% , and the process stability was proved to be satisfactory.
∶leaves of Eucommia ulmoides; chlorogenic acid; cellulose extraction; purification
S789
A
1001-3776(2016)01-0042-05
2015-07-12;
2015-10-28
浙江省自然科学基金资助项目(Y3110393)
周爱存(1984-),男,江苏宿迁人,硕士,讲师,从事中药材与种质资源开发研究;*通讯作者。
