炎症反射研究新进展*
2017-01-03顾云,庄重
顾 云, 庄 重
(1南京中医药大学第二临床医学院针药结合教育部重点实验室, 2南京大学生命科学学院,江苏 南京 210023)
炎症反射研究新进展*
顾 云1, 2△, 庄 重2
(1南京中医药大学第二临床医学院针药结合教育部重点实验室,2南京大学生命科学学院,江苏 南京 210023)
炎症反射; 炎症; 迷走神经; 胆碱能神经元; 交感神经
炎症反应是机体受到损伤或病原体入侵时,固有免疫系统激活,单核细胞、中性粒细胞等迁移到受损部位并释放炎症介质白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子(tumor necrosis factor,TNF)-α、高迁移率族盒蛋白-1(high mobility group box-1 protein, HMGB1)和前列腺素等,局部血管扩张,通透性增加,白细胞渗出,进而清除病原体和受损组织,炎症局部往往伴随有红、热、肿、痛等症状。促炎细胞因子大量生成是炎症反应的主要特征。正常情况下,炎症反应仅在局部发生,用来抵抗病原体入侵和促进受损组织修复,会很快消退。然而,若炎症反应不足,则易引起感染甚至癌症;若炎症反应过度或持续时间过长,则易诱发炎症相关疾病(如类风湿关节炎、克罗恩病、动脉粥样硬化、阿尔茨海默病和多发性硬化等);若炎症反应失控,炎症介质大量生成并释放入血,则易引起脓毒血症等而导致死亡。因此,临床上对炎症反应进行有效调控具有非常重要的意义。
近二十年来,大量的研究表明神经系统也参与炎症反应的调控,机体的外周炎症反应可以通过炎症反射来进行快速调控。过去认为炎症反射的传出神经是迷走神经[1],然而最近的一些研究指出,炎症反射的传出神经并非迷走神经,而是交感神经。本文将主要围绕这方面的研究新进展加以阐述和分析。
1 炎症反射的提出
1999年,Tracey研究小组的Borovikova等[2]在研究抗炎药CNI-1493时,意外发现该药脑室内给药只需1 μg/kg就可以显著抑制用细菌脂多糖(lipopolysaccharide,LPS; 15 mg/kg)给大鼠静脉注射引起的炎症反应,这一脑室内给药剂量远远小于该药的静脉给药剂量(5 mg/kg),这引起了研究人员的好奇,因为这一现象说明该药应该是通过调动神经或体液调节起效的;研究人员又摘除了大鼠的垂体,发现并不影响CNI-1493(icv)的外周抗炎作用,说明CNI-1493并非通过神经内分泌(促进糖皮质激素合成释放)来产生抗炎作用。1995年,Watkins等[3]发现LPS或IL-1β(ip)能通过膈下迷走神经将腹腔炎症反应信息传递入脑。Tracey研究小组受这项研究的启发,推测中枢神经系统(central nervous system,CNS)对外周炎症反应可产生“反射性”调节,并首次提出炎症反射的概念[1]。考虑到迷走神经从延髓迷走神经运动背核(dorsal motor nucleus, DMN)发出后,下行经过颈、胸和腹部,与肺、心、肝、脾、胃肠道等内脏器官形成了弥散的突触联系,Tracey等认为迷走神经很可能就是炎症反射的传出神经,他们通过神经切断、电刺激等多种研究方法,最终确认了迷走神经介导的胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAP)[1, 4]。
2 炎症反射的传入通路
最早人们普遍认为大脑是免疫豁免器官,外周的病原体、免疫细胞及细胞因子等都无法通过血脑屏障(blood brain barrier,BBB),后来逐渐发现外周的免疫信息可以通过体液途径传递入脑,例如:病原体或炎症介质通过缺乏BBB的室周器官(如终板血管器、穹隆下器、正中隆起等)[5]直接入脑;或通过BBB上的转运体蛋白[6]入脑;或激活BBB的血管内皮细胞,使其合成新的炎症介质[7]释放入脑。近二十年,Watkins等[3]发现外周的炎症信息还可以通过炎症介质(主要是IL-1β)经神经途径快速传递入脑,如腹腔的炎症信息通过膈下迷走神经、口舌炎症信息通过三叉神经传递入脑。近年来发现外周免疫信息还可以通过细胞途径传递入脑,发现有外周单核细胞、T细胞和中性粒细胞等迁移入脑[8],如肝损伤炎症模型小鼠中,肝脏生成的TNF-α可激活脑内小胶质细胞生成单核细胞趋化蛋白(monocyte chemotactic protein-1,MCP-1/CCL2),从而吸引单核细胞向脑实质内迁移渗出。
总之,外周炎症反应的信息可通过炎症介质经神经、体液和细胞3条途径传递入脑(如图1所示),其中神经途径的信息传递速度最快。
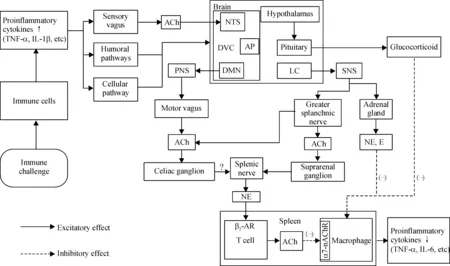
Figure 1.Schema of the inflammatory reflex. ACh: acetylcholine; AP: area postrema; DMN: dorsal motor nucleus; DVC: dorsal vagal complex; E: epinephrine; LC: locus coeruleus; NE: norepinephrine; NTS: nucleus tractus solitarius; PNS: parasympathetic nervous system; SNS: sympathetic nervous system.
图1 炎症反射回路示意图
3 炎症反射相关脑区
外周炎症反应信息通过迷走神经传入纤维进入延髓的孤束核(nucleus tractus solitarius,NTS)、最后区(area postrema,AP)和背侧运动核(dorsal motor nucleus, DMN) 3个脑区组成的背侧迷走神经复合体(dorsal vagal complex,DVC),NTS与AP、DMN相互传递整合信息,最后通过DMN将整合后的信息通过迷走神经传出。DVC与下丘脑、丘脑、海马、杏仁核、内侧前额叶及其它皮层脑区间都有广泛的神经元纤维投射和信息交流,可以使机体的行为、内分泌、代谢和免疫调控等功能相互协调起来[9]。另外,外周炎症反应信息也可以通过体液和细胞途径激活下丘脑-垂体-肾上腺皮质轴和蓝斑-交感神经-肾上腺髓质轴,通过糖皮质激素或去甲肾上腺素(norepinephrine,NE)、肾上腺素(epinephrine,E)对炎症反应进行神经-内分泌调节(如图1所示)。
乙酰胆碱(acetylcholine,ACh)的1型毒蕈碱受体(type 1 muscarinic acetylcholine receptor,M1-AChR)是突触后受体,其激动剂和ACh的作用相同;而ACh的2型毒蕈碱受体(type 2 muscarinic acetylcholine receptor,M2-AChR)则是突触前受体,其激活后,会抑制突触前神经元释放ACh,研究人员常用M2-AChR的拮抗剂来增强胆碱能神经元的活动。研究发现脑内胆碱能神经系统也具有抗炎作用,如脑室内注射M1-AChR的激动剂McN-A-343、占诺美林(xanomeline)和M2-AChR的拮抗剂美索曲明(methoctramine)等都能降低内毒素血症、大肠炎等动物模型的外周炎症水平[4],而切断迷走神经或脾神经则会阻断这种抗炎作用[4];用胆碱酯酶抑制剂(acetylcholinesterase inhibitor,AChEI)也能抑制外周炎症反应,且能通过BBB的AChEI比不能通过BBB的AChEI对外周炎症反应有更强的抑制作用[10],如AChEI加兰他敏、石杉碱A、利凡斯的明和多奈哌齐(可过BBB),都可以通过迷走神经抑制内毒素血症、肠炎、类风湿关节炎和自身免疫性脊髓炎等模型动物的外周炎症反应[4]。
4 炎症反射的传出通路
LPS可激活机体固有免疫(innate immunity)系统,诱导体内生成大量炎症介质,是常用的致炎物质;TNF-α的水平则常用来反映炎症反应的程度。
4.1 迷走神经的外周抗炎作用 Tracey的研究小组最早发现迷走神经的外周抗炎作用,包括切断迷走神经可以去除CNI-1493(icv)对大鼠外周炎症反应的抑制作用[2];电刺激迷走神经(或外周端)可以减少动物模型中LPS引起的血清、肝和心脏炎症介质(TNF-α等)的生成[11];值得注意的是,迷走神经仅仅抑制促炎细胞因子的生成,尤其是TNF-α,但对抗炎细胞因子如IL-10并没有影响[11]。
Huston等[12]研究发现,给Lewis大鼠注射LPS(iv,15 mg/kg)90 min后,脾、肝和肺的TNF-α合成会分别增加30、6和2倍,电刺激颈迷走神经的外周端,脾、肝和肺的TNF-α分别降低94%、40%和20%;另外切除脾或保留脾加电刺激迷走神经,两种处理抑制TNF-α生成的作用相同。这项研究结果有力地说明了脾既是外周TNF-α生成的主要部位,也是电刺激迷走神经抑制外周TNF-α生成的主要靶器官[12]。然而,在脾内并没有胆碱能神经纤维末梢存在[13],迷走神经的抗炎作用是间接产生的,其可能的作用机制如图1所示:迷走神经通过其腹腔支[12]在腹腔神经节换元,通过节后脾交感神经释放NE[13-14],作用于脾内T细胞[15],T细胞[14]释放ACh与巨噬细胞上的α7烟碱样乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7-nAChR)[16]结合后,抑制巨噬细胞释放炎症介质(如TNF-α等)。
值得一提的是,近来研究发现,在小鼠腹腔神经节中有肾上腺素能神经元(色氨酸羟化酶阳性染色)被大量胆碱能神经末梢(乙酰胆碱囊泡转运体阳性染色)围绕[17],研究人员指出这很可能是迷走神经节前神经纤维和脾交感神经换元的地方,提示这些肾上腺素能神经元就是脾神经元胞体[13]。然而,这项研究没有进行神经元的示踪染色标记,并不能确定腹腔神经节的肾上腺素能神经元就是脾神经的胞体,这尚需进一步的研究证明。再者,近来Bratton等[18]利用神经元示踪技术,研究发现脾神经的神经元胞体大部分分布在肾上神经节,仅有约11%分布于左侧腹腔神经节,并且在腹腔神经节没有发现有来自DMN的神经纤维(迷走神经)和脾神经形成突触样连接。
4.2 交感神经(内脏大神经,splanchnic nerve)的外周抗炎作用 近年来的研究说明,炎症反射的传出通路应该是交感神经(内脏大神经),而非迷走神经(如图1所示)。这些研究包括:(1)Bratton等[18]研究发现迷走神经传出纤维末梢和脾神经的神经元胞体之间并不存在直接的突触联系。他们用细胞膜红色荧光探针(1, 1’-dioctadecyl-3, 3, 3’, 3’-tetramethylindocarbocyanine perchlorate,DiI)顺行示踪技术标记延髓DMN的传出神经(即迷走神经)的投射部位,用固蓝(fast blue)逆行示踪技术标记脾神经的神经元胞体所在,发现脾神经的神经元胞体绝大部分分布在肾上神经节而非腹腔神经节,并且在腹腔神经节和肾上神经节也都没有发现任何DiI阳性组织(迷走神经末梢)和固蓝阳性组织(脾神经元胞体)形成突触样结构;另外,电刺激迷走神经外周端也不能引起脾神经的兴奋。这一研究结果说明,迷走神经和脾神经之间并没有突触连接。当然,Bratton等若能在投射区示踪的同时加一个染色指标来标记示踪细胞的性质(胆碱能或肾上腺素能),结果就更有说服力了。(2)Martelli等[19]发现用LPS(iv)可引起内脏大神经和脾神经同时兴奋;切除内脏大神经,脾神经的电活动明显受到抑制,且血浆和脾脏的TNF-α水平也显著升高;另外,切除双侧颈迷走神经对脾神经和内脏大神经的电活动、炎症介质水平都没有显著影响。这一研究结果说明,内脏大神经(交感神经)对脾神经有支配作用,而迷走神经却没有。(3)近来,为了排除麻醉药对实验结果的影响,Martelli等[20]使用清醒动物,发现切断内脏大神经仍旧会促进LPS(iv)大鼠体内炎症介质的生成,这说明内脏大神经本身具有抗炎作用。(4)从其它一些研究小组发表的实验结果中也能发现,切断迷走神经虽有促进LPS(ip或iv)引起炎症反应的趋势,但都达不到统计学显著水平[19, 21-22]。
总之,这些研究说明炎症反射的传出神经是交感神经(内脏大神经),而非迷走神经;内脏大神经在肾上神经节(或腹腔神经节)换元,通过脾神经对脾起抗炎作用(如图1所示)。
4.3 炎症反射的传出通路——迷走神经还是交感神经? 综上4.1和4.2所述,可以确认的是,交感神经[20]和迷走神经[11]都能通过脾神经抑制脾脏的TNF-α生成。另外,过去认为脑卒中后的免疫抑制主要与交感神经系统紧张性增强相关,然而最近研究发现切断迷走神经也会阻断脑卒中引起的免疫抑制效应[23]。因此,脾神经很可能同时受到交感神经和副交感神经的紧张性作用。尽管发现在腹腔神经节有胆碱能和肾上腺素能神经元形成突触联系,但Bratton等[18]利用神经元示踪技术的研究却没有发现迷走神经和脾神经在此处形成的突触样联系,因此,迷走神经和脾神经之间的信息传递方式还待进一步研究确定。
机体内脏多同时受交感和副交感神经的紧张性调节,一般机体交感神经紧张性提高的同时往往伴随有迷走神经紧张性的降低,二者协同作用可以迅速改变机体功能状态,如快速增加心输出量、肺通气量等,这样有利于提高机体对环境的适应性。同样的,外周炎症反应在引起机体应激反应,增强交感神经的紧张性的同时,也应当伴随有迷走神经紧张性的降低,这种现象已有研究报道证实,如Martelli等[19]发现用LPS(iv)可引起交感神经(内脏大神经)兴奋;类风湿性关节炎患者的心率变异性低于正常对照组,有迷走紧张性低,而交感紧张性高的现象(心率变异性和迷走紧张度具有正相关,心率变异性高,则迷走紧张性高)[24],这些研究结果说明,外周炎症反应会降低迷走神经的紧张性。另外,切断迷走神经虽有促进LPS(ip或iv)引起炎症反应的趋势,但都达不到统计学显著水平[19, 21-22]。因此,结合迷走神经的抗炎作用,我们可以推断,迷走神经对外周炎症反应有紧张性抑制作用。
电刺激迷走神经会抑制LPS(iv)引起的外周促炎细胞因子(TNF-α等)的生成,但不会改变抗炎细胞因子IL-10的水平[11];而交感神经(内脏大神经)却可以在抑制LPS(iv)引起的促炎细胞因子生成的同时促进抗炎细胞因子IL-10的生成[20]。因此,根据上述研究结果,可以进一步推断,正常状态下,迷走神经对炎症反应有紧张性抑制作用,用来调控机体免疫监视的水平;而在病原体入侵或损伤情况下,迷走神经紧张性降低,而交感神经紧张性增强,抑制促炎细胞因子生成的同时调动机体抗炎免疫系统,与NE、E、糖皮质激素一起来防止机体出现炎症反应亢进的状态(如图1所示)。
总的来说,外周炎症反应引起炎症反射,其反馈抑制炎症反应的作用主要是通过增强交感神经紧张性实现的。
5 炎症反射与炎症相关疾病的临床相关研究
近来的研究发现,脓毒血症病人中血中单核细胞α7-nAChR的表达水平与机体炎症反应强度呈负相关,已建议用作体内胆碱能抗炎通路活性的检测指标[25]。另外,用α7-nAChR激动剂进行炎症治疗也有一些临床应用研究,如用胆碱可以显著降低哮喘病人的炎症水平[26],用GTS-21虽然不能抑制志愿者LPS(iv,60 ng/kg)引起的炎症反应,但是血药浓度和促炎细胞因子水平明显呈负相关[27];GTS-21还可以抑制LPS诱发的肾病透析患者的全血细胞的炎症反应[28]。
Tracey等[29]认为外周炎症反应亢进,是炎症反射障碍、迷走神经神经紧张性过低引起的,如类风湿关节炎患者迷走神经紧张性低,给他们体内植入迷走神经电子刺激器可以取得一定的抗炎效果[30]。然而,需要注意的是,这里仍有很多问题需要解决:外周炎症反应过强是源自迷走神经紧张不足还是交感神经紧张性不足[31]?还是二者都有?增强迷走神经紧张性的同时是否增强了交感神经的紧张性?迷走神经和交感神经的抗炎作用不同,炎症反应时迷走神经紧张性变化在免疫功能调控中的作用是什么?这些问题仍需要进一步的研究来确认。
6 结论
外周炎症反应同时受到迷走神经和交感神经的紧张性抑制作用,而炎症反射的反馈抑制作用主要是通过交感神经实现。明确炎症反射通路、阐明迷走神经和交感神经抗炎作用的功能特点及其意义,对炎症相关疾病的病因分析、治疗靶点和方法的选择及抗炎药物的研发等都具有重要意义。
[1] Tracey KJ. The inflammatory reflex[J]. Nature, 2002, 420(6917):853-859.
[2] Borovikova L, Ivanova S, Frazier A, et al. Vagotomy blocks the protective effects of i.c.v. CNI-1493 against LPS-induced shock[J]. Shock, 1999, 11(6): 80.
[3] Watkins LR, Goehler LE, Relton JK, et al. Blockade of interleukin-1 induced hyperthermia by subdiaphragmatic vagotomy-evidence for vagal mediation of immune brain communication[J]. Neurosci Lett, 1995, 183(1-2):27-31.
[4] Pavlov VA, Tracey KJ. Neural circuitry and immunity [J]. Immunol Res, 2015, 63(1-3):38-57.
[5] Vitkovic L, Konsman JP, Bockaert J, et al. Cytokine signals propagate through the brain[J]. Mol Psychiatr, 2000, 5(6):604-615.
[6] Banks WA. The blood-brain barrier in psychoneuroimmunology[J]. Neurol Clin, 2006, 24(3):413-419.
[7] Verma S, Nakaoke R, Dohgu S, et al. Release of cytokines by brain endothelial cells: a polarized response to lipopolysaccharide[J]. Brain Behav Immun, 2006, 20(5):449-455.
[8] Capuron L, Miller AH. Immune system to brain signaling: neuropsychopharmacological implications[J]. Pharmacol Ther, 2011, 130(2):226-238.
[9] Pavlov VA, Tracey KJ. The vagus nerve and the inflammatory reflex-linking immunity and metabolism[J]. Nat Rev Endocrinol, 2012, 8(12):743-754.
[10]Miceli PC, Jacobson K. Cholinergic pathways modulate experimental dinitrobenzene sulfonic acid colitis in rats[J]. Auton Neurosci, 2003, 105(1): 16-24.
[11]Borovikova LV, Ivanova S, Zhang M, et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin[J]. Nature, 2000, 405(6785): 458-462.
[12]Huston JM, Ochani M, Rosas-Ballina M, et al. Splenectomy inactivates the cholinergic antiinflammatory pathway during lethal endotoxemia and polymicrobial sepsis[J]. J Exp Med, 2006, 203(7):1623-1628.
[13]Rosas-Ballina M, Ochani M, Parrish WR, et al. Splenic nerve is required for cholinergic antiinflammatory pathway control of TNF in endotoxemia[J]. Proc Natl Acad Sci U S A, 2008, 105(31):11008-11013.
[15]Rosas-Ballina M, Olofsson PS, Ochani M, et al. Acetylcholine-synthesizing T cells relay neural signals in a vagus nerve circuit[J]. Science, 2011, 334(6052): 98-101.
[16]Olofsson PS, Katz DA, Rosas-Ballina M, et al. α7 nicotinic acetylcholine receptor (α7nAChR) expression in bone marrow-derived non-T cells is required for the inflammatory reflex[J]. Mol Med, 2012, 18:539-543.
[17]Downs AM, Bond CE, Hoover DB. Localization of alpha7 nicotinic acetylcholine receptor mRNA and protein within the cholinergic anti-inflammatory pathway [J]. Neuroscience, 2014, 266:178-185.
[18]Bratton BO, Martelli D, McKinley MJ, et al. Neural regulation of inflammation: no neural connection from the vagus to splenic sympathetic neurons [J]. Exp Physiol, 2012, 97(11):1180-1185.
[19]Martelli D, Yao ST, McKinley MJ, et al. Reflex control of inflammation by sympathetic nerves, not the vagus[J]. J Physiol, 2014, 592(7):1677-1686.
[20]Martelli D, Yao ST, Mancera J, et al. Reflex control of inflammation by the splanchnic anti-inflammatory pathway is sustained and independent of anesthesia[J]. Am J Physiol Regul Integr Comp Physiol, 2014, 307(9): R1085-R1091.
[21]Bernik TR, Friedman SG, Ochani M, et al. Pharmacolo-gical stimulation of the cholinergic antiinflammatory pathway[J]. J Exp Med, 2002, 195(6):781-788.
[22]Mihaylova S, Killian A, Mayer K, et al. Effects of anti-inflammatory vagus nerve stimulation on the cerebral microcirculation in endotoxinemic rats[J]. J Neuroinflammation, 2012, 9:183.
[23]Engel O, Akyüz L, da Costa Goncalves AC, et al. Choli-nergic pathway suppresses pulmonary innate immunity facilitating pneumonia after stroke[J]. Stroke, 2015, 46(11):3232-3240.
[24]Evrengül H, Dursunoglu D, Cobankara V, et al. Heart rate variability in patients with rheumatoid arthritis [J]. Rheumatol Int, 2004, 24(4):198-202.
[25]Cedillo JL, Arnalich F, Martin-Sanchez C, et al. Usefulness of alpha 7 nicotinic receptor messenger RNA levels in peripheral blood mononuclear cells as a marker for cholinergic antiinflammatory pathway activity in septic patients: results of a pilot study [J]. J Infect Dis, 2015, 211(1):146-155.
[26]Mehta AK, Singh BP, Arora N, et al. Choline attenuates immune inflammation and suppresses oxidative stress in patients with asthma[J]. Immunobiology, 2010, 215(7):527-534.
[27]Kox M, Pompe JC, Gordinou de Gouberville MC, et al. Effects of the α7 nicotinic acetylcholine receptor agonist GTS-21 on the innate immune response in humans[J]. Shock, 2011, 36(1):5-11.
[28]Hilderman M, Qureshi AR, Al-Abed Y, et al. Cholinergic anti-inflammatory pathway activity in dialysis patients: a role for neuroimmunomodulation?[J]. Clin Kidney J, 2015, 8(5):599-605.
[29]Tracey KJ. Shock medicine [J]. Sci Am, 2015, 312(3):28-35.
[30]Koopman F, Miljko S, Grazio S, et al. First-in-human study of vagus nerve stimulation for rheumatoid arthritis: clinical and biomarker key results through day 84[J]. Ann Rheum Dis, 2013, 72(Suppl 3):A245.
[31]马度芳, 姜 萍, 杨金龙, 等. 调节自主神经系统: 心血管疾病抗炎治疗的新领域[J]. 中国病理生理杂志, 2015, 31(2):374-384.
(责任编辑: 林白霜, 罗 森)
New progress in study of inflammatory reflex
GU Yun1,2, ZHUANG Zhong2
(1KeyLaboratoryofAcupunctureandMedicineResearchofMinistryofEducation,TheSecondClinicalMedicalCollege,NanjingUniversityofChineseMedicine,2SchoolofLifeSciences,NanjingUniversity,Nanjing210023,China.E-mail:guyun@njutcm.edu.cn)
[ABSTRACT] Proinflammatory cytokines induced by peripheral immune challenge can activate the inflammatory reflex, which results in negative-feedback control of inflammation. Some recent studies revealed that it is the splanchnic nerve, not the vagus nerve, to constitute the efferent arm of the inflammatory reflex. Further researches are needed to identify the neural construction and regulatory mechanism of the inflammatory reflex, which might be harnessed for the treatment of inflammation and the development of anti-inflammatory drugs.
Inflammatory reflex; Inflammation; Vagus nerve; Cholinergic neurons; Sympathetic nerve
1000- 4718(2016)12- 2230- 05
2016- 05- 25
2016- 07- 01
国家自然科学基金资助项目(No.81373747);江苏省高校优势学科建设工程一期项目-南京中医药大学中医学优势学科开放课题(No.YS2012ZYX403)
R363
A
10.3969/j.issn.1000- 4718.2016.12.031
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 025-85811233; E-mail: guyun@njutcm.edu.cn
