碧萝芷通过下调ERK磷酸化及自噬水平抑制TGF-β1诱导的肝星状细胞活化
2017-01-03杨淑娟何英利马晓华
杨淑娟, 何英利, 马晓华, 姜 娜
(1西安市第八医院肝病二病科, 2西安交通大学第一附属医院感染科, 3西安市第八医院重症医学科, 陕西 西安 710061)
碧萝芷通过下调ERK磷酸化及自噬水平抑制TGF-β1诱导的肝星状细胞活化
杨淑娟1△, 何英利2, 马晓华3, 姜 娜1
(1西安市第八医院肝病二病科,2西安交通大学第一附属医院感染科,3西安市第八医院重症医学科, 陕西 西安 710061)
目的: 探究碧萝芷对转化生长因子β1(TGF-β1)诱导的肝星状细胞活化的影响。方法:5 μg/L TGF-β1和不同浓度碧萝芷(0、10、25、50 mg/L)分别作用于LX-2细胞,在有或无自噬抑制剂3-MA和ERK抑制剂PD98059的情况下,用MTT法检测细胞活力的变化,Western blot实验检测α-SMA、ColⅠ、TIMP-1、LC3-Ⅱ/Ⅰ、beclin 1、p-ERK1/2和ERK1/2蛋白水平的变化。结果:与对照组相比,5 μg/L TGF-β1组的LX-2细胞活力以及α-SMA、ColⅠ、TIMP-1、LC3-Ⅱ/Ⅰ、beclin 1、p-ERK1/2和ERK1/2蛋白水平明显增加(P<0.05)。而碧萝芷预处理能逆转上述效应,并呈现一定的剂量依赖性,50 mg/L碧萝芷的抑制效果最为显著(P<0.05)。而且,与TGF-β1组相比较,50 mg/L碧萝芷、5 mmol/L 3-MA或者20 μmol/L PD98059预处理下,TGF-β1诱导的LX-2细胞活力以及α-SMA和LC3-Ⅱ/Ⅰ蛋白表达均明显下调(P<0.05)。结论:碧萝芷通过下调ERK磷酸化及自噬水平抑制TGF-β1诱导的肝星状细胞活化。
碧萝芷; 转化生长因子β1; 自噬; 肝星状细胞; 细胞活力
肝纤维化(hepatic fibrosis,HF)是由多种因素引起的细胞外基质(extracellular matrix,ECM)合成和降解不平衡,进而导致肝脏纤维结缔组织的过度沉积,被视为各种慢性肝病向肝硬化发展所共有的病理改变和必经阶段[1-2]。肝星状细胞(hepatic stellate cell,HSC)是形成HF的主要细胞,其过度活化增殖是HF进展的中心环节,以α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)增多为最显著的活化标志。有研究认为,阻止HSC的活化有可能阻断HF的进程[3],因此,寻找合适的药物阻止HSC活化增殖是抗HF的重要途径。
碧萝芷(Pycnogenol,PYC)是法国海岸松树皮的提取物,主要由低聚前花青素和其它生物类黄酮及有机酸等生物活性的水溶性成分组成[4]。它是一种较强的天然抗氧化剂,可通过多种途径清除氧自由基,抑制炎症因子生成。有研究表明,碧萝芷可明显减轻非酒精性脂肪性肝炎大鼠模型的肝损伤反应[5]。HF是继发于各种原因引起的肝脏炎症或肝损伤修复过程中的代偿反应[1],因此我们推测碧萝芷可能在HF发展进程中发挥改善作用。活化的HSC可产生多种细胞因子,其中转化生长因子β1(transforming growth factor-β1,TGF-β1)被认为是最强的致纤维化细胞因子[6]。目前,有关碧萝芷是否影响HF病理进程的研究尚未报道,因此有必要首先探讨碧萝芷是否在外源性TGF-β1诱导的HSC活化中发挥作用。本实验以人肝星状细胞株LX-2为研究对象,探究碧萝芷对TGF-β1诱导的LX-2细胞活化的影响以及相关机制,旨在为临床抗肝纤维化预防和治疗提供新思路。
材 料 和 方 法
1 材料与试剂
人肝星状细胞株LX-2(中国科学院上海生命科学研究院细胞资源中心);碧萝芷粉末(Henkel);DMEM和胎牛血清(Gibco);TGF-β1、二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)、PD98059、3-甲基腺嘌呤(3-methyladenine,3-MA)和抗α-SMA鼠单抗(Sigma);BCA蛋白定量分析试剂盒(Thermo);抗ERK1/2鼠单抗、抗p-ERK1/2羊多抗和抗β-actin兔多抗(Santa Cruz);抗beclin 1兔多抗、抗LC3兔多抗、抗ColⅠ鼠单抗和抗TIMP-1兔单抗(Abcam);PVDF膜(Millipore);ECL、HRP标记的山羊抗鼠IgG II抗、山羊抗兔IgG II 抗和驴抗山羊 IgG II 抗(江苏碧云天生物技术研究所)。
2 方法
2.1 细胞培养 LX-2细胞用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基,在37 ℃、5% CO2条件下进行培养。融合度约为80%时,用0.25%胰蛋白酶消化,根据细胞生长情况,更换培养基,取对数生长期细胞用于后续实验。
2.2 细胞处理 碧萝芷溶解于DMSO中,-20 ℃保存。所有含10、25、50 mg/L 等浓度碧萝芷,20 μmol/L PD98059和5 mmol/L 3-MA的培养液均由含0.2%胎牛血清的DMEM培养基配制。细胞无血清培养24 h后,加入含不同浓度碧萝芷的培养基,预孵育1 h后,加入终浓度为5 μg/L TGF-β1,孵育24 h后,进行相关实验。含20 μmol/L PD98059或者5 mmol/L 3-MA的培养基预处理30 min。各组细胞用相应处理的培养基孵育时间一致。
2.3 MTT法检测细胞活力 按每孔1×104个的密度将LX-2细胞接种于96孔板,每孔200 μL培养基,24 h后换液,无血清培养24 h。随后分5组,对照组,5 μg/L TGF-β1+碧萝芷(0、10、25、50 mg/L)组,分别加180 μL相应处理的培养基,每组设6个复孔。作用24 h后,向待测孔加入20 μL MTT溶液(5 g/L),37 ℃孵育4 h。弃上清,每孔加入150 μL DMSO,溶解后,酶标仪检测490 nm处各孔的吸光度(A),则各组细胞相对活力(%)=处理组平均A值/对照组平均A值×100%。
2.4 Western blot法检测蛋白的水平 按每孔4×105个的密度将LX-2细胞接种于6孔板,24 h后换液,无血清DMEM培养。24 h后,分别加相应处理的培养基孵育。作用24 h后,收集细胞,PBS洗涤2次后,加入RAPI细胞裂解液,提取细胞全蛋白。经BCA定量、上样、SDS-PAGE、转膜、封闭、 I抗孵育、 II 抗孵育和ECL显影等步骤,检测各组细胞中α-SMA、ColⅠ、TIMP-1、LC3-Ⅱ/Ⅰ、Beclin1、p-ERK1/2、ERK1/2和β-actin蛋白水平。
3 统计学分析
实验数据采用SPSS 17.0软件进行统计学分析,计量资料用均数±标准差(mean±SD)表示,各组间比较用单因素方差分析,各组均数间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 碧萝芷抑制TGF-β1诱导的LX-2细胞活力
MTT结果显示,细胞处理24 h后,与对照组相比,5 μg/L TGF-β1组的相对细胞活力明显增加。而在10、25、50 mg/L碧萝芷预处理下,TGF-β1诱导的细胞活力降低,并呈现一定的浓度依赖性,50 mg/L碧萝芷的抑制效果最为显著,见图1。
2 碧萝芷下调TGF-β1诱导的LX-2细胞活化
Western blot实验结果显示,细胞处理24 h后,与对照组相比,5 μg/L TGF-β1组肝星状LX-2细胞活化标志物α-SMA、ColⅠ和TIMP-1等蛋白表达明显升高。而在10、25、50 mg/L碧萝芷预处理下,TGF-β1诱导的LX-2细胞活化标志物蛋白表达水平均下调,并呈现一定的浓度依赖性,50 mg/L碧萝芷的抑制效果最为显著,见图2。

Figure 1.The effect of Pycnogenol (PYC) on TGF-β1-induced viability of the LX-2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.
图1 碧萝芷处理对TGF-β1诱导的LX-2细胞活力的影响
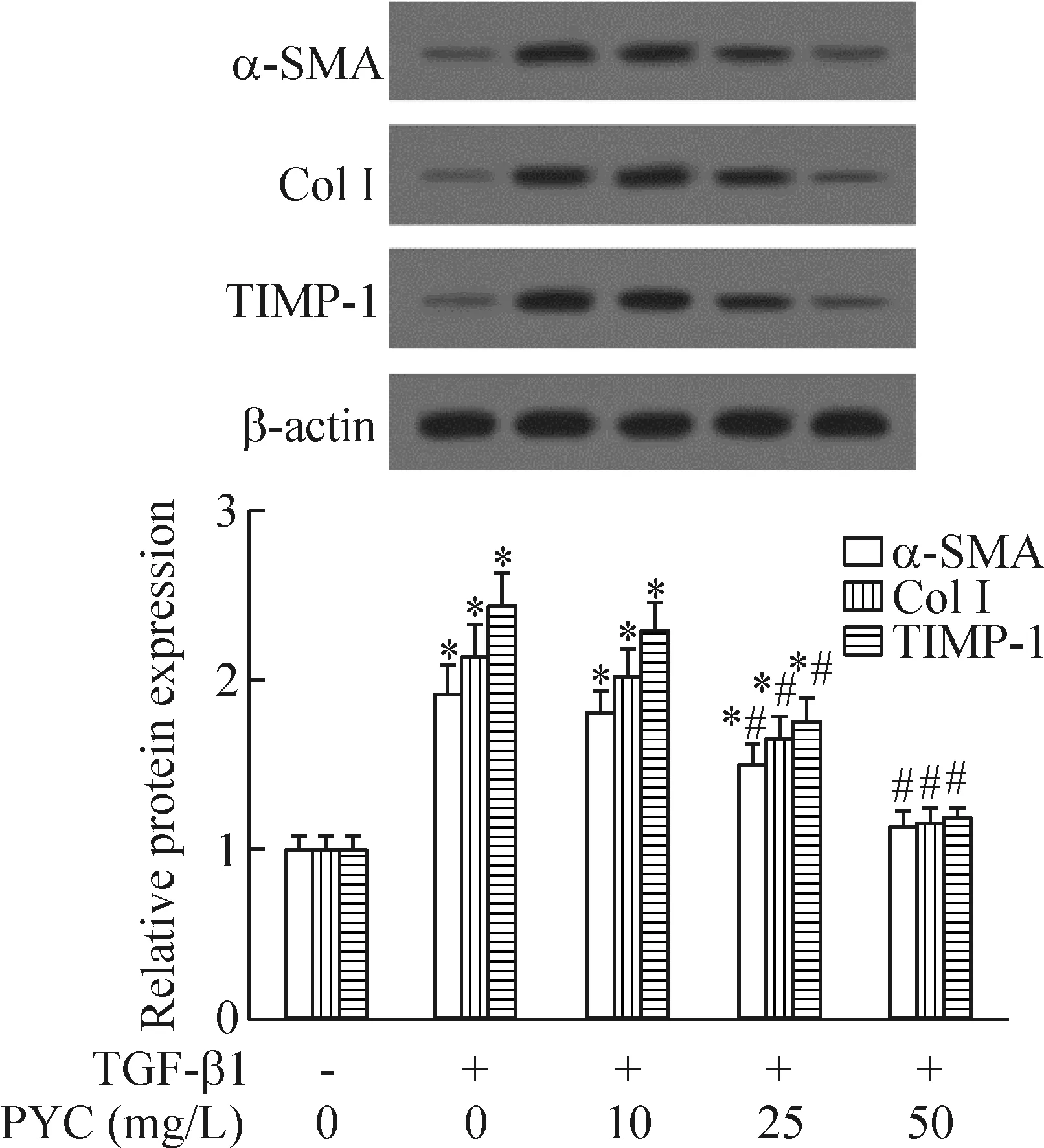
Figure 2.The effect of Pycnogenol (PYC) on TGF-β1-induced protein expression of α-SMA, ColⅠand TIMP-1 in the LX-2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.
图2 碧萝芷处理对TGF-β1诱导的LX-2细胞α-SMA、ColⅠ和TIMP-1蛋白表达的影响
3 碧萝芷抑制TGF-β1诱导的LX-2细胞自噬
Western blot实验结果显示,细胞处理24 h后,与对照组相比,5 μg/L TGF-β1组LX-2细胞LC3-Ⅱ/Ⅰ和beclin1的蛋白表达明显升高。而在10、25、50 mg/L碧萝芷预处理下,TGF-β1诱导的LX-2细胞自噬相关蛋白表达水平均降低,并呈现一定的浓度依赖性,50 mg/L碧萝芷的抑制效果最为显著,见图3。
4 碧萝芷抑制TGF-β1诱导的LX-2细胞ERK磷酸化
Western blot实验结果显示,细胞处理24 h后,与对照组相比,5 μg/L TGF-β1组LX-2细胞p-ERK1/2的蛋白水平明显升高。而在10、25、50 mg/L碧萝芷预处理下,TGF-β1诱导的LX-2细胞p-ERK1/2蛋白表达均降低,并呈现一定的浓度依赖性,50 mg/L碧萝芷的抑制效果最为显著,见图4。

Figure 3.The effect of Pycnogenol (PYC) on TGF-β1-induced protein expression of LC3-Ⅱ/Ⅰand beclin 1 in the LX-2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.
图3 碧萝芷处理对TGF-β1诱导的LX-2细胞LC3-Ⅱ/Ⅰ和beclin 1蛋白表达的影响
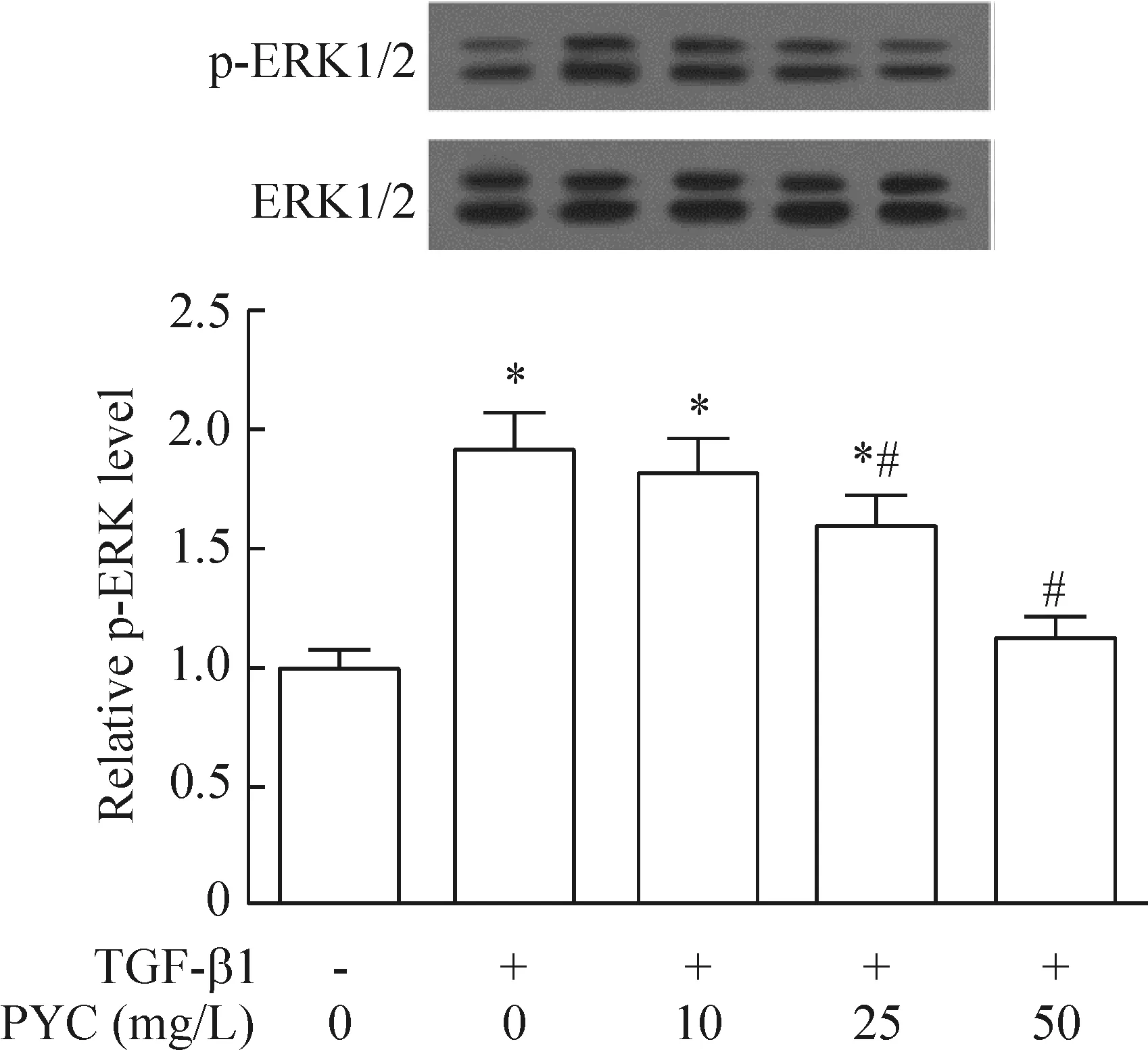
Figure 4.The effects of Pycnogenol (PYC) on TGF-β1-induced protein levels of p-ERK1/2 and ERK1/2 in the LX-2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.
图4 碧萝芷处理对TGF-β1诱导的LX-2细胞p-ERK1/2和ERK1/2蛋白水平的影响
5 碧萝芷通过下调ERK磷酸化及自噬水平抑制TGF-β1诱导的肝星状细胞活化
Western blot实验结果显示,细胞处理24 h后,与5 μg/L TGF-β1组相比较,50 mg/L碧萝芷、20 μmol/L PD98059或者5 mmol/L 3-MA预处理下,TGF-β1诱导的LX-2细胞活力以及p-ERK1/2、α-SMA和LC3-Ⅱ/Ⅰ蛋白水平均明显下调,见图5。

Figure 5.The effects of Pycnogenol (PYC), 3-MA or PD98059 on TGF-β1-induced cell viability (A) and protein levels of p-ERK1/2 (B), α-SMA and LC3-Ⅱ/Ⅰ (C) in the LX-2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.
图5 碧萝芷、3-MA和PD98059处理对TGF-β1诱导的LX-2细胞活力以及p-ERK1/2、α-SMA和LC3-Ⅱ/Ⅰ蛋白水平的影响
讨 论
目前,我国各种肝病发病率呈上升趋势,HF是各种肝病的共同病理学基础,如果得不到有效的治疗,最终发展成肝硬化,甚至引起肝功能衰竭等严重的并发症,并导致死亡。HF形成是由各种致病因子引起肝内结缔组织异常增生,导致肝内ECM过度沉淀的极为复杂的生理病理过程。由于肝纤维化发生的机制极其复杂,目前临床上实用的药物疗效并不理想。TGF-β1是促进HF形成的关键细胞因子,它通过促进HSC活化,使其失去脂质液滴及其向肌成纤维样细胞和成纤维细胞的转化,导致大量ECM合成,加重并最终导致HF。因此,肝纤维化发生的最终途径是HSC活化,如何抑制HSC活化是HF治疗的重要研究方向。
碧萝芷是法国西南部沿海森林中生长的松树的提取物,是一种水溶性复合抗氧化剂。它含有包括生物类黄酮、有机酸及其他有生物活性在内的40多种成分,其中以前花青素为主。原花青素注射的大鼠的血清代谢物可降低HepG2细胞脂类合成[7]。研究发现,碧萝芷具有清除自由基、皮肤保健、抗炎和防治心血管疾病等多种保健功能。碧萝芷可改善免疫缺陷小鼠的肝氧化应激状态[7],有效减轻Ⅱ型糖尿病大鼠中高血糖诱导的肝脏氧化损伤[8]和Ⅰ型糖尿病大鼠模型的糖尿病相关并发症,并抑制TNF-α和IL-1β等炎症因子表达[9]。大量文献显示,碧萝芷对顺铂诱导的大鼠急性肝损伤[10]以及四氯化碳诱导的大鼠肝氧化损伤和急性肝损伤均有明显的抑制作用[11-12]。而且,碧萝芷能显著抑制非酒精性脂肪性肝炎大鼠模型中的肝脂肪变性和和纤维化等肝损伤病理进程[5]。文献报道TGF-β1在人体HF组织中高表达,可在HF过程中诱导α-SMA和ColⅠ的表达[13],并促进HSC的活化增殖[14]。本研究发现,碧萝芷能下调TGF-β1诱导的α-SMA、ColⅠ和TIMP-1等蛋白表达,从而抑制LX-2细胞的活化。
自噬是细胞内大分子物质及细胞器参与自我更新及能量代谢的重要生物学过程,在促进HSC能量代谢并维持HSC活化状态过程中具有重要作用。HSC活化伴随着自噬流升高,下调HSC自噬则显著抑制其活化[15]。自噬抑制剂3-MA通过降低细胞增殖,并下调α-SMA、ColⅠ和LC3-Ⅱ/Ⅰ等蛋白表达,抑制HSC的活化增殖[16]。而且,TGF-β1可通过诱导自噬降低HSC凋亡[17],碧萝芷能降低万古霉素诱导的凋亡和自噬相关蛋白表达[18]。本实验发现,碧萝芷抑制TGF-β1诱导的LX-2细胞自噬。此外,ERK信号通路参与了细胞增殖分化、稳态维持、细胞凋亡等生物学反应,最近发现不同处理因素下ERK磷酸化的增强是自噬发生的一个重要因素[19]。TGF-β1促进ERK磷酸化[20],并刺激上调HSC中α-SMA和TIMP-1蛋白的表达[21]。另外,有研究表明,ERK磷酸化水平的下降和ECM沉积的减少能够有效抑制HF过程中HSC活化[22-23]。ERK抑制剂PD98059可有效抑制HSC中α-SMA的表达[24]。本实验结果表明,碧萝芷通过下调ERK磷酸化及自噬水平抑制TGF-β1诱导的肝星状细胞的活化。结合参考文献,我们推测,碧萝芷可能通过下调ERK介导的自噬抑制TGF-β1诱导的肝星状细胞活化。
[1] Bataller R, Brenner DA. Liver fibrosis[J]. J Clin Invest, 2005, 115(2): 209-218.
[2] 韩 冰, 谢汝佳, 洪 琴, 等. 肝纤维化病理过程中ZEB1和ZEB2的动态表达变化及意义[J]. 中国病理生理杂志, 2012, 28(9): 1639-1643.
[3] 俞富祥, 宋才鑫, 吴志伟, 等. 脂肪特异性蛋白27对大鼠肝星状细胞活化的影响[J]. 中国病理生理杂志, 2013, 29(9): 1597-1602.
[4] Rohdewald P. A review of the French maritime pine bark extract (Pycnogenol), a herbal medication with a diverse clinical pharmacology[J]. Int J Clin Pharmacol Ther, 2002, 40(4): 158-168.
[5] Mei L, Mochizuki M, Hasegawa N. Hepatoprotective effects of pycnogenol in a rat model of non-alcoholic steatohepatitis[J]. Phytother Res, 2012, 26(10): 1572-1574.
[6] Gressner AM, Weiskirchen R, Breitkopf K, et al. Roles of TGF-beta in hepatic fibrosis[J]. Front Biosci, 2002, 7: d793-d807.
[7] Lee J, Nam DE, Kim OK, et al. Pycnogenol attenuates the symptoms of immune dysfunction through restoring a cellular antioxidant status in low micronutrient-induced immune deficient mice[J]. Nutr Res Pract, 2014, 8(5): 533-538.
[8] Parveen K, Khan MR, Mujeeb M, et al. Protective effects of Pycnogenol on hyperglycemia-induced oxidative damage in the liver of type 2 diabetic rats[J]. Chem Biol Interact, 2010, 186(2): 219-227.
[9] Parveen K, Ishrat T, Malik S, et al. Modulatory effects of Pycnogenol in a rat model of insulin-dependent diabetes mellitus: biochemical, histological, and immunohistochemical evidences[J]. Protoplasma, 2013, 250(1): 347-360.
[10]Ko JW, Lee IC, Park SH, et al. Protective effects of pine bark extract against cisplatin-induced hepatotoxicity and oxidative stress in rats[J]. Lab Anim Res, 2014, 30(4): 174-180.
[11]Ahn TH, Yang YS, Lee JC, et al. Ameliorative effects of pycnogenol on carbon tetrachloride-induced hepatic oxidative damage in rats[J]. Phytother Res, 2007, 21(11): 1015-1019.
[12]Yang YS, Ahn TH, Lee JC, et al. Protective effects of Pycnogenol on carbon tetrachloride-induced hepatotoxicity in Sprague-Dawley rats[J]. Food Chem Toxicol, 2008, 46(1): 380-387.
[13]Liu Z, Yi J, Ye R, et al. miR-144 regulates transforming growth factor-β1-induced hepatic stellate cell activation in human fibrotic liver[J]. Int J Clin Exp Pathol, 2015, 8(4): 3994-4000.
[14]Xu T, Ni MM, Xing L, et al. NLRC5 regulates TGF-β1-induced proliferation and activation of hepatic stellate cells during hepatic fibrosis[J]. Int J Biochem Cell Biol, 2016, 70: 92-104.
[15]Thoen LF, Guimaraes EL, Dolle L, et al. A role for autophagy during hepatic stellate cell activation[J]. J Hepatol, 2011, 55(6): 1353-1360.
[16]刘 曼, 何 月, 张吉翔. 自噬抑制剂3-甲基腺嘌呤对肝星状细胞增殖活化的影响[J]. 细胞与分子免疫学杂志, 2013, 29(8): 809-812, 817.
[17]Fu MY, He YJ, Lv X, et al. Transforming growth factorbeta1 reduces apoptosis via autophagy activation in hepatic stellate cells[J]. Mol Med Rep, 2014, 10(3): 1282-1288.
[18]Bayomy NA, Abdelaziz EZ, Said MA, et al. Effect of pycnogenol and spirulina on vancomycin-induced renal cortical oxidative stress, apoptosis, and autophagy in adult male albino rat[J]. Can J Physiol Pharmacol, 2016, 94(8): 838-848.
[19]Hu P, Lai D, Lu P, et al. ERK and Akt signaling pathways are involved in advanced glycation end product-induced autophagy in rat vascular smooth muscle cells[J]. Int J Mol Med, 2012, 29(4): 613-618.
[20]潘霄羽, 王 燕, 黄高翔, 等. TGF-β1激活的p38 MAPK在TGF-β1上调人卵巢癌细胞PAI-1表达中的作用[J]. 中国病理生理杂志, 2015, 31(2): 284-288.
[21]吴艳玲, 安仁波, 宋顺宗. 山楂叶悬钩子水提取物对转化生长因子-β刺激的肝星状细胞活化的抑制作用及其机制[J]. 延边大学医学学报, 2013, 36(3): 170-173.
[22]Zhong C, Jiang C, Xia X, et al. Antihepatic fibrosis effect of active components isolated from green asparagus (AsparagusofficinalisL.) involves the inactivation of hepatic stellate Cells[J]. J Agric Food Chem, 2015, 63(26): 6027-6034.
[23]Xu Y, Peng Z, Ji W, et al. A novel matrine derivative WM130 inhibits activation of hepatic stellate cells and attenuates dimethylnitrosamine-induced liver fibrosis in rats[J]. Biomed Res Int, 2015, 2015:203978.
[24]宋雅芳, 吕志刚, 徐列明. 丹参酚酸B盐对转化生长因子β1活化的大鼠肝星状细胞内细胞外信号调节激酶信号转导通路的抑制作用(英文)[J]. 中西医结合学报, 2012, 10(4): 454-461.
(责任编辑: 卢 萍, 罗 森)
Pycnogenol suppresses TGF-β1-induced hepatic stellate cell activation via ERK-mediated autophagy inhibition
YANG Shu-juan1, HE Ying-li2, MA Xiao-hua3, JIANG Na1
(1DepartmentofHepatologySectionII,TheEighthHospitalofXi’an,2DepartmentofInfectiousDiseases,TheFirstAffiliatedHospitalofXi’anJiaotongUniversity,3DepartmentofIntensiveCareMedicine,TheEighthHospitalofXi’an,Xi’an710061,China.E-mail:pingxuqingdao@163.com)
AIM: To explore the effect of Pycnogenol on transforming growth factor-β1 (TGF-β1)-induced hepatic stellate cell activation. METHODS: Cultured LX-2 cells were treated with 5 μg/L TGF-β1 and different concentrations (0, 10, 25 and 50 mg/L) of Pycnogenol. The viability of the LX-2 cells under the conditions with or without autophagy inhibitor 3-MA and ERK inhibitor PD98059 was determined by MTT assay. The protein levels of α-SMA, ColⅠ, TIMP-1, LC3-Ⅱ/Ⅰ, beclin 1, p-ERK1/2 and ERK1/2 were detected by Western blot. RESULTS: Compared with control group, 5 μg/L TGF-β1 treatment elevated the cell viability, and increased the protein levels of α-SMA, ColⅠ, TIMP-1, LC3-Ⅱ/Ⅰ, beclin 1, p-ERK1/2, and ERK1/2 in the LX-2 cells (P<0.05). However, these effects were reversed by Pycnogenol pretreatment in a dose-dependent manner and the inhibitory effect of 50 mg/L Pycnogenol was the most significant in the LX-2 cells (P<0.05). Furthermore, compared with TGF-β1 group, pretreatment with 50 mg/L Pycnogenol, 5 mmol/L 3-MA or 20 μmol/L PD98059 downregulated TGF-β1-induced cell viability and the protein levels of α-SMA and LC3-Ⅱ/Ⅰ in the LX-2 cells (P<0.05). CONCLUSION: Pycnogenol suppresses TGF-β1-induced hepatic stellate cell activation via p-ERK and autophagy inhibition.
Pycnogenol; Transforming growth factor-β1; Autophagy; Hepatic stellate cells; Cell viability
1000- 4718(2016)12- 2261- 05
2016- 06- 22
2016- 09- 20
R575.2; R363
A
10.3969/j.issn.1000- 4718.2016.12.023
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 18700993968; E-mail: pingxuqingdao@163.com
