3-取代吲哚类化合物的合成研究进展
2016-12-30罗年华钟瑜红蔡久彪吴冬冬
罗年华,钟瑜红,王 勇,蔡久彪,吴冬冬
(1.上饶师范学院 化学化工学院,江西上饶334001;2. 上饶师范学院 教育技术与实验中心,江西上饶334001;3. 新建三中,江西南昌330100 )
3-取代吲哚类化合物的合成研究进展
罗年华1,钟瑜红2,王 勇1,蔡久彪3,吴冬冬1
(1.上饶师范学院 化学化工学院,江西上饶334001;2. 上饶师范学院 教育技术与实验中心,江西上饶334001;3. 新建三中,江西南昌330100 )
吲哚类化合物的合成是杂环化学中重要的研究内容。吲哚类化合物广泛存在于天然有机物中,具有显著的药理和生物活性。作为吲哚类化合物的重要组成部分,3-取代吲哚类化合物在药物、食品添加剂等领域有非常广泛地应用。对近年来3-取代吲哚类衍生物的合成方法及其研究进展进行了综述。
3-取代吲哚;合成;杂环化学
吲哚类化合物具有显著的药理和生物活性[1],广泛存在于天然产物中,其在药物、食品添加剂及染料等领域有着广泛的应用[2-3]。许多天然吲哚类化合物可以作为药物分子,如目前已知的3000多种天然吲哚生物碱中,有40多种是治疗性药物[4]。3-取代吲哚类化合物作为吲哚化合物的重要组成部分,在药物、食品添加剂等领域应用广泛,如已被应用于治疗心脏病、光敏症、癌症、艾滋病等[5]。通过研究者们的不断研究和探索,现已发展出多种合成3-取代吲哚类化合物的方法。这些方法具有成本低、反应收率高、应用范围广等优点。本文主要综述了近年来3-取代吲哚类化合物的合成,如:3-硫化吲哚类、3-吲哚醇类、3-吲哚醛类化合物的合成等。
1 3-硫化吲哚类化合物的合成
1.1 以硫酚、硫醇为原料合成3-硫化吲哚类化合物
2009年,Yadav课题组[6]以乙腈为溶剂,FeCl3为催化剂,以吲哚类衍生物、硫醇或硫酚为原料,加热回流,通过直接硫化反应,高收率地获得了3-硫化吲哚类化合物。该反应具有操作简单、底物拓展性好、反应时间短、产率高等优点(图1)。

图1 3-硫化吲哚类化合物的合成
1.2 以吲哚和二硫醚、二硒醚为原料合成3-硫化吲哚类化合物
2009年,李金恒课题组[7]以FeF3和碘为催化剂,以吲哚类化合物、二硫醚或二硒醚为原料,发生亲电取代反应,高收率地获得了3-硫化吲哚类衍生物。该反应的优点是底物拓展性好和产率高;不足是反应速度比较慢,需要反应36 h(图2)。
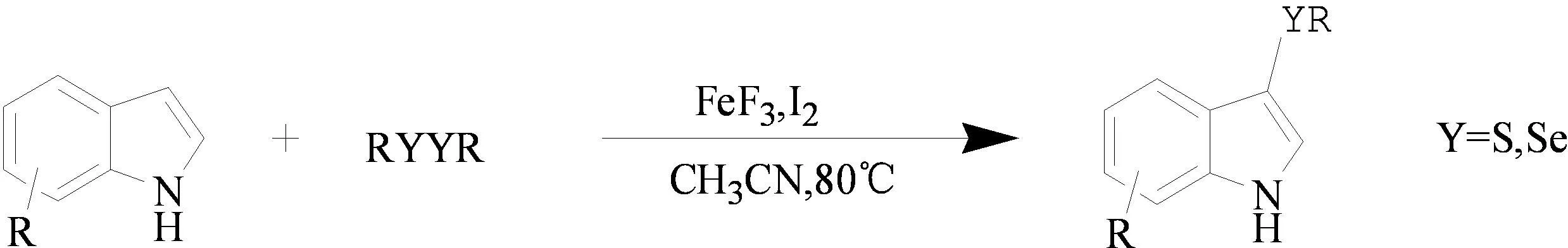
图2 3-硫化吲哚类化合物的合成
该课题组提出了可能的反应机理(图3):二硫醚首先和碘反应生成碘代硫醇,接着碘代硫醇作为亲电试剂,与吲哚发生亲电取代反应获得了3-硫化吲哚类衍生物。

图3 可能的反应机理
1.3 以N-硫基邻苯二甲酰胺为原料合成3-硫化吲哚类化合物
2010年,Silieira课题组[8]以无水CeCl3为催化剂,以DMF为溶剂,以取代吲哚和N-硫基邻苯二甲酰亚胺为原料,高收率地获得了3-硫化吲哚衍生物。该反应的优点是反应时间较短、操作简单和产率高等;其不足是底物的拓展性不是很好和N-硫芳基邻苯二甲酰胺的价格昂贵等 (图4)。

图4 3-硫化吲哚类化合物的合成
2 3-吲哚醇类化合物的合成
2.1 以丙烯酰苯胺为原料合成3-吲哚醇类化合物
2010年,潘毅课题组[9]以Pb为催化剂,在过氧化叔丁醇共同催化氧化作用下,丙烯酰苯胺可以得到3-取代的过氧化吲哚-2-酮化合物。然后,经过钯碳的催化氢化,可以得到3-羟基吲哚-2-酮类化合物(图5)。
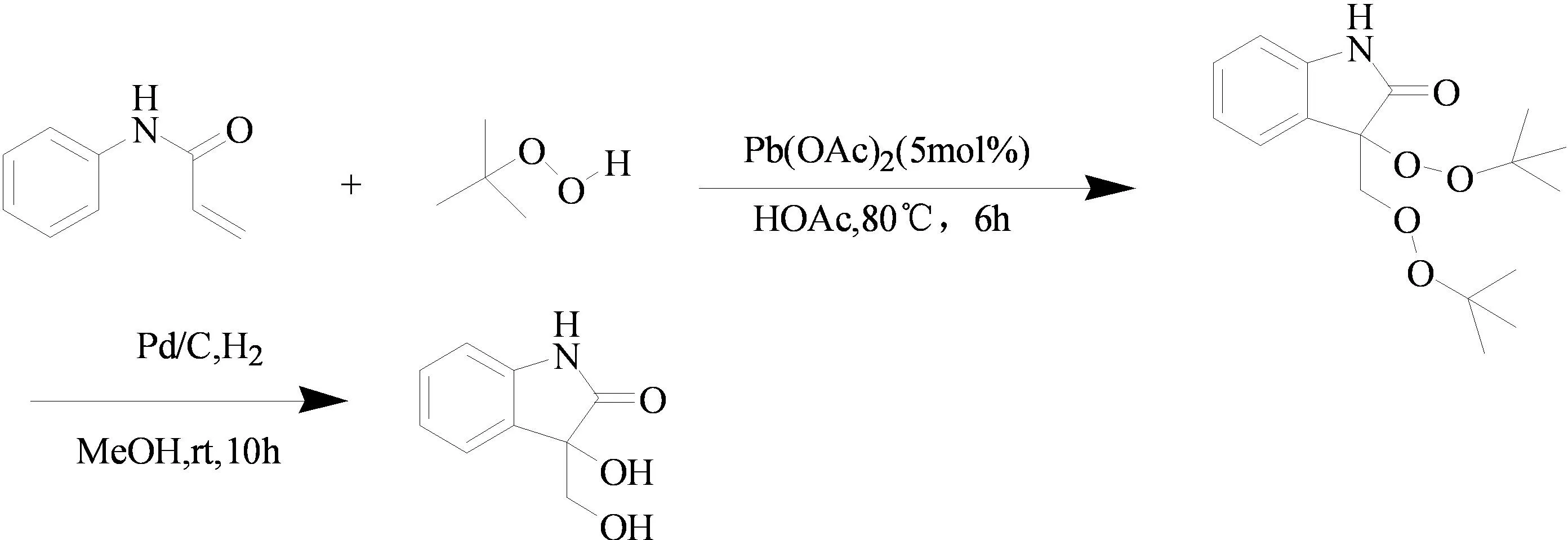
图5 3-吲哚醇类化合物的合成
2.2 以邻硝基甲苯为原料合成3-吲哚醇类化合物
2013年,陶炳志等[10]以邻硝基甲苯为原料,通过溴化、类羟醛缩合、成环、甲醛化和还原等五步反应,以26.5%的总收率合成了6-溴代吲哚3-甲醇。该化合物经过简单的步骤能够合成药性更好的3-吲哚甲醇类衍生物(图6)。
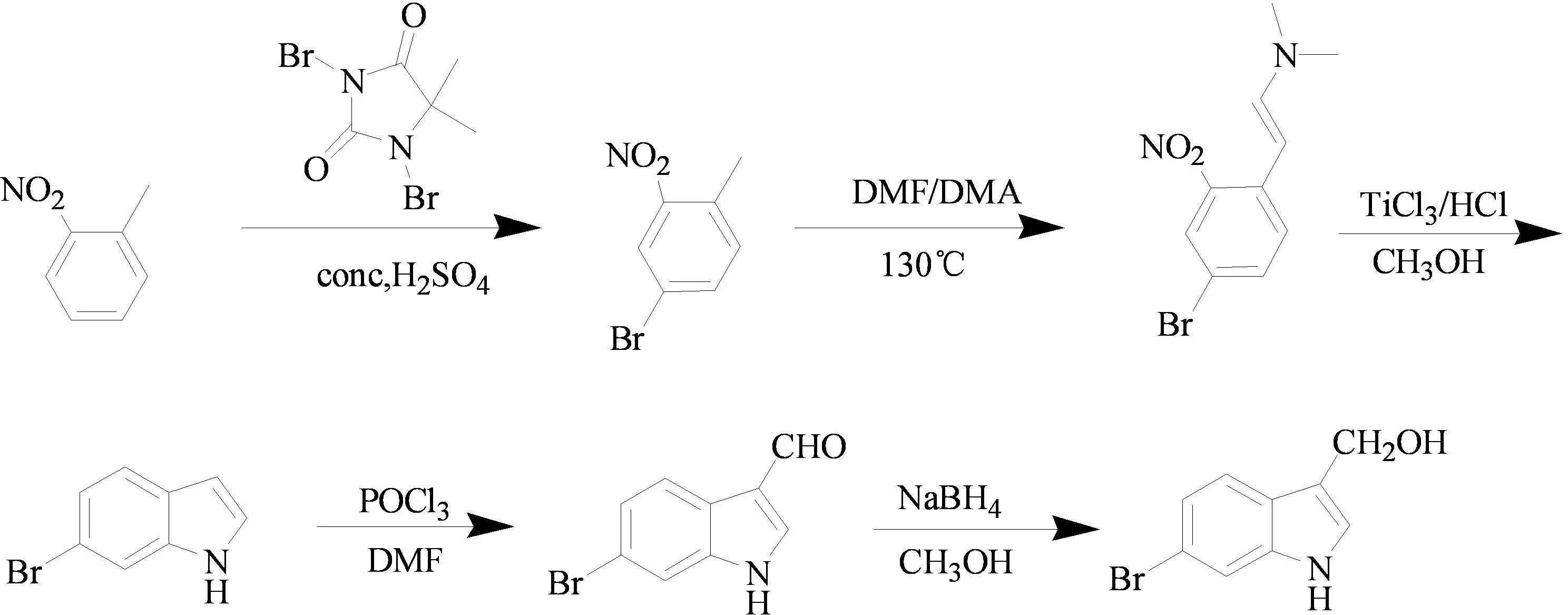
图6 3-吲哚醇类化合物的合成
3 3-吲哚醛类化合物的合成
3.1 以取代邻硝基甲苯为原料合成3-吲哚醛类化合物
2006年,葛裕华课题组[11]利用Leigruber-Batcho吲哚合成法,以N,N-二甲基甲酰胺为溶剂,以哌啶、取代邻硝基甲苯和N,N-二甲基甲酰胺(DMF)/二乙基缩醛(DEA)或N,N-二甲基甲酰胺(DMF)/二甲基缩醛(DMA)为原料,经缩合反应制得了取代的β-哌啶基-2-硝基苯乙烯,然后以铁粉和冰醋酸为还原体系,经环合反应制得了取代吲哚。最后,将前面获得的取代吲哚与三氯氧磷和DMF反应制得了3-吲哚甲醛类化合物。该方法的优点是条件温和、原料便宜易得和收率较高等(图7)。
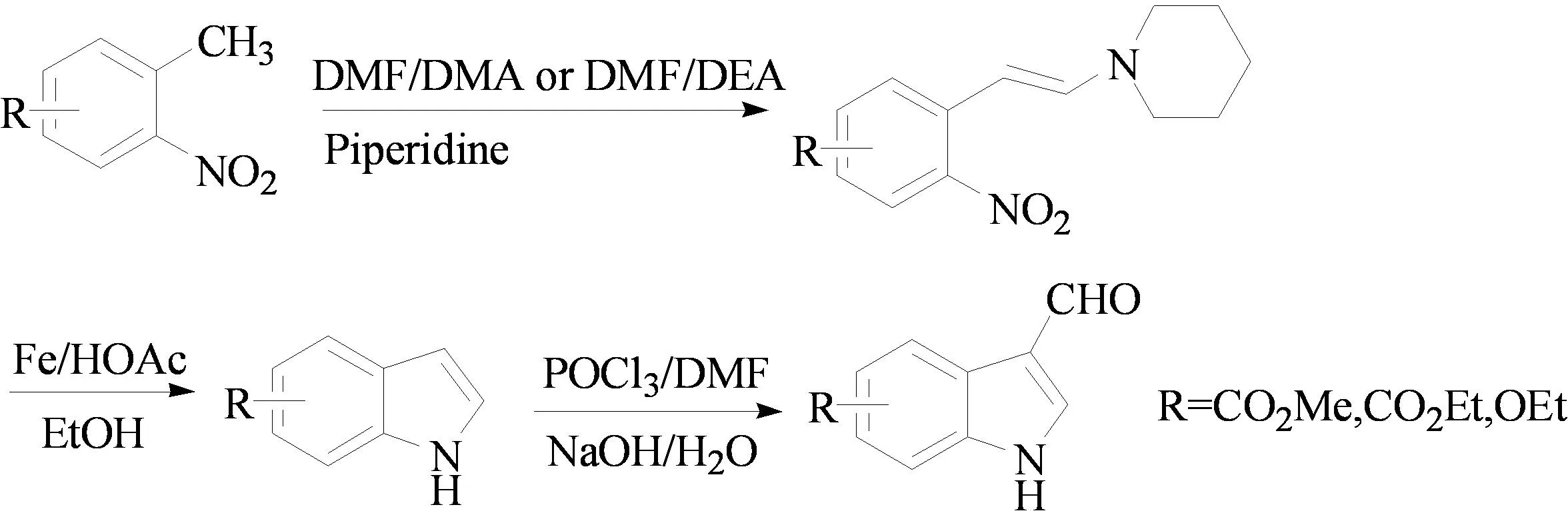
图7 3-吲哚醛类化合物的合成
3.2 以取代吲哚为原料合成3-吲哚醛类化合物
2013年,郑晶课题组[12]以清洁、环境较友好的草酰氯/N,N-二甲基甲酰胺(DMF)为原料(传统的方法以三氯氧磷/DMF为原料),通过改进的Vilsmeier-Haack反应合成一系列3-吲哚甲醛类化合物,收率为80%~95% (图8)。

图8 3-吲哚醛类化合物的合成
4 其他3-取代吲哚类化合物的合成
4.1 以取代马来酰亚胺为原料合成单/双吲哚马来酰亚胺类化合物
2010年,Yasuhiro课题组[13]报道了4-甲硫基马来酰亚胺在醋酸溶剂中与吲哚直接发生加成-消除反应得到了一系列单吲哚马来酰亚胺类化合物 (图9)。

图9 3-单吲哚马来亚胺类化合物的合成
2010年,中国科学院药物研究所陈晓光课题组[14]以N-Ts取代的吲哚为原料,经过两步简单反应合成了3-吲哚硼酸。然后在零价Pd催化下,3-吲哚硼酸和N-甲基二溴马来酰亚胺通过Suzuki偶联合成了双吲哚马来酰亚胺 (图10)。
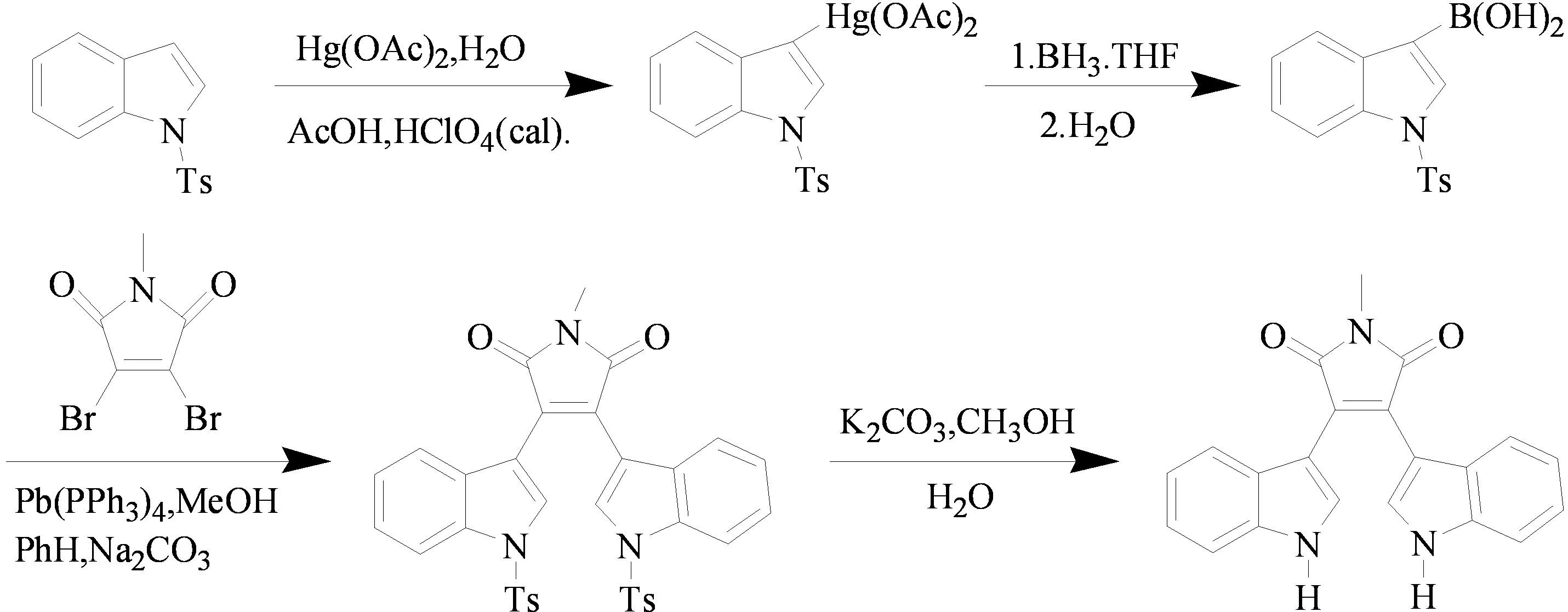
图10 3-双吲哚马来亚胺类化合物的合成
4.2 以不饱和酮为原料合成3-取代吲哚类化合物
针对传统的合成该类化合物方法的不足,2011年蔡源课题组[15]对催化剂进行了改进与筛选,以三价镓十二烷基硫酸盐Ga(DS)3为催化剂,以水为溶剂,高效地获得了一系列3-吲哚酮类化合物(图11)。
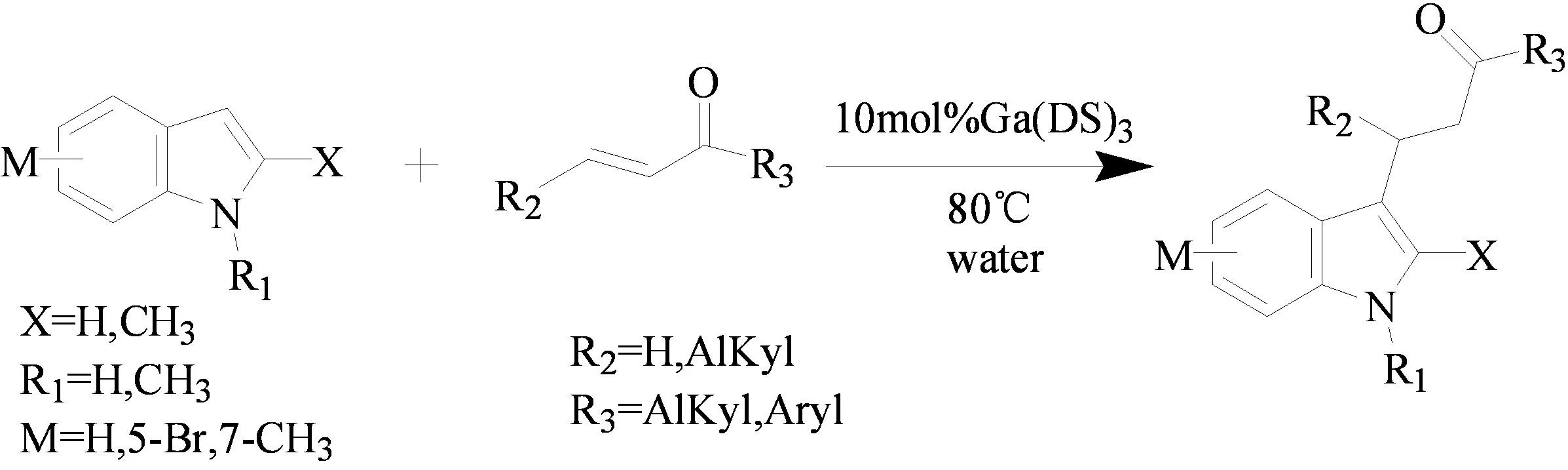
图11 3-吲哚酮类化合物的合成
4.3 以苯基硫代酰胺为原料合成3-取代吲哚类化合物
2011年,Patrazia Diana课题组[16]以溴乙酰基吲哚和苯基硫代酰胺为原料,发生Hantzsch反应,高收率地获得了含有咪唑骨架的3-吲哚类化合物(图12、13)。通过对人类肿瘤中的NCI-60肿瘤细胞株活性检测表明,含有咪唑骨架的3-吲哚类化合物对该类肿瘤细胞株有良好的抑制作用。
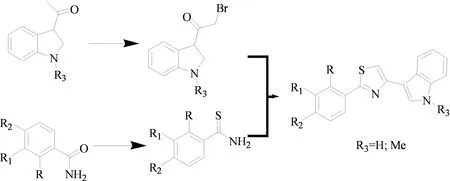
图12 其他3-取代吲哚化合物的合成

图13 其他3-取代吲哚化合物的合成
5 总结与展望
经过化学家们的不断探索与研究,3-吲哚类化合物的合成已经取得了相当大的成就。但是有些反应仍然存在一些不足:如时间较长或者底物的拓展性不是很好等。所以,在寻求高效、廉价的催化体系和开发新的对底物拓展性好的合成3-吲哚类化合物新方法等方面,仍亟待化学家们的不懈努力。
[1] 李记太, 代红光, 蔺志平. 3-取代吲哚衍生物的合成[J]. 化学进展, 2007, 19(5): 751-761.
[2] LO K K, TSANG K H, HUI W K, et a1. Luminescent rhenium(I)diimine indole conjugates·photophysical,eleetrochemical and protein. binding properties[J]. Chem Commu, 2003, 21: 2704-2705.
[3] RAMIREZ A, GARCIA R S. Current progress in the themistry and pharmacology of akuammiline alkaloids[J]. Curr Med Chem, 2003, 10(18): 1 891-1 915.
[4] 于晶, 于良民, 李霞, 等. 吲哚类化合物的合成方法及应用研究进展[J]. 广州化工, 2011,39(13): 4-5,30.
[5] 孙祥军, 徐继光, 段启虎, 等. 吲哚类化合物的抗肿瘤作用[J]. 聊城大学学报(自然科学版), 2011,23(2): 28-32,66.
[6] YADAV J S, REDDY B V. Iron (Ⅲ) chloride: A versatile catalyst for the practical synthesis of 3-sulfenylindoles [J]. Synthesis, 2009, 9: 1520-1524.
[7] FANG X L, TANG R Y, ZHONG P, et al. Iron-catalyzed sulfenylation of Indoles with disulfides promoted by a eatalytic amount of iodine [J]. Synthesis, 2009, 24: 4183-4189.
[8] SILVEIRA C C, Mendes S R, Wolf L, et al. The use of anahydrous CeCl3as catalyst for the synthesis of 3-sulfenyl indoles [J]. Terahedron Lett, 2010, 15: 2014-2016.
[9] AN G, ZHOU W, ZHANG G, et al. Palladium-catalyzed tandem diperoxidation C-H activation resulting in diperoxy-oxindole in air [J]. Org Lett, 2010, 12: 4482-4485.
[10] 陶炳志, 陈何如. 抗肿瘤化合物6-溴代吲哚-3-甲醇的设计合[J]. 中山大学学报(自然科学版), 2012,51(2):3-4.
[11] 葛裕华, 吴亚明, 薛忠俊. 取代吲哚-3-甲醛类化合物的合成[J]. 有机化学, 2006,26(4): 563-567.
[12] 郑晶, 肖绪枝, 肖胜伟, 等. 取代吲哚-3-甲醛类化合物的一种高效合成法[J]. 化学研究与应用, 2013,25(5): 760-763.
[13] SHIGEMITSU Y, KOMIYA K, MIZUYAMA N, et al. Synthesis and TDDFT Investigation of new maleeimmide derivatives bearing pyrrole and indole[J]. Ring Research Letters in Organic Chemistry, 2009(5): 1-5.
[14] WANG K, LI X Y, CHEN X G, et al. Symthesis and antitumor activity of bisindolyl maleimide and amino acid ester conjugates[J]. Journal of Asian Natural Products Research, 2010(1): 36-42.
[15] 蔡源, 蒋丽芬, 许宁, 等.绿色高效Ga (DS)-3在溶剂水中催化加成吲哚酮类化合物[J]. 上海化工, 2011,36(11): 9-11.
[16] DIANA P, CARBONE A, BARAJA P, et al. Synthesis and antitumor activity of 3-(2-phenyl-1, 3-thiazol-yl)-1H-indoles and 3-(2-phenyl-1, 3-thiazol-4-yl)-1H-7-azain doles[J]. Chem Med Chem, 2011(6): 1300-1309.
The Research Progress of 3-substituted Indole Derivatives
LUO Nian-hua1*, ZHONG Yu-hong2, WANG Yong1, CAI Jiu-biao3, WU Dong-dong1
(1. School of Chemistry and Chemical Engineering, Shangrao Normal University, Shangrao Jiangxi 334001,China; 2. Educational Technology & Expenimental Center, Shangrao Normal University, Shangrao Jiangxi 334001,China; 3. The Third Middle School of Xin-jian, Nanchang Jiangxi 330100,China)
The synthesis of indole is important research content in heterocyclic chemistry. Indole and its derivatives widely exists in the natural organics, and has a unique pharmacological and biological activity. As an important part of substituted indole derivatives, 3-substituted indole derivatives has a wide range of application in many research fields, such as medicine, food additives, and et al. In this article, the synthetic methods and research progress of 3-substituted indole derivatives in recent years were reviewed.
3-substituted indole; synthesis; heterocyclic chemistry
2016-03-31
江西省教育厅科技计划项目(GJJ151052);江西省大学生创新创业训练计划项目 (201510416006)
罗年华(1982-),男,江西吉安人,讲师,博士,主要研究方向为不对称合成和方法学研究。E-mail:luoxiaoge102@163.com
O626
A
1004-2237(2016)06-0050-05
10.3969/j.issn.1004-2237.2016.06.011
