鹿茸水提物对四氯化碳致小鼠肝损伤的防护作用研究
2016-12-29覃燕妮
覃燕妮
(广西壮族自治区南宁市中医医院,广西 南宁 530001)
鹿茸水提物对四氯化碳致小鼠肝损伤的防护作用研究
覃燕妮
(广西壮族自治区南宁市中医医院,广西 南宁 530001)
目的 研究鹿茸水提物对四氯化碳(CCl4)所致小鼠急性化学性肝损伤的防护作用及机制。方法 将SPF级昆明种小鼠分为正常组、模型组、鹿茸水提物高剂量组(40 g/kg)、鹿茸水提物中剂量组(20 g/kg)、鹿茸水提物低剂量组(10 g/kg)及联苯双酯组(200 mg/kg)。正常组和模型组以生理盐水灌胃,鹿茸水提物各剂量组和联苯双脂组分别给予相应药物,连续给药7 d,每天1次。采用ELISA试剂盒测定各组小鼠丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)、超氧化物歧化物(SOD)、丙二醛(MDA)、还原型谷胱甘肽(GSH)和谷胱甘肽过氧化物酶(GSH-PX)的含量。采用ELISA试剂盒测定小鼠血清中炎症因子肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白(MCP-1)、白细胞介素-6(IL-6)含量,采用荧光定量PCR法测定炎症因子TNF-α,MCP-1,IL-6的基因表达水平。采用HE染色法观察各组小鼠肝细胞损伤程度。结果 鹿茸水提物高剂量组能明显降低肝损伤小鼠血清的AST及ALT活性(P<0.01),还能显著提高肝组织中SOD,GSH和GSH-PX的活性(P<0.05或 P<0.01),并降低MDA含量,降低炎症因子TNF-α,MCP-1,IL-6含量和基因表达。HE染色结果表明鹿茸能减轻CCl4诱导的小鼠急性肝损伤。结论 鹿茸对CCl4诱导的小鼠急性肝损伤具有一定防护作用,其作用机制可能是通过清除自由基,抑制脂质过氧化,还可能通过减少炎症反应,从而减轻肝损伤。
鹿茸;四氯化碳;肝损伤;小鼠
近年来,越来越多的毒物或药物引起肝损伤,虽然治疗方法在不断发展,但并未得到根本解决,肝损伤的防治依然是一个世界性严峻课题。鹿茸为鹿科动物梅花鹿 Cervus Nippon Temminck var.mantchuricus Swinhoe或马鹿 Cervus elaphus L.尚未骨化的幼角,是传统中医的名贵中药,具有广泛的药理作用,如调节心血管、强壮、性激素样、促进创伤愈合、抗衰老等[1]。但鹿茸抗肝损伤作用及作用机理,目前尚不十分清楚。本研究中对鹿茸抗肝损伤作用及作用机理进行了研究,旨在阐明鹿茸新的药理作用,为充分开发鹿茸新的药用价值,研制开发鹿茸抗肝损伤新药提供理论基础。现报道如下。
1 材料与方法
1.1 动物、材料与仪器
1.1.1 动物
SPF级雄性昆明种小鼠,体质量(20±2)g,由广西医科大学实验动物中心提供,动物合格证编号为SCXK桂2014-0002,动物使用许可证号为SYXK桂2014-0053。
1.1.2 药物与试剂
鹿茸水提物由广西医科大学药理教研室自行提取;四氯化碳(CCl4,成都市科龙化工试剂厂,批号为20150965);联苯双酯滴丸(广西星群药业股份有限公司,批号为HF40038);天门冬酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒,均由南京建成生物工程研究所提供,批号为20150527。
1.1.3 仪器
TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);EL204型电子天平(上海梅特勒-托多利多仪器有限公司)。
1.2 试验方法
1.2.1 动物分组及给药方法[2]
选取 SPF级雄性昆明种小鼠 60只,随机分成 6组,每组10只,即正常对照组(NC)、模型组(MC)、联苯双酯组(BPDC,200 mg/kg),鹿茸水提物高、中、低剂量组(LRH,LRM,LRL,给药剂量分别为40 g/kg,20 g/kg,10 g/kg)。正常组和模型组小鼠按每10 g体质量0.2 mL灌胃生理盐水(NS),其余各组小鼠灌胃相应药物,每天1次,连续灌胃7 d。末次给药后1 h,除正常对照(NC)组外,其余各组小鼠腹腔注射0.2%CCl4花生油溶液10 mL/kg。禁食不禁水24 h后,取血及脏器进行测定。
1.2.2 观察指标
一般指标:试验过程中每天观察小鼠活动状况及对外来刺激的反应,监测小鼠体质量变化。
肝脏指数:取血后颈椎脱臼处死小鼠,快速剖腹取出肝脏,用冰生理盐水漂洗去除积血,拭净后称重并记录,按公式计算肝脏指数,肝脏指数=[肝脏质量(g)/体质量(g)]×100%。
血清生化指标[3]:摘除小鼠眼球取血,将凝固的血液于3 000 r/min离心10 min,分离血清,按各试剂盒说明书的要求测定血清中的AST及ALT活性、炎症因子,如肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白(MCP-1)、白细胞介素-6(IL-6)含量。
肝组织生化指标[4]:选适量肝组织,用冷生理盐水漂洗去除积血,擦干,称重,加入其质量9倍体积的冰生理盐水制成10%肝匀浆,4℃ 3 500 r/min离心15 min,取上清液,按各试剂盒说明书的要求测定SOD,MDA,还原型谷胱甘肽(GSH),谷胱甘肽过氧化物酶(GSH-PX)含量。
肝脏病理学检查:取肝脏左叶距边缘0.5 cm处小块组织,用10%甲醛固定,按常规脱水、透明、浸蜡、包埋、切片后显微镜下观察组织形态学,拍摄片。肝细胞脂肪变性程度和坏死及炎症活动度判断标准分4级[5],见表1。

表1 肝细胞脂肪变性程度和坏死及炎症活动度分级标准
1.2.3 荧光定量PCR法[6]
引物的设计:结果见表2。

表2 PCR引物信息
内参照基因与目的基因扩增效率检测:将正常组cDNA进行倍比稀释,获得原倍、2-1倍、2-2倍、2-3倍、2-4倍、2-5倍、2-6倍浓度的cDNA,并将其作为模板,用上述引物分别扩增β-actin与TNF-α,MCP-1,IL-6。每个样本设3个平行管,20 μL反应体系为2×SY BR Prem ix Ex Taq 10 μL,上下游引物各1 μL,cDNA 3 μL,ROX Reference D yeⅡ0.4 μL,ddH2O 4.6 μL。反应条件为95℃ 60 s;95℃ 10 s,55℃ 20 s,72℃ 20 s,72℃时收集荧光信号,共进行40个循环。PCR扩增结束后,从55~95℃全程读取荧光信号获得融解曲线,以确定扩增产物的特异性。以稀释倍数的2的对数值为 X轴,β-actin和 TNF-α,MCP-1,IL-6的CT值为 Y轴,进行线性回归,观察两条线的斜率,以确定内参βactin基因与目的基因TNF-α,MCP-1,IL-6的扩增效率是否一致。
TNF-α,MCP-1,IL-6 m R N A的表达水平检测:分别以β-actin和TNF-α,MCP-1,IL-6引物进行荧光定量PCR,获得CT均值后,计算Δ CT(CT内参-CT目的)和ΔΔ CT(试验组Δ CT-正常组Δ CT)。并计算试验组TNF-α,MCP-1,IL-6 mRNA表达改变的倍数(2-ΔΔCT)。
1.3 统计学处理
2 结果
2.1 一般指标观察
各组小鼠体质量均有所增加,与正常对照组相比,模型组小鼠体质量增加较缓慢,小鼠反应迟钝,倦卧少动,精神萎靡,毛色黯淡无光泽,出现脱毛现象。鹿茸水提物高、中剂量组比低剂量组小鼠毛色略好,反应略快,营养状态尚可。
2.2 肝脏指数
与正常对照组比较,模型组小鼠肝脏指数明显上升(P<0.05);与模型组比较,鹿茸水提取中、高剂量给药组小鼠肝脏指数有降低趋势(P<0.05)。表明鹿茸水提物对小鼠的肝脏质量有影响。见表3。
表3 鹿茸水提物对肝损伤小鼠肝脏指数的影响(s,n=10)

表3 鹿茸水提物对肝损伤小鼠肝脏指数的影响(s,n=10)
注:与NC组相比,△P<0.05;与MC组相比,*P<0.05。
组别NC组MC组BPDC组LRL组LRM组LRH组剂量(g/kg)--0.20 10 20 40肝脏指数(%)4.24±0.63 5.27±0.94△4.25±0.58 4.77±0.63 4.58±0.86*4.35±0.57*
2.3 血清AST及ALT水平
鹿茸水提物高、中剂量组和BPDC组血清AST含量均降低(P<0.05);鹿茸低剂量对小鼠血清AST的影响无统计学意义(P>0.05)。鹿茸水提物高剂量组和BPDC组血清ALT含量均降低(P<0.05);鹿茸水提物中、低剂量对小鼠血清ALT的影响无统计学意义(P>0.05)。见表4和图1。
2.4 肝组织SOD,MDA,GSH和GSH-PX水平
鹿茸水提物各剂量组和BPDC组肝组织中SOD,GSH和GSH-PX的活性均显著提高(P<0.05或 P<0.01),MDA含量降低(P<0.05)。见表5和图2。
表4 鹿茸水提物对肝损伤小鼠血清ALT及AST影响(s,U/L,n=10)
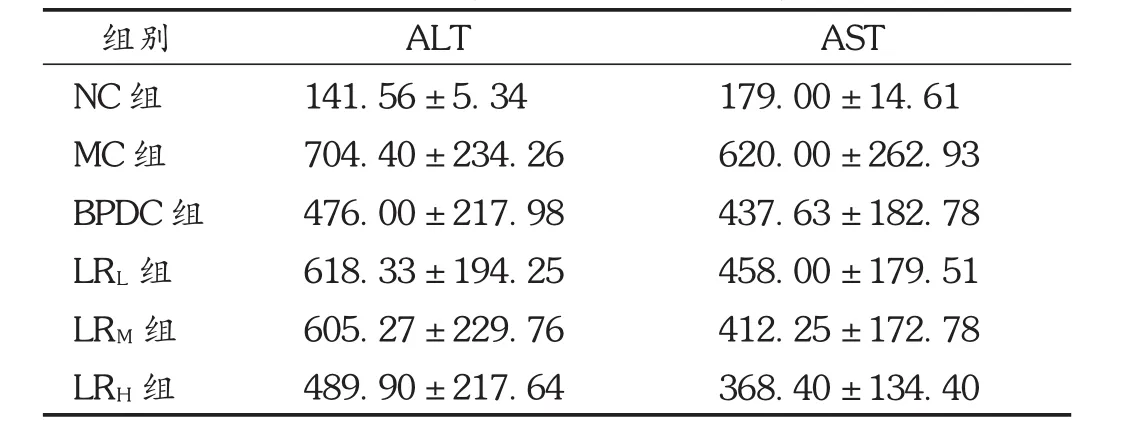
表4 鹿茸水提物对肝损伤小鼠血清ALT及AST影响(s,U/L,n=10)
注:与 NC组相比,△P<0.05;与 MC组相比*P<0.05,**P<0.01,***P<0.001。表5和表6同。
LRM组LRH组605.27±229.76*489.90±217.64**412.25±172.78**368.40±134.40***
2.5 炎症因子表达
鹿茸水提物各剂量组和BPDC组TNF-α mRNA,MCP-1 mRNA,IL-6 mRNA的基因水平均显著降低,小鼠血清中TNF-α,MCP-1,IL-6的含量降低(P<0.05或P<0.01)。见表6和图3。
2.6 肝脏病理组织学变化
对CCl4所致急性肝损伤小鼠肝组织病理组织学进行观察,光学显微镜下,可见正常对照组小鼠肝细胞以中央静脉为中心呈索状排列放射状行走,肝细胞、肝细胞索、肝窦无异常,肝间质无充血、水肿和炎细胞浸润,汇管区无纤维增生。模型组小鼠肝小叶结构欠清晰,肝小叶周边及部分小叶中央区肝细胞呈大片凝固性坏死,坏死呈槽状或桥接连片样,部分肝细胞则呈气球样变性或脂肪变性,胞浆疏松化并有不同程度的炎症反应,汇管区未见纤维增生。鹿茸水提物低剂量组与模型组接近;鹿茸水提物中剂量组小鼠肝小叶结构不清晰,小叶周边肝细胞呈小片坏死;鹿茸水提物高剂量组及BPDC组小鼠肝细胞呈轻度弥漫性颗粒样变性,未见充血、水肿和炎细胞浸润。病理分级结果表明,鹿茸水提物各剂量组及BPDC组小鼠肝损伤程度与模型组比较,差异均有统计学意义(P<0.01或 P<0.05)。见表7及图4。
表5 鹿茸水提物对肝损伤小鼠肝组织SOD,MDA,GSH和GSH-PX的影响(s,n=10)
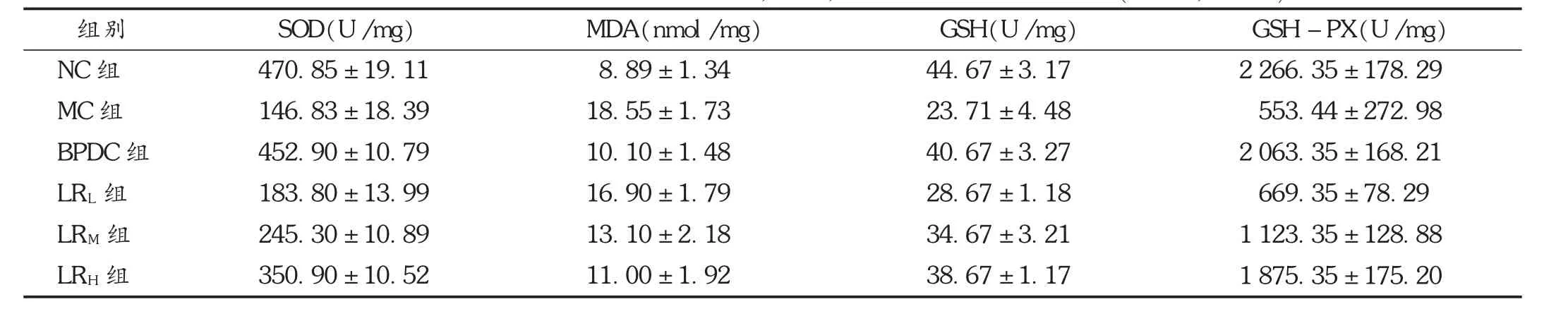
表5 鹿茸水提物对肝损伤小鼠肝组织SOD,MDA,GSH和GSH-PX的影响(s,n=10)
组别NC组MC组BPDC组LRL组LRM组LRH组SOD(U/mg)470.85±19.11 146.83±18.39△452.90±10.79***183.80±13.99 245.30±10.89*350.90±10.52**MDA(nmol/mg)8.89±1.34 18.55±1.73△10.10±1.48**16.90±1.79 13.10±2.18*11.00±1.92**GSH(U/mg)44.67±3.17 23.71±4.48△40.67±3.27***28.67±1.18*34.67±3.21**38.67±1.17***GSH-PX(U/mg)2 266.35±178.29 553.44±272.98△2 063.35±168.21***669.35±78.29 1 123.35±128.88*1 875.35±175.20**
表6 鹿茸水提物对肝损伤小鼠炎症因子的影响(s,n=10)
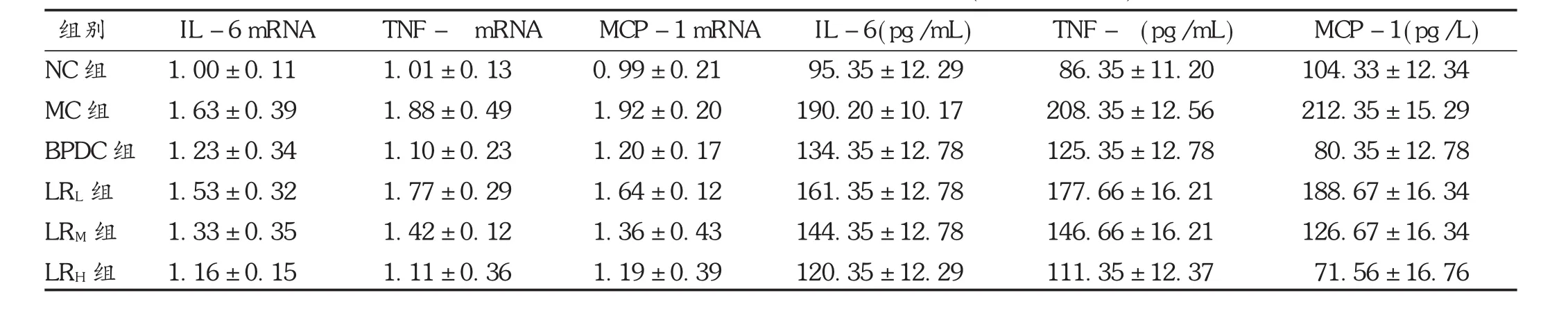
表6 鹿茸水提物对肝损伤小鼠炎症因子的影响(s,n=10)
组别NC组MC组BPDC组LRL组LRM组LRH组IL-6 mRNA 1.00±0.11 1.63±0.39△1.23±0.34***1.53±0.32*1.33±0.35**1.16±0.15***TNF-α mRNA 1.01±0.13 1.88±0.49△1.10±0.23***1.77±0.29*1.42±0.12**1.11±0.36***MCP-1 mRNA 0.99±0.21 1.92±0.20△1.20±0.17***1.64±0.12*1.36±0.43**1.19±0.39***IL-6(pg/mL) 95.35±12.29 190.20±10.17△134.35±12.78***161.35±12.78*144.35±12.78**120.35±12.29***TNF-α(pg/mL) 86.35±11.20 208.35±12.56△125.35±12.78***177.66±16.21*146.66±16.21**111.35±12.37***MCP-1(pg/L) 104.33±12.34 212.35±15.29△80.35±12.78***188.67±16.34*126.67±16.34**71.56±16.76***
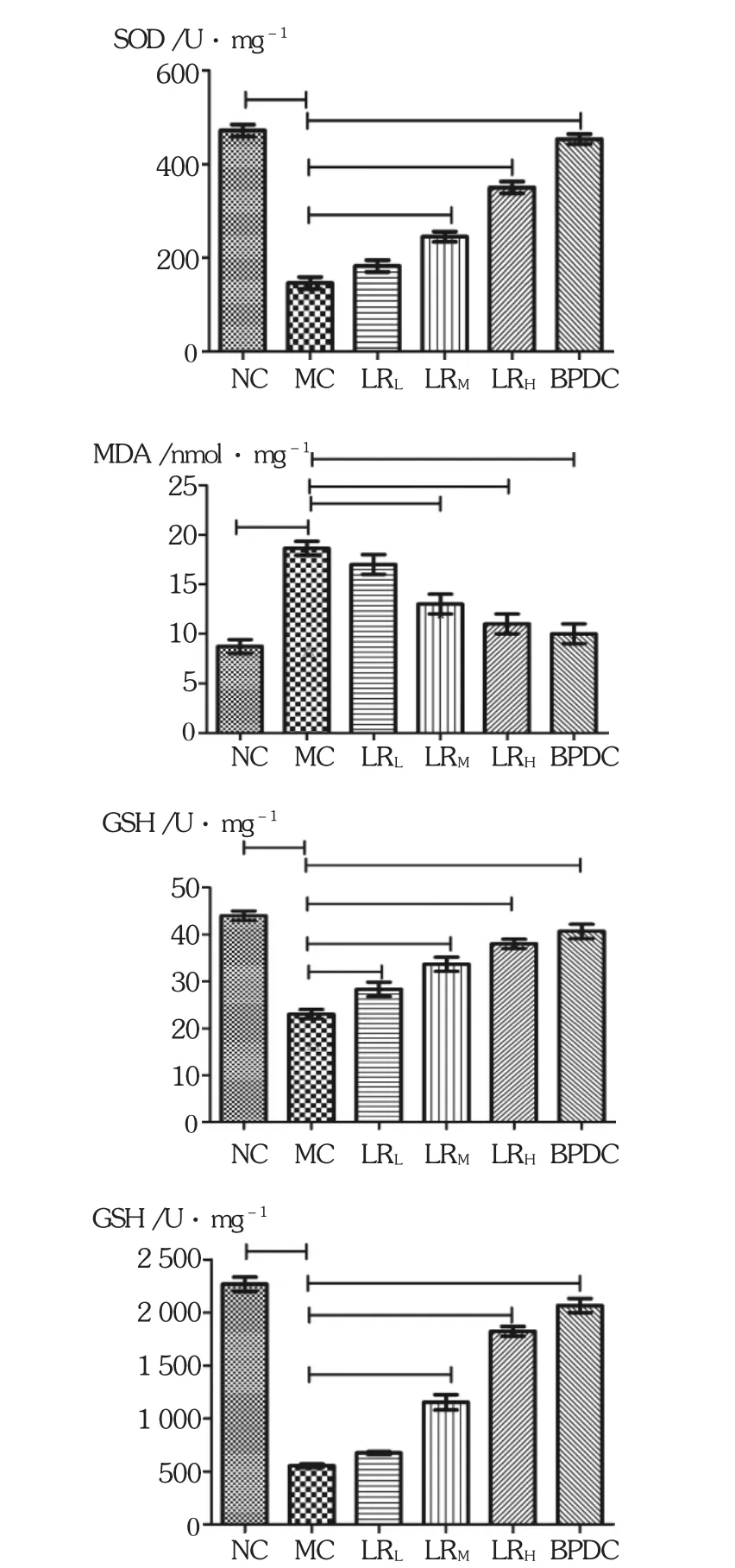
图2 鹿茸水提物对肝损伤小鼠肝组织SOD,MDA,GSH和GSH-PX的影响(n=10)
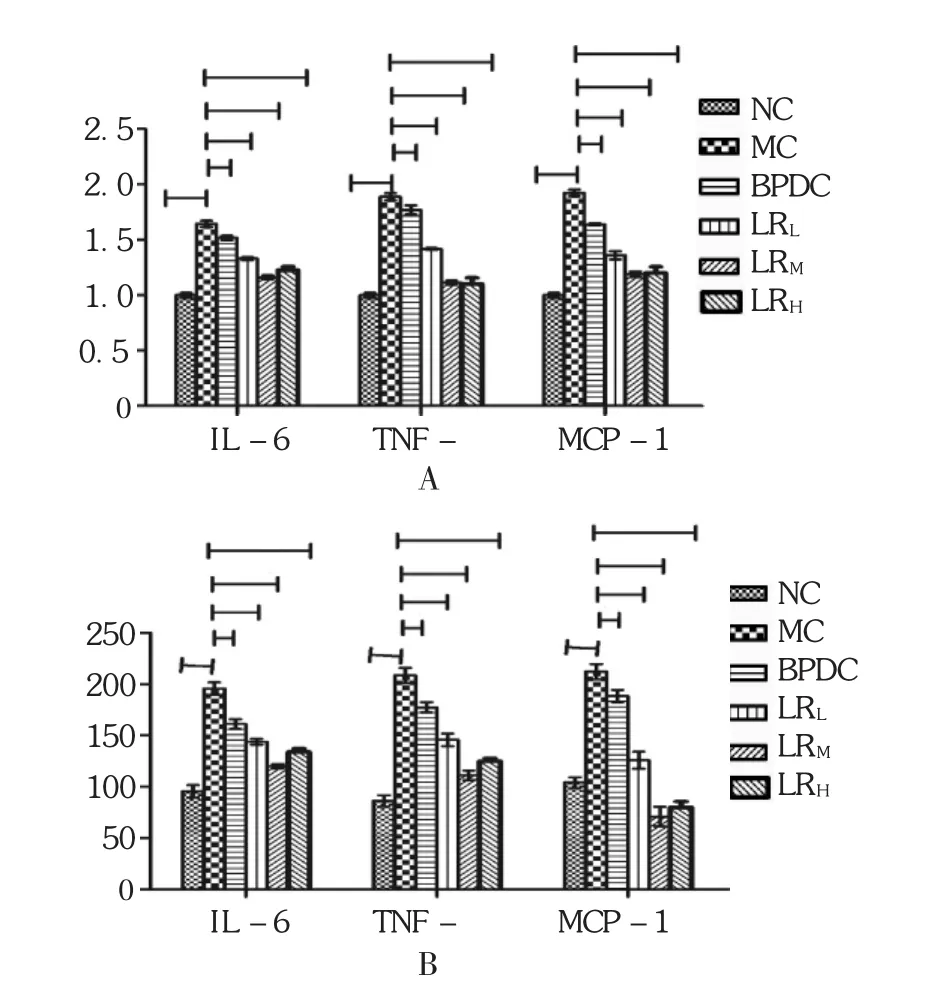
图3 鹿茸水提物对肝损伤小鼠肝组织SOD,MDA,GSH和GSH-PX的影响(n=10)
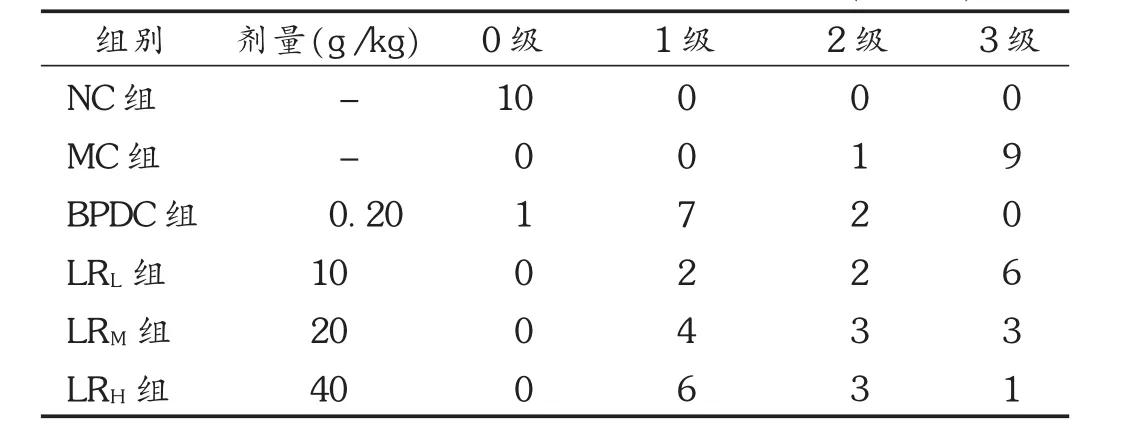
表7 各组小鼠肝损伤程度的病理分级情况(n=10)
3 讨论
严重或持续的肝损伤最终导致肝功能衰竭,化学性肝损伤模型是目前国际常用的肝损伤模型。CCl4为经典急性化学性损伤的诱导剂,可直接损伤肝细胞膜,使大量Ca2+涌入细胞并主要聚集在线粒体内,致使线粒体膜电势丧失,呼吸链功能障碍,电子传递链电子外漏增加,促进了氧自由基的产生[7];同时,其在体内经肝微粒体细胞色素P450代谢激活,生成自由基及一系列氧活性物,最终导致MDA形成增多,肝细胞膜通透性增加[8]。
ALT和AST是迄今国内用于评价肝脏产生急性损伤的最常用酶学检查指标,能客观地反映出肝细胞急性损伤的程度。ALT只存在于细胞浆内,80%的AST存在于线粒体内,细胞浆内只占20%[9]。肝脏产生急性损伤的早期,肝细胞通透性增加,胞浆内的ALT大量释放入血,但细胞尚未被破坏或损伤较轻,血清中AST升高不明显。而当肝细胞严重病变坏死后,线粒体受损使AST释放,导致血清中AST升高[10]。
在各种原因导致肝脏急性肝损伤的过程中,机体均能通过酶系统与非酶系统产生氧自由基,氧自由基能攻击肝细胞膜中的多不饱和脂肪酸,引发脂质过氧化作用,形成具有醛基、酮基、羟基、羰基、氢过氧基等一系列基团的脂质过氧化物,引起肝细胞代谢及功能障碍甚至死亡[11]。SOD是一类广泛分布于组织细胞内的金属酶,体内SOD水平与自由基含量呈负相关,其水平的高低可间接反映机体内自由基的含量,对于自由基继发损伤病情的诊断、自由基清除治疗疗效跟踪和预后判断与评估等具有十分重要的参考价值[12]。MDA作为脂质过氧化的产物,其量能反映机体内脂质过氧化的程度,从而反映出细胞损伤的程度。GSH是一种能在肝脏内生成,由谷氨酸、半胱氨酸和甘氨酸形成的三肽化合物,分为还原型谷胱甘肽和氧化型谷胱甘肽两类。GSH能直接同氧自由基起反应,还能作为谷胱甘肽过氧化酶的底物,还原体内已生成的氧自由基[13]。肝脏中GSH的浓度依赖于肌肉、肠道器官的谷氨酸、半胱氨酸储备,正是由于这些储备,在肝脏受损产生应激的初期,GSH水平升高,来保护肝脏免受应激状态下的氧化损伤[14]。GSHPX是机体内特异性地催化GSH对氢过氧化物的还原反应的酶,具有清除细胞内有害的过氧化物代谢产物,阻断脂质过氧化链反应,保护细胞膜结构和功能完整的作用。因此,SOD,MDA,GSH和GSH-PX的测定常常相互配合,以综合评价肝细胞的过氧化损伤程度和药物对肝损伤的疗效[15]。
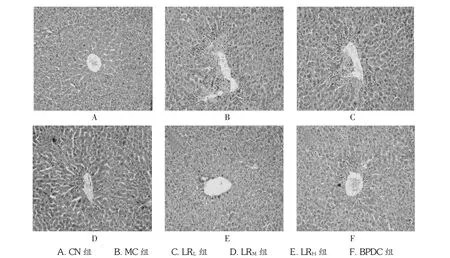
图4 鹿茸对小鼠肝脏病理组织学的影响(HE,×100)
研究表明[16],炎症反应在化学诱导的肝损伤和修复过程中发挥的重要作用,CCl4的毒性作用会造成肝组织局灶性坏死,损伤的肝细胞、肝窦内皮细胞、被激活的Kupffer细胞可以释放TNF-α,IL-6,MCP-1等细胞因子,引发炎性反应,加重肝损伤程度。
本研究结果表明,鹿茸水提物能降低小鼠血清ALT和AST含量,提高SOD,GSH,GSH-PX的活性,降低肝损伤小鼠的肝脏指数和肝组织中肝脂质过氧化产物MDA的生成,对四氯化碳诱导的急性肝损伤均具有一定的防护作用。鹿茸水提物还能降低炎症因子TNF-α,MCP-1,IL-6含量和基因表达。其作用途径可能是通过提高SOD,GSH和GSH-PX等清除自由基的酶活性,也可能是通过增强合成这些酶的功能,来增强机体抗自由基的防御系统的功能;或是通过减少炎症反应从而减轻CCl4引起的肝损伤。可见,鹿茸水提物对急性肝损伤作用的机制可能存在诸多靶点,仍有待进一步研究。
[1]段小群,焦 杨,张士军,等.玉郎伞多糖对过氧化氢诱导大鼠原代肝细胞损伤的保护作用[J].时珍国医国药,2007,18(7):1 592-1 593.
[2]杨亚军,李庆耀,梁生林,等.车前草总三萜对四氯化碳致小鼠肝损伤的保护作用[J].中成药,2012,34(1):140-142.
[3]孙海青,王小琪,时红波,等.肝爽颗粒对CCl4诱导的慢性肝损伤小鼠模型和肝损伤细胞模型的保护作用[J].临床肝胆病杂志,2015,31(7):1 114-1 119.
[4]于伟凡.马鞭草总黄酮对四氯化碳致小鼠急性肝损伤的影响[J].医药导报,2013,32(10):1 289-1 292.
[5]邹礼乐,王巧稚,彭 柯,等.复方丹参注射液对缺氧/复氧HK-2细胞损伤保护机制的研究[J].时珍国医国药,2013,24(3):596-598.
[6]徐 鑫,屈彩芹.肝损伤机制[J].医学综述,2008,14(5):747.
[7]刘彦双,朱淑霞,王永利.急性肝损伤模型的研究进展[J].河北医药,2007,29(6):613.
[8]陈 健,黄媛恒,王乃平,等.玉郎伞多糖和皂苷对氧自由基清除作用研究[J].中药药理与临床,2007,23(5):100.
[9]施 畅,廖明阳.某些化学物致肝损伤机制的研究进展[J].卫生毒理学杂志,2004,18(3):96.
[10]付书婕,黄建春,王乃平,等.玉郎伞多糖对小鼠急性酒精性肝损伤保护作用的研究[J].中国药房,2009,20(6):406.
[11]中华医学会消化病学分会肝胆疾病协作组.急性药物性肝损伤诊治建议(草案)[J].中华消化杂志,2007,27(11):765.
[12]高普均,王小从,朴云峰,等.五杞胶囊对小鼠急性肝损伤的保护作用[J].吉林大学学报:医学版,2003,29(4):448.
[13]赵春景,魏 来.葛根素对CCl4所致大鼠急性肝损伤的保护作用[J].第三军医大学学报,2005,27(7):625.
[14]辛 念,熊建新,韩淑英,等.荞麦种子总黄酮对四氯化碳所致急性肝损伤的保护作[J].第三军医大学学报,2005,27(14):1 456.
[15]杨龙飞,金家兴,高文秀,等.清肝浸膏对小鼠实验性肝损伤模型的保护作用[J].中国实验方剂学杂志,2006,12(6): 41-42.
[16]杨 威,王茜莎,王敏伟,等.陆英颗粒对急性实验性肝损伤的保护作用研究[J].中药材,2005,28(12):1 085-1 088.
Protective Effect of Pilose Antler Against Carbon Tetrachloride-Induced Liver Injury in M ice
Qin Yanni
(Nanning Hospital of Traditional Chinese Medicine,Nanning,Guangxi,China 530001)
Objective To observe the protective effect of pilose antler on acute liver injury induced by carbon tetrachloride in mice.M ethods The SPF Kunming mice were divided into normal control group(NC),model group(MC),high-,medium-and low-doses of pilose antler groups,and BPDC group.The mice of NC and MC groups were treated with normal saline(NS),and all doses of pilose antler groups and BPDC group were treated with LDM (40,20,10 g/kg)and BPDC(200 mg/kg)respectively.All mice were treated with drugs or NS for 7 consecutive d,ig,qd.1 h after the last administration of drugs,each group of mice was induced by CCl4,ip,except the normal control group.The activities of ALT and AST in serum,the content of SOD,MDA,GSH and GSH-PX in liver tissue were measured by ELISA.The content of TNF-a,MCP-1 and IL-6 were measured by ELISA.Relative quantitative real-time PCR were used to determine the expressions of TNF-a,MCP-1 and IL-6 genes.Hematoxylin and eosin(HE)stain was used to examine the degree of hepatic injury.Results The activities of ALT and AST in serum were obviously decreased in the high pilose antler group (P<0.01).The activities of SOD,GSH and GSH-PX in liver were also enhanced obviously(P<0.05 or P<0.01)and the activity of MDA was decreased in that group.The expressions of TNF-α,MCP-1 and IL-6 genes were down-regulated in the high pilose antler group.The result of HE stain indicated that pilose antler could attenuating attenuated carbon tetrachloride-induced liver injury in mice.Conclusion s Pilose antler has protective effect on acute liver injury induced by CCl4 in mice.The mechanism may be involved in attenuating free radical and inhibiting the lipid peroxidation.
pilose antler;carbon tetrachloride;liver injury;mice
R285.6;R282.74
A
1006-4931(2016)23-0033-06
覃燕妮,主管药师,主要从事治疗肝损伤药物的研究工作,(电子信箱)66828673@qq.com。
2016-08-11;
2016-09-18)
图1 鹿茸水提物对肝损伤小鼠血清ALT,AST影响(n=10)
