鲮鱼皮胶原肽的制备及其抗氧化活性的检测
2016-12-28武翠玲吴日帮刘丹杨兴昊张姜黄嘉丰何海伦
武翠玲,吴日帮,刘丹,杨兴昊,张姜,黄嘉丰,何海伦
1 中南大学生命科学学院 医学遗传学国家重点实验室,湖南 长沙 410013
2 长治医学院 生物化学教研室,山西 长治 046000
鲮鱼皮胶原肽的制备及其抗氧化活性的检测
武翠玲1,2,吴日帮1,刘丹1,杨兴昊1,张姜1,黄嘉丰1,何海伦1
1 中南大学生命科学学院 医学遗传学国家重点实验室,湖南 长沙 410013
2 长治医学院 生物化学教研室,山西 长治 046000
武翠玲, 吴日帮, 刘丹, 等. 鲮鱼皮胶原肽的制备及其抗氧化活性的检测. 生物工程学报, 2016, 32(12): 1727-1734.
Wu CL, Wu RB, Liu D, et al. Preparation and antioxidant activity detection of collagen peptide fromCirrhinus molitorellaskin. Chin J Biotech, 2016, 32(12): 1727-1734.
为了以细菌胞外蛋白酶酶解低值蛋白资源制备抗氧化活性肽以及挖掘新型蛋白酶,采用液体发酵培养的方法对假交替单胞菌Pseudoalteromonassp. SHK1-2进行发酵产酶,获得胞外蛋白酶粗酶液用于酶解热水法提取的鲮鱼胶原蛋白,通过超滤、sephadex LH-20分子筛层析获得具有DPPH自由基清除能力 (35.6%±7%)、氧自由基清除能力 (Oxygen radical absorbance capacity,ORAC) 及DNA氧化损伤抑制活性的小分子肽,液相色谱质谱联用鉴定该活性肽分子量为776.2 Da,预测氨基酸序列为Thr-Ala-Gly-His-Pro-Gly-Thr-His。ORAC检测验证了人工合成的多肽同样具有抗氧化活性。研究表明细菌胞外蛋白酶在低值资源高值化中具有一定的应用前景,对于新型蛋白酶及其应用的挖掘具有一定的参考意义。
抗氧化肽,鲮鱼,胶原蛋白,DPPH,ORAC,DNA氧化损伤
活性氧簇 (Reactive oxygen species,ROS)是一系列具有高化学活性的氧化还原反应产物,包括超氧阴离子自由基 (O2−·)、羟自由基(HO·)、氮氧自由基 (NO·)、过氧自由基 (ROO·)、过氧化氢 (H2O2) 等。ROS在宿主抵御外来病原体感染中起着重要的作用,同时也作为信号分子参与到了多种细胞信号通路当中[1-2]。然而,过度累积的活性氧自由基会攻击损伤膜脂、蛋白、核酸以及其他细胞内生物活性大分子,从而引发细胞的衰老、病变与凋亡。
研究发现癌症、糖尿病、神经退行性疾病和免疫功能弱化等多种疾病都存在着脂质过氧化、自由基形成、蛋白氧化、酪氨酸硝基化和DNA/RNA氧化损伤的特征,因此氧化损伤被认为是诱发多种慢性疾病的一个重要因素[3-4]。此外,自由基在食品中也会导致脂类氧化酸败并产生有毒的物质,这逐渐成为食品工业领域一个担忧的问题[5]。为此,多种人工合成的抗氧化剂也应运而生,如二叔丁基对甲酚、叔丁基对苯二酚等,但这些抗氧化剂对人体具有一定的毒性,因此在食品工业与医药领域都被严格限制用量[6-7]。
近年来越来越多的研究发现某些小分子肽段具有自由基清除能力,这为寻找新型抗氧化剂提供了一种新思路。天然存在的抗氧化活性肽种类极少,因此通过水解大分子蛋白质获得新型的抗氧化活性肽成为研究的热点。目前已证实有多种蛋白质资源可用于抗氧化活性肽的制备,如黑鳍鲨皮明胶[8]、黄鱼鱼皮明胶[9]、黄花鱼肉[10]、三文鱼下脚料[11-12]等动物源蛋白,以及微藻[13]、豆粕[14]、油料渣[15]等植物源蛋白质。
鲮鱼Cirrhinus molitorella是一种在我国华南地区广泛养殖的经济鱼类,鱼皮在加工过程中往往被丢弃,而动物皮肤中含有丰富的胶原蛋白,而且鱼皮中胶原蛋白含量比陆地生动物皮肤中胶原蛋白含量要高,胶原结构的稳定性更低,因此可作为一种生物活性肽制备的低值蛋白资源加以利用,但目前国内外利用鲮鱼皮制备活性肽的研究仍十分缺乏。本研究拟采用微生物胞外蛋白酶酶解鲮鱼皮中的胶原蛋白,通过一系列的分离纯化手段制备出具有抗氧化活性的寡肽,为鲮鱼下脚料的综合高值化利用提供参考。
1 材料
1.1 实验材料
假交替单胞菌Pseudoalteromonassp. SHK1-2 (实验室保存菌株),新鲜鲮鱼皮 (水产市场);酵母浸出粉、胰蛋白胨 (OXOID);1,1-二苯基-2-三硝基苯肼 (DPPH,Sigma);其余化学试剂均为国产分析纯。
1.2 主要仪器
液相色谱仪 (上海青浦沪西仪器厂);高速冷冻离心机 (Thermo);EnSpire酶标仪(PerkinElmer);Sephadex LH-20凝胶色谱柱(16 mm×600 mm,GE Healthcare)。
2 方法
2.1 培养基
人工海水:NaCl 2.815 g,MgSO4·7H2O 0.692 g,KCl 0.067 g,MgCl2·6H2O 0.551 g,CaCl20.145 g,ddH2O 100 mL。
2216E培养基:蛋白胨0.5 g,酵母浸出粉0.1 g,Fe2(PO4)30.001 g,人工海水100 mL,pH 7.8。
发酵产酶培养基:玉米粉2 g,麸皮1 g,豆粕2 g,Na2HPO40.1 g,KH2PO40.03 g,CaCl20.1 g,Na2CO30.1 g,人工海水100 mL,pH 7.8。
2.2 发酵产酶
将产胞外蛋白酶菌株Pseudoalteromonassp. SHK1-2接种于2216E液体培养基,17 ℃、200 r/min培养24 h,将活化的菌种按照2%接种量接种发酵培养基,17 ℃、200 r/min培养5 d,将发酵液10 000×g、4 ℃离心20 min,取上清并用20 mmol/L的Tris-HCl (pH 7.8) 透析4 h,重复3次,获得粗酶液。
2.3 鲮鱼皮胶原蛋白的制备
使用热水法提取鲮鱼胶原蛋白:取洗净的鱼皮置于烧杯中,加入超纯水,然后放置在80 ℃水浴锅中静置水浴30 min,用4层纱布过滤,取滤液,12 000×g、4 ℃离心15 min,取上清液,用双蒸水透析4 h,重复3次,然后放置在预冷的真空冷冻干燥机中,进行冷冻干燥,获得鱼皮胶原蛋白。
2.4 制备抗氧化活性肽
2.4.1 酶解胶原蛋白
根据酶与底物比例1∶10 (mL/mg) 将粗酶液与鱼皮胶原蛋白混合,置于37 ℃、100 r/min恒温水平摇床中酶解5 h;将酶解液置于95 ℃水浴锅中加热10 min使酶失活,冷却至室温后,10 000×g、4 ℃离心5 min去除变性大分子蛋白,收集上清,加入到截留分子量为3 kDa的超滤管中,3 000×g离心45 min,收集超滤管下层滤液。
2.4.2 分离纯化
使用Sephadex LH-20凝胶色谱柱对酶解产物进行层析:以两倍体积超纯水作为流动相平衡色谱柱,按柱床体积3%-5%上样,用超纯水洗脱3-4倍体积,流速为1 mL/min,检测波长为220 nm,收集各组分峰,冷冻干燥,然后用超纯水重溶。
2.5 抗氧化能力检测
2.5.1 DPPH自由基清除率
参照刘平怀等[16]的方法进行改进优化。取20 µL浓度为100 μg/mL的分离样品,加入60 µmol/L的DPPH溶液 (以95%乙醇为溶剂) 100 µL,在室温下密封避光反应60 min,然后检测517 nm下的吸光度,清除率计算公式如下:
DPPH清除率=[1-(As-Ab)/Ac]×100%
其中As代表实验组吸光度,Ab代表用95%乙醇代替DPPH后的吸光度,Ac代表用双蒸水代替样品后的吸光度,每组做3次重复实验,以维生素C (VC) 作为阳性对照。
2.5.2 对DNA氧化损伤的抑制作用
参照Sheih等[17]的方法进行改进优化。取6 μL pET-22b质粒DNA,加入4 μL 2 mmol/L FeSO4与6 μL待测组分,轻轻混匀后,加入4 μL0.06 mmol/L H2O2启动反应,37 ℃水浴5 min,然后加入5 μL 5×DNA电泳上样缓冲液,在1%琼脂糖凝胶中进行电泳,电泳缓冲液为TAE缓冲液,电泳条件为120 V恒压电泳25 min,以双蒸水代替样品作为损伤组。
2.5.3 氧自由基吸收能力评价 (ORAC)
2.6 液相色谱质谱联用鉴定活性肽
使用Agilent 6200 Series TOF/6500 Series Q-TOF LC/MS系统对活性组分峰进行液相色谱质谱联用鉴定。
3 结果与分析
3.1 鲮鱼皮胶原蛋白酶解产物的分离纯化
如图1所示,通过3 kDa截留分子量超滤分离后的鲮鱼皮胶原蛋白酶解产物,经过Sephadex LH-20分子筛层析后获得8个主要的组分,根据洗脱时间分别命名为F1-F8。
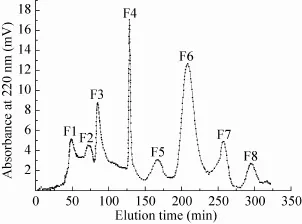
图1 酶解产物下层超滤组分的Sephadex LH-20分子筛色谱图Fig. 1 Sephadex LH-20 size exclusion chromatography of small fraction from hydrolysate after ultrafiltration.
3.2 检测DPPH自由基清除能力
如图2所示,同一质量浓度下各分离组分均有一定的DPPH自由基清除能力,其中组分F8的自由基清除能力最强,为35.6%±7%,该结果符合抗氧化肽分子量较小的特点。
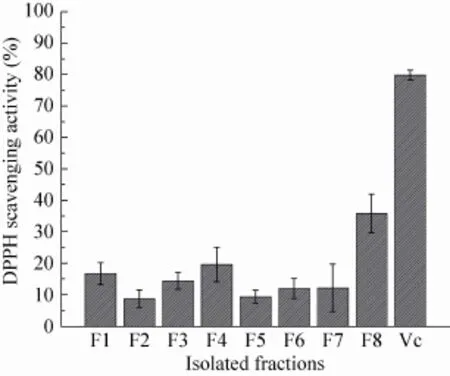
图2 Sephadex LH-20分离组分的DPPH自由基清除能力Fig. 2 DPPH scavenging activity of fractions purified by Sephadex LH-20.
3.3 检测活性组分对氧化诱导DNA损伤的抑制作用
如图3所示,无损伤组超螺旋结构质粒DNA含量最高,说明质粒DNA结构完好,损伤组超螺旋结构质粒DNA基本消失,DNA含量也明显降低,说明质粒DNA受到严重的氧化损伤,加入酶解样品和分离样品的实验组DNA均有一定程度的损伤,但损伤程度小于损伤组,说明酶解产物和分离组分具有一定的抗氧化性。DNA损伤是生物体内由氧化应激引起的细胞病变的典型现象之一。目前已有相关研究发现部分抗氧化活性肽具有该能力。Sheih等[17]研究表明酶解藻蛋白制备的抗氧化肽具有DNA保护功能以及提高AGS细胞在氧化损伤后存活率的功能。Karawita等[19]发现微藻蛋白酶解物具有抑制DNA氧化损伤以及修复过氧化氢损伤小鼠L5178淋巴细胞的作用。具有抑制DNA氧化损伤功能的多肽可作为一种潜在药物或功能补充剂用于预防与氧化应激相关疾病的发生,如肿瘤[20]、心血管疾病[21]以及阿尔兹海默[22]。
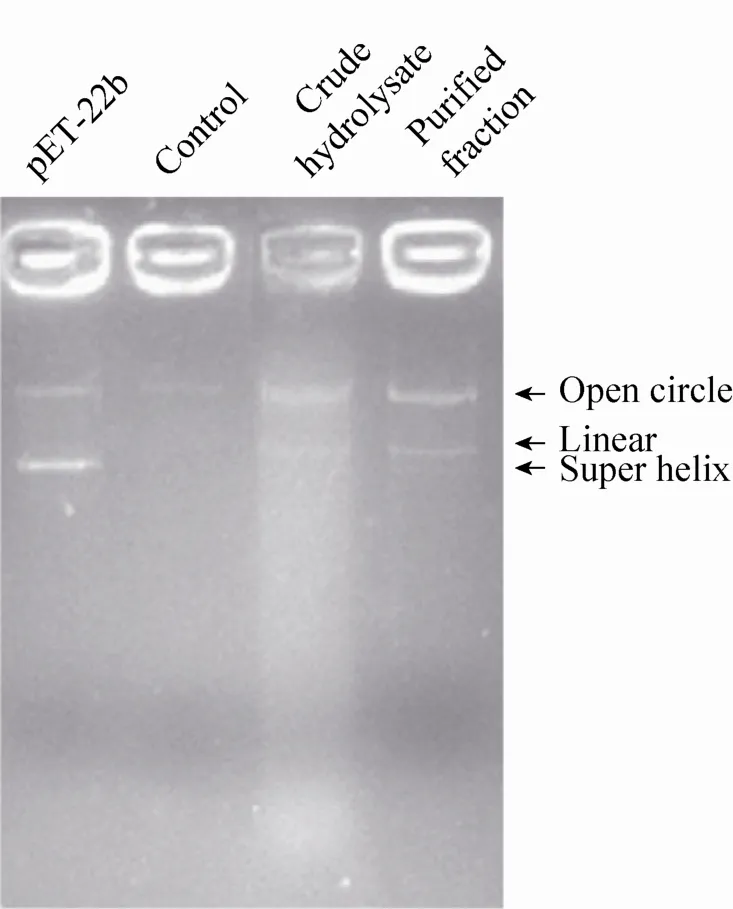
图3 分离组分F8抑制氧化诱导损伤DNA的能力Fig. 3 Inhibition activity of isolated fraction F8 in DNA oxidation-induced damage test.
3.4 检测活性组分的氧自由基吸收能力
由荧光衰减曲线图4可见,PBS缓冲液对照组荧光强度衰减非常迅速,而高浓度的VC能够抑制荧光强度的衰减,当分离组分F8存在时,也可以抑制由自由基引起的荧光变化,且抑制程度随浓度增加而增加,由此可知分离组分F8具有一定的氧自由基吸收能力。抗氧化肽通过提供氢原子与氧自由基反应而阻断过氧自由基的持续损伤,供氢能力与特定的氨基酸残基有密切联系[23],如半胱氨酸残基、酪氨酸残基、组氨酸残基等,可分别从其侧链基团上的巯基、酚羟基以及咪唑环上提供氢原子,并且通过形成二硫键或以电子共轭的方式稳定自身结构,从而阻断自由基链式反应[24]。
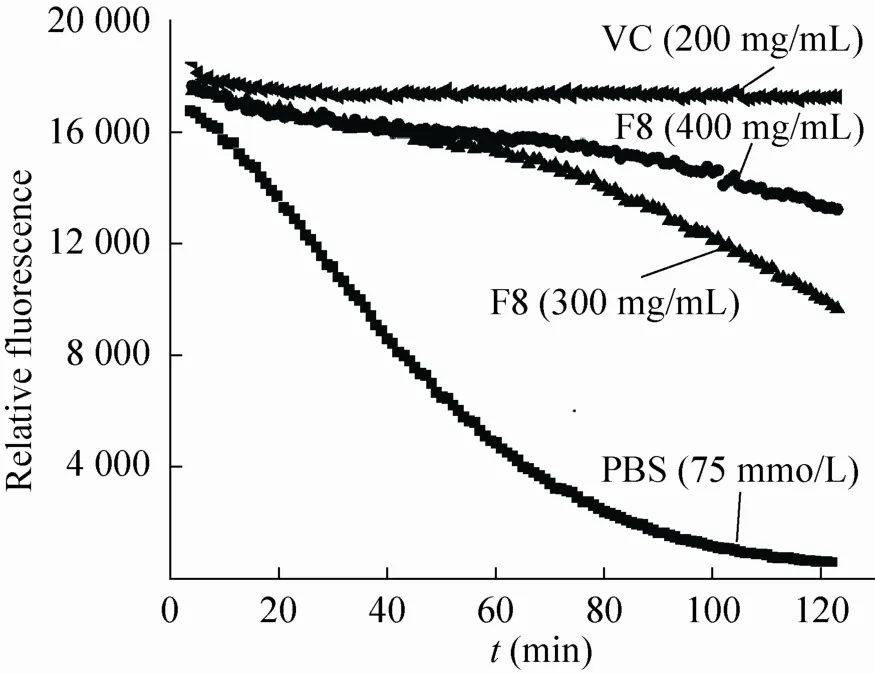
图4 分离组分F8氧自由基清除活性Fig. 4 Peroxyl radical scavenging activity assay of isolated fraction F8.
3.5 活性组分F8的液相色谱质谱联用鉴定结果
如图5所示,组分F8在高效液相色谱中有一主要的成分,通过质谱鉴定该组分分子量约为776.2 Da,通过比对预测该活性肽序列为Thr-Ala-Gly-His-Pro-Gly-Thr-His,具有典型的胶原蛋白Gly-X-Y序列特征,理论分子量为776.4 Da,与检测值接近。根据质谱检测所获得的多肽氨基酸序列进行固相合成 (由上海强耀生物科技有限公司合成),并使用氧自由基吸收能力检测方法验证该合成多肽的抗氧化活性。从图6可见,与PBS缓冲液对照组的荧光曲线相比,加入浓度为100 μg/mL的合成多肽后,荧光素钠衰减明显减慢,证明该多肽具有一定清除氧自由基的能力。
4 结论
Pseudoalteromonassp. SHK1-2发酵所产胞外蛋白酶对热水法提取的鲮鱼胶原蛋白进行酶解,通过超滤分离、Sephadex LH-20分子筛层析纯化后可获得具有DPPH自由基清除能力和氧自由基吸收能力的抗氧化活性肽,并且对氧化诱导损伤的DNA具有一定的保护作用,通过液质联用结果预测以及人工合成多肽验证,抗氧化活性肽的序列为Thr-Ala-Gly-His-Pro-Gly-Thr-His,是一种新型抗氧化肽。目前市售蛋白酶面临的主要问题为成本高,酶活性不高,对温度、盐度、pH值的适应性较低,这限制了市售蛋白酶在低值蛋白酶解制备生物活性肽中的应用。本研究利用细菌发酵所产胞外蛋白酶代替市售蛋白酶,可大大减少酶制剂采购成本,同时可促进自主性新型胶原蛋白酶的挖掘与利用,对于弥补蛋白酶制备活性肽领域的空白具有重要的意义。此工艺成本较低,使用热水法提取胶原蛋白不仅有效缩短胶原提取工艺时间,减少化学试剂的使用,提高蛋白提取率,还能适当破坏胶原蛋白的紧密结构,有利于蛋白酶的结合与作用,从而提高活性肽的产量。下一步将对酶解工艺进行优化,获得最优酶解条件,同时对鉴定获得的多肽的氨基酸进行增加、减少、替换和多肽修饰等处理,探究氨基酸种类、关键氨基酸位置、多肽结构对抗氧化活性的影响,为抗氧化肽的应用提供科学依据,指导新型抗氧化肽制备与发掘。
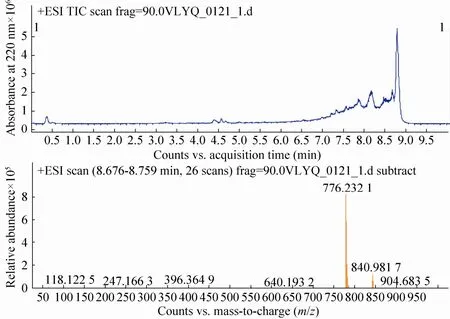
图5 分离组分F8的液相色谱质谱联用分析结果Fig. 5 Liquid chromatography mass spectrum analysis of isolated fraction F8.

图6 合成多肽的氧自由基清除活性Fig. 6 Peroxyl radical scavenging activity assay of synthesized peptide.
[1] Yu BP. Cellular defenses against damage from reactive oxygen species. Physiol Rev, 1994, 74(1): 139−162.
[2] Krapfenbauer K, Engidawork E, Cairns NJ, et al. Aberrant expression of peroxiredoxin subtypes in neurodegenerative disorders. Brain Res, 2003, 967(1/2): 152−160.
[3] Zhu LJ, Chen J, Tang XY, et al. Reducing, radical scavenging, and chelation properties ofin vitrodigests of alcalase-treated zein hydrolysate. J Agric Food Chem, 2008, 56(8): 2714−2721.
[4] Butterfield DA, Castegna A, Pocernich CB, et al. Nutritional approaches to combat oxidative stress in Alzheimer's disease. J Nutr Biochem, 2002, 13(8): 444−461.
[5] Frankel EN. Lipid Oxidation. 2nd ed. Bridgwater: The Oily Press, 2005: 470−490.
[6] Ren Y, Wu H, Li XF, et al. A two-step, one-pot enzymatic method for preparation of duck egg white protein hydrolysates with high antioxidant activity. Appl Biochem Biotechnol, 2014, 172(3): 1227−1240.
[7] Hettiarachchy NS, Glenn KC, Gnanasambandam R, et al. Natural antioxidant extract from fenugreek (Trigonella foenumgraecum) for ground beef patties. J Food Sci, 1996, 61(3): 516−519.
[8] Kittiphattanabawon P, Benjakul S, Visessanguan W, et al. Gelatin hydrolysate from blacktip shark skin prepared using papaya latex enzyme: antioxidant activity and its potential in model systems. Food Chem, 2012, 135(3): 1118−1126.
[9] Wang B, Wang YM, Chi CF, et al. Isolation and characterization of collagen and antioxidant collagen peptides from scales of croceine croaker (Pseudosciaena crocea). Mar Drugs, 2013, 11(11): 4641−4661.
[10] Nazeer RA, Kumar NS, Jai Ganesh R.In vitroandin vivostudies on the antioxidant activity of fish peptide isolated from the croaker (Otolithes ruber) muscle protein hydrolysate. Peptides, 2012, 35(2): 261−268.
[11] Ahn CB, Je JY, Cho YS. Antioxidant and anti-inflammatory peptide fraction from salmon byproduct protein hydrolysates by peptic hydrolysis. Food Res Int, 2012, 49(1): 92−98.
[12] Ahn CB, Kim JG, Je JY. Purification and antioxidant properties of octapeptide from salmon byproduct protein hydrolysate by gastrointestinal digestion. Food Chem, 2014, 147: 78−83.
[13] Balboa EM, Conde E, Moure A, et al.In vitroantioxidant properties of crude extracts and compounds from brown algae. Food Chem, 2013,138(2/3): 1764−1785.
[14] Xiao Y, Wang LX, Rui X, et al. Enhancement of the antioxidant capacity of soy whey by fermentation withLactobacillus plantarumB1-6. J Funct Foods, 2015, 12: 33−44.
[15] Chang SK, Ismail A, Yanagita T, et al. Antioxidant peptides purified and identified from the oil palm (Elaeis guineensisJacq.) kernel protein hydrolysate. J Funct Foods, 2015, 14: 63−75.
[16] Liu PH, Wang CN, Chen DL, et al.Determinnation of antioxidant capacity ofVatica mangachapoiaccelerated solvent extraction (ASE) with DPPH assay. Chin J Exp Tradit Med Formul, 2011, 17(21): 69−73 (in Chinese).刘平怀, 汪春牛, 陈德力, 等. DPPH法测定青皮加速溶剂萃取提取物的抗氧化活性. 中国实验方剂学杂志, 2011, 17(21): 69−73.
[17] Sheih IC, Wu TK, Fang TJ. Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate in different oxidation systems. Bioresour Technol, 2009, 100(13): 3419−3425.
[18] Dávalos A, Gómez-Cordovés C, Bartolomé B. Extending applicability of the oxygen radical absorbance capacity (ORAC-Fluorescein) assay. J Agric Food Chem, 2004, 52(1): 48−54.
[19] Karawita R, Senevirathne M, Athukorala Y, et al. Protective effect of enzymatic extracts from microalgae against DNA damage induced by H2O2. Mar Biotechnol, 2007, 9(4): 479−490.
[20] Spolarics Z. Endotoxemia, pentose cycle, and the oxidant/antioxidant balance in the hepatic sinusoid. J Leukocyte Biol, 1998, 63(5): 534−541.
[21] Diaz MN, Frei B, Vita JA, et al. Antioxidant and atherosclerotic heart disease. N Eng J Med, 1997, 337(6): 408−416.
[22] Stohs SJ. The role of free radicals in toxicity and disease. J Basic Clin Physiol Pharmacol, 1995, 6(3/4): 205−228.
[23] Wang B, Gong YD, Li ZR, et al. Isolation and characterisation of five novel antioxidant peptides from ethanol-soluble proteins hydrolysate of spotless smoothhound (Mustelus griseus) muscle. J Funct Foods, 2014, 6(1): 176−185.
[24] Wu RB, Wu CL, Liu D, et al. Overview of antioxidant peptides derived from marine resources: the sources, characteristic, purification and evaluation methods. Appl Biochem Biotechnol, 2015, 176(7): 1815−1833.
(本文责编 郝丽芳)
Preparation and antioxidant activity detection of collagen peptide from Cirrhinus molitorella skin
Cuiling Wu1,2, Ribang Wu1, Dan Liu1, Xinghao Yang1, Jiang Zhang1, Jiafeng Huang1, and Hailun He1
1 State Key Laboratory of Medical Genetics, School of Life Sciences, Central South University, Changsha 410013, Hunan, China 2 Department of Biochemistry, Changzhi Medical College, Changzhi 046000, Shanxi, China
In order to prepare antioxidant peptide through hydrolyzing low-value protein resources with bacterial extracellular proteases and to discover novel proteases, crude extracellular protease fromPseudoalteromonassp. SHK1-2 was obtained through fermentation which was used to hydrolyze collagen extracted fromCirrhinus molitorellaskin. Small peptide fraction was isolated from hydrolysate by ultrafiltration and Sephadex LH-20 size exclusion chromatography and showed 1, 1-diphenyl-2-picrylhydrazyl radical scavenging activity (35.6%±7%), oxygen radical absorbance capacity and inhibition of DNA oxidation damage. The molecule weight was 776.2 Da, and amino acid sequence was Thr-Ala-Gly-His-Pro- Gly-Thr-His through liquid chromatography mass spectrum. Our findings suggest that peptide obtained from low-value protein of fish waste by hydrolysis with bacterial protease has antioxidant activity.
antioxidant peptide,Corrhinus molitorella, collagen, DPPH, ORAC, DNA oxidation damage
Hailun He. Tel: +86-181-63676344; E-mail: helenhe@csu.edu.cn
Received:April 21, 2016;Accepted:October 8, 2016
Supportedby: National Natural Science Foundation of China (No. 31370104), National Sparking Plan Project (No. 2013GA770009), Scientific Research Foundation of Changzhi Medical College (No. QDZ201517).
国家自然科学基金 (No. 31370104),国家星火计划面上项目 (No. 2013GA770009),长治医学院科研启动基金项目 (No. QDZ201517) 资助。
时间:2016-10-24
http://www.cnki.net/kcms/detail/11.1998.Q.20161024.1059.001.html
