肝靶向肽-人内皮抑制素融合蛋白表达条件的优化及活性鉴定
2016-12-28马艳李伟李小波鲍冬梅卢建培
马艳,李伟,李小波,鲍冬梅,卢建培
1 广东药科大学 基础学院 广东省生物活性药物研究重点实验室,广东 广州 510006
2 广东药科大学 中药学院,广东 广州 510006
肝靶向肽-人内皮抑制素融合蛋白表达条件的优化及活性鉴定
马艳1,李伟2,李小波1,鲍冬梅1,卢建培1
1 广东药科大学 基础学院 广东省生物活性药物研究重点实验室,广东 广州 510006
2 广东药科大学 中药学院,广东 广州 510006
马艳, 李伟 李小波, 等. 肝靶向肽-人内皮抑制素融合蛋白表达条件的优化及活性鉴定. 生物工程学报, 2016, 32(12): 1715-1726.
Ma Y, Li W, Li XB, et al. Optimization of expression conditions and activity identification of hepatocyte-targeting peptide-human endostatin. Chin J Biotech, 2016, 32(12): 1715-1726.
为了获得足够多纯度高且有活性的肝靶向肽-人内皮抑制素融合蛋白(HTP-rES),首先研究了BL21/pET21b-HTP-rES重组菌株的生长曲线和最佳诱导时机;单因素分析不同pH值、不同诱导时间、不同诱导剂浓度、不同诱导温度时融合蛋白表达量;通过包涵体洗涤、复性、纯化,以获得高纯度的肝靶向肽-人内皮抑制素融合蛋白;最后采用流式细胞仪和MTT对融合蛋白进行活性鉴定。结果表明,BL21/pET21b-HTP-rES重组菌株在1.5-3.5 h处于对数生长期,培养基pH 8.0、IPTG终浓度0.06 mmol/L、42 ℃、诱导表达5 h为最佳表达条件。包涵体洗涤后纯度达60%,经复性、纯化后获得的目的蛋白纯度达到95%以上,对人肝癌细胞具有靶向性,能抑制人脐静脉内皮细胞的增殖。研究确立了融合蛋白最佳表达条件以及复性、纯化条件,为进一步研究其生物学活性及药物开发奠定基础。
肝靶向肽,人内皮抑制素,表达条件优化,活性鉴定
国家自然科学基金 (No. 81502520),广东省自然科学基金 (No. 2016A030310299) 资助。
内皮抑制素 (Endostatin,ES) 是由细胞外基质成分胶原ⅩⅧ的羧基末端水解而来的一种动物体内天然存在的蛋白,是一种内源性血管形成抑制因子,能选择性地靶向微血管内皮细胞,抑制血管内皮细胞的增殖、迁移和黏附,负性调节血管形成过程,具有广谱的抗肿瘤作用[1-4]。另外,ES对一些肿瘤细胞的增殖、迁移、侵袭等也具有明显的抑制作用[5-6]。但ES用药剂量大、疗效不够理想等缺点,限制了其在临床中的应用。肝靶向肽 (Hepatocyte-targeting peptide) 能与肝细胞表面上的受体特异性结合,将具有药物活性的物质 (如放射性核素、化疗药物、毒素、酶和生物反应调节剂等) 尽量集中于肝脏部位,发挥其生物学功能[7-8]。本课题组提出将肝靶向肽与人内皮抑制素进行融合,制备肝靶向人内皮抑制素 (HTP-rES),提高药物在病灶部位的局部浓度,从而可提高药物的治疗指数。
前期工作中,我们利用SOE-PCR重组了肝靶向肽-人内皮抑制素融合基因,并成功构建了大肠杆菌表达系统BL21/pET21b-HTP-rES。本研究通过优化目的蛋白在大肠杆菌中的表达条件、目的蛋白包涵体复性条件以及目的蛋白的纯化条件,以期确立目的蛋白最佳表达条件,获得足够多的纯度高且有活性的目的蛋白,为进一步研究肝靶向肽-人内皮抑制素的生物学活性及药物开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 表达菌株和细胞株
BL21/pET21b-HTP-rES由广东药科大学广东省生物活性药物研究重点实验室保存,人脐静脉内皮细胞 (HUVECs) 购自美国ScienCell公司,人肝癌细胞HepG2、人正常肝细胞Chang's购自上海科学院细胞所。
1.1.2 主要试剂
酵母提取物、胰蛋白胨 (OXOID公司),异丙基-β-D-硫代半乳糖苷 (IPTG)、还原型谷胱甘肽 (GSH)、氧化型谷胱甘肽 (GSSG) (Sigma公司),His Trap HP 亲和层析柱 (GE公司),Endothelial cell medium (ECM,ScienCell公司),Dulbecco's modified Eagle's medium (DMEM)、FBS (Gibco公司)。
1.1.3 主要仪器
蛋白垂直电泳仪、Gel100凝胶成像系统、全波长扫描分光光度计 (BIO-RAD公司);大型高速冷冻离心机 (Backman公司);超声波细胞破碎仪 (Sonics公司):蛋白质层析纯化设备(GE公司)、超低温冷冻干燥仪 (Labconco公司)、制备型高效液相 (Waters公司)。
1.2 方法
1.2.1 生长曲线的测定
将构建好的表达菌株BL21/pET21b-HTP-rES接种到LB液体培养基中,37 ℃、180 r/min培养过夜。按1∶100 (V/V) 接入到20 mL LB培养基中扩大培养,此时开始计时,分别在0、0.5、1、1.5、2、2.5、3、3.5、4、5、6、7、8、9和10 h各取1 mL菌液进行OD600值测量,绘制出BL21/pET21b-HTP-rES生长曲线,确定其生长规律。
1.2.2 最佳诱导时机试验
将过夜培养的BL21/pET21b-HTP-rES按1∶100 (V/V)接入到35 mL LB培养基中,当菌体达到对数生长期即OD600≈0.5后加入终浓度为0.1 mmol/L IPTG诱导剂,开始计时,分别于0、1.5、2、2.25、2.5、2.75、3和3.5 h,取1 mL菌液进行SDS-PAGE,分析表达菌株的最佳诱导时机。
1.2.3 表达条件的优化
在最佳诱导时机,单因素分析不同培养温度 (17 ℃、25 ℃、32 ℃、37 ℃、42 )℃、不同诱导时间 (0、1.5、2、3、4、5、6、7、8 h)、不同IPTG浓度 (0.03、0.06、0.12、0.24、0.48、0.96、1.92、3.84 mmol/L)、不同pH培养基 (4、5、6、7、8、9、10) 时目的蛋白的表达量,确定最佳诱导表达条件。
1.2.4 目的蛋白包涵体的洗涤分离
在优化的表达条件下,大量诱导表达蛋白,8 000 r/min离心15 min收集菌体。将菌体用1×PBS洗涤1次,裂解缓冲液 (10 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0) 重悬,冰上超声裂解,超声条件:300 W超声10 s,间隔15 s,25 min,菌体变澄清。8 000 r/min离心15 min去上清,沉淀用洗涤液A (50 mmol/L Tris-HCl,1 mmol/L EDTA,1% TritonX-100,pH 8.0) 洗3次,或者用洗涤液B (50 mmol/L Tris-HCl,1 mmol/L EDTA,2 mol/L尿素,pH 8.0) 洗3次,洗涤上清和沉淀分别取样进行SDS-PAGE分析。
1.2.5 目的蛋白包涵体的复性
对所得包涵体称重,每0.1 g包涵体加入10 mL变性液 (6 mol/L盐酸胍,20 mmol/L Tris-HCl,2 mmol/L β-巯基乙醇,1 mmol/L EDTA,pH 8.0),室温下搅拌至液体澄清,8 000 r/min离心15 min收集上清。将变性液按1∶10稀释到稀释液 (3 mol/L盐酸胍,20 mmol/L Tris-HCl,4 mmol/L GSH,1 mmol/L GSSG,pH 8.0),然后进行梯度盐酸胍透析复性。透析液分别为A (2.0 mol/L盐酸胍,20 mmol/L Tris-HCl,pH 8.2);B (1.0 mol/L盐酸胍,20 mmol/L Tris-HCl,pH 8.2);C (0.5 mol/L盐酸胍,0.2 mmol/L GSSG,1 mmol/L GSH,20 mmol/L Tris-HCl,pH 8.2);D (0.25 mol/L盐酸胍,0.2 mmol/L GSSG,1 mmol/L GSH,20 mmol/L Tris-HCl,pH 8.2)和E (20 mmol/L Tris-HCl,pH 8.2),每种透析液透析12 h。8 000 r/min离心15 min收集透析液E上清,获得复性后融合蛋白,BCA法测定复性后蛋白浓度。
1.2.6 目的蛋白的纯化
复性重折叠的上清液用Ni-NTA (30 mL,GE公司) 亲和层析柱进行纯化。首先对AKTA纯化仪进行冲洗、平衡。设置程序,用5 mL/min的速度上样复性后的蛋白液,缓冲液A (20 mmol/L Tris-HCl,0.4 mol/L NaCl,0.5% TritonX-100,10 mmol/L咪唑,pH 7.4) 平衡柱子,在5个柱体积内用缓冲液B (20 mmol/L Tris-HCl,0.4 mol/L NaCl,0.5% TritonX-100,1.0 mol/L咪唑) 从0%−100%梯度洗脱吸附在柱子上的蛋白;分阶段收集洗脱的蛋白溶液,SDS-PAGE分析,将杂蛋白少融合蛋白含量高的蛋白液进行脱盐,冷冻干燥,并储存在-80 ℃备用。
1.2.7 目的蛋白RP-HPLC检测
用C18型HPLC进行蛋白纯度分析。流动相为CH3OH∶0.05 mol/L KH2PO4-H3PO4缓冲液=40∶60 (V/V),pH 5.5,流速为1.0 mL/min,柱温为25 ℃,检测波长为254 nm,目标物浓度以色谱峰面积计算。
1.2.8 融合蛋白的活性鉴定
融合蛋白对肝癌细胞的靶向作用:用分别含20 μg/mL内皮抑素、10 μg/mL HTP-rES的培养基培养人肝癌细胞HepG2,37 ℃、30 min后收集细胞,依次加入Anti-ES与PE标记的二抗,采用流式细胞仪检测细胞表面的荧光强度,即HTP-rES与人肝癌细胞HepG2的结合活性。HTP-rES对细胞的抑制作用:取对数生长期的细胞,细胞计数后加入96孔细胞培养板中,细胞贴壁后,加入10.0、5.0、2.5、1.25、0.625、0.312、0.0 μg/mL HTP-rES,6个复孔,培养48 h,MTT法测定OD490的值,计算细胞的生长抑制率。
2 结果与分析
2.1 BL21/pET21b-rhES重组菌株的生长曲线分析
生长曲线反映了重组菌株的生长变化趋势,从曲线中可以确定工程菌在某一时刻所处的生长阶段。依此为依据,选择合适的诱导条件进行诱导。由BL21/pET21b-HTP-rES重组菌株的生长曲线 (图1) 可见,在1.5−3.5 h之间,菌株处于对数生长期。
2.2 诱导时机考察
根据文献报道,基因工程菌选择在对数生长期进行诱导,此时工程菌生长速度较快,蛋白积累速度加快,表达水平较高。根据菌株生长曲线,本实验考察了0 h、1.5 h、2 h、2.25 h、2.5 h、2.75 h、3 h、3.5 h七个诱导时机对融合蛋白表达水平的影响。SDS-PAGE结果分析表明(图2),在2.5 h进行诱导,目的蛋白表达量和目的蛋白在总蛋白中比例都较高。因此选择2.5 h为最佳诱导时机。
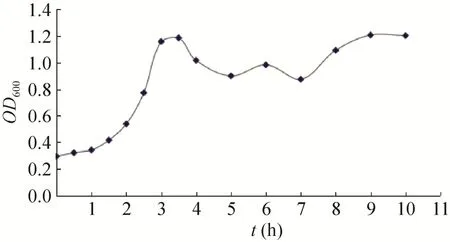
图1 BL21/pET21b-HTP-rES重组菌株的生长曲线Fig. 1 The growth curve of BL21/pET21b-HTP-rES.
2.3 表达条件的优化
在最佳诱导时机,不同诱导时间表明 (图3),随着时间的延长目的蛋白表达量随之增加,在5 h时达到高峰,并持续到7 h,但杂蛋白也有所增加,所以最佳诱导时间为5 h。以最佳的诱导时间,在不同温度、不同pH值和不同IPTG浓度下进行诱导表达,SDS-PAGE分析表明 (图4、5、6),42 ℃表达量最高,pH 8.0表达量最高,IPTG浓度为0.06、0.48、0.96 mmol/L时表达量相当。因为IPTG对菌株有毒性,本实验选择42 ℃、pH 8.0、IPTG终浓度为0.06 mmol/L、诱导5 h是最佳表达条件。

图2 BL21/ pET21b-HTP-rES重组菌株的不同诱导时机的表达量Fig. 2 The expression of pET21b-HTP-rES at different induction time. (A) Expression of pET21b-HTP-rES at different induction timing by SDS-PAGE in 15% resolving gel that stained with Coomassie Blue. (B) The percent of target protein in band was scanned by quantity one gel analysis software.
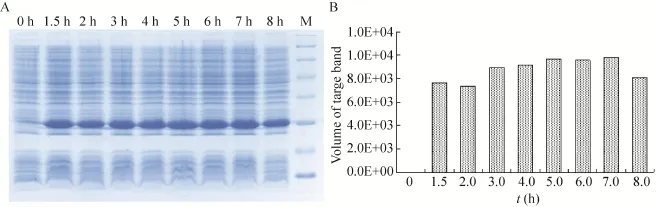
图3 不同诱导表达时间的SDS-PAGE分析Fig. 3 SDS-PAGE of expression level at differient induction times. (A) Expression of pET21b-HTP-rES at differient induction times by SDS-PAGE in 15% resolving gel that stained with Coomassie Blue. (B) The volume of target protein in band was scanned by quantity one gel analysis.
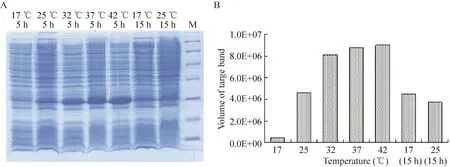
图4 不同温度诱导表达的SDS-PAGEFig. 4 SDS-PAGE of induced expression at different temperature. (A) Expression of pET21b-HTP-rES at different temperature by SDS-PAGE in 15% resolving gel that stained with Coomassie Blue. (B) The volume of target protein in band was scanned by quantity one gel analysis.
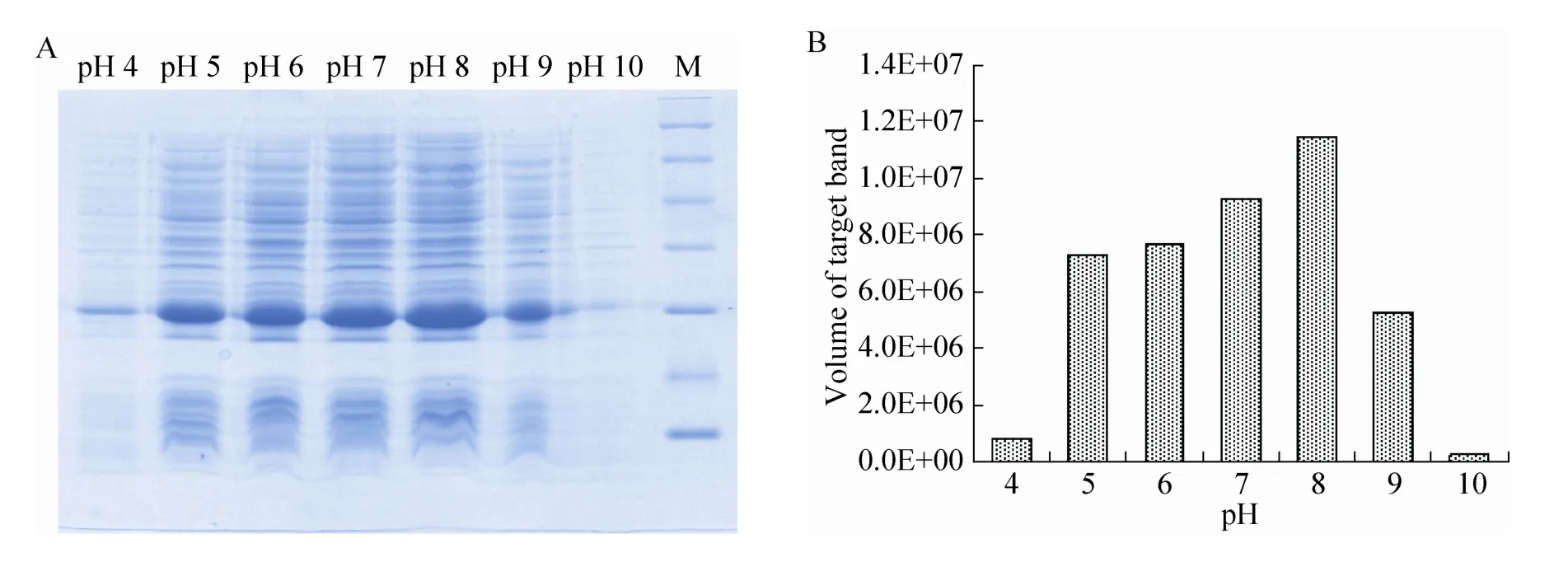
图5 不同pH值诱导表达的SDS-PAGE分析Fig. 5 SDS-PAGE of induced expression at different pH. (A) Expression of pET21b-HTP-rES at different pH by SDS-PAGE in 15% resolving gel that stained with Coomassie Blue. (B) The volume of target protein in band was scanned by quantity one gel analysis.
2.4 目的蛋白包涵体的洗涤、溶解和复性
包涵体经洗涤液洗涤的电泳结果 (图7),洗涤液粗略洗涤后,包涵体中的细菌杂蛋白有了明显减少。为获得有生物活性的蛋白,需将溶解后的蛋白进行复性。本实验选用稀释梯度透析复性。多次实验发现,溶解稀释后的蛋白浓度在0.5 mg/mL时有利于后续的复性实验;当透析液中盐酸胍浓度为0.5 mol/L时有少量沉淀产生,说明融合蛋白在盐酸胍浓度为0.5 mol/L时开始复性。在盐酸胍浓度为0.5 mol/L和0.25 mol/L复性液中添加GSH和GSSG,蛋白复性率大大提高 (表1)。
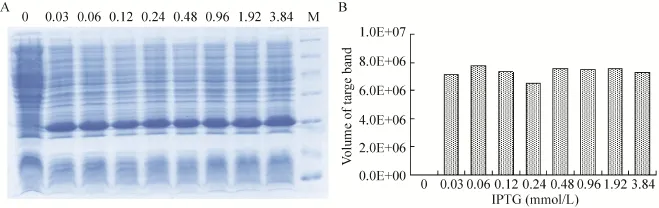
图6 不同IPTG浓度诱导表达的SDS-PAGE分析Fig. 6 SDS-PAGE of induced expression at different IPTG. (A) Expression of pET21b-HTP-rES at different IPTG by SDS-PAGE in 15% resolving gel that stained with Coomassie Blue. (B) The volume of target protein in band was scanned by quantity one gel analysis.

表1 HTP-rES蛋白复性率Table 1 Refolding yield of HTP-rES
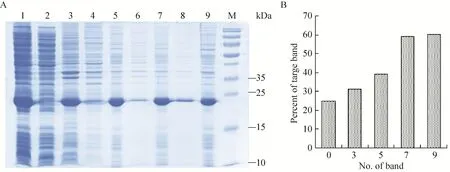
图7 不同洗涤液洗涤包涵体后的SDS-PAGE分析Fig. 7 SDS-PAGE of the inclusion body after washed by the different washing buffer. (A) Expression of pET21b-HTP-rES at different induction timing by SDS-PAGE in 15% resolving gel that stained with Coomassie Blue. 1: whole cells after induction; 2: supernatant of lysate; 3: precipitation of lysate; 4: supernatant after first washing; 5: precipitate after first washing; 6: supernatant after second washing; 7: precipitate after second washing; 8: supernatant after third washing; 9: precipitate after third washing; M: protein marker. (B) The percent of target protein in band was scanned by quantity one gel analysis software.
2.5 目的蛋白的纯化及RP-HPLC
融合蛋白N端有6×His标签,复性后的融合蛋白经过Ni-NTA亲和层析柱纯化后,在咪唑浓度为150 mmol/L时出现目的蛋白洗脱峰,SDS-PAGE和RP-HPLC结果表明:得到纯度高达95%的融合蛋白 (图8和图9)。
2.6 目的蛋白的活性鉴定
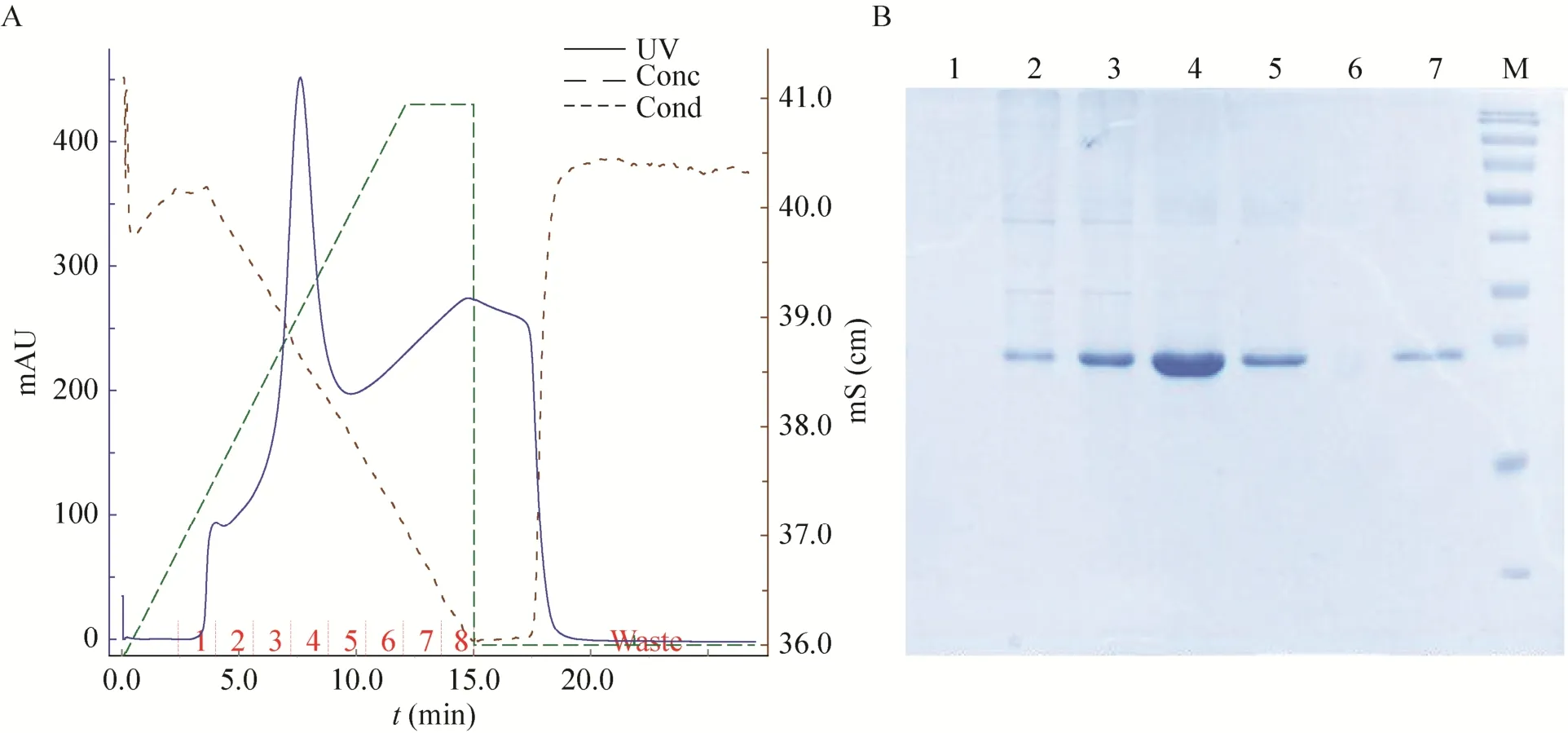
图8 融合蛋白纯化的洗脱条件和SDS-PAGE分析Fig.8 Elution conditions of fusion protein purification and SDS-PAGE analysis. 1-7: elution buffer of collection tube 1 to 7 with different imidazole; M: protein marker.
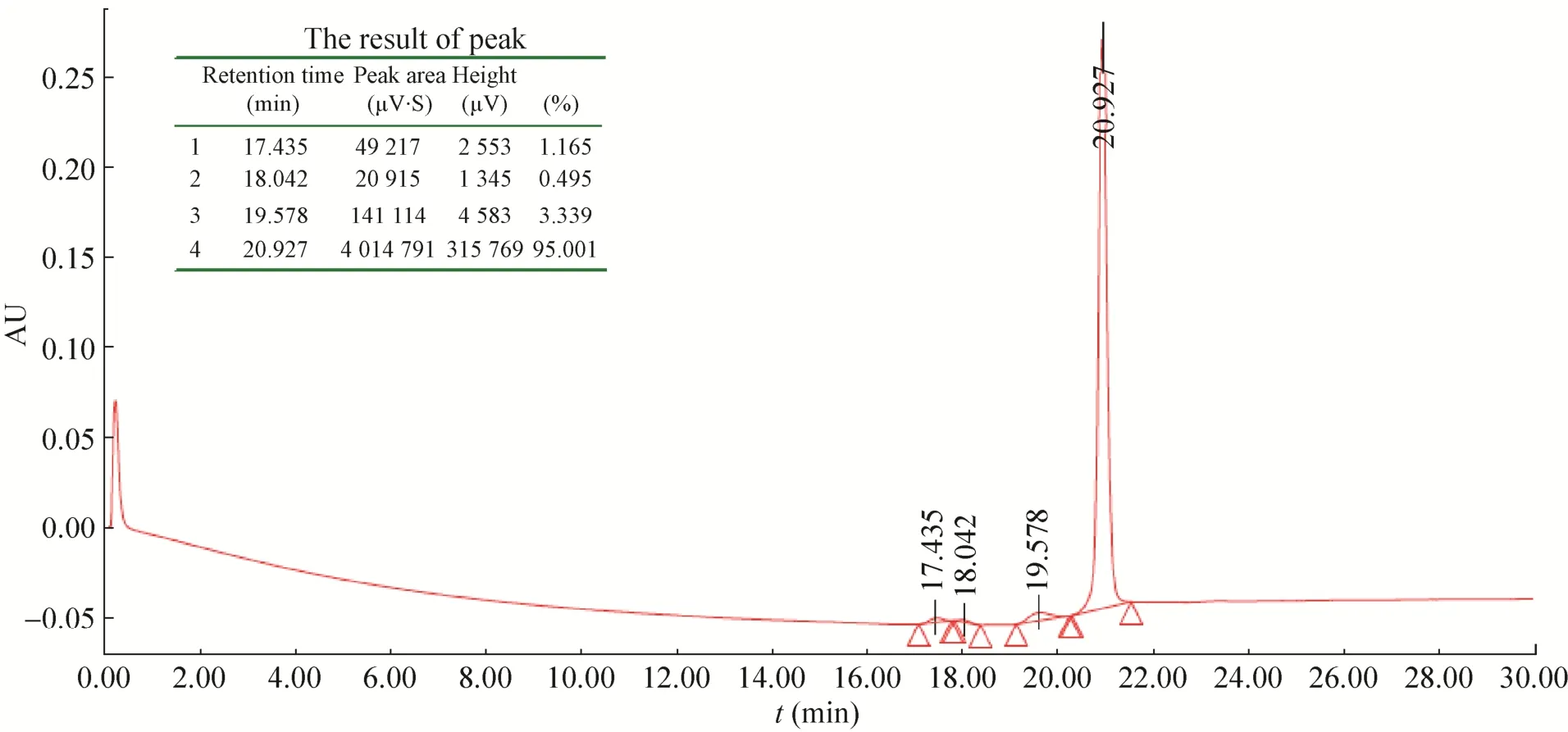
图9 纯化后融合蛋白的RP-HPLC结果Fig. 9 RP-HPLC of the fusion protein after purified.
流式细胞术检测HTP-rES与HepG2结合活性 (图10),可见含有HTP-rES融合蛋白处理过的HepG2细胞荧光强度明显高于无肝靶向肽的人内皮抑制素和空白对照。表明HTP-rES对人肝癌细胞HepG2细胞具有靶向性。
MTT实验结果 (图11) 表明HTP-rES可以抑制人脐静脉内皮细胞的增殖,并具有一定的剂量依赖性。在10 μg/mL时,对细胞增殖的抑制效果最好,达到48.75%;而HTP-rES对正常肝细胞Chang's作用不明显。
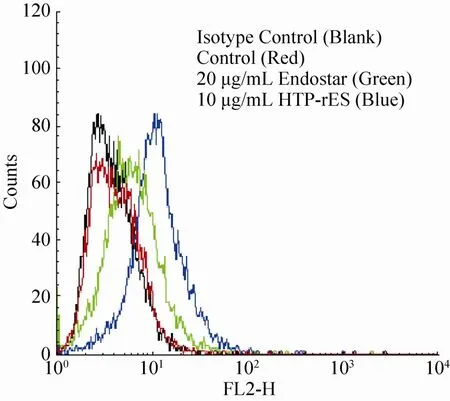
图10 融合蛋白对人肝癌细胞HepG2的结合活性Fig. 10 The binding of the fusion protein to HepG2.
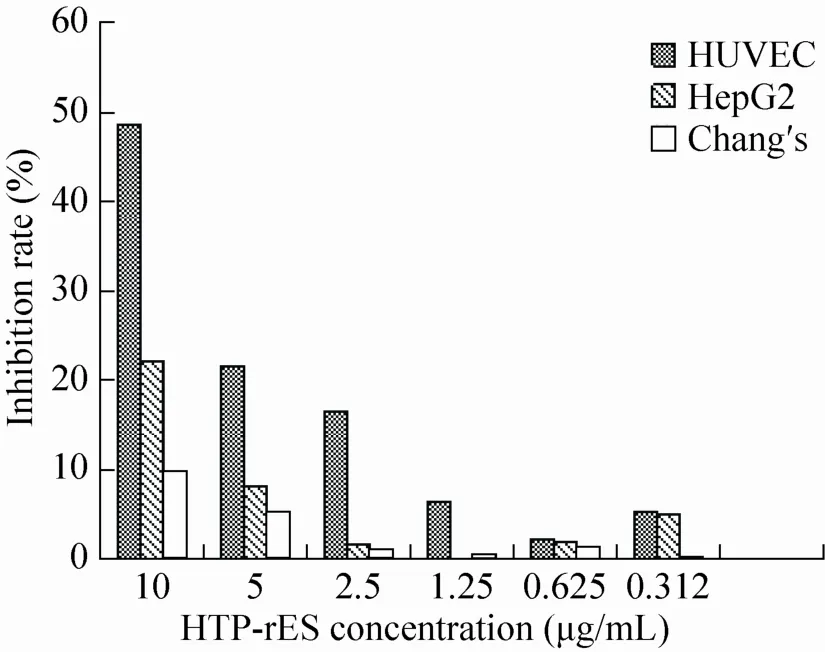
图11 融合蛋白对细胞的抑制作用Fig. 11 Inhibition of the fusion protein to different cells.
3 讨论
蛋白质药物因为具有高活性、强特异性、低毒性、生物功能明确和有利于临床应用等特点,已成为医药产品中的重要组成部分。利用DNA重组技术生产重组蛋白质药物成本低、成功率高、安全可靠,越来越受到研究者的青睐。原核表达系统因为其易于培养、繁殖快、表达量高、成本低、易纯化和遗传背景清楚等优点,成为表达重组蛋白药物的首选体系[9-11]。原核表达时,不同诱导条件在很大程度上影响目的蛋白得率[12-15]。为提高目的蛋白的表达效率,本实验测定了重组菌株的生长曲线,进一步对蛋白表达条件进行优化,最终确定最佳诱导时机、最适pH、最适IPTG浓度、最适诱导时间和最适温度;通过包涵体的洗涤、溶解、复性和纯化获得了既能靶向于肝癌细胞又能抑制内皮细胞增殖的融合蛋白。在本实验中,通过考察不同时机发现,在2.5 h进行诱导,目的蛋白表达量和目的蛋白在总蛋白中比例都较高,为最佳诱导时机。单因素优化表达条件结果表明,融合蛋白的表达最佳条件为42 ℃、pH 8.0、IPTG浓度0.06 mmol/L和诱导5 h,占细胞总蛋白的30%。由于包涵体中的融合蛋白与部分破碎的细胞膜膜蛋白及脂体粘连在一起,影响后续复性效率,所以在溶解包涵体之前要先洗涤包涵体,通常用去污剂如1% TritonX-100或低浓度的变性剂 (如2 mol/L尿素) 在50 mmol/L Tris-HCl、1 mmol/L EDTA中洗涤,通过洗涤包涵体沉淀得到粗制的融合蛋白,高浓度的变性剂能使包涵体溶解,如6 mol/L盐酸胍或8 mol/L尿素,通过离子间的相互作用,破坏包涵体蛋白间的氢键而使大部分包涵体蛋白溶解。本实验分别或先后使用1% TritonX-100或2 mol/L尿素洗涤,发现用2 mol/L尿素洗涤时会有部分目的蛋白被洗下来,另外2 mol/L尿素洗涤后包涵体在6 mol/L盐酸胍中的溶解率降低,最后确定用洗涤液A (1% TritonX-100,50 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0) 洗涤3次,用6 mol/L盐酸胍溶解。为获得有生物活性的蛋白,需将溶解后的蛋白进行复性。本实验选用稀释透析复性。多次实验发现,当透析液中盐酸胍浓度为0.5 mol/L时有少量沉淀产生,当透析液中不含盐酸胍时产生大量沉淀,说明融合蛋白在盐酸胍浓度为0.5 mol/L时开始复性。增加盐酸胍浓度为0.25 mol/L透析液,缓慢去除变性剂,添加GSH和GSSG,有利于二硫键的缓慢形成,蛋白复性率大大提高。
肝细胞癌 (Hepatocellular carcinoma,HCC)是血管丰富的实体性肿瘤,肿瘤血管生成在其发生、发展和转移中发挥了重要作用[16-18]。因此,HCC的抗肿瘤血管生成治疗具有巨大的科学意义和重要的实用价值。ES与血管内皮细胞膜上的肝素/硫酸肝素 (HS)、Integrin和VEGF等多种受体结合,抑制血管内皮细胞的增殖、迁移和黏附;另外,ES还能与一些肿瘤细胞上的Integrin α5β1结合影响增殖、迁移、黏附等。美国EntreMed公司采用毕赤酵母表达系统生产了人内皮抑制素,因为产量低且半衰期短而限制了其在临床上的应用[19-20]。大肠杆菌表达系统生产了新型重组人内皮抑制素 (Recombinant human endostatin,rES,商品名Endostar,恩度),其氨基末端经过基因修饰加上了9个氨基酸序列 (MGGSHHHHH),形成6个组氨酸标签,从而提高了产量,简化了纯化工艺,蛋白质活性和稳定性也有了明显提高,目前已用于治疗多种肿瘤[21-24]。但治疗时ES在体内各组织分布相对平均,在病灶部位形成有效浓度较低,为了达到临床效果,只有加大药物剂量,或增加给药次数,或联合化疗药物用药;因此,提高治疗成本,引起较严重的毒副作用。提高ES的靶向性,可将药物有效地输送至病变部位,可提高药物的治疗指数,减少其毒副作用[25-27]。本研究构建的肝靶向肽-重组人内皮抑制素融合蛋白,经原核系统诱导表达、复性和亲和层析纯化后,获得纯度高达95%的融合蛋白。该融合蛋白与肝癌细胞HepG2的结合能力明显高于无靶向性的重组人内皮抑制素Endostar具有良好的肝细胞靶向性;同时还能抑制人脐静脉内皮细胞HUVEC的增殖,可能成为肝癌靶向治疗一种新型、有效的治疗手段。该研究确定了融合蛋白最佳表达条件,获得了纯度高且有活性的目的蛋白,为进一步研究其生物学活性及药物开发奠定基础。
[1] O'Reilly MS, Boehm T, Shing Y, et al. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth. Cell, 1997, 88(2): 277-285.
[2] Sund M, Hamano Y, Sugimoto H, et al. Function of endogenous inhibitors of angiogenesis as endotheliumspecific tumor suppressors. Proc Natl Acad Sci USA, 2005, 102(8): 2934-2939.
[3] Chen Y, Wang S, Lu X, et al. Cholesterol sequestration by nystatin enhances the uptake and activity of endostatin in endothelium via regulating distinct endocytic pathways. Blood, 2011, 117(23): 6392-6403.
[4] Lim J, Duong T, Lee G, et al. The effect of intracellular protein delivery on the anti-tumor activity of recombinant human endostatin. Biomaterials, 2013, 34(26): 6261-6271.
[5] Yokoyama Y, Ramakrishnan S. Binding ofendostatin to human ovarian cancer cells inhibits cell attachment. Int J Cancer, 2007, 121(11): 2402-2409.
[6] Lakatosova-Andelova M, Duskova M, Lucansky V, et al. Effects of endostatin production on oncogenicity and metastatic activity of HPV16-transformed mouse cells: role of interleukin 1α. Int J Oncol, 2009, 35(1): 213-222.
[7] Longmuir KJ, Robertson RT, Haynes SM, et al. Effective targeting of liposomes to liver and hepatocytes in vivo by incorporation of a plasmodium amino acid sequence. Pharm Res, 2006, 23(4): 759-769.
[8] Lee YL, Ahn BC, Lee Y, et al. Targeting of hepatocellular carcinoma with glypican-3-targeting peptide ligand. J Pept Sci, 2011, 17(11): 763-769.
[9] Qing GL, Ma LC, Khorchid A, et al. Cold-shock induced high-yield protein production in Escherichia coli. Nat Biotechnol, 2004, 22(7): 877-882.
[10] Long XB, Gou YR, Luo M, et al. Soluble expression, purification, and characterization of active recombinant human tissue plasminogen activator by auto-induction in E. coli. BMC Biotechnol, 2015, 15: 13.
[11] Salimi A, Babashamsi M. Cloning and optimization of soluble vascular endothelial growth factor 165 expression in Escherichia coli. Avicenna J Med Biotechnol, 2016, 8(1): 23-28.
[12] Chang GD, Li ZL, Qin JY, et al. Optimization of fermentation of recombinant human endostatin (rh-Endostatin) expression in Escherichia coli. Chin J Biotech, 2005, 21(4): 662-666 (in Chinese).常国栋, 李壮林, 秦加阳, 等. 重组人血管内皮抑制素(rh-Endostatin)大肠杆菌表达体系发酵条件的优化. 生物工程学报, 2005, 21(4): 662-666.
[13] Alimu Ryhgl, Mao XF, Liu ZY. Expression optimization and characterization of Tenebrio molitor antimicrobiol peptides TmAMP1m in Escherichia coli. Chin J Biotech, 2013, 29(6): 836−847 (in Chinese).热依汗古丽·阿里木, 毛新芳, 刘忠渊. 黄粉虫抗菌肽在大肠杆菌中表达条件优化及活性分析. 生物工程学报, 2013, 29(6): 836−847.
[14] Collins T, Azevedo-Silva J, da Costa A, et al. Batch production of a silk-elastin-like protein in E. coli BL21(DE3): key parameters for optimisation. Microbial Cell Factories, 2013, 12: 21.
[15] Jiang YS, Li JB, Gao M, et al. Optimized expression, preparation of human papillomavirus 16 L2E7 fusion protein and its inhibitory effect on tumor growth in mice. Chin J Biotech, 2015, 31(4): 566-576 (in Chinese).姜云水, 李剑波, 高孟, 等. 人乳头瘤病毒16型L2E7融合蛋白的优化表达、制备及其对肿瘤生长的抑制作用. 生物工程学报, 2015, 31(4): 566-576.
[16] Cheng AL, Kang YK, Chen ZD, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebocontrolled trial. Lancet Oncol, 2009, 10(1): 25-34.
[17] Goyal A, Wang S, Siegel AB, et al. Prognostic value of vascular endothelial growth factor levels in patients with hepatocellular carcinoma. J Clin Oncol, 2012, 30(9): 1018-1019.
[18] Muto J, Shirabe K, Sugimachi K, et al. Review of angiogenesis in hepatocellular carcinoma. Hepatol Res, 2015, 45(1): 1-9.
[19] Herbst RS, Hess KR, Tran HT, et al. Phase I study of recombinant human endostatin in patients with advanced solid tumors. J Clin Oncol, 2002, 20(18): 3792-3803.
[20] Kulke MH, Bergsland EK, Ryan DP, et al. Phase II study of recombinant human endostatin in patients with advanced neuroendocrine tumors. J Clin Oncol, 2006, 24(22): 3555-3561.
[21] Jiang LP, Zou C, Yuan X, et al. N-terminal modification increases the stability of the recombinant human endostatin in vitro. Biotechnol Appl Biochem, 2009, 54(2): 113-120.
[22] Zhao X, Mei K, Cai XH, et al. A randomized phase II study of recombinant human endostatin plus gemcitabine/cisplatin compared with gemcitabine/ cisplatin alone as first-line therapy in advancednon-small-cell lung cancer. Invest New Drugs, 2012, 30(3): 1144-1149.
[23] Chen JH, Yao Q, Li D, et al. Neoadjuvant rh-endostatin, docetaxel and epirubicin for breast cancer: efficacy and safety in a prospective, randomized, phase II study. BMC Cancer, 2013, 13: 248.
[24] Cui CL, Mao LL, Chi ZH, et al. A phase II, randomized, double-blind, placebo-controlled multicenter trial of endostar in patients with metastatic melanoma. Mol Ther, 2013, 21(7): 1456-1463.
[25] Zhang HT, LI HC, LI ZW, et al. A tumor-penetrating peptide modification enhances the antitumor activity of endostatin in vivo. Anticancer Drugs, 2011, 22(5): 409-415.
[26] Shin SU, Cho HM, Merchan J, et al. Targeted delivery of an antibody-mutant human endostatin fusion protein results in enhanced antitumor efficacy. Mol Cancer Ther, 2011, 10(4): 603-614.
[27] Pu CY, Xu HM, Hu JL, et al. RGD-modified endostatin fragments showed an antitumor effect through antiangiogenesis. Anticancer Drugs, 2012, 23(8): 788-802.
(本文责编 陈宏宇)
Yan Ma. Tel: +86-20-39352552; E-mail: mayan820901@126.com
Optimization of expression conditions and activity identification of hepatocyte-targeting peptide-human endostatin
Yan Ma1, Wei Li2, Xiaobo Li1, Dongmei Bao1, and Jianpei Lu1
1 Guangdong Key Laboratory of Pharmaceutical Bioactive Substances, School of Basic Sciences, Guangdong Pharmaceutical University, Guangzhou 510006, Guangdong, China
2 School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, Guangdong, China
To obtain sufficient purified and active fusion protein-hepatocyte-targeting peptide-human endostatin (HTP-rES), we studied the growth curve and the optimal induction timing of BL21/pET21b-HTP-rES. Different conditions of pH value, induction time, induction concentration and induction temperature were optimized by univariate analysis. After washing, refolding and purifying, the activity of fusion protein was identified by flow cytometry and 3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide (MTT). Results show that the logarithmic growth phase of BL21/pET21b-HTP-rES was from 1.5 h to 3.5 h, the optimum expression conditions were pH 8.0, 0.06 mmol/L IPTG, at 42 ℃ for 5 h. The purity of inclusion bodies was up to 60% after washing. The purity of target protein was more than 95% after refolding and purification. Our findings provide the foundation for further biological activity and drug development.
hepatocyte-targeting peptide, human endostatin, expression conditions, activity identification
Supported by:National Natural Science Foundation of China (No. 81502520), Natural Science Foundation of Guangdong Province (No. 2016A030310299).
Received:April 28, 2016;Accepted:August 8, 2016
