螯合剂和鼠李糖脂联合淋洗污染土壤中Cd
2016-12-28陈冬月施秋伶张进忠刘江钱盛
陈冬月,施秋伶,张进忠,2*,刘江,钱盛
(1.西南大学资源环境学院,三峡库区生态环境教育部重点实验室,重庆 400715;2.重庆市农业资源与环境重点实验室,重庆 400716)
螯合剂和鼠李糖脂联合淋洗污染土壤中Cd
陈冬月1,施秋伶1,张进忠1,2*,刘江1,钱盛1
(1.西南大学资源环境学院,三峡库区生态环境教育部重点实验室,重庆 400715;2.重庆市农业资源与环境重点实验室,重庆 400716)
采用pH为4.31的土壤,制备3种Cd浓度水平的模拟污染土壤,研究了螯合剂和鼠李糖脂对土壤中Cd的淋洗特征,探讨了乙二胺四乙酸二钠(EDTA)和鼠李糖脂联合淋洗土壤中Cd的形态变化。结果表明,在淋洗剂浓度为0.025 mol·L-1、初始pH为7时,EDTA、乙二胺二琥珀酸(EDDS)和柠檬酸(CIT)淋洗分别在220、140、60 min达到平衡,EDTA的淋洗效果最好,其对0.38、0.69、0.93 mg·kg-1Cd污染土壤的最大淋洗率分别达到93.16%、93.62%和94.09%;淋洗过程符合准二级动力学模型,淋洗速率常数表现为0.38 mg·kg-1Cd污染土壤>0.69 mg·kg-1Cd污染土壤>0.93 mg·kg-1Cd污染土壤。当EDTA和鼠李糖脂(浓度均为0.025 mol·L-1)的体积比为1.5∶1时,3种土壤中Cd的淋溶率分别为85.45%、89.25%和93.88%,淋洗平衡时间为50 min。EDTA和鼠李糖脂联用能够有效淋洗污染土壤中的交换态、碳酸盐结合态和有机结合态Cd,可能的作用机制是EDTA的螯合作用和鼠李糖脂的胶束增溶作用产生的协同效应。
镉;污染土壤;螯合剂;鼠李糖脂;淋洗特征
随着工业、农业和交通运输业的迅猛发展,城镇化进程的不断加快,通过各种途径进入土壤中的重金属呈现逐年增加的趋势。2014年《全国土壤污染状况调查公报》显示,我国耕地土壤点位超标率为19.4%,轻微、轻度、中度和重度污染比例分别达到13.7%、2.8%、1.8%和1.1%,主要污染物为Cd、Pb、Hg、As和Cr等,土壤重金属污染已对我国农业生态环境构成严重威胁。土壤中的Cd主要来自电镀、电池、颜料等工业排放以及干湿沉降、施肥、污水灌溉和污泥农用等途径[1],针对Cd污染土壤的修复技术主要有客土法、电动修复法、植物修复法和化学钝化法等。客土法的修复成本高,电动修复容易改变土壤理化性质,化学钝化只是改变重金属在土壤中的存在形态,当环境条件发生变化时,重金属会重新释放出来。植物修复成本低廉、环境友好,但是修复速度慢、效率低。采用多种技术联合修复Cd污染土壤逐渐受到学术界的青睐。化学淋洗能够提高土壤中重金属的生物有效性,结合植物修复治理重金属污染土壤,具有广阔的发展前景[2]。与使用单一螯合剂相比,多种螯合剂联用可以显著提高Cd的淋洗效率[3-4]。
与化学表面活性剂相比,生物表面活性剂不仅毒性低、容易降解,而且分子结构多样、专一性强[5-6]。作为生物表面活性剂的代表,鼠李糖脂兼有糖类和脂类化合物的物理化学性质,具有较低的临界胶束浓度(CMC),能够显著降低溶液表面张力,分子中的羟基和羧基基团还可与土壤中的重金属离子络合,使重金属从土壤中解吸出来[7]。鼠李糖脂可以提取尾矿中的Cu[8],对Cd2+的络合率能够达到92%[9];用鼠李糖脂提取沉积物中的Cd,浸提率可以达到20%[10];在40℃时淋洗污染土壤,其中的Cd和Cu去除率分别达到53.8%和63.2%[11]。由此看来,应用鼠李糖脂修复重金属污染土壤具有一定潜力。
采用螯合剂淋洗土壤中重金属可以获得较高的淋洗率,但淋洗平衡时间较长;表面活性剂能够增加土壤中金属离子的溶解性,淋洗速率较快,但淋洗效率低。针对单一螯合剂或表面活性剂在污染土壤修复中各自的局限,将不同类型的淋洗剂进行优化复配,利用它们的螯合作用和协同增溶效应,能够强化污染物去除和减少淋洗剂用量[12]。将螯合剂和生物表面活性剂联用有望提高重金属的淋洗效率,如施加鼠李糖脂和乙二胺二琥珀酸(EDDS)能够大幅提高土壤溶液中Cu、Pb、Cd的浓度[13];鼠李糖脂和柠檬酸联用对土壤中Cd的淋洗率可以达到60%[14];用体积比为1∶5的柠檬酸和皂素联合淋洗土壤中的Zn和Pb,去除率分别达到67.2%和68.8%[15];NaOH和乙二胺四乙酸二钠(EDTA)联合淋洗As污染土壤,去除率可以达到91.83%[16];用体积比为1∶1的酒石酸和皂素浸提土壤中的Cd,去除率甚至高达87.62%[17]。另一方面,现有研究大多集中在单一污染水平的土壤修复,针对多个污染水平的研究相对较少。为此,本文采用振荡淋洗实验,研究螯合剂对3种污染水平土壤中Cd的淋洗特征,筛选出可有效洗脱土壤中Cd的螯合剂,再用土柱淋溶实验,考察螯合剂与鼠李糖脂联用的淋洗效果,比较淋溶前后土壤中Cd的形态变化,初步分析污染土壤中Cd的联合淋洗机制。
1 材料与方法
1.1 土壤样品
1.1.1 原土
用多点混合采样法,采集重庆市某果园的蜜橘园表土样品(0~20 cm),土壤类型主要为冷沙黄泥,质地偏砂、渗透性好。土壤样品经自然风干、粉碎后过2 mm筛,用于测定土壤理化性质;过100目筛的土壤样品用于Cd含量分析。土壤的基本理化性质为:pH4.31(土∶水为1∶5),有机质含量33.21 mg·kg-1,阳离子交换量(CEC)6.71 cmol·kg-1;土壤中Cd的本底含量为0.16 mg·kg-1。
1.1.2 模拟污染土壤
参照《绿色食品产地环境技术条件》(NY/T 391—2000)中“pH<6.5的土壤中各项污染物的指标要求”[18],土壤中Cd轻度、中度和重度污染水平分别为0.3、0.6、0.9 mg·kg-1,配制模拟污染土壤;参照《土壤农业化学分析方法》[19]和Tessier五步连续浸提法[20],采用火焰原子吸收分光光度法测定土壤样品中Cd的全量和各形态含量。
模拟Cd污染土壤:称取过100目筛的原土4 kg,分别加入3.3、6.6、9.9 mg Cd(NO3)2·4H2O,充分混合2 h,间歇搅拌1周,覆盖,在阴凉处放置1个月,自然风干、研磨、过100目筛,测得3种模拟污染土壤中Cd全量分别为0.38、0.69、0.93 mg·kg-1。
1.2 主要试剂
Cd(NO3)2·4H2O和EDTA均为分析纯,购自成都科龙化学试剂公司;EDDS为分析纯,购自Sigma-Aldrich(上海)贸易有限公司;柠檬酸(CIT)为分析纯,重庆市科试化学有限公司生产;鼠李糖脂主要由单糖和双糖构成,单双糖比为2∶1,纯度≥95%,相对平均分子量为546.7,临界胶束浓度为50 mg·L-1[21],湖州紫金生物科技有限公司生产。3种螯合剂与鼠李糖脂的主要理化性质见表1。
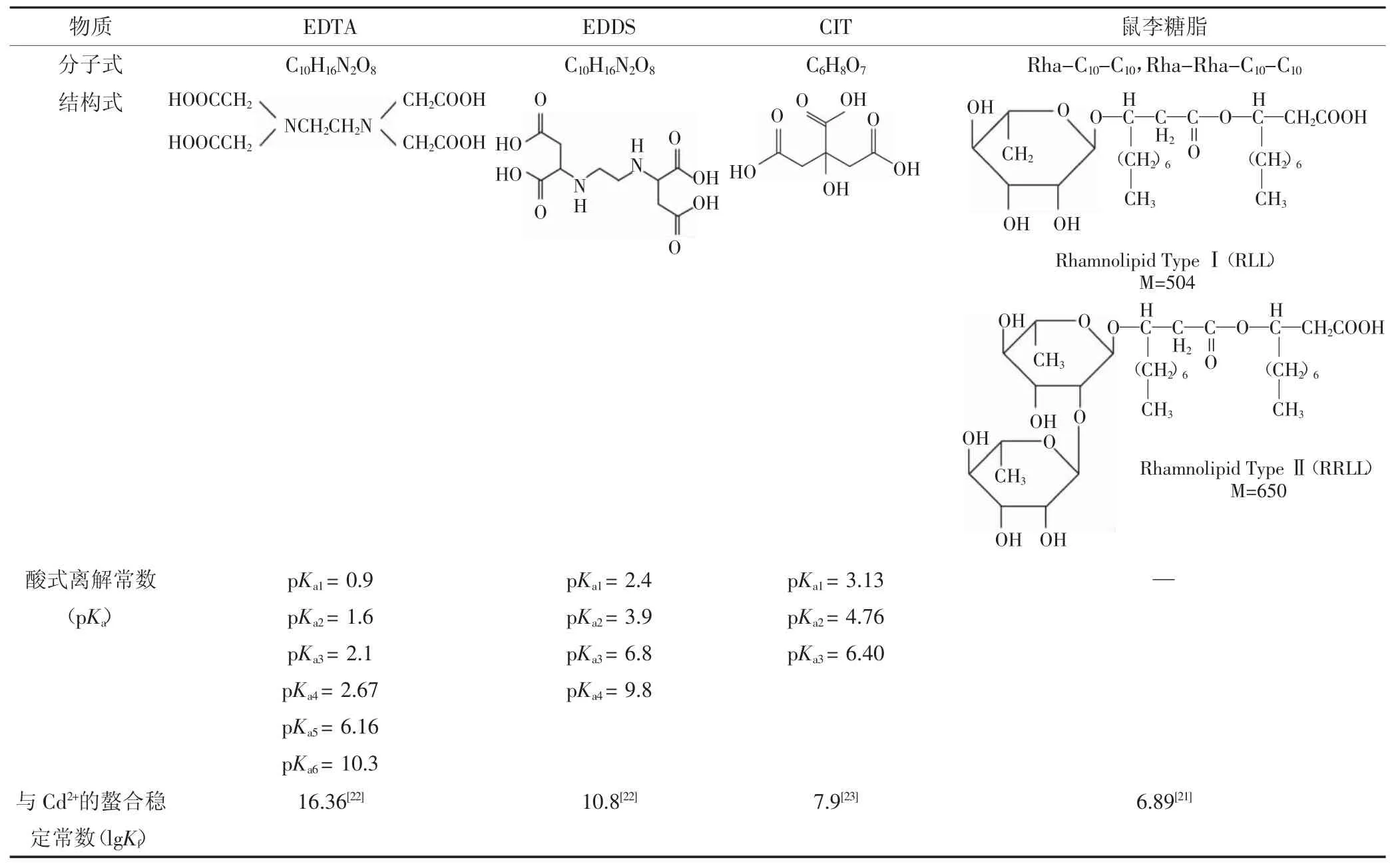
表1 3种螯合剂和鼠李糖脂的主要理化性质Table 1 Main physicochemical property of the three chelates and rhamnolipid
1.3 主要仪器
pHs-4C+型酸度计,成都市方舟科技有限公司;ZHWY-211B型恒温摇床,上海智城分析仪器制造有限公司;TDL-5C型离心机,上海安亭科学仪器厂;SHZ-D(Ⅲ)型循环式真空泵,河南巩义予华仪器有限责任公司;TAS-990型火焰原子吸收分光光度计,北京普析通用仪器有限责任公司。
1.4 实验步骤
1.4.1 螯合剂、鼠李糖脂淋洗污染土壤中的Cd
用0.1 mol·L-1NaOH溶液调节0.025 mol·L-1EDTA溶液的pH至7,称取模拟污染土壤样品0.50 g于50 mL塑料离心管中,分别加入pH 7的EDTA溶液20 mL,在室温条件下,以220 r·min-1分别振荡5、15、20、30、45、90、120、180、240、360、480 min。取出离心管,4000 r·min-1离心分离10 min,取上清液过0.45 μm滤膜,测定滤液中Cd的浓度,计算土壤中残留的Cd含量,研究模拟污染土壤中Cd的淋洗动力学特征。每个处理重复3次,下同。
土壤中Cd的淋出量(Q1)、残留量(Q2)和淋洗率(η)分别用下列各式计算:
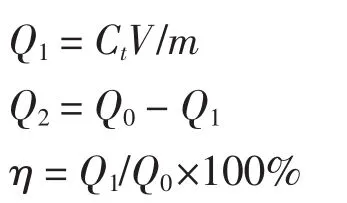
式中:t为淋洗时间,min;Q0为土壤中Cd的总量,mg· kg-1;Ct为t时刻时淋出液中Cd的浓度,mg·L-1;V为淋洗液体积,L;m为土壤质量,kg。
采用EDDS、CIT、鼠李糖脂为淋洗剂时,实验步骤同上。
1.4.2 螯合剂、鼠李糖脂淋洗的影响因素
(1)淋洗液浓度
基于EDTA、CIT和鼠李糖脂淋洗Cu、Pb污染的塿土时,淋洗剂浓度在0.02 mol·L-1时淋洗率达到最大[24],本研究设置淋洗剂的浓度范围为0.001~0.04 mol·L-1,考察淋洗液浓度对Cd淋洗的影响。
称取模拟污染土壤样品0.50 g于50 mL塑料离心管中,分别加入20mL浓度为0.001、0.005、0.01、0.015、0.02、0.025、0.03、0.04mol·L-1的EDTA溶液(pH7),室温条件下以220r·min-1振荡4h。取出离心管,在4000r· min-1离心分离10min,取上清液过0.45μm滤膜,测定滤液中Cd的浓度,计算土壤中Cd的淋洗率。
采用EDDS、CIT、鼠李糖脂为淋洗剂时,实验步骤同上。
(2)淋洗液的初始pH
在pH为3~8时,EDTA、EDDS能与大部分重金属离子(特别是Pb、Cd、Cu和Zn)形成稳定的螯合物[25-26],淋洗率基本不受pH变化的影响;在pH为3~ 6时,CIT对Cd的解吸量随pH增大而减少,pH值为3时解吸量最大[27]。本研究的供试土壤pH为4.31,因此设置淋洗液初始pH范围为4~7,考察淋洗液初始pH对Cd淋洗的影响。
用0.1 mol·L-1HNO3或NaOH溶液调节0.015 mol·L-1EDTA溶液的pH分别至4、5、6和7,称取模拟污染土壤样品0.50 g于50 mL塑料离心管中,分别加入20 mL不同pH的EDTA溶液,室温条件下以220 r·min-1振荡4 h。取出离心管,在4000 r·min-1离心分离10 min,取上清液过0.45 μm滤膜,测定滤液中Cd的浓度,计算土壤中Cd的淋洗率,研究淋洗液初始pH对Cd淋洗的影响。
采用EDDS和CIT为淋洗剂时,实验步骤同上。1.4.3螯合剂和鼠李糖脂联合淋洗污染土壤中的Cd
(1)螯合剂与鼠李糖脂配比的影响
在1.4.1和1.4.2节的基础上,选取淋洗效果最佳的螯合剂和淋洗液条件,配制螯合剂和鼠李糖脂的混合淋洗液,设置的体积比分别为1∶1、1.5∶1和2∶1。土柱淋溶实验采用直径6 cm、高30 cm的PVC管,上下层各铺尼龙布和5 cm厚的石英砂,中间装入20 cm模拟污染土壤样品,用淋洗液连续淋洗,收集淋出液。将淋出液过0.45 μm滤膜,测定滤液中Cd的浓度,计算土壤中Cd的淋溶率,研究螯合剂与鼠李糖脂配比对Cd淋溶的影响。同时以单独螯合剂、鼠李糖脂淋溶作对照实验。
(2)联合淋洗后土壤中Cd形态测定
当淋出液中不能检出Cd时,终止淋溶,用去离子水反复淋洗土柱,待土柱中不再有液体流出时停止淋洗,取出土柱中的土样,自然风干、研磨、过100目筛。取此土样2 g,分别测定交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态Cd含量,比较淋溶前后土壤中Cd的形态变化。
1.5 数据处理与统计分析
采用Excel 2016软件处理和分析实验数据,用单因素方差分析法检验数据的显著性。
2 结果与讨论
2.1 螯合剂、鼠李糖脂淋洗土壤中Cd的动力学特征
2.1.1 淋洗平衡时间
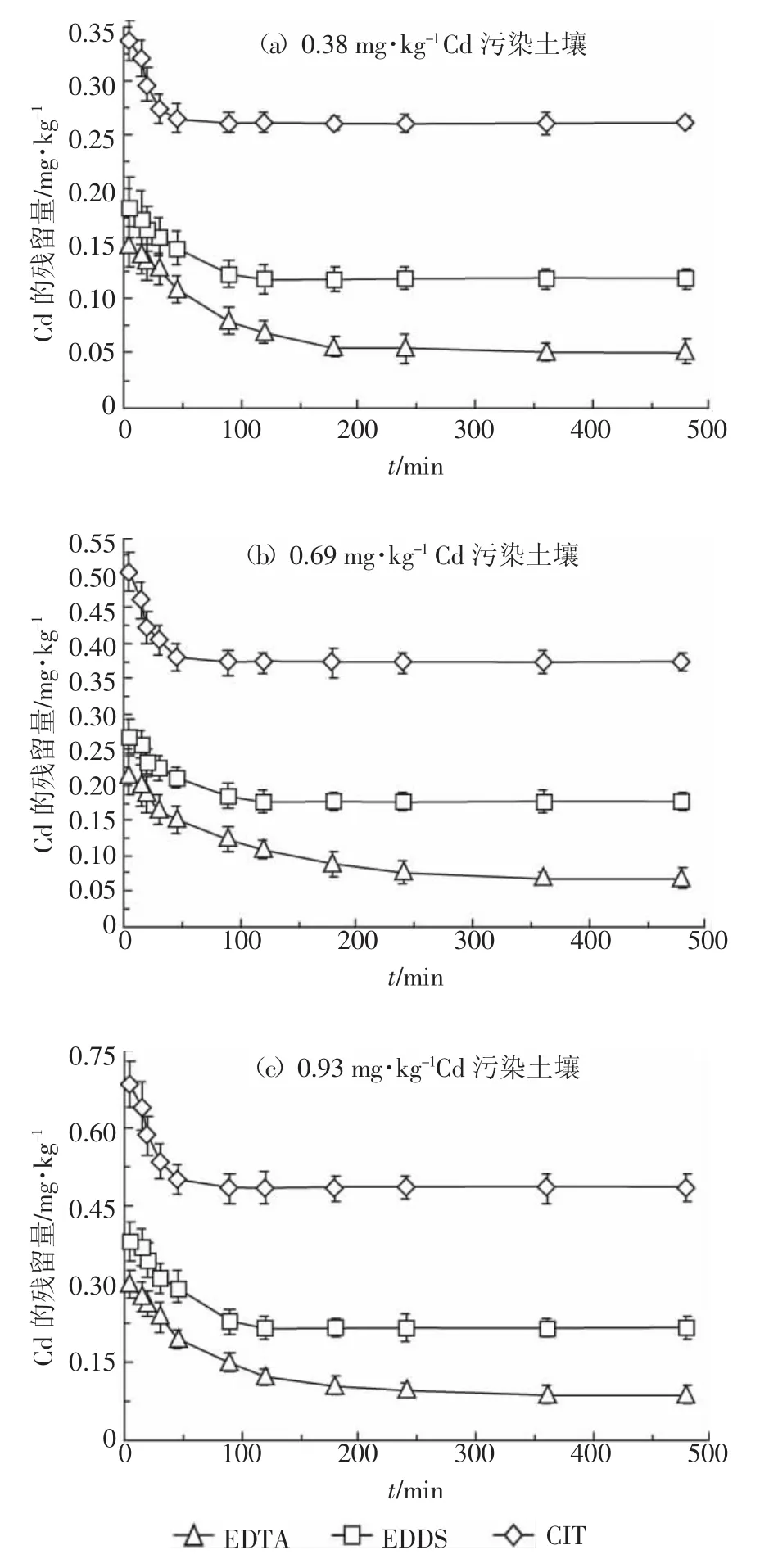
图1 螯合剂淋洗污染土壤中Cd的动力学曲线Figure 1 Leaching kinetic curves of Cd in the contaminated soils with the three chelates
由于纯水对Cd的淋洗率低于1.8%,对实验结果影响很小,本研究忽略Cd在纯水中的溶出。图1表示初始pH为7、浓度为0.025 mol·L-1的3种螯合剂对污染土壤中Cd的淋洗动力学曲线。可以看出,淋洗初期土壤中Cd的残留量均随时间的增加而快速下降,EDTA、EDDS和CIT淋洗分别在220、140、60 min达到平衡。吴少飞等[28]用EDTA提取水稻土壤中的Cd时,淋洗达到平衡的时间(120 min)比本研究提前,其原因可能是其使用的EDTA浓度(0.05 mol·L-1)较高。3种螯合剂对污染土壤中Cd的淋出量依次为EDTA>EDDS>CIT,CIT对Cd的淋出量明显低于其他两种螯合剂;EDTA、EDDS和CIT对0.38 mg·kg-1Cd污染土壤的最大淋洗率分别为93.16%、91.58%和85.53%,对0.69 mg·kg-1Cd污染土壤分别为93.62%、92.03%和86.38%,对0.93 mg·kg-1Cd污染土壤分别为94.09%、92.58%和87.31%。
图2表示初始pH为7、浓度为0.025 mol·L-1的鼠李糖脂对污染土壤中Cd的淋洗动力学曲线。可以看出,随着淋洗时间的增加,鼠李糖脂对土壤中Cd的淋洗率变化不大,3种污染水平的土壤均在20 min左右达到淋洗平衡。鼠李糖脂对0.38、0.69、0.93 mg· kg-1Cd污染土壤的最大淋洗率分别为21.32%、22.90%和24.19%。
比较图1和图2可以看出,鼠李糖脂淋洗土壤中的Cd明显比3种螯合剂快,表明鼠李糖脂淋洗是一个快速过程。这是因为鼠李糖脂不仅对Cd具有螯合作用(lgKf为6.89[21]),还具有胶束增溶作用,即分子中的疏水基团使鼠李糖脂形成胶束,胶束外围为带负电荷的亲水基团,这些基团通过降低土壤表面张力,影响土壤与Cd结合物之间的粘附性。因为这种结合力小于土壤对Cd的吸附力,所以会快速达到淋洗平衡,使得Cd的淋出量较低。
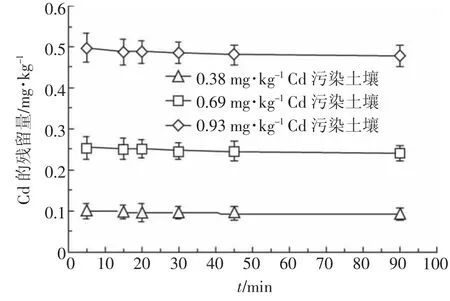
图2 鼠李糖脂淋洗污染土壤中Cd的动力学曲线Figure 2 Leaching kinetic curves of Cd in the contaminated soils with rhamnolipid
2.1.2 淋洗动力学特征
目前大多采用一级和二级动力学模型来描述螯合剂对重金属的淋洗过程。Wasay等[29]用螯合剂淋洗土壤中的Pb、Cd和Cu,发现准一级动力学方程可以很好地描述该淋洗过程。准一级动力学模型适用于固-液体系中污染物的溶解或解吸,并在两相间发生迁移和达到分配平衡的过程[30];准二级动力学模型认为,淋洗率主要受淋洗剂与污染物之间化学作用的影响。采用准一级和准二级动力学方程分别拟合螯合剂和鼠李糖脂淋洗土壤中Cd的实验结果,获得如表2所示的动力学参数。

表2 淋洗剂淋洗污染土壤中Cd的动力学参数Table 2 Kinetic parameters of Cd in the contaminated soils leached by the four eluents
准一级动力学方程可表达为:

准二级动力学方程可表达为:
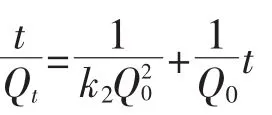
式中:Qt为t时刻时土壤中Cd的残留量,mg·kg-1;Q0为淋洗前土壤中Cd的含量,mg·kg-1;k1为一级速率常数,min-1;k2为二级速率常数,kg·mg-1·min-1;t为淋洗时间,min。
从表2可以看出,准二级动力学模型可以很好地描述3种螯合剂对土壤中Cd的淋洗过程,淋洗速率常数均表现为0.38 mg·kg-1Cd污染土壤>0.69 mg· kg-1Cd污染土壤>0.93 mg·kg-1Cd污染土壤;3种螯合剂对Cd的淋洗速率常数依次为CIT>EDDS>EDTA,与用EDTA、CIT分别淋洗Cu、Pb复合污染土壤的结果基本一致[24]。其原因可能是CIT为低分子量有机酸,对Cd的淋洗作用包括CIT与Cd2+的螯合、H+对Cd的溶解作用,两种作用的协同效应使得淋洗速率加快,而EDTA和EDDS主要以螯合作用为主。根据EDTA(H6Y2+)的酸式离解常数pKa5=6.16可知,pH为7时EDTA的主要存在形式为HY3-[22],容易与Cd2+形成螯合物;EDDS(H4Z)的酸式离解常数pKa3=6.8,pH为7时EDDS的主要存在形式为HZ3-[22],能够与Cd2+形成螯合物;CIT(H3L)的酸式离解常数pKa3=6.40,pH为7时CIT的主要存在形式为L3-[23],也能与Cd2+形成稳定的配合物。准二级动力学模型也能很好地描述鼠李糖脂对土壤中Cd的淋洗过程,淋洗速率常数也表现为0.38 mg·kg-1Cd污染土壤>0.69 mg·kg-1Cd污染土壤>0.93 mg·kg-1Cd污染土壤。鼠李糖脂对土壤中Cd的淋洗速率常数远远大于3种螯合剂,说明鼠李糖脂对土壤中Cd的淋洗时间更短。
2.2 淋洗液浓度和初始pH对淋洗效果的影响
2.2.1 淋洗液浓度
图3表示3种螯合剂浓度对污染土壤中Cd淋洗率的影响。
从图3可以看出,当螯合剂浓度低于0.025 mol· L-1时,3个污染水平的土壤中Cd淋洗率均随螯合剂浓度的升高而增大;当螯合剂浓度为0.025 mol·L-1时,淋洗率达到最大,随后趋于平衡。采用同一浓度的相同螯合剂时,Cd淋洗率均随土壤污染程度的增加而增加,与用柠檬酸淋洗中低度污染土壤中Cd的结果[31]基本一致;对于同一污染水平的土壤,EDTA对Cd的淋洗率比EDDS和CIT高。当螯合剂浓度为0.025 mol·L-1时,EDTA对0.38、0.69、0.93 mg·kg-1Cd污染土壤的淋洗率分别达到90.16%、92.61%和95.09%,EDDS对Cd的淋洗率分别为72.19%、76.42%和78.99%,CIT对Cd的淋洗率分别为35.61%、42.61%和47.87%,表现为EDTA>EDDS> CIT的顺序,与陈晓婷等[32]的研究结果相似。这是因为EDTA与Cd2+的螯合稳定常数(lgKf为16.36[22])远大于EDDS和CIT,表现出更强的配位能力,所以使Cd2+更容易从土壤中释放出来。
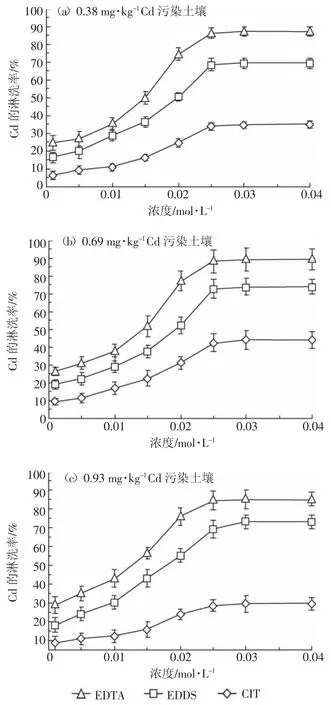
图3 螯合剂浓度对土壤中Cd的淋洗率影响Figure 3 Effect of the concentration of the three chelates on the leaching percentages of Cd in the soils
图4表示鼠李糖脂浓度对污染土壤中Cd淋洗率的影响。可以看出,Cd的淋洗率均随鼠李糖脂浓度的升高而增大;对于同一浓度的鼠李糖脂,淋洗率均随土壤污染程度的增加而增大。总体来说,当鼠李糖脂浓度为0.025 mol·L-1时,Cd的淋洗率达到最大,0.38、0.69、0.93 mg·kg-1Cd污染土壤中淋洗率分别为18.79%、21.74%和24.06%,与Champion等[33]用鼠李糖脂淋洗0.69 mg·kg-1Cd污染土壤的结果非常相近。这可能是因为当鼠李糖脂浓度较低时,其胶束结构不足以形成囊泡状,不易将Cd从土壤中解吸出来;随着浓度的升高,鼠李糖脂胶束结合形成更大的胶团,溶出更多的有机质,进而降低土壤-溶液界面张力,削弱土壤对Cd的粘附性,促进土壤中Cd的释放[34]。此外,Haryanto等[35]发现随着鼠李糖脂浓度升高,其Zeta电位负电势增大,有利于与Cd发生配位反应,进而增大Cd的淋洗率。

图4 鼠李糖脂浓度对污染土壤中Cd淋洗率的影响Figure 4 Effect of the rhamnolipid concentration on the leaching percentages of Cd in the soils
2.2.2 淋洗液初始pH
淋洗剂的酸度会影响螯合剂的存在形态和土壤对重金属的吸附能力[3],进而影响重金属与螯合剂的配位平衡和重金属的淋洗率。图5表示3种螯合剂初始pH对土壤中Cd淋洗率的影响。
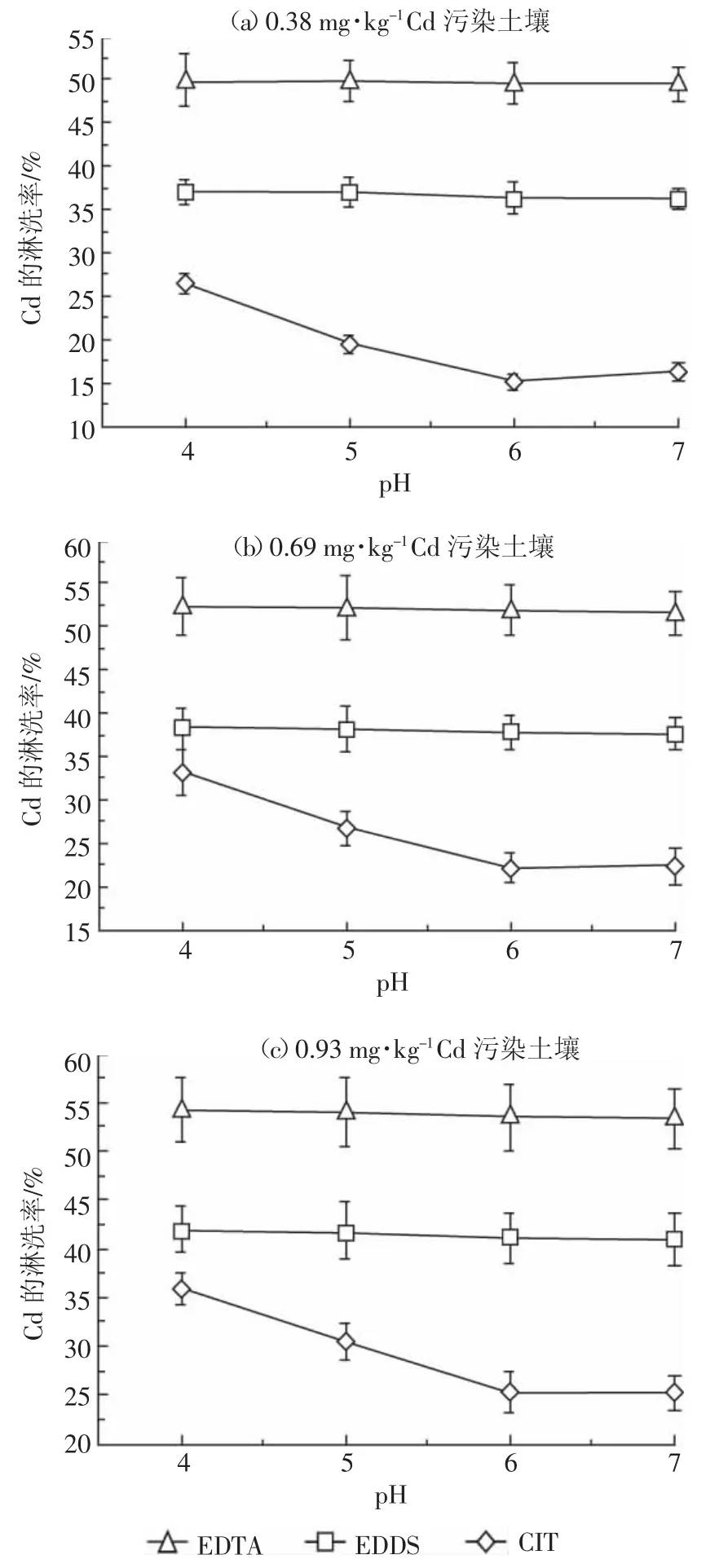
图5 螯合剂初始pH对土壤中Cd的淋洗率影响Figure 5 Effect of the initial pH of the three chelates on the leaching percentages of Cd in the soils
从图5可以看出,用EDTA淋洗时,随着EDTA溶液初始pH的增加,3个污染水平的土壤中Cd淋洗率稍有下降,但总体变化不大。EDTA与Cd2+的螯合稳定常数的对数值为16.36[22],根据EDTA的酸式离解平衡,当pH为4~7时,EDTA的主要存在形式为H2Y2-[22],与Cd2+形成配位比为1∶1的螯合物,使得Cd2+的淋洗率变化不大。EDDS与Cd2+的螯合稳定常数的对数值为10.8[22],表现出较强的螯合能力和与EDTA类似的淋洗趋势。EDDS是EDTA的同分异构体(分子式均为C10H16N2O8),EDDS分子中两个羧基与亚甲基相连,另两个羧基与次甲基相连,空间位阻较大,而EDTA分子中的4个羧基都直接与亚甲基相连,空间位阻相对较小,因此EDTA与Cd2+的配位能力较强。用EDTA和EDDS淋洗时,污染程度越严重的土壤,Cd的淋洗率越高。吴青等[36]用谷氨酸N,N-二乙酸四钠提取污泥中的Cd、Ni、Cu和Zn时,在pH为4~7时,4种重金属的提取率均随pH的升高而稍有下降,与本研究的结果相似。当pH为4~6时,CIT对Cd的淋洗率呈下降趋势,随后趋于平衡。这是因为CIT分子中含有羧基、羟基等酸性基团,可在淋洗过程中解离出H+,通过酸解作用促进土壤中Cd的淋洗;pH变化会影响CIT的存在形态,在溶液中可以H3L、H2L-、HL2-和L3-4种形态存在,H2L-、HL2-和L3-与Cd2+的配位稳定常数的对数值分别为7.9、4.0和11.3[23],L3-的配位能力最强。在pH为4~6时,CIT主要以H2L-和HL2-存在,配位作用较弱,淋洗土壤中的Cd以酸解作用为主。
鼠李糖脂的碱溶性强,在pH较高时可形成更多的小型胶束,有利于Cd2+与其结合[37];pH升高使得鼠李糖脂的分子结构发生变化,依次为:片状→囊泡状→胶束,结构趋于开放,亲水基团更容易与Cd2+结合,同时鼠李糖脂中的羧基氢离解,有利于羧基阴离子与Cd2+形成配合物,促使土壤中Cd的释放。Bodagh等[38]用鼠李糖脂淋洗Cd时发现,鼠李糖脂的表面活性顺序为胶束>片状>泡状,其临界胶束浓度随着pH的升高而增大,在pH为6.5~7时表面活性最强;蓝梓铭等[39]用鼠李糖脂去除剩余污泥中的Cu和Ni,也发现类似的结果。因此,本研究直接设定鼠李糖脂溶液的初始pH为7。
2.3 EDTA和鼠李糖脂联合淋洗污染土壤中的Cd
根据2.1和2.2节的结果,EDTA对Cd的淋洗率显著高于其他两种螯合剂,且EDTA溶液初始pH对淋洗率没有明显影响。因此,以初始pH为7、浓度均为0.025 mol·L-1的EDTA和鼠李糖脂溶液为淋洗剂,设置EDTA和鼠李糖脂的体积比为1∶1、1.5∶1和2∶1,采用土柱淋溶实验,研究它们对污染土壤中Cd的联合淋洗效果,获得如图6所示的结果。
从图6可以看出,当EDTA和鼠李糖脂的体积比为1.5∶1时,3种污染水平的土壤中Cd的淋洗率最大,获得0.38、0.69、0.93 mg·kg-1Cd污染土壤的淋洗率分别为85.45%、89.25%和93.88%。这是因为混合淋洗剂中鼠李糖脂浓度为0.01 mol·L-1(5.47 g·L-1),远大于鼠李糖脂的CMC(50 mg·L-1),胶束的增溶作用能够增加重金属离子的水溶性[40],促进土壤中Cd的淋洗;EDTA二钠盐中的Na+增加了土壤溶液的离子强度,还能交换出部分被土壤吸附的Cd,而EDTA在混合淋洗剂中占比的增加,有利于Cd2+与EDTA形成稳定的螯合物。
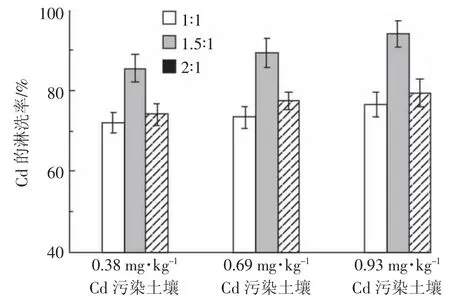
图6 EDTA和鼠李糖脂配比对污染土壤中Cd淋溶率的影响Figure 6 Effect of the volume ratio of EDTA and rhamnolipid on the leaching percentages of Cd in the soils
采用体积比为1.5∶1的EDTA和鼠李糖脂联合淋洗Cd污染土壤,获得如图7所示的动力学曲线。可以看出,当淋洗时间为0~50 min时,3种污染土壤中Cd残留量均随时间的增加而减小,并在50 min左右达到平衡。尽管联合淋洗的淋洗率比单独使用EDTA时有所下降,但是联合淋洗显著降低了EDTA的用量,减少了EDTA污染环境的风险,而且淋洗平衡时间大幅缩短。因此,从保护环境和缩短淋洗时间的角度考虑,采用EDTA和鼠李糖脂联合淋洗具有一定的优势。
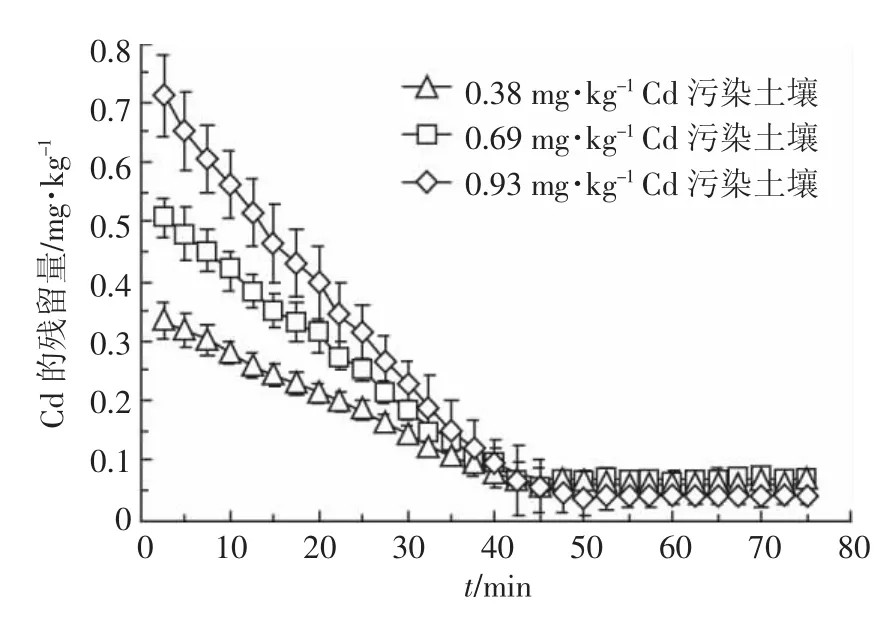
图7 EDTA和鼠李糖脂联合淋洗污染土壤中Cd的动力学曲线Figure 7 Leaching kinetic curves of Cd in the pollution soils with EDTA and rhamnolipid
2.4 EDTA和鼠李糖脂联合淋洗土壤中Cd的形态变化
重金属进入土壤后,通过物理、化学或生物作用,与土壤中物质形成不同的结合形态,而淋洗剂对不同形态重金属的淋出能力差异较大。用EDTA和鼠李糖脂联合淋洗0.93 mg·kg-1Cd污染土壤,淋洗前后土壤中Cd的形态分布如图8所示。
从图8可以看出,淋洗前土壤中Cd以交换态、碳酸盐结合态和有机结合态为主,3种形态含量分别为0.23、0.35、0.24 mg·kg-1,占Cd全量的24.73%、37.63%和25.81%;铁锰氧化物结合态和残渣态含量分别为0.03、0.06 mg·kg-1,占Cd全量的3.23%和6.45%。淋洗后土壤中5种形态的Cd含量都有不同程度的下降,其中交换态、碳酸盐结合态和有机结合态含量分别降低至0.003、0.001、0.003 mg·kg-1,比淋洗前分别下降98.70%、99.71%和98.75%,而铁锰氧化物结合态和残渣态含量分别下降43.66%和18.71%。因此,EDTA和鼠李糖脂联用对交换态、碳酸盐结合态和有机结合态Cd的淋洗效果最好。李尤等[11]用鼠李糖脂淋洗Pb、Cd、Zn、Cu和As污染的土壤,发现淋洗后土壤中5种重金属的酸提取态、氧化物结合态和有机物结合态含量大幅下降;孟蝶[14]用鼠李糖脂和柠檬酸联合淋洗有机-无机复合污染土壤,发现交换态和碳酸盐结合态Cd的去除率分别达到82.2%和65.3%。这是因为交换态和碳酸盐结合态重金属与土壤结合较弱,迁移能力强,容易从土壤中释放出来[34],鼠李糖脂的胶束增溶作用促进了有机结合态Cd的释放。

图8 联合淋洗前后污染土壤中Cd的形态分布Figure 8 Speciation distribution of Cd in the pollution soil before and after leaching
本研究单独用鼠李糖脂淋洗时,Cd的淋洗率较低,说明它与Cd的螯合作用较弱,淋洗时胶束增溶作用为主导。当鼠李糖脂浓度低于其CMC(50 mg· L-1)[26]时,主要以单分子形式存在,淋洗Cd以配位-螯合作用为主;浓度高于CMC时,则以胶束增溶作用为主[41]。混合淋洗剂中鼠李糖脂浓度为5.47 g·L-1,远大于它的CMC,故可以形成胶团,将Cd包围在多个鼠李糖脂分子之间,阻止Cd与土壤颗粒结合,进而使Cd随胶团转移到液相,增加了土壤中Cd的溶解。由于鼠李糖脂疏水基团和亲水基团的共同作用,土壤表面的氢键作用和静电吸引使其快速吸附在土壤矿物表面,改变固-液界面性质,促使Cd与EDTA有效接触,形成稳定的五元环螯合物,使Cd从土壤中释放出来;鼠李糖脂还可与释放出来的Cd形成配合物,促进土壤中Cd的进一步释放,达到强化淋洗的效果。此外,EDTA溶液中的Na+能够压缩鼠李糖脂胶团的双电层,降低鼠李糖脂间的排斥作用,使得更多的鼠李糖脂离子进入胶团,提高胶团的增溶作用。
3 结论
螯合剂和鼠李糖脂对Cd污染土壤的淋洗率均随污染水平的增加而增加,EDTA对Cd污染土壤的淋洗率最高;尽管用鼠李糖脂淋洗的速率较快,但是淋洗率较低。采用体积比为1.5∶1的EDTA和鼠李糖脂联合淋洗,能够显著降低污染土壤中的交换态、碳酸盐结合态和有机结合态Cd含量,减少EDTA污染环境的风险,大幅缩短淋洗平衡时间。
[1]刘莉.镉对不同作物幼苗生长和生理特性的影响[D].杭州:浙江大学,2005.
LIU Li.Effects of cadmium on the growth and physiological characteristics of different crop seedlings[D].Hangzhou:Zhejiang University,2005.
[2]Kos B,Leštan D.Induced phytoextraction/soil washing of lead using biodegradable chelate and permeable barriers[J].Environmental Science &Technology,2003,37(3):624-629.
[3]尹雪,陈家军,蔡文敏.EDTA与柠檬酸复配洗涤修复多重金属污染土壤效果研究[J].环境科学,2014,35(8):3096-3101.
YIN Xue,CHEN Jia-jun,CAI Wen-min.Evaluation of compounding EDTA and citric acid on remediation of heavy metal contaminated soil [J].Environmental Science,2014,35(8):3096-3101.
[4]尹雪,陈家军,吕策.螯合剂复配对实际重金属污染土壤洗脱效率影响及形态变化特征[J].环境科学,2014,35(2):733-739.
YIN Xue,CHEN Jia-jun,LÜ Ce.Impact of compounded chelants on removal of heavy metals and characteristics of morphologic change in soil from heavy metals contaminated sites[J].Environmental Science,2014, 35(2):733-739.
[5]Mulligan C N,Yong R N,Gibbs B F.Heavy metal removal from sediments by biosurfactants[J].Journal of Hazardous Materials,2001,85(1):111-125.
[6]李玉双,胡晓钧,孙铁珩,等.污染土壤淋洗修复技术研究进展[J].生态学杂志,2011,30(3):596-602.
LI Yu-shuang,HU Xiao-jun,SUN Tie-heng,et al.Soil washing/flushing of contaminated soil:A review[J].Chinese Journal of Ecology,2011, 30(3):596-602.
[7]孟蝶,万金忠,张胜田,等.鼠李糖脂对林丹-重金属复合污染土壤的同步淋洗效果研究[J].环境科学学报,2014,34(1):229-237.
MENG Die,WAN Jin-zhong,ZHANG Sheng-tian,et al.Simultaneous removal of lindane and heavy metals from contaminated soils by rhamnolipids enhanced washing[J].Acta Scientiae Circumstantiae,2014,34(1):229-237.
[8]Dahrazma B,Mulligan C N.Extraction of copper from a low-grade ore by rhamnolipids[J].Practice Periodical of Hazardous Toxic and Radioactive Waste Management,2004,8(3):166-172.
[9]Tan H,Champion J T,Artiola J F,et al.Complexation of cadmium by a rhamnolipidbiosurfactant[J].EnvironmentalScience&Technology,1994, 28(13):2402-2406.
[10]时进钢,袁兴中,曾光明,等.鼠李糖脂对沉积物中Cd和Pb的去除作用[J].环境化学,2005,24(1):55-58.
SHI Jin-gang,YUAN Xing-zhong,ZENG Guang-ming,et al.Removal of heavy metals from sediment by rhamnolipid[J].Environmental Chemistry,2005,24(1):55-58.
[11]李尤,廖晓勇,阎秀兰,等.鼠李糖脂淋洗修复重金属污染土壤的工艺条件优化研究[J].农业环境科学学报,2015,34(7):1287-1292.
LI You,LIAO Xiao-yong,YAN Xiu-lan,et al.Optimization of technological conditions for remediation of heavy metal contaminated soil by rhamnolipid washing[J].Journal of Agro-Environment Science,2015, 34(7):1287-1292.
[12]叶茂,杨兴伦,魏海江,等.持久性有机污染场地土壤淋洗法修复研究进展[J].土壤学报,2012,49(4):803-814.
YE Mao,YANG Xing-lun,WEI Hai-jiang,et al.Review of remediation of POPs contaminated sites with soil washing method[J].Acta Pedologica Sinica,2012,49(4):803-814.
[13]石福贵,郝秀珍,周东美,等.鼠李糖脂与EDDS强化黑麦草修复重金属复合污染土壤[J].农业环境科学学报,2009,28(9):1818-1823.
SHI Fu-gui,HAO Xiu-zhen,ZHOU Dong-mei,et al.Remediation of the combined polluted soil by growing ryegrass enhanced by EDDS/ rhamnolipid[J].Journal of Agro-Environment Science,2009,28(9):1818-1823.
[14]孟蝶.鼠李糖脂-柠檬酸对有机-无机复合污染土壤的同步洗脱研究[D].南京:南京农业大学,2014.
MENG Die.Simultaneous washing of organic and inorganic pollutants from soils by rhamnolipid combined with citric acid[D].Nanjing:Nanjing Agricultural University,2014.
[15]许中坚,许丹丹,郭素华,等.柠檬酸与皂素对重金属污染土壤的联合淋洗作用[J].农业环境科学学报,2014,33(8):1519-1525.
XU Zhong-jian,XU Dan-dan,GUO Su-hua,et al.Combined leaching of heavy metals in soil by citric acid and saponin[J].Journal of Agro-Environment Science,2014,33(8):1519-1525.
[16]陈寻峰,李小明,陈灿,等.砷污染土壤复合淋洗修复技术研究[J].环境科学,2016,37(3):1147-1155.
CHEN Xun-feng,LI Xiao-ming,CHEN Can,et al.Mixture leaching remediation technology of arsenic contaminated soil[J].Environmental Science,2016,37(3):1147-1155.
[17]平安,魏忠义,李培军,等.有机酸与表面活性剂联合作用对土壤重金属的浸提效果研究[J].生态环境学报,2011,20(6/7):1152-1157.
PING An,WEI Zhong-yi,LI Pei-jun,et al.Study on the extractive effect of soil heavy metals with organic acids and surfactants[J].Ecology and Environmental Sciences,2011,20(6/7):1152-1157.
[18]中华人民共和国农业部.NY/T 391—2000绿色食品产地环境技术条件[S].北京:中国标准出版社,2000.
Ministry of Agriculture of the PRC.NY/T 391—2000 Green food:Technical conditions for environmental of area[S].Beijing:China Standards Press,2000.
[19]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社, 2000.
LU Ru-kun.Analytical methods in soil agricultural chemistry[M].Beijing:China Agricultural Science and Technology Press,2000.
[20]Tessier A,Cambell P G C,Bisson M.Sequential extraction procedure for the speciation of particulate trace metals[J].Analytical Chemistry, 1979,51(7):844-851.
[21]Ochoa-Loza F J,Artiola J F,Maier R M.Stability constants for the complexation of various metals with a rhamnolipid biosurfactant[J]. Journal of Environmental Quality,2001,30(2):479-485.
[22]Bucheli-Witschel M,Egli T.Environmental fate and microbial degradation of aminopolycarboxylic acids[J].FEMS Microbiology Reviews, 2001,25(1):69-106.
[23]胡群群,李志安,黄宏星,等.柠檬酸促进土壤镉解吸的机理研究[J].生态环境学报,2011,20(8/9):1338-1342.
HU Qun-qun,LI Zhi-an,HUANG Hong-xing,et al.Effects of citric acid on the desorption of Cd from soil[J].Ecology and Environmental Sciences,2011,20(8/9):1338-1342.
[24]刘霞,王建涛,张萌,等.螯合剂和生物表面活性剂对Cu、Pb污染塿土的淋洗修复[J].环境科学,2013,34(4):1590-1597.
LIU Xia,WANG Jian-tao,ZHANG Meng,et al.Remediation of Cu-Pb-contaminated loess soil by leaching with chelating agent and biosurfactant[J].Environmental Science,2013,34(4):1590-1597.
[25]Ding Z H,Wang Q Y,Hu X.Extraction of heavy metals from water-stable soil aggregates using EDTA[J].Procedia Environmental Sciences, 2013,18(7):679-685.
[26]胡忻,罗璐瑕,陈逸珺.生物可降解的螯合剂EDDS提取城市污泥中Cu,Zn,Pb和Cd[J].环境科学研究,2007,20(6):110-114.
HU Xin,LUO Lu-xia,CHEN Yi-jun.Extractability of Cu,Zn,Pb and Cd in municipal sludges using a biodegradable chelating agent-[S,S] stereoisomer of ethylenediamine disuccinate[J].Research of Environmental Sciences,2007,20(6):110-114.
[27]许端平,李晓波,孙璐.有机酸对土壤中Pb和Cd淋洗动力学特征及去除机理[J].安全与环境学报,2015,15(3):261-266.
XU Duan-ping,LI Xiao-bo,SUN Lu.Washing kinetics and mechanism of removing Pb and Cd from the contaminated soil with the organic acids[J].Journal of Safety and Environment,2015,15(3):261-266.
[28]吴少飞,丁竹红,胡忻,等.EDTA及其与柠檬酸交替对污染水稻土壤重金属元素的分步连续提取研究[J].江苏农业科学,2014,42(11):369-372.
WU Shao-fei,DING Zhu-hong,HU Xin,et al.Sequential extraction of heavy metals from contaminated rice soil by EDTA and citric acid[J]. Jiangsu Agricultural Sciences,2014,42(11):369-372.
[29]Wasay S A,Barrington S F,Tokunaga S.Remediation of soils polluted by heavy metals using salts of organic acids and chelating agents[J]. Environmental Technology,1998,19(4):369-379.
[30]谢丹,徐仁扣,蒋新,等.有机酸对Cu、Pb、Cd在土壤表面竞争吸附的影响[J].农业环境科学学报,2006,25(3):704-710.
XIE Dan,XU Ren-kou,JIANG Xin,et al.Effect of organic acids on competitive adsorption of Cu(Ⅱ),Pb(Ⅱ)and Cd(Ⅱ)by variable charge soils[J].Journal of Agro-Environment Science,2006,25(3):704-710.
[31]许超,夏北城,林颖.柠檬酸对中低污染土壤中重金属的淋洗动力学[J].生态环境学报,2009,18(2):507-510.
XU Chao,XIA Bei-cheng,LIN Ying.Kinetics of heavy metals in medium and slight pollution load soils under effects of citric washing[J].E-cology and Environmental Sciences,2009,18(2):507-510.
[32]陈晓婷,王欣,陈新.几种螯合剂对污染土壤的重金属提取效率的研究[J].江苏环境科技,2005,18(2):9-10,13.
CHEN Xiao-ting,WANG Xin,CHEN Xin.Study on the extraction efficiency of heavy metals by chelates[J].Jiangsu Environmental Science and Technology,2005,18(2):9-10,13.
[33]Champion J T,Gilkey J C,Lamparski H,et al.Electron microscopy of rhamnolipid(biosurfactant)morphology:Effects of pH,cadmium,and octadecane[J].Journal of Colloid and Interface Science,1995,170(2):569-574.
[34]Miller R M.Biosurfactant facilitated remediation of metal contaminated soils[J].Environmental Health Perspectives Supplements,1995,103(Suppl 1):59-62.
[35]Haryanto B,Chang C H.Removing adsorbed heavy metal ions from surfaces via applying interfacial properties of rhamnolipid[J].Journal of Oleo Science,2015,64(2):161-168.
[36]吴青,崔延瑞,汤晓晓,等.生物可降解螯合剂谷氨酸N,N-二乙酸四钠对污泥中重金属萃取效率的研究[J].环境科学,2015,36(5):1733-1738.
WU Qing,CUI Yan-rui,TANG Xiao-xiao,et al.Extraction of heavy metals from sludge using biodegradable chelating agent N,N-bis(carboxymethyl)glutamic acid tetrasodium[J].Environmental Science, 2015,36(5):1733-1738.
[37]黄翔峰,杨硕,陆丽君,等.鼠李糖脂淋洗法去除土壤中重金属研究进展[J].四川环境,2010,29(6):142-146.
HUANG Xiang-feng,YANG Shuo,LU Li-jun,et al.Research progress of removing heavy metals in soils by elution with rhamnolipid[J]. Sichuan Environment,2010,29(6):142-146.
[38]Bodagh A,Khoshdast H,Sharafi H,et al.Removal of cadmium(Ⅱ)from aqueous solution by ion flotation using rhamnolipid biosurfactant as an ion collector[J].Industrial and Engineering Chemistry Research, 2013,52(10):3910-3917.
[39]蓝梓铭,莫创荣,段秋实,等.鼠李糖脂对剩余污泥中铜和镍的去除[J].环境工程学报,2014,8(3):1174-1178.
LAN Zi-ming,MO Chuang-rong,DUAN Qiu-shi,et al.Removal of copper and nickel from excess sludge by rhamnolipid[J].Chinese Journal of Environmental Engineering,2014,8(3):1174-1178.
[40]周楠楠.EDTA强化茶皂素对土壤中Cu、Zn、Cd淋洗修复的影响研究[D].泰安:山东农业大学,2011.
ZHOU Nan-nan.The improved leaching of Cu,Zn,Cd contaminated soil by synergistic effect of tea saponin and EDTA[D].Tai′an:Shandong Agricultural University,2011.
[41]Chang S H,Wang K S,Kuo C Y,et al.Remediation of metal-contaminated soil by an integrated soil washing-electrolysis process[J].Soil and Sediment Contamination,2005,14(6):559-569.
Leaching characteristics of Cd in the contaminated soils with chelates and rhamnolipid
CHEN Dong-yue1,SHI Qiu-ling1,ZHANG Jin-zhong1,2*,LIU Jiang1,QIAN Sheng1
(1.Key Laboratory of the Three Gorges Reservoir Region′s Eco-Environment,Ministry of Education,College of Resources and Environment, Southwest University,Chongqing 400715,China;2.Chongqing Key Laboratory of Agricultural Resources and Environment,Chongqing 400716,China)
The simulated pollution soils with three Cd concentration levels were prepared,the leaching characteristics of Cd from the soils were studied with chelates and rhamnolipid,and the speciation variations of Cd in soil during the joint leaching process with EDTA and rhamnolipid was also discussed.When the eluent concentration was 0.025 mol·L-1and the initial pH was 7,the leaching process reached equilibrium at 220,140 and 60 min with EDTA,ethylenediamine disuccinic acid(EDDS)and citric acid,respectively.The best leaching results could be obtained with EDTA,and the maximal leaching percentages were 93.16%,93.62%and 94.09%for 0.38,0.69 and 0.93 mg· kg-1Cd contaminated soils,respectively.The leaching process with EDTA could be described by pseudo two-order kinetic model,and the leaching rate constant showed a decreasing order of 0.38 mg·kg-1Cd contaminated soil,0.69 mg·kg-1Cd contaminated soil and 0.93 mg·kg-1Cd contaminated soil.When the volume ratio of EDTA and rhamnolipid(0.025 mol·L-1)was 1.5∶1,the leaching percentages reached 85.45%,89.25%and 93.88%for the three contaminated soils,respectively,and the leaching equilibrium time decreased to 50 min.Joint leaching can effectively release the exchangeable,carbonate bound and organic bound Cd in the contaminated soils,and the possible mechanism is the synergistic effect of EDTA chelation and the micellar solubilization of rhamnolipid.
cadmium;contaminated soil;chelates;rhamnolipid;leaching characteristics
X53
A
1672-2043(2016)12-2334-11
10.11654/jaes.2016-0873
陈冬月,施秋伶,张进忠,等.螯合剂和鼠李糖脂联合淋洗污染土壤中Cd[J].农业环境科学学报,2016,35(12):2334-2344.
CHEN Dong-yue,SHI Qiu-ling,ZHANG Jin-zhong,et al.Leaching characteristics of Cd in the contaminated soils with chelates and rhamnolipid[J].Journal of Agro-Environment Science,2016,35(12):2334-2344.
2016-07-02
国家高技术研究发展计划(863)项目(2012AA101405)
陈冬月(1991—),女,硕士研究生,从事污染控制化学研究。E-mail:2534949709@qq.com
*通信作者:张进忠E-mail:jzhzhang@swu.edu.cn
