长链非编码RNA punisher对血管平滑肌细胞增殖和凋亡的影响及机制
2016-12-28李孟鹏唐宁宁杨艳艳张银凤王建勋李培峰
李孟鹏,于 涛,陈 潇,唐宁宁,杨艳艳,张银凤,王 昆,王建勋,李培峰
·基础研究·
长链非编码RNA punisher对血管平滑肌细胞增殖和凋亡的影响及机制
李孟鹏,于 涛,陈 潇,唐宁宁,杨艳艳,张银凤,王 昆,王建勋,李培峰
目的探究长链非编码RNA(long noncoding RNA,lncRNA)punisher与动脉粥样硬化的关系及其对血管平滑肌细胞增殖和凋亡的影响及机制。方法12只健康纯种雄性8周龄载脂蛋白E(apolipoprotein E,ApoE)基因敲除小鼠(ApoE-/-小鼠),通过高脂饲喂制作动脉粥样硬化模型小鼠(模型组);12只健康C57BL/ 6J小鼠饲以基础饲料为对照组;人体血管平滑肌细胞系根据转染情况分为小干扰-punisher组和阴性对照(negative control,NC)组。通过荧光定量聚合酶链反应测定模型组与对照组小鼠主动脉弓的punisher表达。通过合成punisher的小干扰RNA作为反向对照抑制punisher在人血管平滑肌细胞中的表达,应用实时荧光定量聚合酶链反应验证punisher表达情况;分别采用细胞计数试剂盒(cell counting kit-8,CCK-8)、划痕实验及流式细胞术检测抑制punisher表达对人血管平滑肌细胞增殖、迁移和凋亡的影响;蛋白印迹法检测B淋巴细胞瘤-2(B-cell leukemia-lymphoma-2,Bcl-2)、半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,caspase3)、caspase8、p-p38、p53凋亡相关蛋白的表达。结果①血脂4项及血管苏木精-伊红染色证明造模成功。荧光定量聚合酶链反应显示,动脉粥样硬化模型组小鼠血管punisher表达高于对照组(P<0.05);②CCK-8检测显示小干扰-punisher组的光密度值在转染36 h之后低于NC组(t36=2.683、P<0.05,t48=2.554、P<0.05);划痕实验显示小干扰-punisher组细胞迁移低于NC组(t=3.136、P<0.05);③流式细胞术显示,小干扰-punisher组中凋亡细胞数占比多于NC组(22.6%和11.7%,χ2=4.245、P<0.05);④蛋白印迹法显示小干扰-punisher组Bcl-2、caspase3-30×103、p53蛋白表达水平明显低于NC组(t分别为9.546、5.647、5.42,P<0.05),caspase3-17×103蛋白表达水平高于NC组(t=4.892、P<0.05)。结论沉默lncRNA punisher可以促进血管平滑肌细胞的凋亡并抑制其增殖。
长链非编码RNA;动脉粥样硬化;细胞凋亡;血管平滑肌细胞
动脉粥样硬化(atherosclerosis,AS)是最常见的心血管疾病,并且它是缺血性心脑血管疾病的病理基础[1]。有统计显示,超过80%的50岁以上人群可见明显的AS斑块,AS已成为威胁广大人民生命健康的重大疾病[2]。因此,研究AS的分子机制,发现和寻找其早期诊断和治疗靶点迫在眉睫。
血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖和迁移是AS引起血管损伤和再狭窄的一个关键因素。在AS的发展之初VSMC从收缩型变为分泌型并迁移到血管内膜从而导致内膜的增生[3]。因此,研究VSMC的增殖和凋亡对发现AS的新治疗和检测靶点具有重要意义。
长链非编码RNA(long noncoding RNA,lncRNA)是一类长度超过200 bp没有蛋白质编码功能的RNA。虽然最初人们认为lncRNA只是转录噪音,但如今人们发现lncRNA几乎参与到细胞生命活动的各个分支之中[4]。近年来,研究证实lncRNA在包括AS在内的心血管疾病的发生和发展中起着十分重要的作用[5]。LncRNA punisher是一个最新发现的在内皮细胞中含量丰富的lncRNA。研究表明,沉默punisher可以抑制内皮细胞的增殖和血管的生成[6]。由于内皮细胞和VSMC有密切的联系,并且内皮细胞和VSMC在AS的发生和发展中都起着重要的作用,推测punisher对VSMC的生物学功能和AS的发展都可能起着重要的调节作用[7]。
1 材料与方法
1.1 材料 总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、三酰甘油(triacylglycerol,TG)测试盒购自南京建成生物工程研究所,苏木精-伊红(hematoxylin-eosin,HE)染料购自北京索莱宝公司,TRIzol试剂盒购自美国Thermo Fisher Scientific公司,RNA反转录试剂盒购自日本TaKaRa公司,沉默punisher的小干扰RNA(small interfering RNA,siRNA)由上海吉玛公司合成,LipofectamineTM2000购自美国 Invitrogen公司,细胞计数试剂盒(cell counting kit-8,CCK-8)以及细胞凋亡检测试剂盒(碘化丙啶、异硫氰酸荧光素双染法)购自上海七海复泰生物科技有限公司,放射免疫沉淀法裂解液购自北京索莱宝公司,增强化学发光液购自德国Millipore公司,B淋巴细胞瘤-2(B-cell leukemia-lymphoma-2,Bcl-2)多克隆抗体及二抗均购自美国Cell Signaling Technology公司,载脂蛋白 E(apolipoprotein E,ApoE)基因敲除小鼠(ApoE-/-小鼠)购自江苏省卡文斯实验动物有限公司[SCXK-(苏)-2011-0003],C57BL/6J小鼠购自青岛市药检所[SCXK-(鲁)-2014-0007],人主动脉血管平滑肌细胞(human aortic vascular smooth muscle cells,HA-VSMC)购自上海中国科学院细胞库。
1.2 实验方法
1.2.1 AS模型小鼠的制备与鉴定 12只健康纯种雄性8周龄ApoE-/-小鼠作为AS模型组,模型组给予高脂饲料(2%胆固醇、0.5%胆汁酸、3%猪油、0.2%丙硫氧嘧啶和94.3%的基础饲料);对照组为12只健康C57BL/6J小鼠,饲以基础饲料。动物饲养在带不锈钢盖底的塑料笼内,每笼4只,自由饮水,室温19~23℃,自然采光。
1.2.2 血液和动脉样本的采集 实验第5周,各组小鼠禁食过夜,在3%水合氯醛腹腔麻醉下分离主动脉。刨开胸腔,注射器心脏取血,血液经3 000 r/ min离心15 min后取血清检测血脂4项。显微镜下找到主动脉剪下约1 cm,立即用4%的多聚甲醛固定用于形态学观察。
1.2.3 血脂检测 取血清,用直接法测定LDL-C和HDL-C,胆固醇氧化酶-过氧化物酶偶联法测定TC,甘油磷酸氧化酶-过氧化物酶偶联测定TG。
1.2.4 病理学观察 将4%多聚甲醛固定的主动脉脱水透明后用石蜡包埋,以厚度为0.6 mm连续切片后,切片固定在载玻片上,HE染色,之后光镜观察。
1.2.5 细胞培养和转染 HA-VSMC用含10%胎牛血清的达尔伯克改良伊格尔培养基(Dulbecco’s modified Eagle medium,DMEM),置于37℃、5%CO2的培养箱培养。待细胞汇合度达到80%左右时用LipofectamineTM2000将si-punisher和对照-siRNA转入细胞中,分别为si-punisher组和阴性对照(negative control,NC)组。punisher序列为5′-ACUCCACC UCAAACUCUUATT-3′,对照-siRNA序列为5′-UUCUCC GAACGUGUCACGUTT-3′。
1.2.6 punisher表达水平检测 组织样本:取100 mg血管样本加1 mL TRIzol试剂冰上研磨提取组织总RNA;细胞样本:细胞转染24 h后用TRIzol试剂裂解细胞(6孔板每孔加1mL TRIzol试剂)。提取总RNA,反转录以互补脱氧核糖核酸作为模板。实时荧光定量聚合酶链反应条件为95℃ 5 min、95℃10 s、60℃ 30 s共40个循环,实验重复3次。实时荧光定量聚合酶链反应产物引物序列分别为:lnc-RNA punisher上游序列5′-GTCCTCCACTCCACCTC AAA-3′、下游序列5′-TGAGTTCCTGATCGTGTCCA-3′;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)mRNA上游序列5′-GGACTC ATGACCACAGTCCATGCC-3′、下游序列5′-TCAGGG ATGACCTTGCCCACAG-3′。
1.2.7 CCK-8法检测细胞增殖 细胞以2×105/mL的密度100 μL接种于96孔板,每组重复6孔。细胞铺板12 h后进行转染。分别对转染0、12、24、36、48 h的细胞进行检测,检测时每孔换含10 μL的CCK-8试剂的100 μL培养基,37℃孵育1 h后用酶标仪测定各孔450 nm处光密度(optical density,OD)值。
1.2.8 细胞划痕实验 细胞以4×105/mL的密度1 mL接种于6孔板中。待细胞汇合度至70%~80%时进行细胞转染处理。转染12 h后换无血清培养基,待生长24 h后用移液枪头划线,之后用磷酸缓冲盐溶液冲洗3次,拍照,换无血清培养基培养24 h进行下一次拍照。
1.2.9 流式细胞仪检测细胞凋亡情况 VSMC细胞转染48 h后,制备5×105/mL的细胞悬液,取1 mL细胞悬液4℃1 000 r/min离心10 min,弃上清。之后加1 mL预冷磷酸缓冲盐溶液轻轻震荡细胞,1 000 r/min离心10 min,弃上清,如此反复洗涤3遍。之后按凋亡试剂盒操作说明进行。最后尼龙膜过滤细胞团块,用美国BD Accuri C6流式细胞仪进行检测。
1.2.10 蛋白印迹法检测蛋白表达 采用蛋白印迹法检测目标蛋白的表达水平。放射免疫沉淀法提取转染48 h细胞的总蛋白,按照二辛可宁酸试剂盒说明书进行蛋白定量并分装,-80℃保存。取等量蛋白,十二烷基硫酸钠聚乙丙烯酰胺凝胶电泳后将分离的蛋白质转移至聚偏二氟乙烯膜上,用5%脱脂奶粉封闭1 h后加入Bcl-2、caspase3、caspase8、p-p38和p53的多克隆抗体(1∶1 000),室温孵育2 h,TBST液(Tris 6.05 g/L、NaCl 8.5 g/L、Tween 20 1 mL,pH值7.45)洗膜,辣根过氧化物酶标志的二抗(1∶2 000)孵育1.5 h,增强化学发光显色,Susion Solos凝胶分析系统中曝光,采用ImageG软件计算曝光条带OD值,以目标蛋白OD值/内参照肌动蛋白(βactin,1∶2 000)OD值的比值反映蛋白表达水平。每组实验独立重复3次结果取平均值。
1.3 统计学处理 应用sigmaplot 12.5软件绘图。应用SPSS 13.0软件,计量资料用均数±标准差(± s)表示,多个组间的数据比较采用t检验;计数计量占比用百分数表示,采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 AS模型小鼠的鉴定 模型组血清血脂水平明显高于对照组(P<0.05,表1)。HE染色,40倍镜下显示模型组血管内壁可见明显斑块(图1)。

表1 血脂4项检测(mmol/L,n=12)

图1 光镜下各组血管HE染色(1∶40)
2.2 AS各组细胞punisher表达水平 AS模型组punisher表达水平明显高于对照组(t=9.597、P<0.05,图2);si-punisher组细胞的punisher表达水平明显低于NC组(t=27.044、P<0.05,图3)。

图2 主动脉弓中punisher的表达

图3 细胞内punisher的相对表达
2.3 si-punisher对HA-VSMC增殖和迁移的影响
在转染36 h之后,si-puni-sher组细胞较NC组比较出现明显的生长抑制(t36=2.684、P<0.05,t48=2.554、P<0.05,图4A)。划痕实验显示si-punisher组细胞迁移或增殖受到显著抑制(t=3.136、P<0.05,图4B)。
2.4 si-punisher对HA-VSMC凋亡的影响 si-punisher组细胞凋亡明显多于NC组(χ2=4.245、P<0.05,图5)。
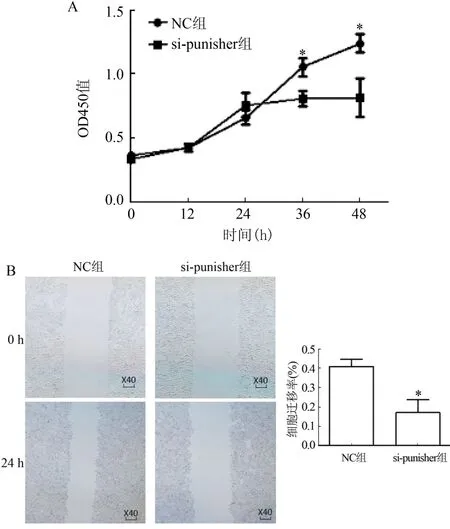
图4 各组细胞增殖情况

图5 流式细胞术检测细胞凋亡
2.5 蛋白印迹法检测凋亡相关蛋白在各组中的表达 si-punisher组中Bcl-2、caspase3-30×103、p53表达明显低于NC组(t分别为9.546、5.647、5.42,P<0.05,图6),caspase3-17×103表达高于NC组(t=4.892、P<0.05,图6)。Caspase8与p-p38的表达无明显变化。

图6 蛋白印迹法检测凋亡相关蛋白的表达
3 讨论
虽然最初人们把lncRNA当做转录噪音,然而近年来越来越多的证据表明lncRNA在生命活动中起着重要的作用[8]。现如今lncRNA已成为和微小RNA(microRNA,miRNA)并驾齐驱的研究热点。目前,大量的研究表明,lncRNA在AS的发生和发展中起着重要的作用[7],如 INK4位点反义非编码RNA与AS等多种心血管疾病密切相关,它可提高平滑肌细胞的增殖和黏附,并能抑制细胞凋亡[9];活化T细胞核因子非编码基因可以调控血管生成及内皮细胞的增殖和迁移[10];巨噬细胞中E330013P06参与泡沫细胞的形成[11];肝癌高表达基因调控脂质代谢等[12]。因此,研究lncRNA的生物功能和分子机制具有重要的意义。
lncRNA punisher最初发现富集于内皮细胞并影响其增殖[6],因为内皮细胞和平滑肌细胞经常协同调控血管的各种生理功能,并且两者在位置上相邻,因此推测punisher可能在VSMC的生物学功能中起着重要的作用,并有可能影响AS的发生、发展。本实验结果发现,在AS模型组血管中punisher的表达水平明显高于对照组。这表明高表达的punisher可能是引起AS的原因或其结果之一;进一步的实验结果表明,沉默punisher可以抑制VSMC的增殖同时促使其凋亡。此结果与punisher在内皮细胞中的结果一致。因此,有理由相信punisher是AS发展过程中的一个重要调节因素。
本研究进一步发现,si-punisher组较NC组Bcl-2、p53和caspase3-30×103的蛋白表达水平都有明显下降,caspase3-17×103有所提高,而caspase8和pp38的表达没有明显差异。由此可见,si-punisher组细胞凋亡可能是由于Bcl-2表达水平降低导致。而作为凋亡诱导因子的p53表达水平也出现了降低。因此,推测punisher并不是直接作用于Bcl-2或p53,很有可能有更复杂的机制。现阶段研究已经证实,lncRNA可以通过表观遗传、转录调控和转录后调控等多个层面对基因进行调控,同时起作用的分子机制也是多种多样的[8]。其中核内lncRNA通常通过调控信使RNA的间接来控制基因转录,细胞质lnc-RNA则通过调节信使RNA的稳定性或miRNA的活性来调节基因表达[13]。本团队在研究心血管疾病的发病机制方面具有丰富的经验,近2年分别在European Heart Jourmal、Nat Communications和PloS Genetics等杂志报道过非编码核酸调控心血管疾病的作用分子机制[14-16]。这提供了一个新的可能,即punisher可能是通过影响miRNA的表达进而调节各个凋亡相关蛋白来影响细胞的增殖与凋亡。
由于lncRNA有很强的组织特异性,所以很容易成为疾病的特异性标志物或靶点。例如INK4位点反义非编码RNA因为其在心肌梗死患者中高表达的特性,被人们视为新的分子标志物[17]。本实验发现,在模型小鼠初期其血管的punisher表达量就高于对照组,达到4倍。因此,punisher有望成为新的、重要的AS前期的分子标志物。
综上所述,本研究在AS模型组小鼠血管中发现punisher表达水平明显高于对照组小鼠;进一步细胞实验表明,沉默punisher可以导致平滑肌细胞增殖的抑制和凋亡的增强。这些结果说明,punisher对VSMC的生物学功能具有重要的调控作用,其在AS的发生和发展中可能起着十分关键的影响;同时,这也为AS的前期诊断和治疗提供了新的分子靶标。
[1]Libby P,Ridker PM,Hansson GK.Progress and challenges in translating the biology of atherosclerosis[J].Nature,2011,473(7347):317-325.
[2]Tuzcu EM,Kapadia SR,Tutar E,et al.High prevalence of coronary atherosclerosis in asymptomatic teenagers and young adults:evidence from intravascular ultrasound[J]. Circulation,2001,103(22):2705-2710.
[3]Gomez D,Owens GK.Smooth muscle cell phenotypic switching in atherosclerosis[J].Cardiovasc Res,2012,95(2): 156-164.
[4]Quinn JJ,Chang HY.Unique features of long non-coding RNA biogenesis and function[J].Nat Rev Genet,2016,17 (1):47-62.
[5]Archer K,Broskova Z,Bayoumi AS,et al.Long non-coding RNAs as master regulators in cardiovascular diseases[J]. Int J Mol Sci,2015,16(10):23651-23667.
[6]Kurian L,Aguirre A,Sancho-Martinez I,et al.Identification of novel long noncoding RNAs underlying vertebrate cardiovascular development[J].Circulation,2015,131(14): 1278-1290.
[7]Li H,Zhu H,Ge J.Long noncoding RNA:recent updates in atherosclerosis[J].Int J Biol Sci,2016,12(7):898-910.
[8]Kung JT,Colognori D,Lee JT.Long noncoding RNAs:past,present,and future[J].Genetics,2013,193(3):651-669.
[9]Holdt LM,Beutner F,Scholz M,et al.ANRIL expression is associated with atherosclerosis risk at chromosome 9p21 [J].Arterioscler Thromb Vasc Biol,2010,30(3):620-627.
[10]Sharma S,Findlay GM,Bandukwala HS,et al.Dephosphorylation of the nuclear factor of activated T cells(NFAT) transcription factor is regulated by an RNA-protein scaffold complex[J].Proc Natl Acad Sci USA,2011,108(28): 11381-11386.
[11]Reddy MA,Chen Z,Park JT,et al.Regulation of inflammatory phenotype in macrophages by a diabetes-induced long noncoding RNA[J].Diabetes,2014,63(12):4249-4261.
[12]Cui M,Xiao Z,Wang Y,et al.Long noncoding RNA HULC modulates abnormal lipid metabolism in hepatoma cells through an miR-9-mediated RXRA signaling pathway[J]. Cancer Res,2015,75(5):846-857.
[13]Qi P,Du X.The long non-coding RNAs,a new cancer diagnostic and therapeutic gold mine[J].Mod Pathol,2013,26(2):155-165.
[14]Wang K,Liu CY,Zhou LY,et al.APF lncRNA regulates autophagy and myocardial infarction by targeting miR-188-3p[J].Nat Commun,2015,6:6779.
[15]Wang K,Long B,Liu F,et al.A circular RNA protects the heart from pathological hypertrophy and heart failure by targeting miR-223[J].Eur Heart J,2016,37(33):2602-2611.
[16]Wang K,Zhou LY,Wang JX,et al.E2F1-dependent miR-421 regulates mitochondrial fragmentation and myocardial infarction by targeting Pink1[J].Nat Commun,2015,6: 7619.
[17]Vausort M,Wagner DR,Devaux Y.Long noncoding RNAs in patients with acute myocardial infarction[J].Circ Res,2014,115(7):668-677.
The regulatory mechanism of long noncoding RNA punisher on proliferation and apoptosis of vascular smooth muscle cell
LI Mengpeng,YU Tao,CHEN Xiao,TANG Ningning,YANG Yanyan,ZHANG Yinfeng,WANG Kun,WANG Jianxun,LI Peifeng
(Institute for Translational Medicine,Qingdao University,Qingdao Shandong 266071,China)
Objective Explore the relationship and mechanism of long noncoding RNA(lnc-RNA)punisher with atherosclerosis(AS)and its effects on the proliferation and apoptosis of vascular smooth muscle cell(VSMC).Methods Twelve healthy male 8 week old apolipoprotein E(ApoE) knockout mice(ApoE-/-mice),produced the model of atherosclerosis in mice by high fat fed (model group);12 healthy C57BL/6J mice were fed with basal diet as control group;hunman vascular smooth muscle cell were divided in small interfering-punisher group and negative control(NC) group by their different transfection.Aortic arch tissue sample of the AS model and control mice were used to determine the punisher expression using fluorescence quantitative polymerase chain reaction (PCR)method.Small interference RNA of punisher were used to downregulate the expression ofpunisher in vascular smooth muscle cell.Moreover,cell counting kit-8(CCK-8),scratch-wound experiment and flow cytometry method were used to detect the regulatory role of punisher in vascular smooth muscle cell proliferation migration and apoptosis respectively.Finally Western Blot was used to determine the expression levels of B-cell leukemia-lymphoma-2(Bcl-2).Results ①The levels of triacylglycerol(TG),total cholesterol(TC),low density lipoprotein-cholesterol(LDL-C)and high density lipoprotein-cholesterol(HDL-C)along with Hematoxylin and Eosin(HE)staining proved that model building success.The fluorescence quantitative PCR results showed that the punisher expression is higher(t=9.597,P<0.05)in model mice than in control group.②According to the CCK-8 assay,the knockdown of punisher group showed significantly(P>0.05)lower proliferation level than the NC group(t36=2.683,P<0.05;t48=2.554,P<0.05).Scratch-wound experiments si-punisher cells migration has been supressed(t=3.136,P<0.05).③Flow cytometry showed that silencing of punisher lncRNA significantly increased VSMC apoptosis cell number compared to NC group(22.6%and 11.7%;χ2=4.245,P<0.05).④Western Blot results showed a significant down regulation of expression of Bcl-2,caspase3-30×103and p53(t respectively 9.546,5.647,5.42;P<0.05)and a significant upregulation of expression of caspase 3-17×103(t=4.892,P<0.05)upon silencing of punisher lncRNA in VSMC.Conclusion Silence lncRNA punisher can increasing vascular smooth muscle cell apoptosis and downregulation of cell proliferation.
Long noncoding RNA(lncRNA);Atherosclerosis(AS);Cell apoptosis;Vascular smooth muscle cell(VSMC)
Q522;R329.2+8;R541.4
A
2095-3097(2016)06-0339-06
10.3969/j.issn.2095-3097.2016.06.006
2016-11-05 本文编辑:徐海琴)
中国博士后科学基金(2016M590616);山东省博士后创新项目(201601016)
266071山东青岛,青岛大学转化医学研究院(李孟鹏,于 涛,陈 潇,唐宁宁,杨艳艳,张银凤,王 昆,王建勋,李培峰)
于涛,E-mail:yutao0112@qdu.edu.cn;李培峰,E-mail:peifli@qdu.edu.cn
