临床生物样本库血液样本的可控性采集和质量管理
2016-12-28吴曼丽王柱清康晓楠
吴曼丽,王柱清,罗 凯,康晓楠
临床生物样本库血液样本的可控性采集和质量管理
吴曼丽,王柱清,罗 凯,康晓楠
目的建立医疗过程中血液样本可控性采集模式,保证样本的采集、处理过程可回溯,为肿瘤、自身免疫性疾病、心脑血管疾病及代谢性疾病的研究提供高质量的血液样本。方法通过建立网络化样本采集管理流程,将样本采集电子申请、项目管理以及样本处理中涉及血液样本的各项前处理因素整合到电子工作程序中,保证标准流程的执行情况处于可控状态,形成规范化的血液采集、前处理、保存和管理办法。结果仁济医院血液样本库有临床疾病20余种,含有完整的临床及随访资料。血液样本与相应的组织样本、临床信息相匹配;系统记录每份样本采集时间、到库时间、入库时间等;可通过组合查询筛选相应质量要求的样本。共采集血液样本40 000余份,抽样检查90%的样本分子生物学指标稳定。结论仁济医院可控性血液采集、处理模式和管理模式为综合性医院血液生物样本库建设提供管理经验,为血液样本的规范化、高质量采集、前处理、保存提供详细操作经验参考,为肿瘤、自身免疫性疾病、心脑血管疾病及代谢性疾病的研究提供高质量的血液样本及信息资源。
样本;生物样本库;血液样本库
配套的血液样本和组织样本及相应的信息是临床生物样本库(简称样本库)收集的主要内容。血液样本作为样本库的重要组成部分,其亚成分血浆、血清、红细胞、白细胞、血小板、活性冻存外周血单核细胞(peripheral blood mononuclear cell,PBMC)[1]、血凝块、血液样本衍生物(DNA、RNA)[2]都是基因组学、代谢组学、蛋白质组学等主要研究对象,在肿瘤、心脑血管疾病及代谢性疾病等重大疾病的基础研究、转化研究、临床研究中发挥着重要作用[3]。
作为综合性医院的中心样本库,仁济医院样本库在上海市科学技术委员会、上海交通大学985工程专项课题的支撑下,根据国际生物和环境样本库协会、美国国家癌症研究所国际规范[4-5]建设,目的是为医院各特色疾病研究提供经过标准流程采集、中心化处理和规范保存的样本资源平台。样本库通过建立标准操作流程(standard operating procedure,SOP)来规范样本的处理操作,从而保证样本质量。但是在临床工作实践中,往往很难对这些流程环节进行监督和记录,即SOP可控性不强。
血液样本的生物学质量受到采集方式、采集时间、运送方式、运送温度、离心条件以及后期存储许多前处理因素[6]的影响。从流程管理的角度建设统一的、中心化的血液样本可控性采集流程规范,可以兼顾多病种血液样本管理,是大型医院样本库的流程建设重要内容。按照疾病研究特点作为项目管理分类,实际工作中分为血液样本处理小组(血液组,也包含其他体液处理工作)和组织样本处理小组(组织组),信息录入时归档到统一的项目中,从而实现匹配样本可以统一查询;血液样本虽然来自于各个疾病,但其采集处理原则相似,科学采集和保存血液样本及其亚成分是最大程度地利用好这部分生物样本的重要基础。
1 材料与方法
1.1 材料
1.1.1 耗材与试剂 一次性使用真空采血管(促凝剂、乙二胺四乙酸二钠盐、肝素锂、枸橼酸钠,浙江拱东医疗科技有限公司),细胞制备管(cell preparation tube,CPT,美国BD Vacutainer®公司),1.5 mL离心管(上海万格科学器材有限公司),冻存盒(上海万格科学器材有限公司),RNAlater(美国Ambion公司),德国QIAGEN基因组DNA提取试剂盒。
1.1.2 设备 二维码标签打印机及二维码条(美国Brady公司),台式高性能离心机(美国Thermo公司),微量离心机(美国Thermo公司),自动化移液站(瑞士Tecan公司),100~1000 μL移液器(德国Eppendorf公司),二维码扫描器(美国Honeywell公司),超净台、海尔超低温冰箱和卧式超低温保存箱(青岛海尔特种电器有限公司),NanoDrop 2000紫外分光光度计(美国Thermo公司),台式电脑(联想控股有限公司)。
1.2 方法
1.2.1 采血管类型、采集时间的采集方案确定 采集前需要根据研究方案以及将要使用的实验方法,明确每个病种的血液采血管类型、采集时间及地点、血液样本类型、采集数量、保存方式。
采血管类型主要依据研究目的、科研用途、下游实验检测方法等来确定,目前常见的采血管类型见表1。

表1 常见采血管类型
仁济医院样本库目前主要以储备性采集为主,鉴于乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)采血管可知用途范围较广,选用EDTA采血管分离血浆及血细胞;根据促凝管价格及适合的下流实验用无添加剂的促凝管分离血清;基于CPT便于采集和处理,以CPT分离PBMC。仁济医院一般采用的几种采血管类型见表2。
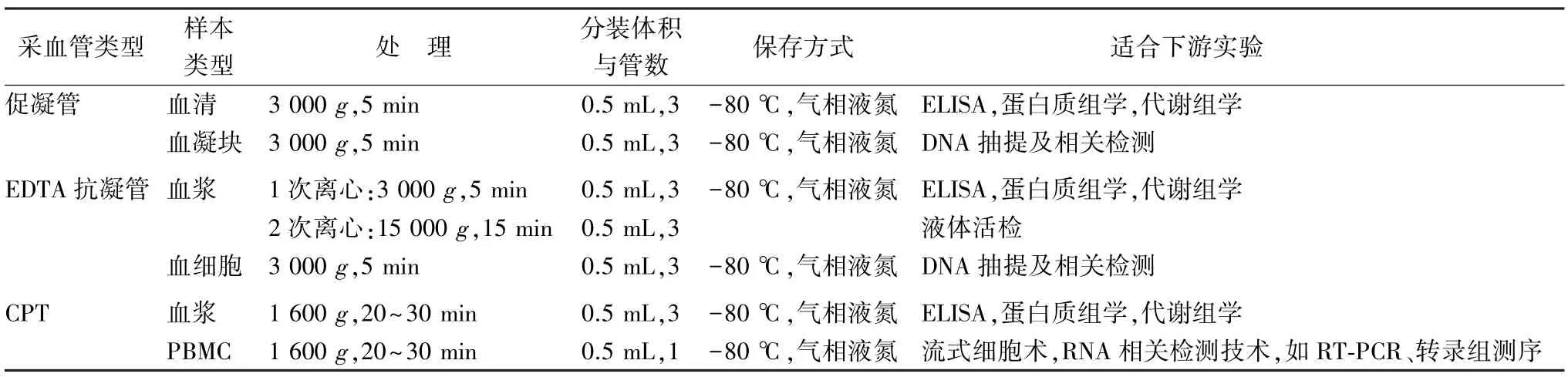
表2 仁济医院选用的采血管类型
采集时间根据不同项目研究目的设计。仁济医院目前一般以术前清晨空腹采集及随访清晨空腹采集为主,还包括相关项目采集术前、术后24 h、术后2 d清晨空腹血样本。
1.2.2 项目信息管理 不遵守采样操作规程的生物标志物检测研究具有极大的偏差风险。仁济医院自主开发信息管理系统,在样本管理流程上,如电子记录的办法,根据每个病种特点在软件中设计样本采集流程模块,通过血液样本采集SOP与分析前编码标准结合,将分析前编码标准的理念融合到样本信息管理系统的每一步。通过质量控制结果,分析信息系统与质量控制的样本相关前处理变量,调整、改进采集流程,不断提升与控制样本质量,实现质量管理。
仁济医院信息管理与血液样本采集、处理、保存、质量控制流程见图1。
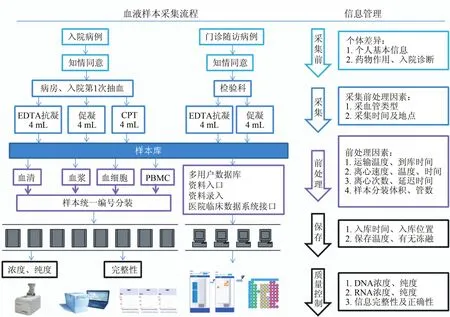
图1 仁济医院信息管理与血液样本采集、处理、保存、质量控制流程
通过软件系统实现可控性采集。科室通过样本库网络信息管理系统完成样本申请。
样本申请单中可以通过住院号、身份证号或门诊号三者任何一个信息经接口对接临床信息平台,从而获取包括患者姓名、性别、年龄、出生日期、住院号、身份证号或门诊号、入院诊断;血液样本自身相关信息包括样本采血管类型、采集时间及地点、样本采集人员、样本有无溶血、样本到库时间、运输温度、离心速度、离心温度、离心时间、样本离心次数及离心延迟时间、样本分装体积、样本储存管唯一编码、亚组分类型(血浆、血清、血细胞等)、入库时间、入库位置、保存温度、有无冻融,所有字段都可以作为检索词用于查找样本。同时,可以通过患者管理接口对接医院临床信息系统,方便查询捐赠者其他临床信息如临床诊断、病理诊断、检验报告、影像报告、手术类型、用药情况、治疗方法、手术时间及地点、主治医生、个人病史。
1.2.3 仁济医院血液样本采集 仁济医院血液样本及信息采集由门诊及各科室医务人员、护理人员按要求在门诊和病房中完成,可以登录网络化样本信息管理系统。患者捐献的血液体积一般为4 mL促凝血或抗凝血;血液采集通常与临床检验采集时间一致,避免增加患者痛苦,采血顺序通常为先采集促凝血、后采集抗凝血。促凝血采集后,需室温放置25~30 min以促进凝血(表2),而后置于湿冰上,立即转运至样本库;抗凝血采集完成后,应轻轻颠倒采血管8次,而后低温转运至样本库。CPT采血完成后,应颠倒6~8次,室温保存。
血液样本自样本离体至处理的最佳时间为2 h以内,不宜超过6 h(CPT为24 h),采集至处理前应避免采血管过度震荡,防止溶血。
1.2.4 血液样本自动化工作站前处理 综合性样本库样本量较大,如何快速处理并储存大量样本且充分保证样本质量及信息准确性成为一个难题。仁济医院样本库采用瑞士Tecan公司自动化移液站批量处理血液样本,提高大量样本处理速度的同时,保证样本质量和样本处理的一致性,并减轻样本库工作人员工作强度及人为失误。以不同颜色的1.5 mL冻存管保存并将每个样本赋予样本类型及唯一二维码,便于统计分析、信息及实体入库。
血液样本前处理以6 h内完成为宜,并应详细记录样本前处理变量。
1.2.4.1 抗凝血及促凝血前处理 抗凝血转运与前处理完成前应使样本处于2~8℃,以最快速度完成处理。处理步骤:将采血管轻柔颠倒混匀3次,3 000 g 4℃离心10 min,所得上清为血浆或血清,剩余为血细胞或血凝块。若为进行血浆外泌体或肿瘤早期诊断等研究,需将血浆二次离心,15 000 g 4℃离心5 min,之后根据程序提示分离血细胞。
1.2.4.2 CPT抗凝血前处理 CPT抗凝血需室温保存。室温1 600 g离心30 min,液面从上至下依次分为血浆、白细胞、凝胶层、血小板与红细胞4层。吸取最上层血浆并分装;吸取血清下层的白色、云雾状PBMC层,磷酸缓冲盐溶液洗涤2次后,加入500 μL RNAlater重悬并吹打混匀,4℃过夜后,转移至-80℃冰箱。
1.2.5 血液样本实体入库、保存和分发 血液样本保存温度取决于分析物的性质,一般-80℃足以保存广泛的血液样本[7]。仁济医院目前选用-80℃冰箱保储血液样本。仁济医院样本库储存区设39台-80℃冰箱,其中卧式-80℃整理冰箱2台,存储空间接近200万份库容;并设有应急冰箱4台,防止因冰箱故障致使样本质量受损。-80℃冰箱均在信息系统预设有冻存盒结构,便于提高出入库效率。冰箱采用自动化温度检测系统,连续检测并记录所有储存设备实时动态温度,使样本保存温度可回溯化,报警温度为-65℃。样本库房侧壁及天花板装有自动化温度传感器,报警温度上限为35℃、下限为0℃。
样本转运装置维持温度取决于样品的性质和后续分析方法。样本可以在室温(20~30℃)、冷藏(2~8℃)、冷冻(-20℃、-70℃)条件下及液氮罐中转运。
1.2.6 血液样本质量控制 血液样本质量控制包括信息质量控制、生物学质量控制。
1.2.6.1 信息质量控制 按照每月实现约样本总量的1%随机抽取样本进行核对,包括位置信息是否正确、条码是否脱落或漏贴、样本相关信息是否完整等。
1.2.6.2 生物学质量控制 生物学质量控制包括全血DNA、RNA、蛋白质等。按照病种和样本类型随机抽出100份血细胞样本,提取其中 DNA及RNA,分光光度计法测定DNA、RNA浓度,光密度(optical density,OD)值OD260/OD280检测其纯度,以美国Agilent 2100生物芯片分析系统检测DNA、RNA的完整性。
2 结果
2.1 信息系统建设与信息管理 仁济医院网络化流程管理基于浏览器/服务器架构,平台直观、方便,科室、门诊设有样本电子申请模块,与样本库软件实时对接。样本采集流程与临床工作相适应。设置样本前处理因素电子记录模块,全程记录样本数据。注重同一患者不同时间点和不同类型样本的配套性和完整性。通过医院信息科,将样本信息与医院信息系统、实验室信息系统、手术麻醉系统相对接。仁济医院每月血液样本采集总量约4 000份,每个月对40份样本进行信息核对,其中约99%样本位置信息正确、信息完整。
2.2 样本储存总量 仁济医院形成以泌尿科疾病样本(如前列腺癌、膀胱癌、肾癌)为特色,涵盖有风湿科、内分泌科、血管外科等24种疾病项目的特色、综合、大型的生物样本库。共采集血液样本41 061份,其中血清样本8 300余份、血浆样本15 500余份、血细胞样本15 500余份、血凝块样本1 600余份、白细胞样本100余份(图2)。每份独立样本均包含完整的临床资料及样本处理信息。目前已出库血液样本15 00余份,共服务9个项目,涉及课题金额2 000余万元。

图2 各样本类型及各科室样本采集总量
2.3 生物学质量控制 血液样本质量控制主要通过流程控制、信息完善、大分子检测等方法实现。医院样本库随机抽出的100份血液样本,经-80℃冻存1~2年后,血细胞样本经DNA和RNA提取,可得高浓度的DNA及RNA,约90%样本所得DNA OD260/ OD280=1.6~1.8、RNA OD260/OD280=1.8~2.0。其中血细胞样本经Aglient 2100检测,所得RNA 80%完整性参数(RNA integrity number,RIN)>7,白细胞90%以上RIN>7。
3 讨论
信息系统建立的根本目的在于:①实现多种信息系统与样本之间的准确对接,便于数据整合,精确、高效指导科学研究;②准确再现样本生命周期全过程,保证样本下游分析结果的可回溯性,为科学研究提供真实、可靠样本信息;③便于科研人员快速、适时掌握储存样本和动态样本储存情况查询、队列样本储存情况查询、批量样本出库查询等;④便于生物样本库进行信息管理、信息查询、信息统计以及实体和信息入库、出库工作。因此,信息管理软件应与医院信息系统、实验室信息系统、影像归档和通信系统相对接。同时,应具备详细的样本捐赠者信息、真实的、可回溯的样本前处理信息。建立图形化入库虚拟空间,便于快速入库,减少样本在室温或低温暴露时间;还应包括快速查询模块、入库出库模块、统计分析功能等。
血液样本采集、转运、前处理、保存的关键在于:①建立正确采集方案;②最大限度保证样本生物学活性;③规范化、标准化操作,保证样本及其对应信息准确性;④真实记录每个样本生命周期各个流程操作信息。
血液采集前,应根据需求确定采血管类型、采集时间、数量。抗凝剂的选择对于后续样本分析具有重要影响[8-9]。EDTA可维持血浆内生物大分子的稳定,适用于基于基因组、表观基因组及蛋白质组、代谢组学、细胞学相关研究[10-11];枸橼酸钠抗凝剂有利于维持细胞形态及活性[12-13],适用于功能性凝血因子测定;肝素会与某些蛋白结合并影响基于聚合酶链反应的后续基因分析[14];肝素锂、肝素钠采血管处理的血浆适用于代谢组学研究,但会影响淋巴细胞增殖[15]、中性粒细胞恢复效率[11];CPT适用于细胞学如PBMC分离、流式细胞术相关研究。血液样本采集时间一般由科室提出并制定,可供参考的血液样本采集时间为手术前当天于手术室采集及手术后24、48 h采集。采集总体积一般为4 mL,基本可以满足基因组、蛋白质组、代谢组以及血浆外泌体分析。除此之外,采集时间点、麻醉前或后、静脉或动脉采集方式都将影响某些生物标志物的水平[16]。在样本转运及前处理过程应以最快速度并尽量在低温环境完成,以减少生物分子降解,避免提取量及活性降低。前处理完成后,尽快将样本冻存于-80℃超低温冰箱或液氮中[17]。枪头、离心管与样本直接接触的器材需高压灭菌,样本分装份数不小于3份。
前处理完成后,样本可先浸液氮,可使样本温度迅速降低,减少降解。仁济医院血液样本保存温度-80℃,结果表明大多数血液样本生物学指标稳定。一般血清及血浆保存于-80℃即可稳定维持DNA、蛋白质及代谢物活性[18-21]。
血液样本质量控制是不断循环持续改进的动态过程,主要通过流程控制、信息完善、大分子检测等方法对样本采集、转运、前处理等与样本质量相关因素进行检测并持续改进而实现。在血液样本生物大分子质量控制方面,除仁济医院血液样本库采用的对样本中DNA进行质量控制外,还可对血浆、血清、血细胞样本中蛋白质进行质量控制,可采用蛋白浓度测定法如聚氰基丙烯酸正丁酯法[22]、酚试剂法[23]测定蛋白质浓度,通过聚丙烯酰胺凝胶电泳检测样本中所含有的总蛋白完整性,以蛋白质印迹法检测特异性蛋白的含量[24-25];还可以通过对血细胞及白细胞中的RNA进行质量控制,提取RNA后,检测RIN[26]。目前仍缺乏特异性的血液样本质量控制标志物。
[1]Lemieux J,Jobin C,Simard C,et al.A global look into human T cell subsets before and after cryopreservation using multiparametric flow cytometry and two-dimensional visualization analysis[J].J Immunol Methods,2016,434:73-82.
[2]Mohamadkhani A,Poustchi H.Repository of human blood derivative biospecimens in biobank:technical implications [J].Middle East J Dig Dis,2015,7(2):61-68.
[3]Iwae S,Masui T.Governance and measures for the ethical and social aspects of biobanks[J].Gan To Kagaku Ryoho,2012,39(4):493-497.
[4]Campbell LD,Betsou F,Garcia DL,et al.Development of the ISBER best practices for repositories:collection,storage,retrieval and distribution of biological materials for research[J].Biopreserv Biobank,2012,10(2):232-233.
[5]Vaught J,Rogers J,Myers K,et al.An NCI perspective on creating sustainable biospecimen resources[J].J Natl Cancer Inst Monogr,2011,2011(42):1-7.
[6]Shabihkhani M,Lucey GM,Wei B,et al.The procurement,storage,and quality assurance of frozen blood and tissue biospecimens in pathology,biorepository,and biobank settings[J].Clin Biochem,2014,47(4/5):258-266.
[7]Hubel A,Spindler R,Skubitz AP.Storage of human biospecimens:selection of the optimal storage temperature[J]. Biopreserv Biobank,2014,12(3):165-175.
[8]Holland NT,Smith MT,Eskenazi B,et al.Biological sample collection and processing for molecular epidemiological studies[J].Mutat Res,2003,543(3):217-234.
[9]Gillio-Meina C,Cepinskas G,Cecchini EL,et al.Translational research in pediatricsⅡ:blood collection,processing,shipping,and storage[J].Pediatrics,2013,131(4): 754-766.
[10]Nielsen H.Influence of five different anticoagulants on human blood monocyte isolation and functional activities[J]. Acta Pathol Microbiol Immunol Scand C,1985,93(2): 49-52.
[11]Freitas M,Porto G,Lima JL,et al.Isolation and activation of human neutrophils in vitro.The importance of the anticoagulant used during blood collection[J].Clin Biochem,2008,41(7/8):570-575.
[12]Sobel JH,Wu HQ,Canfield RE.The development of assays for the detection of fibrin(ogen)olysis based on COOH-terminal A alpha chain epitopes[J].Blood,1994,84(2): 535-546.
[13]Kohek M,Leme C,Nakamura IT,et al.Effects of EDTA and Sodium Citrate on hormone measurements by fluorometric(FIA)and immunofluorometric(IFMA)methods [J].BMC Clin Pathol,2002,2(1):2.
[14]Elliott P,Peakman TC,UK Biobank.The UK Biobank sample handling and storage protocol for the collection,processing and archiving of human blood and urine[J].Int J Epidemiol,2008,37(2):234-244.
[15]Capila I,Linhardt RJ.Heparin-protein interactions[J].Angew Chem Int Ed Engl,2002,41(3):391-412.
[16]Kahn N,Riedlinger J,Roeßler M,et al.Blood-sampling collection prior to surgery may have a significant influence upon biomarker concentrations measured[J].Clin Proteomics,2015,12(1):19.
[17]Anton G,Wilson R,Yu ZH,et al.Pre-analytical sample quality:metabolite ratios as an intrinsic marker for prolonged room temperature exposure of serum samples[J]. PLoS One,2015,10(3):e0121495.
[18]Elshimali YI,Khaddour H,Sarkissyan M,et al.The clinical utilization of circulating cell free DNA(CCFDNA)in blood of cancer patients[J].Int J Mol Sci,2013,14(9): 18925-18958.
[19]Tremlett H,Dai DL,Hollander Z,et al.Serum proteomics in multiple sclerosis disease progression[J].J Proteomics,2015,118:2-11.
[20]Barelli S,Crettaz D,Thadikkaran L,et al.Plasma/serum proteomics:pre-analytical issues[J].Expert Rev Proteomics,2007,4(3):363-370.
[21]Se Fum Wong S,Kuei JJ,Prasad N,et al.A simple method for DNA isolation from clotted blood extricated rapidly from serum separator tubes[J].Clin Chem,2007,53(3): 522-524.
[22]Smith PK,Krohn RI,Hermanson GT,et al.Measurement of protein using bicinchoninic acid[J].Anal Biochem,1985,150(1):76-85.
[23]Lowry OH,Rosebrough NJ,Farr AL,et al.Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
[24]Mareninov S,De Jesus J,Sanchez DE,et al.Lyophilized brain tumor specimens can be used for histologic,nucleic acid,and protein analyses after 1 year of room temperature storage[J].J Neurooncol,2013,113(3):365-373.
[25]Ericsson C,Franzén B,Nistér M.Frozen tissue biobanks. Tissue handling,cryopreservation,extraction,and use for proteomic analysis[J].Acta Oncol,2006,45(6):643-661.
[26]Fleige S,Pfaffl MW.RNA integrity and the effect on the real-time qRT-PCR performance[J].Mol Aspects Med,2006,27(2/3):126-139.
The controllability collection and quality management of clinical biobank for blood biospecimen
WU Manli,WANG Zhuqing,LUO Kai,KANG Xiaonan
(Renji Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200127,China)
Objective The aim of the Renji hospital biobank blood sample controllability collection and quality management is to establish a blood sample controllable acquisition mode for medical procedure,ensure that the sample collection,the process can be traced back and provide high-quality blood samples for cancer,autoimmune diseases,cardiovascular diseases and metabolic diseases research.Methods Integrated the sample collection electronic filing,project management as well as the various preanalytical variables of blood sample to electronic work program through the establishment of the network management process to ensure the implementation of standard processes under control,formed a standardized blood collection,pre-processing,conservation and management approach.Results Renji Hospital biobank has collected more than 20 kinds of clinical disease blood samples,and all samples contained the complete clinical follow-up data.Blood samples were correspond with tissue samples and matched with clinical information;information management system recorded each sample collection time,time to biobank and the storage time.Samples can be screened for the corresponding requirements through the information management system.Till now,Renji hospital has collected more than 40 000 blood samples,90%of them have stable molecular markers.Conclusion The controllable blood collection,processing and management model of Renji Hospital provide management experience for comprehensive hospital in construction of blood biobank,provide detailed experience reference for standard,high-quality,pre-process,storage,etc of blood specimen,and provide high quality boold specimen and information for cancer,autoimmune diseases,cardiovascular diseases and metabolic diseases research.
Specimen;Biospecimen;Blood biobank
R-05
A
2095-3097(2016)06-0327-06
10.3969/j.issn.2095-3097.2016.06.003
2016-06-29 本文编辑:徐海琴)
上海市科学技术委员会科研计划项目(15DZ2292100);上海市卫生计生系统重要薄弱学科建设计划(2015ZB0206)
200127上海,上海交通大学医学院附属仁济医院(吴曼丽,王柱清,罗 凯,康晓楠)
康晓楠,E-mail:xnkang7@163.com
