计算机辅助设计新型人脂肪酸合酶抑制剂及其抗肿瘤活性
2016-12-27刘诗雨米婷婷任建东范开华
刘诗雨,米婷婷,任建东,范开华,何 菱*
·研究论文·
计算机辅助设计新型人脂肪酸合酶抑制剂及其抗肿瘤活性
刘诗雨1,米婷婷2*,任建东2,范开华2,何 菱1*
(1.四川大学 华西药学院,四川 成都 610041;2.中国人民解放军 成都军区总医院 药剂科,四川 成都 610083)
以Orlistat为先导化合物,利用AutoDock进行计算机模拟对接,在对接结果中选择能量较低的6个结构进行合成与抗肿瘤活性筛选。以orlistat为原料,经2步反应制得苄基(2S,3S,5S)-2-己基-3,5-二羟基十六酸酯(2);再经4步反应获得(3S,4S)-3-己基-4-[(S)-2-羟基十三烷基]氧杂环丁烷-2-酮(5);5在EDCI作用下与酸经缩合反应合成了4个计新型人脂肪酸合酶抑制剂(6a~6d),其中6b~6d为新化合物,其结构经1H NMR,13C NMR 和HR-MS(ESI)表征。体外初步活性测试表明:(S)-1-[(1S,2S)-3-己基-4-氧代氧杂环丁烷-2-基]十三烷-2-烟酸酯(6a)对MDA-MB-231细胞有较好的抑制作用,其IC50为11.72 μmol·mL-1,优于Orlistat(21.5 μmol·mL-1)。
Orlistat;计算机辅助药物设计;抗肿瘤活性;合成;人脂肪酸合酶抑制剂
随着人类平均寿命的延长,以及环境的持续恶化,恶性肿瘤已经成为人类生命与健康安全的一大威胁。传统的化疗药物虽然能对肿瘤细胞起到一定的抑制作用,但因其作用机制等原因,不良反应也较为严重;且肿瘤细胞易突变,很容易产生耐药性。因此,寻找新靶点的抗肿瘤药物成为了抗肿瘤药物的一个设计思路。

Scheme 1
Orlistat对人脂肪酸合酶具有抑制作用[1],且Orlistat与人脂肪酸合酶结合的单晶及其结合方式已确定[2]。而人脂肪酸合酶在多种肿瘤细胞内均有较高表达[3-5],抑制此酶可以诱导肿瘤细胞凋亡[5-7]。根据Orlistat与人脂肪酸合酶的结合单晶可知,四元内酯环是形成Orlistat酰脂肪酸合酶的必须结构,两条长脂肪链则提供结合初期绝大部分的疏水力。因此,我们希望以Orlistat为先导化合物,保留其长脂肪链与四元内酯环结构,借助计算机辅助,设计一系列Orlistat衍生物,以期得到抗肿瘤活性较强的化合物。
本研究以Orlistat为原料[4],经水解,苄溴保护羧基生成苄基(2S,3S,5S)-2-己基-3,5-二羟基十六酸酯(2);2经选择性保护5-位羟基生成苄基(2S,3S,5S)-2-己基-3-羟基-5-[(三异丙基硅基)氧基]十六酸酯(3);3经钯碳催化氢解与N-苯基-双三氟甲磺酰亚胺合环生成(3S,4S)-3-己基-4-{(S)-2-[(三异丙基硅基)氧基]十三烷基}氧杂环丁烷-2-酮(4);4在氟化氢吡啶盐的作用下脱去硅保护生成(3S,4S)-3-己基-4-[(S)-2-羟基十三烷基]氧杂环丁烷-2-酮(5);最后5与不同羧酸在EDCI作用下缩合形成新型人脂肪酸合酶抑制剂(6a~6d,Scheme 1),其中6b~6d 为新化合物,其结构经1H NMR,13C NMR 和HR-MS(ESI)表征。并对化合物2,5及6a~6d的抗肿瘤活性进行了初步探索。
1 实验部分
1.1 仪器与试剂
Varian Mercury 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Aglient-6890型质谱仪;分子模拟工作站(联想深腾1800型服务器,Autodock 4.0,Chimera,Accelrys DS Visualizer 模拟软件) 。
Orlistat,纯度98%,上海笛柏化学品技术有限公司;其余所用试剂均为分析纯。
1.2 分子模拟和化合物虚拟筛选
从蛋白质数据库中下载2PX6.pdb文件作为生物大分子[2]。利用Chimera剥离单晶中的配体,水分子等小分子,使结合空腔暴露出来。采用AutoDock-Tools 1.5.6分别导入配体与大分子文件,并为其添加极性氢与电荷。根据已有单晶中orlistat与人脂肪酸合酶的硫酯酶结构域的结合位置确定模拟计算时格子中心坐标为(13.51,-5.582,27.876),格子大小为(48 Å×42 Å×54 Å),格点间距0.375 Å。分子对接运算采用 Lamarckian 遗传算法(对接循环参数 200,其余参数为默认值),配体和受体间的结合情况采用半经验自由能计算方法。具体运算用 Autodock 4.2.6完成。采用分子对接算法模拟化合物与人脂肪酸合酶的结合模式与能量。在模拟计算的配体数据库中选取结合能量较低的化合物进行合成,并进行体外抗肿瘤活性筛选。
1.3 合成
(1) 2的合成[6]
(2) 3的合成[6]
氮气保护下,在反应瓶中加入2 1.35 g(2.82 mmol)和无水DCM 31 mL,冷却至-78 ℃,搅拌下加入2,4,6-三甲基吡啶0.95 mL和TIPSOTf 1.2 mL,加毕,于-78 ℃反应3 h。加水淬灭反应,用DCM萃取4次,合并有机相,依次用1 mol·mL-1盐酸和饱和氯化钠溶液洗涤,无水Na2SO4干燥,过滤,滤液浓缩得无色油状粗产物,经硅胶柱层析(洗脱剂:A=20/1)纯化得无色油状液体3 1.73 g,产率95.6%;1H NMRδ:7.36~7.31(m,5H),5.08(s,2H),4.85(d,J=4.0 Hz,1H),4.03~4.02(m,1H),3.64~3.61(m,1H),2.39~2.37(m,1H),1.55~1.13(m,35H),1.05~0.91(m,18H),0.86~0.81(m,6H)。
(3) 4的合成[6]
向100 mL烧瓶中加入3 1.73 g(2.79 mmol),10%无水钯碳300 mg与无水乙酸乙酯15 mL,搅拌下于常温常压进行氢解。抽滤,滤液浓缩得无色油状物中间体,加入无水DCM 25 mL和TEA 0.77 mL,搅拌下加入PhNTf21.5 g,氮气保护下于室温反应过夜。浓缩,残余物经硅胶柱层析[洗脱剂:V(石油醚):V(二氯甲烷)=6:1]纯化得无色油状液体4 0.90 g,产率63.2%;1H NMRδ:4.50~4.47(m,1H),3.99~3.97(m,1H),3.28~3.24(m,1H),2.10~1.26(m,35H),1.06(m,18H),0.89~0.87(m,6H)。
(4) 5的合成[6]
在塑料反应器中加入4 750 mg(1.47 mmol),无水THF 12.5 mL,搅拌下于5~10 ℃加入HF-Py (65~70%) 1.02 g,缓慢升至室温,反应过夜。加水淬灭反应,用乙酸乙酯萃取,合并有机相,用无水Na2SO4干燥。抽滤,滤液浓缩,残余物经经硅胶柱层析(洗脱剂:A=7/1)纯化得白色石蜡状固体5 380 mg,产率73.1%;1H NMRδ:4.49~4.45(m,1H),3.82~3.77(m,1H),3.34~3.29(m,1H),2.06~1.23(m,33H),0.89~0.87(m,6H)。
(5) 6a~6d的合成(以6a为例[5])
随着国网供电公司对于智能化电网工作的不断推进以及新型电力营销方法的普及,对电网智能化和精细化管理要求越来越高。为满足国网供电公司营配业务的高效运行,满足配电网维修、抢修效率的要求,实现以“标准规范先行、数据治理和应用融合并重、应用建设促功能实用化”的工作思路,重点推进营配业务数据的整理、录入、核实以及信息化采集系统适用性改造等工作,清理原始数据,规范新增数据;同时也为提高居民低压集抄系统建设小区的台区线损率计算准确性,研发和推广适应新形势下电网建设和电网精细化管理的新一代全数字化、多功能、智能化台区识别仪,可以满足电网建设和管理需要,为实现台区精细化管理提供真实准确的基础数据[2]。
在反应瓶中加入5 30 mg(0.084 6 mmol),EDCI 33 mg,DMAP 21 mg,烟酸21 mg和无水DCM 3 mL,氮气保护下于室温搅拌反应过夜。经经硅胶柱层析(洗脱剂 :A=9/1)纯化得6a。
用类似的方法合成6b~6d。
6a:无色油状液体,收率84.8%;1H NMRδ:9.29(br s,1H),8.87(br s,1H),8.65(d,J=7.6 Hz,1H),7.74(br s,1H),5.38~5.36(m,1H),4.41~4.37(m,1H),3.28~3.24(m,1H),2.34~1.26(m,32H),0.89~0.87(m,6H)。
6b:无色油状液体,收率86.5%;1H NMRδ:6.44(dd,J=1.2 Hz,17.4 Hz,1H),6.15(dd,J=10.4 Hz,17.4 Hz,1H),5.88(dd,J=1.2 Hz,17.4 Hz,1H),5.09~5.03(m,1H),4.36~4.31(m,1H),3.25~3.19(m,1H),2.26~1.25(m,32H),0.89~0.86(m,6H);13C NMRδ:171.05,165.69,131.12,128.39,74.68,71.27,56.97,38.68,34.15,31.93,31.47,29.63,29.54,29.46,29.35,28.97,27.69,26.69,25.26,22.70,22.51,14.11,14.01;HR-MS(ESI)m/z:Calcd for C25H44O4{[M+H]+}409.324 0,found 409.331 2。
6c:无色油状液体,收率73.0%;1H NMRδ:7.71(d,J=16.0 Hz,1H),7.55~7.53(m,2H),7.41~7.39(m,3H),6.45(d,J=16.0 Hz,1H),5.13~5.11(m,1H),4.41~4.36(m,1H),3.27~3.22(m,1H),2.30~1.25(m,32H),0.89~0.83(m,6H);13C NMRδ:171.12,166.41,145.27,134.17,130.42,128.87,128.08,117.72,74.68,71.06,56.85,38.64,34.18,31.85,31.42,29.57,29.49,29.41,29.31,28.94,27.64,26.66,25.25,22.63,22.45,14.08,13.96;HR-MS(ESI)m/z:Calcd for C31H49O4{[M+H]+} 485.363 1,found 485.364 2。
6d:无色油状液体,收率76.1%;1H NMRδ:8.071(brs,1H),7.63(d,J=8.0 Hz,1H),7.37(d,J=8.0 Hz,1H),7.22~7.18(m,2H),7.15~7.11(m,1H),4.99~4.97(m,1H),4.15~4.10(m,1H),3.77(s,2H),3.10~3.06(m,1H),2.14~1.20(m,32H),0.89~0.86(m,6H);13C NMRδ:171.63,171.26,136.07,127.03,123.04,122.20,119.64,118.72,111.21,108.21,74.71,71.32,56.61,38.48,34.05,31.86,31.61,31.39,29.57,29.47,29.39,29.30,29.25,28.85,27.42,26.50,25.16,22.64,22.48,14.08,13.99;HR-MS(ESI)m/z:Calcd for C32H50NO4{[M+H]+} 512.374 0,found 512.373 3。
1.4 抗肿瘤活性测定
乳腺癌细胞系MDA-MB-231在含有10%胎牛血清,42 mmol·L-1谷氨酰胺,1 mmol·L-1丙酮酸钠,100 μg·mL-1青霉素,100 μg·mL-1链霉素和0.25 μg·mL-1两性霉素的DMEM培养基中常规培养。培养物于37 ℃的温度下维持在5%CO2。细胞被接种在含有10%胎牛血清的DMED培养基的24孔板培养板上,接种密度为每孔20 000个。然后将细胞用Orlistat衍生物在0.01 mmol·L-1至1 nmol·L-1间的5种不同的剂量范围培养5 d。等体积的DMSO被用作空白对照。利用细胞数与细胞活力分析仪(Beckman Coulter公司)进行计数。以药物处理过的细胞存活数除以空白对照的细胞存活数计算细胞存活百分比。从试验化合物的剂量-存活比曲线计算的IC50。
2 结果与讨论
2.1 计算机模拟对接
分子模拟与实验结果产生偏差的原因主要有:(一)由于AutoDock的模拟计算是以配体已经进入大分子的特定区域为前提进行对接,因此对由于分子大小或理化性质等原因造成配体难以进入该区域与大分子结合的化合物将产生较大偏差;(二)本次计算使用的是刚性大分子,无法对配体-受体间的诱导契合效应进行模拟与评价;(三)AutoDock本身计算精度有限,且模拟对接时使用的是去除水分子的大分子模型,因此模拟对接会与真实的配体-受体的接合过程存在差异;(四)AutoDock的模拟对接是以可逆吸附为前提计算的,因此对共价药物会出现一定的偏差。
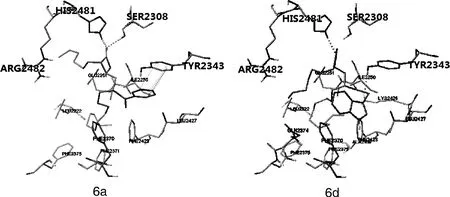
图1 6a与6d的对接结果
如图1所示,6a的吡啶环结构可以与TYR2343的苯环形成π—π堆积,其四元内酯环的羰基氧可以与SER2308和HIS2481两个氨基酸残基形成氢键并将四元内酯环固定在SER2308附近,使其与orlistat酰脂肪酸合酶的结构更加接近,更容易形成共价键[2]。
与6a的作用类似,6d结构中吲哚乙酸的羰基氧与TYR2343形成氢键,且四元内酯环的羰基氧与HIS2481形成氢键。增加了6d与脂肪酸合酶的结合力。以上因素可能是6a与6d活性较高的原因。
2.2 抗肿瘤活性
为了验证模拟对接结果,我们以MDA-MB-231肿瘤细胞为模型,测试各化合物对该肿瘤细胞的IC50值,结果见表1。由表1可见,6a和6d对MDA-MB-231细胞的抑制活性明显优于Orlistat。尤其是6a(IC50=11.72 μmol·mL-1)。可看出当R含氮芳香杂环结构时其抗肿瘤作用较好,为以后相关研究奠定了基础。

表1 化合物的抗肿瘤活性
*μmol·mL-1。
3 结论
通过计算机辅助设计,以Orlistat为原料经水解保护、关环、脱保护及酯化等步骤反应合成了6个新型人脂肪酸合酶抑制剂(2、5、6a~6d) ,其中6b~6d为新化合物。体外活性测试表明:(S)-1-[(1S,2S)-3-己基-4-氧代氧杂环丁烷-2-基]十三烷-2-烟酸酯(6a)对MDA-MB-231细胞有较好的抑制活性,其IC50为11.72 μmol·mL-1,优于Orlistat (21.5 μmol·mL-1)。说明基于人脂肪酸合酶的计算机模拟结果与该化合物对肿瘤细胞的抑制活性是相关的。
[1] Steven J K,Fumiko A,Natasha R,etal.Orlistat is a novel inhibitor of fatty acid synthase with antitumor activity[J].Cancer Research,2004,64:2070-2075.
[2] Pemble C W,Johnson L C,Kridel S J,etal.Crystal structure of the thioesterase domain of human fatty acid synthase inhibited by Orlistat[J].Nature Structural &Molecular Biology,2007,14(8):704-709.
[3] Rashid A,Pizer E S,Moga M,etal.Elevated expression of fatty acid synthase and fatty acid synthetic activity in colorectal neoplasia[J].American Journal of Pathology,1997,150(1):201-208.
[4] Giorgio O,Tiziana B,Alessia L,etal.Tetrahydrolipstatin analogues as modulators of endocannabinoid 2-arachidonoylglycerol metabolism.[J].J med chem,2008,51(21):6970-6979.
[5] West N P,Cergol K M,Xue M,etal.Inhibitors of an essential mycobacterial cell wall lipase(Rv3802c) as tuberculosis drug leads[J].Chemical Communications,2011,47(18):5166-8.
[6] Menendez J A,Vellon L,Lupu R.Antitumoral actions of the anti-obesity drug orlistat (Xenical (TM)) in breast cancer cells:Blockade of cell cycle progression,promotion of apoptotic cell death and PEA3-mediated transcriptional repression of Her2/neu(erbB-2) oncogene[J].Annals of Oncology,2005,16(8):1253-1267.
Computer Aided Design of Novel Human Fatty Acid Synthase Inhibitors and Their Antitumor Activities
LIU Shi-yu1, MI Ting-ting2*, REN Jian-dong2, FAN Kai-hua2, HE Ling1*
(1.West China School of Pharmacy,Sichuan University,Chengdu 610041,China; 2.Pharmaceutical Preparation Section of Chengdu Military General Hospital,Chengdu 610083,China)
With orlistat as the pilot,six compounds with low-energy structures were chosen by computer stimulation for further synthesis and a ntineoplastic activity screening using AutoDock.Benzyl (2S,3S,5S)-2-hexyl-3,5-dihydroxyhexadecanoate(2) was prepared by two steps of reaction from Orlistat.(3S,4S)-3-hexyl-4-[(S)-2-hydroxytridecyl]oxetan-2-one(5) was prepared by four steps of reaction from 2.Human fatty acid synthase inhibitors(6a~6d) were obtained from 5 by condensation reaction with corresponding acid in the presence of EDCI,Among them 6b~6d were novel compounds.The structures were characterized by1H NMR,13C NMR and HR-MS(ESI).Invitrotest results showed that(S)-1-[(2S,3S)-3-hexyl-4-oxooxetan-2-yl]tridecan-2-yl nicotinate(6a) exhibited better inhibitory activity againstfattyacidsynthasewith IC50of 11.72 μmol·mL-1,which is better than Orlistat (21.5 μmol·mL-1).
Orlistat;computer-aided drug design;antineoplastic;synthesis;human fatty acid synthase Inhibitor
2016-03-28;
2016-09-23
国家自然科学基金资助项目(21072131);四川省科技厅科技支撑计划资助项目(2015SZ0168)
刘诗雨(1989-),男,汉族,河北唐山人,硕士,主要从事药物化学的研究。 E-mail:470558926@qq.com
何菱,教授,Tel.028-85503365,E-mail:lhe2001@sina.com.cn;米婷婷,主管药师,E-mail:miting85@163.com
O621.3
A
10.15952/j.cnki.cjsc.1005-1511.2016.12.16086
