CYP11A1基因在藏猪和藏梅猪卵巢、子宫和输卵管组织表达差异
2016-12-27李江凌陈晓晖龚建军杨跃奎吕学斌
刘 锐 李江凌 陈晓晖龚建军 杨跃奎 吕学斌
(1四川省畜牧科学研究院,四川成都 610066;2动物遗传育种四川省重点实验室,四川成都 610066)
CYP11A1基因在藏猪和藏梅猪卵巢、子宫和输卵管组织表达差异
刘 锐1,2李江凌1,2陈晓晖1,2龚建军1,2杨跃奎1,2吕学斌1,2
(1四川省畜牧科学研究院,四川成都 610066;2动物遗传育种四川省重点实验室,四川成都 610066)
基因是催化类固醇激素生成过程中的第一个水解酶,也是该过程的限速酶,对于受到激素调节的动物繁殖生理过程有重要作用。本文研究了基因在产仔数有明显差异两个猪种卵巢、子宫和输卵管三个组织中的表达差异,结果发现基因在卵巢组织中表达最丰富,且在两个不同猪种中有显著差异 (P<0.05)。这说明基因猪卵巢功能发挥具有重要作用。
基因;藏猪;藏梅猪;差异表达
1 材料与方法
1.1试验动物及组织样品采集
试验所用的藏猪和藏梅猪均由四川省畜牧科学研究院育种科研基地提供。随机选择发情期母猪藏猪和藏梅猪各3头,其中,藏梅猪为四川省畜牧科学研究院自主培育的川藏黑猪配套系母本品系,该品系是由藏猪和梅山猪血缘组成的合成品系。藏猪和梅山猪在母猪繁殖力上有明显的差异,是研究猪繁殖力的良好试验材料。
猪只屠宰后,立即小心获取生殖系统组织——卵巢、输卵管和子宫入冷冻管,投入液氮保存以便于后续研究。
1.2组织样品总RNA提取及cDNA合成
将-80℃冻结的大约50~100 mg组织样品迅速转移至用液氮预冷的研钵中,用研杵研磨组织,其间不断加入液氮,直至研磨成粉末(无明显的可见颗粒),然后加入适量的RNAiso Plus(TaKaRa),将研磨成粉末状的样品完全覆盖,室温静置直至样品完全融化,再用研杵继续研磨至裂解液呈玫瑰红色透明状。将匀浆液转移至离心管中,按照试剂盒说明书进行总RNA提取。用NanoDrop 2000(Thermo)对提取的RNA进行质检,RNA纯度通过计算A260/280 nm(介于1.90和2.10之间)进行评估,RNA完整性通过1%琼脂糖凝胶电泳观测。
反转录采用TransScript One-Step gDNA Removal and cDNA synthesis supermix试剂盒(北京全式金生物技术有限公司),按照其操作说明书完成cDNA的合成。
1.3荧光定量PCR
引物用PRIMER3软件(http://frodo.wi.mit.edu/)设计,以肽基脯氨酰异构酶A(PPIA)、核糖体蛋白L4(RPL4)和Tyr-3/Trp-5单氧酶激活蛋白Zeta(YWHAZ)作为内参基因,由深圳华大基因科技有限公司合成,序列信息见表1。设计引物时要求至少有一条引物跨过了外显子之间的连接处,以确保定量准确,设计好的引物Primer Blast(http://www.ncbi.nlm.nih.gov/tools /primer-blast)进行评价,并用2.5%琼脂糖凝胶电泳检测PCR产物的特异性。
qPCR采用SsoFastTMEvaGreenSupermix(Bio-Rad)试剂盒,反应在CFX96 TouchTM荧光定量PCR仪上进行(Bio-Rad)。根据试剂盒操作说明进行扩增,PCR反应条件如下:95℃热启动30秒,40个热循环包括95℃变性5秒,退火/延伸(表1)5秒。PCR扩增后进行熔解曲线分析,温度以0.5℃/30秒的速率从65℃缓慢递增到95℃。每个样品做3个重复。表1中列出的Q-PCR扩增效率用等比例稀释模板,通过软件得到的标准曲线计算而来。
1.4数据分析
目标基因在各组织中的表达水平采用2-△△Ct(Livak)法进行相对定量。用在猪各组织稳定表达的基因PPIA、RPL4和YWHA作看家基因。不同品种不同组织目标基因的表达差异情况用SPSS软件进行t检验。
2 结果与分析
由图1可知,CYP11A1基因在猪生殖系统组织都有表达,但在藏猪和藏梅猪的不同生殖系统组织中的表达量有所不同。在卵巢组织中,CYP11A1基因mRNA含量丰富,其在藏梅猪表达量极显著地高于藏猪(<0.01),说明在母猪发情期的生理过程中,该基因对于卵巢生理功能的发挥具有明显的促进作用。而在输卵管组织中,藏梅猪基因表达量极显著地低于藏猪(<0.01),说明在母猪发情期,基因表达对输卵管组织发挥生理功能是负向调节;在子宫组织中,两个猪种间无显著差异(>0.05),这种丰富却无显著差异的转录意味着基因的表达对于发情期子宫发挥生理作用是必需的。。
三个生殖系统组织中,CYP11A1基因在藏梅猪和藏猪的表达模式也不完全相同。两个猪种中都是卵巢组织表达量最高,但是在藏猪中,CYP11A1基因在输卵管表达量略高于子宫,而藏梅猪中却恰好相反,虽然这两个组织的差别表达并未达显著水平(>0.05)。这一结果表明,CYP11A1基因的表达对于发情期卵巢的功能发挥有重要作用。

表1 荧光定量PCR引物序列及相关信息
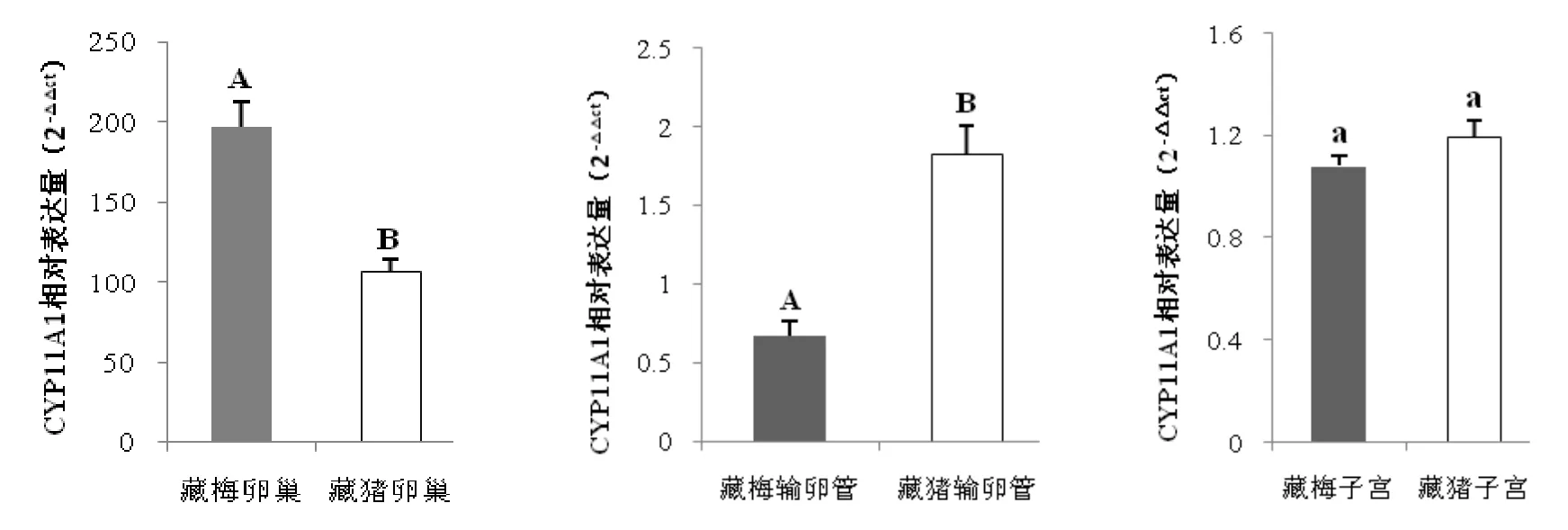
图1 藏猪和藏梅猪CYP11A1基因在卵巢、输卵管、子宫组织的表达差异
3 讨论
尽管有关CYP11A1基因功能研究的相关资料非常有限,但是目前可以查到在人类以及模式生物(鼠)和其他动物(羊、牛、家禽)上的有关资料,这些资料表明,CYP11A1基因除了参与类固醇激素的合成这一主要功能外,也参与其他信号通路,比如调节T细胞功能,调节卵泡生成等[7-8]。
Gregoraszczuk E等[13]的研究表明,无论是青年母猪,还是经产母猪,大剂量的瘦素会使CYP11A1和17b-HSD蛋白表达量增加,从而使孕酮和睾酮分泌增加,造成卵巢囊肿。他们的研究证实了母猪暴露在过多的雄性激素中时,CYP11A1的表达量增加,增加患卵巢囊肿的几率,即使是雌性胎儿也是如此(Hogg K等[14]。
[1]Zhang CW,Zhang XL,Xia YJ,et al.Association between polymorphisms of the CYP11A1 gene and polycystic ovary syndrome in Chinese women[J].Mol Biol Rep,2012,39(8): 8379-8385.
[2]Reddy KR,Deepika ML,Supriya Ke,et al.CYP11A1 microsatellite (tttta)n polymorphism in PCOS women from South India[J].J Assist Reprod Genet,2014,31(7):857-863.
[3]Kowalski KI,Tilly JL,Johnson AL.Cytochrome P450 side-chain cleavage (P450scc)in the hen ovary.I.Regulation of P450scc messenger RNA levels and steroidogenesis in theca cells of developing follicles[J].Biol Reprod,1991,45(6):955–966.
[4]Tilly JL,Kowalski KI,Johnson AL.Cytochrome P450 side-chain cleavage (P450scc)in the hen ovary.II.P450scc messenger RNA,immunoreactive protein,and enzyme activity in developing granulosa cells[J].Biol Reprod,1991,45(6):967–974.
[5]Johnson A,Woods DC.Dynamics of avian ovarian follicle development: cellular mechanisms of granulosa cell differentiation[J].Gen Comp Endocrinol,2009,163(1):12-17.
[6]Qi Xu,Yadong Song,Yang Chen,et al.Molecular cloning and expression patterns of the cholesterol side chain cleavage enzyme(CYP11A1)gene during the reproductive cycle in goose (Anas cygnoides)[J].Journal of Animal Science and Biotechnology,2015,6:54.
[7]Jia Y,Domenico J,Takeda K,et al.Steroidogenic enzyme Cyp11a1 regulates Type 2 CD8+T cell skewing in allergic lung disease[J].Proc Natl Acad Sci USA,2013,110(20):8152-8157.
[8]Hatey F,Gasparoux JP,Mulsant P,et al.P450scc regulation in pig granulosa cells:investigation into the mechanism of induction[J].J Steroid Biochem Mol Biol,1992,43(8):869-874.
[9]Moe M,Meuwissen T,Lien S,et al.Gene expression profiles in testis of pigs with extreme high and low levels of androstenone[J].BMC Genomics 2007,8:405.
[10]Grindflek E,Berget I,Moe M,et al.Transcript profiling of candidate genes in testis of pigs exhibiting large differences in androstenone levels[J].BMC Genetics 2010,11:4.
[11]Robic A,Le Mignon G,Fève K,et al.New investigations around CYP11A1 and its possible involvement in an androstenone QTL characterised in Large White pigs[J].Genet Sel Evol,2011,43:15.
[12]Newell-Fugate AE,Taibl JN,Alloosh M,et al.Effects of Obesityand Metabolic Syndrome on Steroidogenesisand Folliculogenesis in the Female Ossabaw Mini-Pig[J].PLoS ONE, 2015,10(6):e0128749.doi:10.1371/journal.pone.0128749.
[13]Gregoraszczuk E?1,Rak-Mardy?a A.Supraphysiological leptin levels shift the profile of steroidogenesis in porcine ovarian follicles toward progesterone and testosterone secretion through increased expressions of CYP11A1 and 17b-HSD:a tissue culture approach[J].Reproduction,2013,145(3):311-317.
[14]Hogg K,McNeilly AS,Duncan WC.Prenatal androgen exposure leads to alterations in gene and protein expression in the ovine fetal ovary[J].Endocrinology,2011:152(5):2048-2059.
■简讯
万洲国际子公司1.45亿美元购美国猪肉产品生产商
【本刊辑】据北京商报2016年11月24日报道,继3年前在美国买下全球最大猪肉供应商史密斯菲尔德(Smithfield)之后,万洲国际再度出手,准备买下美国肉食企业荷美尔(Hormel Foods)的子公司Clougherty。根据万洲国际11月22日公告,史密斯菲尔德以1.45亿美元的价格收购Clougherty。
根据万洲国际提供的资料显示,Clougherty是美国综合猪肉产品生产及加工商。Clougherty植根加州,经营多个品牌如Farmer John及Saag’s Specialty Meats等,每年销售额约500百万美元。其产品主要在美国西南部出售,包括热狗、培根、早餐肉肠、生鲜猪肉、火腿、午餐肉及烟熏香肠。
万洲国际表示,收购Clougherty将使史密斯菲尔德获得既有的具盈利能的业务、生鲜肉及肉制品的客户,以及直接进入美国西岸市场的通道,这将扩充并加强密斯菲尔德的垂直整合供应链。
S828.2
B
1673-4645(2016)12-0059-04
2016-12-06
猪高繁殖力关键基因高通量筛选及新基因鉴定(2014JY0086)
刘锐,女,博士,副研究员,研究方向为畜禽分子遗传育种;Email:liuruicau@126.com
