挤压膨化脱脂处理对高温豆粕制备蛋白多肽抗氧化性的影响
2016-12-26齐宝坤隋晓楠马文君王中江江连洲王胜男
齐宝坤 隋晓楠 马文君 王中江 丁 俭 李 杨 江连洲 王胜男
(东北农业大学食品学院,哈尔滨 150030)
挤压膨化脱脂处理对高温豆粕制备蛋白多肽抗氧化性的影响
齐宝坤 隋晓楠 马文君 王中江 丁 俭 李 杨 江连洲 王胜男
(东北农业大学食品学院,哈尔滨 150030)

挤压膨化 高温豆粕 多肽 抗氧化性
高温豆粕经过不同蛋白酶水解可降解为可溶性蛋白和多肽的混合物,通过进一步的分离纯化得到的豆粕多肽具有溶解性高、黏度低、稳定性强等功能特性及降血糖、降血压等生理活性[1]。此外,豆粕多肽还具有良好的抗氧化性[2]。近年来挤压膨化在油脂和生物活性肽的提取和制备方面都得到了较好的应用[3],在挤压膨化过程中,高温、高压和高剪切作用,使物料的结构和组织状态发生变化,其中蛋白质发生适度变性伸展,暴露出更多的作用位点,增加了对蛋白酶的敏感性,利于蛋白质水解成多肽[4]。同时,挤出物的理化性质和生物活性受到挤压膨化中物理作用与化学作用的共同影响[5]。Choudhury 等[6]研究了双螺杆挤压技术在抗氧化性食品上的应用,从显微结构上研究了膨胀比、剪切应力、剪切强度、密度和粘度与抗氧化性的关系。江连洲等[7]采用挤压膨化预处理水酶法提取大豆多肽,并应用响应面法对大豆挤压膨化后水酶法提取多肽的最佳工艺进行优化,比相同酶解条件下未经挤压膨化预处理大豆多肽得率有显著提高。
电子自旋共振(ESR)光谱仪,主要用于包含有未成对电子的顺磁性物质的研究,已在地质学、物理学、生物医药学等方面得到了广泛应用[8],特别是近些年来许多学者将ESR应用于测定抗氧化剂对自由基的清除作用,该方法主要应用于水溶性成分对自由基的清除活性。
为了提高豆粕蛋白资源的利用率,降低豆粕多肽的生产成本,提高豆粕多肽的抗氧化性,本试验利用酶法水解高温豆粕制备豆粕多肽,再通过超滤处理分离出不同分子质量的多肽,研究挤压膨化脱脂处理对高温豆粕制备蛋白多肽抗氧化性的影响,为高温豆粕的综合利用及抗氧化蛋白多肽的制备提供理论依据。
1 材料与方法
1.1 材料与仪器
大豆片:哈尔滨市九三油厂;Alcalase 2.4L 碱性蛋白酶:novo公司;电子自旋捕获剂(DMPO):Sigma公司;其他试剂均为分析纯。
双螺杆挤压机:东北农业大学工程学院农产品加工试验室自制;F2102型植物试样粉碎机:天津泰斯特仪器有限公司;电热恒温水浴锅:余姚市东方电工仪器厂;LDZ5-2型台式低速离心机:上海安亭科学仪器厂;LGJ-25型冷冻干燥机:上海医用科学仪器厂;DU800型紫外分光光度计:美国贝克曼库尔特有限公司;ESR 300E型波谱仪:德国布鲁克公司。
1.2 试验方法
1.2.1 工艺流程
大豆片→挤压膨化→脱脂→高温脱溶→高温豆粕→粉碎→豆粕粉→与水混合→酶解→灭酶→冷却→调pH4.5→离心分离→豆粕多肽溶液→超滤→真空浓缩→冷冻干燥→豆粕多肽
将原料大豆片经粉碎后,利用双螺杆挤压膨化机在不同条件下进行挤压膨化处理,然后采用乙醚对挤压膨化后的大豆片进行脱脂5 h,再放入90 ℃烘箱中高温脱溶1 d得到高温豆粕。将高温豆粕粉碎后,以1:10的料液比与水混合,调节混合液温度55 ℃、pH8.5,以20 000 U/g底物的加酶量加入Alcalase 2.4L碱性蛋白酶进行酶解4.5 h,迅速升温到90 ℃,灭酶10 min。然后冷却至室温,用1.0 mol/L的HCl溶液调节pH至4.5,4 000 r/min离心15 min,收集上清液即为豆粕多肽溶液。将豆粕多肽溶液依次通过分子质量为1 ku和3 ku的平板膜。在室温下,调节膜前压力为1 MPa,膜后压力为0.4 MPa,进行超滤处理,分别得到P1(分子质量>3 ku)、P2(分子质量1~3 ku)、P3(分子质量<1 ku)3种分子质量的豆粕多肽溶液,然后真空浓缩、冷冻干燥即得豆粕多肽。多肽得率为35%左右,将得到的多肽配成10 μg/mL的溶液进行抗氧化性分析。
1.2.2 挤压膨化工艺单因素试验
1.2.3 挤压膨化工艺响应面优化试验


表1 响应面试验因素水平表
1.2.4 豆粕多肽分子质量对其抗氧化性的影响
将得到的不同分子质量豆粕多肽P1(>3 ku)、P2(1~3 ku)、P3(<1 ku),分别配成10 ug/mL的多肽溶液,以磷酸盐缓冲溶液(PBS)作为对照,采用电子自旋共振(ESR)法测定豆粕多肽对·OH的清除作用。
1.3 测定方法


式中:A0表示空白组在波长322 nm的吸光度值;A1表示试样组在波长322 nm的吸光度值。
1.3.2抑制脂过氧化自由基(ROO·)能力的测定
采用亚油酸脂质过氧化体系法[10]。取50 μL多肽溶液与974 μL蒸馏水,26 μL亚油酸,2 mL无水乙醇,2 mL 50 mmol的pH 7.0的磷酸缓冲液混合,40 ℃暗处反应12 h。取上述混合物50 μL加入0.8 mL的蒸馏水、0.2 mL 8.1% SDS、1.5 mL 20% pH 3.5的醋酸溶液、1.5 mL 0.8%巴比妥酸。将上述反应液在100 ℃加热60 min,冷却,在532 nm处测定吸光度值,以空白作参比。抑制ROO·能力按公式计算:
式中:A0表示抗氧化剂空白样的吸光度;AS表示加抗氧化剂样品的吸光度。
1.3.3 电子自旋共振(ESR)法测定羟自由基(·OH)清除率
参照Rosen等[11]的方法。羟基自由基由Fenton反应产生。50 μL不同分子质量豆粕多肽样品或作为对照的等体积的pH7.4磷酸盐缓冲溶液(PBS)加入到50 μL 0.3 mol/L的DMPO和50 μL 10 mmol/L硫酸亚铁中,再加入50 μL 10 mmol/L过氧化氢溶液启动反应。将反应体系吸入密封的毛细管中,2.5 min后用Brucker ESR 300E波谱仪记录ESR图谱。测试条件:中心场强为351.194 mT,扫描宽度为10.00 mT,微波频率为9.858 GHz,功率为2.25 mW。豆粕多肽对·OH的清除作用以清除率(%)表示,计算公式:
式中:HX为不同分子质量豆粕多肽的ESR图谱信号强度;H0为对照组的ESR图谱信号强度。
1.4 数据处理
采用SPSS17.0、Origin85和Design-Expert进行统计分析及数据处理。
2 结果与分析
2.1 挤压膨化工艺单因素分析

图1 物料含水量对高温豆粕多肽抗氧化性的影响

图2 套筒温度对高温豆粕多肽抗氧化性的影响
2.2 挤压膨化工艺响应面分析

表2 响应面试验方案及结果

表2(续)

Y1=45.05+0.82A+1.16B+0.45C+0.55D+0.28AB+0.11AC+0.57AD+0.76BC+0.06BD-0.54CD-1.02A2-0.87B2-1.04C2-0.30D2

表清除能力的方差分析结果

抑制ROO·能力Y2通过统计分析软件Design-Expert进行数据分析,建立二次响应面回归模型为:
Y2=49.97+0.74A+0.40B+1.15C+0.61D+0.24AB+0.14AC+0.44AD+0.64BC-0.64BD+0.13CD-0.93A2-1.02B2-0.77C2-0.34D2
采用Design-Expert软件对方程进行方差分析,抑制ROO·能力Y2的方差分析结果见表4。
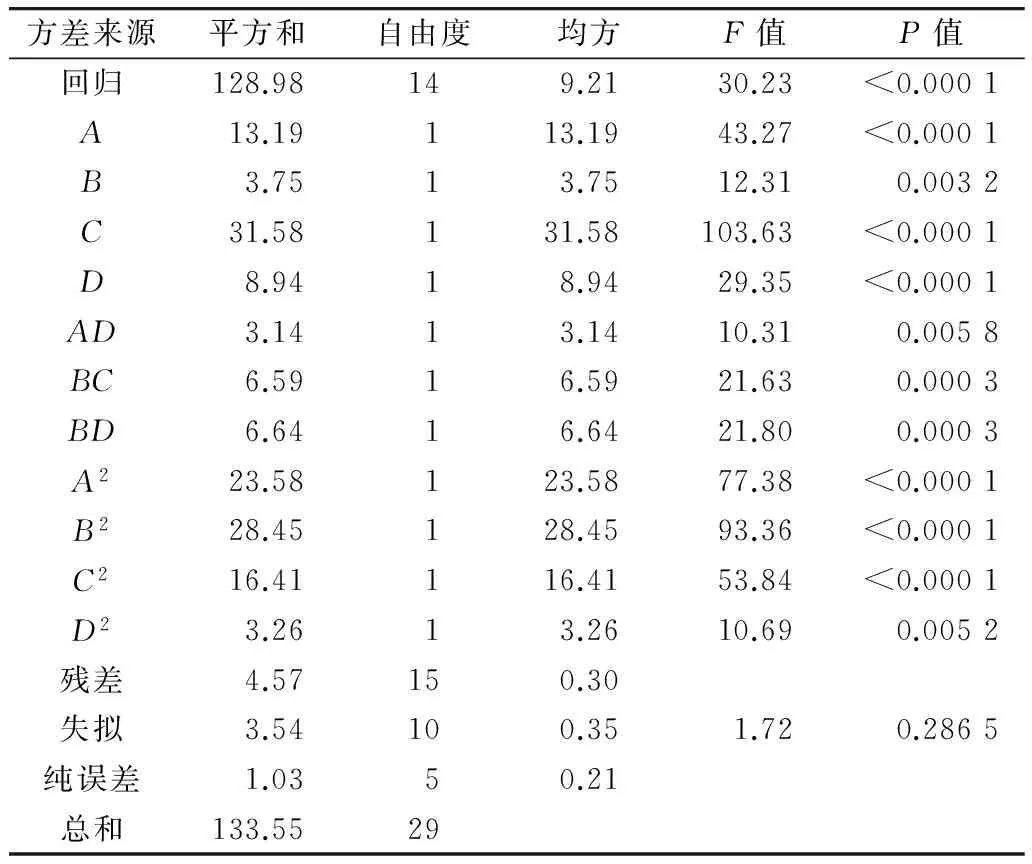
表4 抑制ROO·能力的方差分析结果
由表4可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(P<0.000 1),失拟项不显著(P>0.05),并且该模型R2=96.58%,说明96.58%的变化能通过这个模型解释,试验误差较小,模型成立,可以通过此模型对抑制ROO·能力进行预测和分析。由F检验可以得到因子贡献率为:C>A>D>B,即螺杆转速>物料含水量>模孔孔径>套筒温度。


2.3 豆粕多肽分子质量对其抗氧化性的影响
由图3可以看出,波谱呈现出典型的ESR测定·OH清除率的标准四峰情况。ESR法测定·OH清除能力,主要是考察ESR波谱中的第2峰的高度与空白对照品第2峰高度之间的关系。波谱中的第2峰越高,则清除能力越差,反之,第2个峰的高度越低,说明其清除能力越强[14]。通过·OH清除率公式的计算可知,当豆粕多肽分子质量分别为>3 ku、1~3 ku、<1 ku时,·OH清除率分别为67.56%、93.13%、99.00%,可见·OH清除率与豆粕多肽分子质量呈负相关。豆粕多肽分子质量<1 ku时,·OH清除率几乎达到100%,可见豆粕多肽对·OH有很好的清除能力,尤其是小分子质量多肽的·OH清除能力尤为显著。小分子质量多肽比大分子质量多肽具有更好的抗氧化活性,Saiyi Zhong等[15]研究表明,在其所研究的5个肽段中,小分子质量肽展现出了更好的抗氧化活性,其抗氧化活性与维生素E相似。
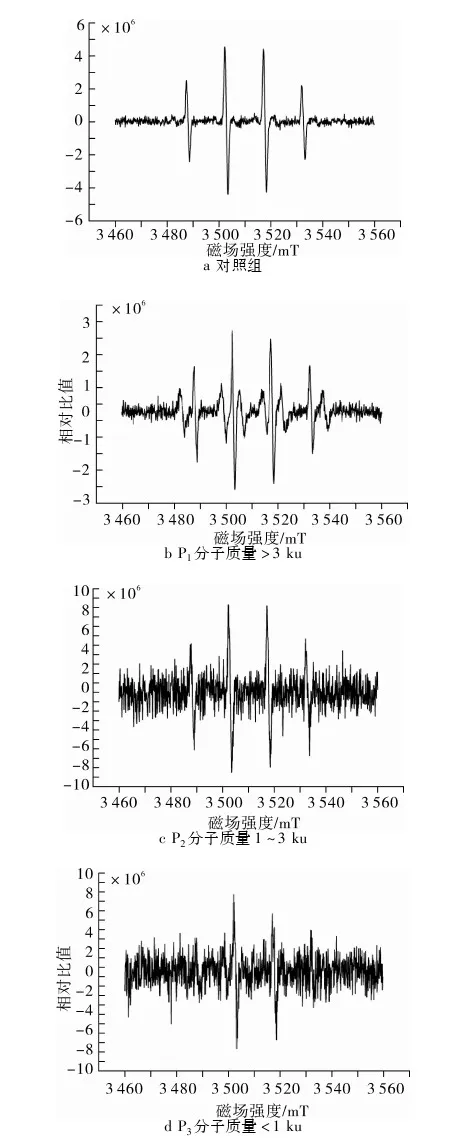
图3 不同分子质量豆粕多肽的ESR图谱
3 结论

[1]Schmidl M K, Taylor S L, Nordlee J A. Use of hydrolysatebased products in special medical diets[J]. Food Technology, 1994 10: 77-80
[2]俞伟辉, 阳建辉, 谭溪清,等. 酶法水解大豆蛋白的研究进展[J]. 饲料与畜牧,2008(8):26-28
Yu Weihui, Yang Jianhui, Tan Xiqing, et al. Research progress for enzymatic hydrolysis of soybean protein[J]. Feed and Husbandry, 2008(8):26-28
[3]Stephanie J, Abdullah A M. Low temperature dry extrusion and high-pressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J]. Food Chemistry, 2009,114: 947-954
[4]Lin Chen, Jianshe Chen, Jiaoyan Ren, et al. Modifications of soy protein isolates using combined extrusion pre-treatment and controlled enzymatic hydrolysis for improved emulsifying properties[J]. Food Hydrocolloids, 2011, 25(5): 887-897
[5]Mary E C. Chemical and Nutritional Changes in Food during Extrusion. In: Mian N. Riaz, Ph. D. edited. Extruders in Food Application[C]. New York, Technomic Publishing Company, 2000:127-142
[6]Choudhury M H, Chakraborty R, Raychaudhuri U. Application of twin screw extrusion technology for development of new generation snacks with antioxidant: An analysis[J]. Advances in Polymer Technology, 2013, 12(29): 24-32
[7]江连洲, 隋晓楠, 齐宝坤,等. 酶法水解大豆膨化料提取多肽的工艺[J]. 食品科学, 2011, 32(14): 161-164
Jiang Lianzhou, Sui Xiaonan, Qi Baokun, et al. Enzymatic Extraction of Peptides from Extruded Soybean[J]. Food Science, 2011, 32(14): 161-164
[8]Cheng H Y, Lin T C, Yu K H, Yang, et al. Antioxidant and free radical scavenging activities of terminalia chebula[J]. Biol Pharm Bull, 2003, 26(9): 1331-1335
[9]王莉娟, 陶文沂. 大豆肽体外抗氧化活性研究[J]. 生物加工过程, 2008, 7(4): 69-73
Wang Lijuan, Tao Wenyi. Anti-oxidative effect of soybean peptides in vitro[J]. Chinese Journal of Bioprocess Engineering, 2008, 7(4): 69-73
[10]Huamin C, Koji M, Fumio Y. Structural analysis of antioxidative peptides from soybean β-conglycinin[J]. J Agric Food Chem, 1995,43: 574-578
[11]Rosen G M, Rauckman E J, Packer I L. Spin trapping of superoxide and hydroxyl radicals[J]. Methods in Enzymology, 1984,105: 198-209
[12]Fujita Y, Noda Y. The effect of hydration on the thermal stability of ovalbumin as measured by means of differential scanning calorimetry[J]. Bulletin of the Chemical Society of Japan, 1981 54: 3233-3234
[13]Petra B W. Investigation of absorption-induced structural changes of proteins at solid/liquid interfaces by differential scanning calorimetry[J]. Thermochimica Acta, 2002, 382(1-2): 174-188
[14]Park P J, Je J Y, Kim S K. Free radical scavenging activities of differently deacetylated chitosans using an ESR spectrometer[J]. Carbohydrate Polymers, 2004,55: 17-22
[15]Saiyi Z, Changwei M, Young C L, et al. Antioxidant properties of peptide fractions from silver carp (Hypophthalmichthys molitrix) processing by-product protein hydrolysates evaluated by electron spin resonance spectrometry[J]. Food Chemistry, 2011,126: 1636-1642.
Effect of Extrusion Degreasing Process on Antioxidative Activity of Peptides Prepared by High Temperature Soybean Meal
Qi Baokun Sui Xiaonan Ma Wenjun Wang Zhongjiang Ding Jian Li Yang Jiang Lianzhou Wang Shengnan
(College of Food Science, Northeast Agricultural University, Harbin 150030)

extrusion, high temperature soybean meal, peptides, antioxidative activity
TS214.2
A
1003-0174(2016)12-0051-06
国家自然科学基金(31301501),黑龙江省教育厅自然科学基金面上项目(12531049),黑龙江省自然基金(QC2013C014),黑龙江博士后科研启动金(LBH-Q13018)
2015-04-16
齐宝坤,男,1986年出生,博士,粮食油脂及植物蛋白工程
江连洲,男,1960年出生,教授,粮食油脂及植物蛋白工程
