SENP3对大鼠成骨细胞端粒酶活性及端粒长度的影响
2016-12-26史素琴
史素琴, 潘 研, 岳 新, 赵 璐
(河南中医药大学 1第一附属医院, 2中医学博士后流动站, 第三附属医院博士后研发基地,河南 郑州 450008)
SENP3对大鼠成骨细胞端粒酶活性及端粒长度的影响
史素琴1, 潘 研1, 岳 新1, 赵 璐2△
(河南中医药大学1第一附属医院,2中医学博士后流动站, 第三附属医院博士后研发基地,河南 郑州 450008)
目的: 研究sentrin特异性蛋白酶3(SENP3)对大鼠成骨细胞端粒酶活性及端粒长度的影响。方法:首先0.2 mmol/L H2O2处理体外培养的大鼠成骨细胞后,Western blotting法检测SENP3及特异性蛋白1(Sp1)的表达。pcDNA3.0-SENP3转染成骨细胞,分别于24 h、48 h、72 h后采用四甲基偶氮唑蓝(MTT)法检测细胞活力的变化。转染48 h后,Western blotting法检测Sp1和端粒酶逆转录酶(TERT)的表达,PCR-TRAP法及PCR法检测端粒酶活性及端粒长度;ELISA检测上清中碱性磷酸酶(ALP)和骨桥蛋白(OPN)的含量;放射免疫法(RIA)检测骨钙蛋白(OCN)的含量。最后将pcDNA3.0-SENP3与siRNA-Sp1共转染成骨细胞,并检测以上指标。结果:H2O2处理成骨细胞后,SENP3和Sp1的表达显著上升。pcDNA3.0-SENP3转染成骨细胞后,Sp1和TERT的表达显著上升,细胞活力、ALP、OPN及OCN含量也都显著上升;端粒酶活性显著增加及端粒长度缩短显著延缓。而当pcDNA3.0-SENP3与siRNA-Sp1共转染成骨细胞后,细胞活力,ALP、OPN及OCN含量,端粒酶活性及端粒长度均未发生显著变化。结论:SENP1通过上调Sp1的表达促进TERT的表达,增加端粒酶活性上升及延缓端粒长度缩短,从而增强成骨细胞增殖能力。
Sentrin特异性蛋白酶3; 特异性蛋白1; 端粒酶逆转录酶; 成骨细胞; 端粒酶
成骨-破骨细胞在维持骨重建平衡中发挥重要的作用[1],正常情况下,二者保持平衡,但随着年龄的增长,成骨细胞的活性会随之降低,导致骨吸收大于骨形成,骨密度降低,最终形成骨质疏松[2]。由此可见,骨质疏松与衰老有一定的关系,而端粒酶在衰老过程中发挥重要的作用[3]。
端粒是染色体末端的一段富含G的DNA重复序列,在复制分裂过程中会逐渐丢失碱基对,导致端粒逐渐缩短,细胞发生老化。端粒酶(telomerase)则由端粒酶相关蛋白1(telomerase-associated protein 1,TEP1)、端粒酶RNA(telomerase RNA)和端粒酶逆转录酶(telomerase reverse transcriptase,TERT)组成,其中,TERT对端粒酶活性起着限速作用。
Sentrin特异性蛋白酶3(sentrin-specific protease 3,SENP3)是介导去小泛素样修饰物(small ubiquitin-like modifier,SUMO)化修饰的酶家族成员之一,主要功能是催化底物蛋白去除SUMO2/3,并进一步调节蛋白质的活性,尤其是对细胞内转录因子的调控[4]。研究报道,轻度的氧化应激条件下,SENP3蛋白水平即可显著增加,而且可通过去除转录因子特异性蛋白1(specificity protein 1, Sp1)的SUMO2/3修饰,进而增加Sp1的活性[5-7];而Sp1可以激活人TERT基因的表达,提高端粒酶活性,增加端粒长度[8],起到抗衰老的作用。在骨质疏松的发生发展过程中常伴有氧化应激的发生,氧化应激可抑制成骨细胞分化,抑制成骨细胞的矿化作用。因此,本文旨在探索SENP3是否可通过影响Sp1的活性,进而在骨质疏松中发挥抗衰老的作用,以期为治疗骨质疏松提供新的药物靶点及策略。
材 料 和 方 法
1 动物
24 h内新生的SD大鼠15只,购买于南京君科生物工程有限公司,合格证号为SCXK(沪)2013-0016。
2 主要试剂及材料
透明质酸酶、I型胶原酶、DMEM培养基、胰蛋白酶、胎牛血清、β-甘油磷酸钠、MTT和telomerase检测试剂盒均购于Sigma;巴比妥纳购于上海恒远生化试剂有限公司; H2O2购于上海谱振生物科技有限公司;Lipofectamine 2000购于Thermo Fisher;SENP3、Sp1、TERT等I抗购于Abcam;PVDF膜购于Millipore;脱脂奶粉购于南京生兴生物技术有限公司;ECL发光液购于碧云天生物技术有限公司;骨钙素放射免疫分析试剂盒购于上海研晶生物科技有限公司。
3 主要方法
3.1 成骨细胞的分离及培养 将出生24 h内的大鼠拉颈处死,用75%的乙醇消毒5 mim后,取其颅盖骨放入PBS中进行清洗,然后去除骨表面被膜和软组织,并将骨片剪成(1~3) mm×1 mm×1 mm大小,加入0.2% I型胶原酶和0.1%透明质酸酶进行消化,总共消化5次,每次20 min;收集第5次消化后的细胞悬液,1 000 r/min离心10 min,弃掉上清后,加入含10%胎牛血清的DMEM培养基重悬细胞,并接种于培养瓶中,于37 ℃、5% CO2的培养箱中进行培养,24 h后换液,待细胞铺满至80%时,加入0.25%的胰酶进行消化,即为原代成骨细胞,于倒置相差显微镜下观察细胞形态。
3.2 碱性磷酸酶(alkaline phosphatase,ALP)染色法鉴定成骨细胞 将无菌的玻片放入培养瓶中,传代时加入适量的细胞悬液,待细胞长满玻片后取出。用PBS冲洗后加入冷丙醇固定10 min,蒸馏水冲洗多次;将其放入现配的ALP孵育液(3% β-甘油磷酸钠5 mL,2%巴比妥纳5 mL,2% CaCl210 mL,2% MgSO41 mL,蒸馏水10 mL)中,于37 ℃孵育4~6 h;蒸馏水清洗数次后,在2%硝酸钴中浸泡3~5 min,蒸馏水清洗;再置于1%硫化铵中2 min,蒸馏水清洗,晾干,封固,于光镜下观察。
3.3 H2O2处理成骨细胞诱导氧化应激状态 将对数期生长的成骨细胞,用0.25%胰酶消化后,加入终浓度为0.2 mmol/L 的H2O2,继续培养24 h诱导氧化应激状态,并用于后续实验。
3.4 重组pcDNA3.0-SENP3载体转染成骨细胞 重组pcDNA3.0-SENP3质粒由辉骏生物科技有限公司构建。所用细胞为H2O2处理细胞。实验分为pcDNA3.0-SENP3转染组、pcDNA3.0空载转染组(pcDNA3.0 vector组)和未转染组[即空白对照(blank control, BC)组]。将培养的成骨细胞以每孔1×106接种于6孔培养板中,待其长满后取出。吸取鉴定后的pcDNA3.0-SENP3质粒20 μL,Lipofectamine 2000 100 μL,不含胎牛血清的DMEM培养基1 mL,均匀混合后,室温下静置15 min。然后将质粒、脂质体混合物转移到培养瓶中,每孔300 μL,再将其放入37 ℃、5% CO2培养箱中继续培养,未转染组则加入等量的DMEM培养液,每组均重复3孔,并设置3次独立重复试验。
3.5 pcDNA3.0-SENP3 与Sp1-siRNA共转染成骨细胞 重组Sp1-siRNA由辉骏生物科技有限公司构建合成。所用细胞为H2O2处理细胞。实验分为未转染组(即BC组)、pcDNA3.0-SENP3+Sp1-siRNA转染组(pcDNA-SENP3+si-Sp1)和只加转染试剂组(mock组),将培养的成骨细胞以每孔1×106接种于6孔培养板中,待其长满后取出。吸取鉴定后的pcDNA3.1-SENP3质粒及Sp1-siRNA质粒共20 μL,Lipofectamine 2000 100 μL,不含胎牛血清的DMEM培养基1 mL,均匀混合后,室温下静置15 min。然后将质粒、脂质体混合物转移到培养瓶中,每孔300 μL,再将其放入37 ℃、5% CO2培养箱中继续培养,未转染组则加入等量的DMEM培养液,每组均重复3孔,并设置3次独立重复实验。
3.6 Western blotting实验 按照3.4与3.5步骤中所述各组进行转染,48 h后,将细胞于冰上放置30 min,12 000 ×g离心10 min。将30 mg总蛋白加入到10% 的SDS-PAGE凝胶中进行电泳,再将蛋白转至PVDF膜上,经5% 脱脂奶粉封闭后,加入相应的 I 抗(SENP3、Sp1和TERT)于4 ℃孵育过夜,然后加II抗室温孵育1 h后,利用ECL液显影,扫描仪成像。
3.7 MTT法检测细胞活力 取对数期生长的细胞(H2O2处理),以1×106/L的浓度接种于96孔培养板中,每孔200 μL,按照3.4和3.5步骤中所述各组进行转染。每组均重复5个孔,并进行独立重复实验3次。分别于转染后的24、48和72 h后向各孔加入20 μL MTT溶液,继续培养4 h后,弃掉上清后加入150 μL的DMSO,于酶标仪490 nm处测吸光度(A)值。
3.8 TRAP-PCR法检测端粒酶活性 按照3.4与3.5中所述转染细胞48 h后,分别收集细胞。严格按照TRAP-PCR试剂盒说明书进行操作。先提取细胞端粒酶,然后进行PCR扩增,再进行聚丙烯酰氨凝胶电泳,最后银染,用Fragment Manager凝胶分析仪进行分析。
3.9 PCR法测定端粒长度 按照3.4与3.5所述转染细胞48 h后,提取细胞总DNA,按照李杰华等[9]所述进行操作。上游引物序列为5’-TTAGGG-3’,下游引物为5’-CCCTAA-3’。反应程序为:94 ℃ 50 s, 55 ℃ 50 s,72 ℃ 2 min,30 个循环;72 ℃ 10 min。反应完后,向45 μL PCR产物中加入90 μL 无水乙醇,28 μL 乙酸铵,放于-20 ℃冰箱反应20 min后,4 ℃、12 000 r/min离心20 min,去掉上清,加入50 μL TE缓冲液溶解沉淀,然后加入灭菌的双蒸水到200 μL,最后于260 nm处测定紫外吸收值,进行定量分析。
3.10 ELISA法检测ALP和骨桥蛋白(osteopontin,OPN)的含量 ALP和OPN的检测按照其相应的ELISA试剂盒说明书进行操作。
3.11 放射免疫法(radioimmunoassay,RIA)检测骨钙蛋白(osteocalcin,OCN)含量 按照3.4与3.5中所述进行转染,48 h后收集各组细胞,按照[125I]OCN放射免疫分析试剂盒说明书进行操作。
4 统计学处理
数据采用SPSS 13.0统计软件进行分析,所有数据均以均数±标准差(mean±SD)表示。两组间均数比较采用Student’st检验,多组间均数比较采用单因素方差分析LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 成骨细胞的鉴定
倒置显微镜下观察成骨细胞,显示细胞大多数呈梭形,有突起;ALP染色可见细胞中有灰黑色颗粒状或块状沉淀,胞质染色较为明显,见图1。

Figure 1.Identification of osteoblasts (×200). A: the osteoblasts were observed under inverted microscope; B: the osteoblasts were identified using ALP staining.
图1 成骨细胞的鉴定图
2 H2O2处理成骨细胞后对SENP3和Sp1表达的影响
首先,我们用H2O2处理成骨细胞,利用Western blotting法检测轻度氧化应激状态下成骨细胞中SENP3和Sp1的表达。结果显示与对照组相比较,H2O2处理后SENP3和Sp1的表达都显著上升(P<0.05),见图2。
3 过表达SENP3对成骨细胞活力的影响
用MTT实验检测过表达SENP3后对成骨细胞活力的影响。结果显示与对照组相比较,成骨细胞转染SENP3 24 h、48 h及72 h后,细胞活力显著上升(P<0.05),见图3。
4 过表达SENP3对ALP、OCN和OPN含量的影响
与对照组相比较,过表达SENP3 48 h后,成骨细胞的ALP、OCN及OPN的含量显著上升(P<0.05),见图4。

Figure 2.The effect of H2O2on the protein expression of SENP3 and Sp1 in the osteoblasts determined by Western blotting. Mean±SD.n=3.*P<0.05vsblank control (BC).
图2 Western blotting法检测H2O2对成骨细胞中SENP3和Sp1表达的影响
5 过表达SENP3对Sp1和TERT表达的影响
与对照组相比较,将过表达载体pcDNA3.0-SENP3转染到成骨细胞后 Sp1和TERT的表达显著上升(P<0.05),见图5。

Figure 3.The effect of overexpression of SENP3 on the viability of osteoblasts measured by MTT assay. Mean±SD.n=5.*P<0.05vsblank control (BC).
图3 MTT法测定过表达SENP3对成骨细胞活力的影响
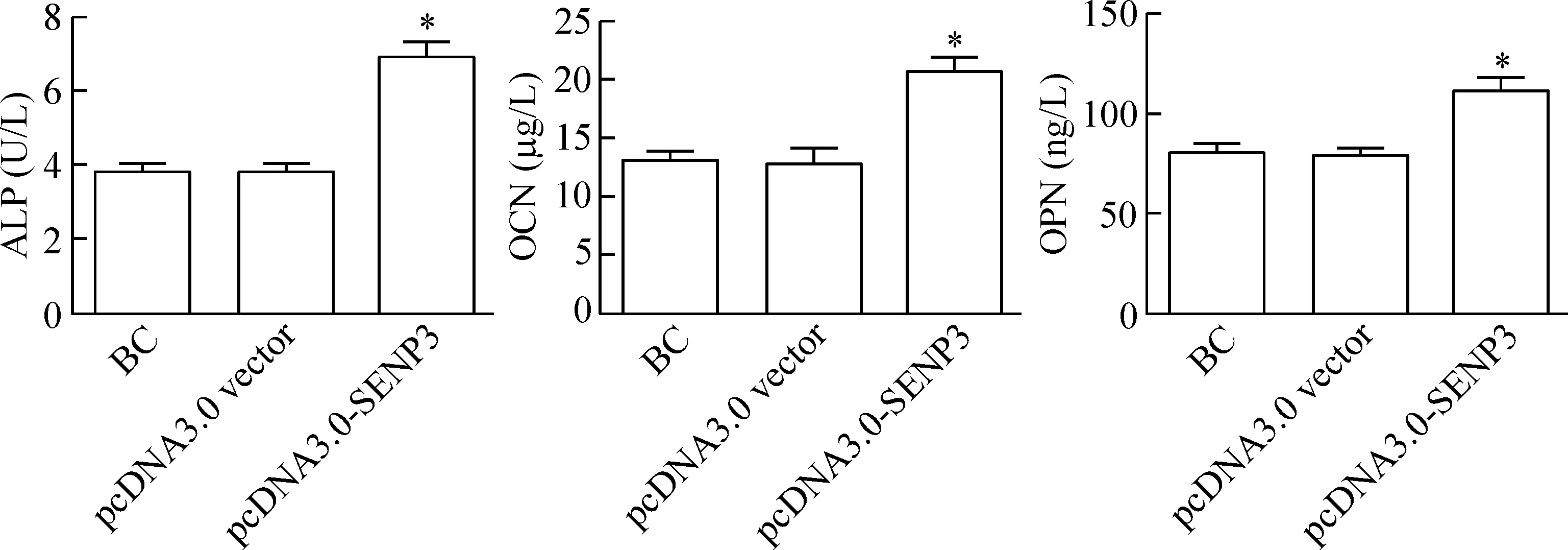
Figure 4.The effects of overexpression of SENP3 on the concentrations of ALP, OCN and OPN in the osteoblasts. Mean±SD.n=3.*P<0.05vsblank control (BC).
图4 过表达SENP3对成骨细胞中ALP、OCN以及OPN含量的影响

Figure 5.The effects of overexpression of SENP3 on the expression of Sp1 and TERT in the osteoblasts determined by Western blotting. Mean±SD.n=3.*P<0.05vsblank control (BC).
图5 Western blotting法检测成骨细胞过表达SENP3对Sp1和TERT表达的影响
6 过表达SENP3对端粒酶活性及端粒长度的影响
与对照组相比较,过表达SENP3后端粒酶活性显著上升(P<0.05),为对照组的1.90倍;端粒长度缩短显著延缓(P<0.05),为对照组的2.04倍,见图6。
7 共转染pcDNA3.0-SENP3与siRNA-Sp1对成骨细胞的影响
为了研究SENP3是否是通过促进Sp1的表达,进而增加端粒酶活性及端粒长度,我们将pcDNA3.0-SENP3与siRNA-Sp1共转染成骨细胞,结果发现,与对照组相比较,共转染pcDNA3.0-SENP3与siRNA-Sp1后,细胞活力变化的差异无统计学显著性,ALP、OCN及OPN的含量,Sp1与TERT的表达,端粒酶活性及端粒长度也无明显变化,见图7。
讨 论
成骨能力下降而骨吸收加快是骨质疏松的主要病理基础,成骨细胞的增生和产生新生骨质又是骨折愈合的基础,因此,促进成骨细胞增殖,改善成骨细胞功能对治疗骨质疏松具有重要的意义[10-11]。

Figure 6.The effects of overexpression of SENP3 on the activity of telomerase and the length of telomere in the osteoblasts. A: the activity of telomerase was measured by TRAP-PCR; B: the length of telomere was measured by PCR. Mean±SD.n=3.*P<0.05vsblank control (BC).
图6 成骨细胞过表达SENP3对端粒酶活性及端粒长度的影响

Figure 7.siRNA-Sp1 (si-Sp1) reversed the effect of pcDNA3.0-SENP3 (pcDNA-SENP3) on the osteoblasts. Mean±SD.n=3.*P<0.05vsblank control (BC).
图7 siRNA-Sp1可反转pcDNA3.0-SENP3对成骨细胞的作用
SENP3为SUMO化特异性蛋白酶家族成员之一,已有研究证明,在氧化应激状态下,SENP3的表达显著上升[12],而且与细胞增殖相关,如SENP3在氧化应激状态下不但可促进人脐静脉内皮细胞、小鼠胚胎成纤维细胞和HeLa细胞增殖,而且还可以促进前骨髓细胞癌细胞的增殖[13];本文研究结果也表明,成骨细胞在轻度氧化应激状态下,SENP3的表达显著升高,而且,过表达SENP3后可显著增强成骨细胞的活力,成骨细胞标志蛋白ALP、OCN及OPN含量也显著上升;而对照组细胞活性较小,可能因为其细胞分化程度较低,与前研究结果一致,如张永青[14]成功分离培养出1日龄大鼠的成骨细胞,经不同浓度黄芪甲苷处理后,其可显著促进成骨细胞的增殖,而对照组则相对较低。可见,SENP3可通过促进成骨细胞的活性,进而在骨质疏松中发挥一定的作用。
衰老是骨质疏松症的一个重要病因,而在这一过程中,常伴随着端粒的丢失,端粒酶活性的下降,端粒酶活性却主要依赖于TERT的表达水平。如Yudoh等[15]将人TERT基因转染到人成骨细胞NHOst 54881中后可显著增加端粒酶活性。芮钢等[16]将hTERT稳定转染到成骨细胞中,能显著增加成骨细胞的寿命,防治细胞老化并保持成骨细胞的功能特性。因此,对端粒酶活性的研究已成为抗骨质疏松的热点。Sp1是一种含锌指结构的转录因子,且研究证明Sp1参与调控了TERT的表达,如Sp1可增加皮肤角化细胞中hTERT的表达和端粒酶活性[8];而在轻度的氧化应激状态下,SENP3又可促进Sp1的表达[5-6],本文研究结果也表明,H2O2处理成骨细胞后,过表达SENP3,Sp1的表达显著上升,其次,端粒酶活性显著增加及端粒长度缩短延缓;而当pcDNA3.0-SENP3与siRNA-Sp1共同转染成骨细胞后,结果显示细胞活力、成骨细胞标志蛋白含量、Sp1的表达以及端粒酶活性、端粒长度均未发生显著变化,由此可见,SENP3可通过促进 Sp1的表达,进而增加端粒酶活性,延缓端粒长度的缩短。
综上所述,本文在细胞水平上证明SENP3可通过诱导成骨细胞中Sp1的转录活性,进而增加端粒酶活性,延缓端粒长度的缩短,为预防老年性骨质疏松提供了新的治疗靶点及理论依据,然而,SENP3抗骨质疏松的具体作用机制还有待进一步的研究。
[1] Albert JS, Bhattacharyya N, Wolfe LA, et al. Impaired osteoblast and osteoclast function characterize the osteoporosis of Snyder-Robinson syndrome[J]. Orphanet J Rare Dis, 2015, 10(1):1-13.
[2] 杲 丽, 胡成虎, 金 岩. 骨髓间充质干细胞在小鼠早衰性骨质疏松中的细胞生物学功能研究[J]. 中国病理生理杂志, 2013, 29(4): 707-712.
[3] 李 颖. 端粒酶与骨质疏松[J]. 中国骨质疏松杂志, 2007, 13(4): 288-292.
[4] Ren YH, Liu KJ, Wang M, et al. De-SUMOylation of FOXC2 by SENP3 promotes the epithelial-mesenchymal transition in gastric cancer cells[J]. Oncotarget, 2014, 5(16): 7093-7104.
[5] Wang M, Sang J, Ren Y, et al. SENP3 regulates the global protein turnover and the Sp1 level via antagonizing SUMO2/3-targeted ubiquitination and degradation[J]. Protein Cell, 2016, 7(1): 63-77.
[6] 王 铭, 桑 晶, 易 静. 氧化应激条件下SENP3通过调节Sp1的SUMO2/3修饰促进其稳定[C]//中国细胞生物学学会. 中国细胞生物学学会2013年全国学术大会·武汉论文摘要集. 2013:208.
[7] 储慧玲, 颜琼宇, 刘科家, 等. SENP3对不同程度氧化应激的感受和应答[J]. 中国细胞生物学学报, 2015, 37(7): 946-953.
[8] Bisson F, Paquet C, Bourget JM, et al. Contribution of Sp1 to telomerase expression and activity in skin keratinocytes cultured with a feeder layer[J]. J Cell Physiol, 2015, 230(2): 308-317.
[9] 李杰华, 霍力为, 喻永新, 等. 补肾健脾活血方药对成骨细胞端粒酶活性及长度的实验研究[J]. 医学信息, 2010, 23(6): 1840-1842.
[10]An J, Yang H, Zhang Q, et al. Natural products for treatment of osteoporosis: the effects and mechanisms on promoting osteoblast-mediated bone formation[J]. Life Sci, 2016, 147: 46-58.
[11]张荣华, 舒晓春. 中药复方补肾活血液对成骨细胞影响的实验研究[J]. 中国病理生理杂志, 2003, 19(6): 769-772.
[12]Yang YQ, Li H, Zhang X, et al. Expression and cell distribution of SENP3 in the cerebral cortex after experimental subarachnoid hemorrhage in rats: a pilot study[J]. Cell Mol neurobio, 2015, 35(3): 407-416.
[13]Han Y, Huang C, Sun X, et al. SENP3-mediated de-conjugation of SUMO2/3 from promyelocytic leukemia is correlated with accelerated cell proliferation under mild oxidative stress[J]. J Biol Chem, 2010, 285(17): 12906-12915.
[14]张永青. 黄芪甲苷对体外培养成骨细胞增殖与分化影响的实验研究[D]. 济南:山东中医药大学, 2014.
[15]Yudoh K, Matsuno H, Nakazawa F, et al. Reconstituting telomerase activity using the telomerase catalytic subunit prevents the telomere shorting and replicative senescence in human osteoblasts[J]. J Bone Miner Res, 2001, 16(1):1453-1464.
[16]芮 钢, 王者生, 刘戈飞, 等. 人端粒酶反转录酶稳定转染成骨细胞构建组织工程骨的实验研究[J]. 中国组织工程研究, 2004, 8(14): 2613-2615.
(责任编辑: 陈妙玲, 罗 森)
Effects of SENP3 on activity of telomerase and length of telomere of rat osteoblasts
SHI Su-qin1, PAN Yan1, YUE Xin1, ZHAO Lu2
(1TheFirstAffiliatedHospital,2PostdoctoralMobileStationofTraditionalChineseMedicine,PostdoctoralResearchandDevelopmentBaseoftheThirdAffiliatedHospital,HenanUniversityofTraditionalChineseMedicine,Zhengzhou450008,China.E-mail:zhaolu.cn@163.com)
AIM: To analyze the effect of sentrin-specific protease 3 (SENP3) on the activity of telomerase and the length of telomere of rat osteoblasts. METHODS: The rat osteoblasts was treated with 0.2 mmol/L H2O2. The expression of SENP3 and specificity protein 1 (Sp1) was detected by Western blotting. The rat osteoblasts were transfected with pcDNA3.0-SENP3. The viability of the osteoblasts was evaluated by MTT assay. The concentrations of alkaline phosphatase (ALP) and osteopontin (OPN) were measured by ELISA. Osteocalcin (OCN) was measured by RIA. The expression of Sp1 and telomerase reverse transcriptase (TERT) were determined by Western blotting. The activity of telomerase was analyzed by PCR-TRAP method. The length of telomere was detected by PCR. pcDNA3.0-SENP3 and siRNA-Sp1 were co-transfected into osteoblasts, and the above indicators were measured. RESULTS: After the osteoblasts were treated with H2O2, the expression of SENP3 and Sp1 was significantly increased. After pcDNA3.0-SENP3 was transfected into the osteoblasts, the expression of Sp1 and TERT, the cell viability, and the concentrations of ALP, OCN and OPN were all dramatically increased. The activity of telomerase and the length of telomere were significantly enhanced. However, once pcDNA3.0-SENP3 and siRNA-Sp1 were co-transfected into the osteoblasts, no significantly change of above indicators was observed.CONCLUSION: SENP3 increases the expression of TERT through increasing the expression of Sp1, leading to the increase in the activity of telomerase and the length of telomere, finally enhances the viability of osteoblasts.
Sentrin-spectific protease 3; Specificity protein 1; Telomerase reverse transcriptase; Osteoblasts; Telomerase
1000- 4718(2016)11- 2043- 06
2016- 05- 07
2016- 08- 22
R681
A
10.3969/j.issn.1000- 4718.2016.11.021
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 15829303233; E-mail: zhaolu.cn@163.com
