真空辅助旋切活检与开放切除活检在临床触诊阴性乳腺病灶中的应用比较
2016-12-26何俊玲罗华杨慧芬胡祖健苏昆仑杨欧欧刘玲琳蓝天徐海滨
何俊玲 罗华 杨慧芬 胡祖健 苏昆仑 杨欧欧 刘玲琳 蓝天 徐海滨
真空辅助旋切活检与开放切除活检在临床触诊阴性乳腺病灶中的应用比较
何俊玲 罗华 杨慧芬 胡祖健 苏昆仑 杨欧欧 刘玲琳 蓝天 徐海滨
随着科学技术的发展,越来越多的临床触诊阴性的乳腺病灶(nonpalpable breast lesion,NPBL)被发现。NPBL是指通过彩色超声、X线、MRI等检查发现而临床体检不可触及的乳腺病变。有资料显示美国每年有500 000例NPBL被发现[1]。另据统计在NPBL中约有27%为恶性病变[2]。随着超声高频探头及乳腺全容积成像在乳腺检查中的广泛应用,临床上发现了许多NPBL,这些病灶可通过术中超声定位下的真空辅助旋切活检(vacuum assisted biopsy,VAB)或开放切除活检来明确诊断。但对这两种活检方法的优劣尚有不同看法,对此笔者进行了研究,现将结果报道如下。
1 对象和方法
1.1 对象 本院2013至2014年间经超声检查发现的NPBL行活检的149例患者共214个病灶,均为女性。60例患者行VAB,其中单发42例,多发18例;中位年龄36岁(20~69岁);共有83个病灶,长径0.3~1.6cm,平均(0.975±0.290)cm;病灶超声乳腺影像报告及数据系统(Breast Imaging Reporting and Data System,BIRADS)评分2级2个,3级56个,4A级25个。89例患者行开放切除活检,其中单发59例,多发30例;中位年龄43岁(23~82岁);共有131个病灶,长径0.3~3.6cm,平均(1.164±0.452)cm;病灶超声BI-RADS评分2级3个,3级89个,4A级36个,4B级3个。
1.2 仪器设备 ALOKA prosound SSD-a5超声诊断仪(日本阿洛卡有限公司);SonoSite(S-Nerve)超声诊断仪(美国索诺声有限公司);536 L形术中超声探头(4-13 MHz)(日本阿洛卡有限公司);Mammotome(SCM23型,美国强生有限公司)及Encor真空辅助旋切系统(ENCSYS-US,美国巴德有限公司)。
1.3 操作方法 术前超声检查行结节体表标记定位;椎旁神经阻滞麻醉;选择合适体位,再次超声检查确认及定位;常规消毒铺巾。行VAB者,根据结节的位置及长径方向选择合适的穿刺点,将稀释的肾上腺素液局部浸润至结节表面及结节后方及穿刺针道组织内。在实时超声引导下将一次性旋切探针置入乳腺结节后方,以扇形进行旋切,直至结节在超声图像上完全消失,再向四周各旋切1条组织;取出旋切探针后再次超声探查残腔内有无病灶残留,挤出积血;术腔局部压迫3~5min,穿刺针口用蓝灵胶水粘合,术腔绷带加压包扎3~5d。行开放切除活检者,采用536 L形术中超声探头(该探头较小,可置入切口内,定位准确)对结节进行定位并选取合适切口,切开皮肤、皮下组织,在超声实时引导下完整切除结节,或区段切除包括结节在内的乳腺组织;再次超声检查以确认病灶包含在切除组织内,而残腔内无明显病灶残留;止血,缝合乳腺组织及皮肤切口;术腔绷带包扎1d。
1.4 观察指标 记录两组患者的病理检查结果,观察比较两组患者的手术时间、术后并发症发生情况及随访结果。
1.5 统计学处理 采用SPSS13.0统计软件,计量资料以表示,组间比较采用t检验;计数资料组间比较采用χ2检验。
2 结果
2.1 术后病理诊断 两组患者术后病理诊断(若1个病灶有多种病理诊断,以最主要的病理诊断为准)结果见表1。
由表1可见,两组患者的病理诊断无明显差别,纤维腺瘤占绝大多数。在VAB组患者中,良性病灶共80个;良性伴不典型导管上皮增生(atypical ductal hyperplasia,ADH)1个,该例轻度不典型增生患者拒绝行扩大切除术;恶性病灶2个(2例患者):1例为低度恶性分叶状肿瘤,1例为中级别导管内癌(ductal carcinoma in situ,DCIS)。分叶状肿瘤患者再行扩大切除发现残腔有少许纤维样瘤组织成分;DCIS患者再行保留乳头乳晕的皮下腺体切除+前哨淋巴结活检+一期假体重建术,术后病理示残腔旁见中级别DCIS残留约0.5cm。另有1例良性患者因冷冻切片示上皮乳头状增生倾向低级别DCIS,常规病理检查示腺病伴导管上皮乳头状增生及筛状增生,未见DCIS。遂再行扩大切除术,术后病理检查示腺病伴小区有纤维腺瘤形成趋势、局灶导管上皮实体筛状增生及基底样细胞显著增生。该3例VAB后再行开放切除手术的患者,2例发现残腔有肿瘤细胞残留。在开放切除活检病例中,良性病灶共127个;良性伴ADH 1个;恶性病灶3个(3例患者),均为浸润性导管癌(invasive ductal carcinoma,IDC)。1例IDC患者病灶最大径约0.4cm,家属要求行改良根治术;另1例IDC患者病灶最大径1.5cm,行保乳+前哨淋巴结活检术;第3例IDC患者,病灶最大径0.6cm,行改良根治术+背阔肌转移皮瓣+假体重建术。该3例患者再手术后病理检查原残腔均未发现肿瘤细胞残留。
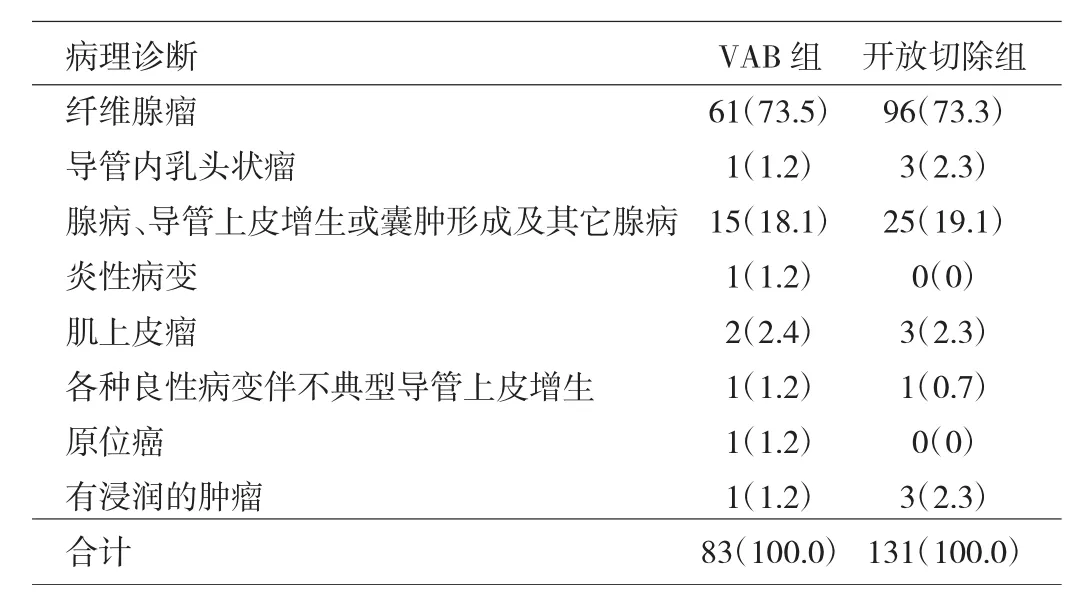
表1 两组患者NPBL的病理诊断[个(%)]
2.2 手术时间 由于多发病灶者难以比较手术时间,故只对单发病灶者统计手术时间,手术时间从肾上腺素局部浸润开始至穿刺口粘合结束,或从切开皮肤开始至切口缝合结束。VAB组中,有42例为单发病灶,手术时间约8~40min,平均(18.05±5.35)min。开放切除组中,有59例为单发病灶,手术时间约15~50min,平均(33.80±7.02)min。VAB组手术时间明显短于开放切除组(t=12.795,P<0.01)。
2.3 手术并发症 VAB组发生局部血肿3例,皮下明显瘀斑4例,局部略凹陷3例,胸大肌组织切入3例,无切口感染。所有血肿行冷敷及加压包扎后未再增大,3个月后复查均已吸收。开放切除组发生皮下瘀斑1例,局部略凹陷3例,无局部血肿、切口感染等。VAB组出血发生率为11.7%(7/60),开放切除组为1.1%(1/89),VAB组发生出血的概率较开放组高(χ2=5.90,P<0.05)。但这些血肿均不需行开放止血,经局部加压包扎,先冷敷,后热敷等处理后均能吸收。两组局部凹陷、胸大肌组织切入发生率的差异均无统计学意义(χ2=0.005﹑2.361,均P>0.05)。
2.4 随访结果 VAB组患者获得超声检查随访38例,随访率63.3%(38/60),中位随访时间18个月(3~25个月)。其中36例良性病变中,有7例原发灶部位发现小结节,考虑残留或复发,残留复发率为19.4%(7/36),因超声BI-RADS分级为3级,未再行手术治疗,继续随访;2例原发灶附近发现小结节;3例原发灶部位发现小囊肿形成,考虑术后改变;2例回声改变,考虑为瘢痕组织;1例其它部位再发结节。另2例恶性病变患者未发现复发及转移。开放切除组患者获得超声检查随访67例,随访率75.3%(67/89),中位随访时间15个月(3~26个月)。其中65例良性病变中有2例原发灶部位发现小结节,考虑残留或复发,残留复发率为3.1%(2/65),因超声BI-RADS分级为3级,未再行手术治疗,继续随访;1例术后16个月原发灶附近(非原发部位)发现小结节,超声BI-RADS分级为4A级,遂再行超声定位下开放切除术,病理诊断为IDC,遂行乳癌改良根治术;4例患者同侧乳房其它部位或对侧乳腺发现小结节。3例恶性病变患者2例获得随访,未发现复发及转移。VAB组的残留复发率较开放切除组高(χ2=5.76,P<0.05)。
3 讨论
有文献报道称NPBL中27%是乳腺癌,其中浸润性癌占39%,而且在这些乳腺癌患者中已有11.3%发生腋窝淋巴结转移[2]。因此,针对超声发现的NPBL,需酌情进行临床处理,主要手术方式为术中超声定位下VAB与开放切除活检两种。分析本院近年来针对NPBL所做的处理,笔者发现两种活检方法各有优缺点。
3.1 手术时间 VAB明显短于开放切除活检,究其原因在于VAB减少了切口缝合及手术时寻找病灶的时间。笔者的体会是:对于病灶没有包膜,与周边组织分界不清者,开放切除的手术时间会大大延长,这部分患者寻找病灶需较长时间,为求完整切除,往往需行区段切除,加上缝合切口的时间,故总的手术时间明显延长;但对于那些结节包膜完整、回声非常清晰的患者,因寻找病灶方便,开放切除的时间也非常短,2~5min就可切除病灶,主要为切口皮内缝合的时间。VAB手术时间确实较短,但包扎需时相对较长,因为术毕先要压迫数分钟,然后放置较多纱布或棉垫,绷带加压包扎过程中,要保证不移位,才能保证包扎确切有效。但总的来说,VAB相对于开放切除活检在手术时间上有明显的优势[3]。
3.2 手术切口 VAB穿刺口只有0.5cm,这是开放切除活检无法比拟的。开放切除活检因病变不可触及,一般切口≥2.0cm。行VAB的患者待血肿及瘀斑吸收后,仅少部分患者局部略有凹陷之外,由于没有明显的切口瘢痕,远期美容效果明显较开放切除活检好。
3.3 手术并发症 VAB最主要的并发症是出血及病灶残留。本文两组的出血发生率分别为11.7%、1.1%,VAB组较开放切除组明显为高。Abbate等[4]报道VAB后有8.5%的血肿发生率。张爱玲等[5]报道VAB后并发血肿者占4.66%,皮下瘀斑者占2.67%,局部病灶残留者占0.14%。出血发生率与本研究结果一致。张爱玲的报道中只有2例病灶残留,但为超声检查所见,真实情况需要再行开放切除残腔并行病理检查才能明确。本研究中有3例VAB后再行开放切除的患者,超声检查虽未探及病灶残留,但后续的开放切除术中还是发现了2例患者有肿瘤细胞残留,残留率66.7%。李顺荣等[6]对VAB发现的13例乳腺癌患者,再次行开放手术,病理检查提示6例患者有癌组织残留,残留率46.2%,与本研究结果一致。若病灶为恶性,后续的手术治疗时发现残留率相当高。VAB发现的乳腺癌,还存在针道种植问题。本研究中2例乳腺恶性肿瘤患者在后续治疗中未发现肿瘤细胞针道种植,可能与收集的病例数太少有关。李顺荣等在上述13例乳腺癌患者的穿刺针道中亦未检出癌细胞。也有文献报道:VAB后的外科切除标本中23%存在癌细胞针道种植,但在接受系统治疗后,局部复发率并未增高,这可能与宿主的免疫系统清除了孤立的肿瘤细胞和术后系统综合治疗有关[7]。所以VAB明确诊断的乳腺恶性肿瘤,无需担心病灶残留及针道种植的问题,因为可通过后续的治疗予以解决。对于良性病变的残留及复发问题,由于无法确切估计,只能在随访中以超声检查所见的残留复发率来间接提示。本研究中,VAB组的残留复发率较开放切除组高(19.4%与3.1%),亦有文献报道,VAB患者32.6%的病灶有残留[4]。Povoski等[8]报道在VAB完全切除组中,中位随访时间6个月,超声复查也发现有较高的病灶残留率(约11%)。
3.4 手术创伤 对一般的NPBL而言,由于VAB不需要切开皮肤,手术定位准确,不必切除过多的乳腺组织,故手术创伤比开放切除术要小。但对于结节包膜完整,回声非常清晰的小病灶患者,因VAB不管病灶多小,每条组织切除长度仍需约2.0cm,所以对该类患者,开放切除活检创伤更小。任晖等[9]亦认为:对于未婚、未育者,若肿瘤位于乳晕或多发,一位技术精良的乳腺外科医生行开放切除手术会比VAB手术对乳腺导管损伤更小。
3.5 术后病理结果 Meloni等[10]对73例NPBL进行了超声引导下的VAB,其准确率为97.3%,灵敏度为94.7%,特异度为100.0%,阴性预测值为94.6%,阳性预测值为100.0%。对NPBL的治疗,VAB与开放切除活检均无假阴性或病理低估[3]。所以对VAB病理诊断的正确性无需置疑。本研究中VAB诊断乳腺恶性肿瘤的2例均无病理低估。但由于病灶已变为多条组织,影响病理科医生全面观察病灶,不利于对病灶大小的估计以及切缘的明确。在这方面VAB不如开放切除活检,但其在诊断方面有优势。另外,对VAB患者建议不行术中冷冻切片检查,这样可以减少组织量的损失,更有利于诊断。
综上所述,笔者认为,术中超声定位下VAB与开放切除活检各有优缺点,可根据患者具体情况作出最优选择。对超声发现的NPBL,若病灶边界清,考虑纤维腺瘤的可能性大,优先选择开放切除活检,手术切口不大,切除方便,手术创伤小,手术时间也短,而且可以完整切除,残留率低;若表现为边界不清的低回声结节或低回声区,则行VAB有更大的优势,病灶可以准确切除,手术切口和创伤小,术后美容效果好,手术时间短。对恶性病变,VAB只能起诊断作用,不能用于治疗,因为有比较高的肿瘤残留率。
[1] Al-SobhiS S,Helvie MA,Pass H A,et al.Extent oflumpectomy for breast cancer after diagnosis bystereotactic core versus wire localization biopsy[J].Ann Surg Oncol,1999,6(4):323-324.
[2] Marrujo G,Jolly P C,Hall M H.Nonpalpable breast cancer:needle-localized biopsy for diagnosis and considerations fortreatment[J].Am J Surg,1986,151(5):599-602.
[3] ChenSC,Yang HR,Hwang TL,etal.Intraoperative ultrasonographically guided excisional biopsy or vacuum-assisted core needle biopsy for nonpalpable breast lesions[J].Ann Surg,2003,238 (5):738-742.
[4] Abbate F,Cassano E,Menna S,et al.Ultrasound-guided vacuum-assisted breast biopsy:Use at the European Institute of Oncology in 2010[J].J Ultrasound,2011,14(4):177-181.
[5] 张爱玲,张蓉,张月欢,等.超声引导下麦默通微创旋切系统在乳腺病灶诊治中的应用 (附1761例报告)[J/CD].中华乳腺病杂志,2010,4(1): 84-89.
[6] 李顺荣,苏丹晨,萧俏珍,等.麦默通旋切系统切除乳腺癌13例[J].广东医学,2009,30(8):1099-1100.
[7] Diaz L K,Wiley E L,Venta L A.Are malignant cells displaced by large-gauge needle core biopsy of the breast[J].American JournalofRoentgenology,1999,173(5):1303-1313.
[8] Povoski S P,Jimenez R E.A comprehensive evaluation of the 8-gauge vacuum-assistedMammotome?System for ultrasoundguided diagnostic biopsy andselective excision of breast lesions [J].World J Surg Oncol,2007,5:83.
[9] 任晖,刘俊娥,刘颖.真空辅助活检装置常见问题的处理体会[J].西北国防医学杂志,2012,33(3):231-233.
[10] Meloni G B,Dessole S,Becchere M P,et al.Ultrasound-guided mammotome vacuum biopsy for the diagnosis of impalpable breastlesion[J].Ultrasound ObstelGynecol,2001,18(5):520-524.
2015-11-09)
(本文编辑:沈叔洪)
杭州市科技发展计划项目(20140733Q35)
310006 杭州市中医院乳腺外科
徐海滨,E-mail:haibin0512@126.com
