肺纤维化动物模型研究进展
2016-12-25,,
,,
(中南大学药学院药理学系,湖南 长沙 410078)
·文献综述·
肺纤维化动物模型研究进展
李燕飞,胡长平,李峰*
(中南大学药学院药理学系,湖南 长沙 410078)
肺纤维化是以肺泡上皮细胞损伤、肺成纤维细胞大量增殖和细胞外基质聚集增多为主要特征的一类严重肺间质疾病。然而,目前肺纤维化的发病机制尚不清楚,临床上的早期防治亦未获得突破性进展。为了阐明肺纤维化疾病的发病机制并寻找有效的治疗药物,已建立多种肺纤维化动物模型,主要分为基因相关模型与非基因相关模型,前者主要指基因工程动物模型,后者包括环境性、药物/毒物性及其他类型的动物模型。本文综述各种肺纤维化动物模型的最新建模方法、发病机制、应用范围及优缺点。
肺纤维化; 博来霉素; 动物模型
肺纤维化是一种严重的间质性肺疾病,其病理特点为肺泡上皮细胞损伤和增殖、基底膜剥蚀、肺泡实变和成纤维细胞病灶,并最终导致患者出现进行性呼吸困难、咳嗽、呼吸生理机能受限及气体交换障碍等症状[1]。肺纤维化按病因可分为原因已明和原因未明两大类,其中病因未明的特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是临床上最常见最严重的肺纤维化,具有高发病率和高死亡率的特点。IPF预后差,诊断后平均生存期仅3~5年。部分患者可出现IPF的急性恶化,呼吸困难(< 1个月)急性发作伴随组织缺氧加剧,最终呼吸衰竭而死亡[2]。为了阐明肺纤维化(尤其是IPF)的发病机制和寻找新的药物靶点,已建立多种肺纤维化动物模型。目前肺纤维化动物模型可分为基因相关模型与非基因相关模型,前者主要指基因工程动物模型,非基因相关模型主要指在相同或相似的遗传背景下,通过环境因素、药物/毒物或其他因素诱导得到的肺纤维化模型。本文就目前出现的肺纤维化动物模型进行分类并综述其最新进展。
1 基因相关模型
1.1转基因模型
1.1.1 细胞因子过表达模型 利用转基因技术过表达细胞因子造成严重的肺纤维化,主要细胞因子包括:TGF-β、TGF-α、IL-13、TNF-α和IL-1β等[1]。一般通过病毒载体过表达特定的细胞因子。常用的病毒载体有腺病毒和慢病毒,其中腺病毒多用于短暂性地过表达细胞因子,慢病毒则可用于长期基因过表达分析[3]。此外,一些肺特异性启动子(Ⅱ型肺泡上皮细胞中的表面活性蛋白SPC启动子、支气管上皮细胞中的CC-10启动子以及成纤维细胞中的Ⅰ型胶原启动子)可介导促纤维化细胞因子的表达,通过启动这些组织特异性启动子可诱导肺纤维化形成[4],因此相比于传统造模方法,细胞因子过表达模型可在多种组织细胞类型中探索促纤维化细胞因子诱导肺纤维化的下游信号通路,也能研究多种促纤维化细胞因子之间的交叉调节作用。这类模型靶点明确,对筛选抗纤维化药物意义重大。此外,如果通过诱导时间特定启动子,可使目的基因只表达于成年小鼠中,用于模拟肺纤维化在成年晚期出现的临床特征。通常介导转基因所用的病毒载体本身具潜在危害性,且人类肺纤维化的过程是多基因多种因子共同作用的结果,因此这种单一的过表达基因模型与多基因相关的肺纤维化存在一定差异[5]。
1.1.2 靶向Ⅱ型肺泡上皮细胞损伤模型 Ⅱ型肺泡上皮细胞(alveolar epithelial cells,AECs)受损与肺纤维化的发生和发展密切相关[6]。目前靶向损伤Ⅱ型AECs的模型是利用转基因技术将白喉毒素受体(diphtheria toxin receptor,DTR)与Ⅱ型肺泡上皮细胞启动子(surfactant protein C,SPC)通过载体融合,形成SPC-DRT表达框,然后将SPC-DTR表达框注入C57Bl/6小鼠受精卵中,建立Ⅱ型肺泡上皮细胞中表达DTR的转基因小鼠品系。用白喉毒素(diphtheria toxin ,DT)反复刺激DTR转基因小鼠可特异性损伤肺泡上皮细胞,诱导增殖性反应,使肺间质增厚[7]。该模型模拟肺纤维化发生过程中Ⅱ型AECs的病理变化,可用于阐明Ⅱ型AECs损伤所致的成纤维细胞增殖、胶原沉积和肺泡破裂的下游机制。
1.2基因突变模型研究发现遗传性的特发性肺纤维化与四种基因的突变密切相关,这四种基因分别是:肺表面活性蛋白C (SFTPC)、肺表面活性蛋白A2(SFTPA2)、端粒酶逆转录酶(TERT)和端粒酶RNA复合物(TERC)[8]。
SFTPC和 SFTPA2由Ⅱ型AECs特异性分泌,参与Ⅱ型AECs蛋白在内质网中的折叠反应。当SFTPC和SFTPA2发生突变时可导致内质网中蛋白错误折叠和聚集从而引起内质网应激。Lawson等将突变的人L188Q SFTPC导入小鼠Ⅱ型AECs中,小鼠在低剂量博来霉素诱导下易形成肺纤维化,说明内质网应激可以加剧纤维化反应[9]。因此,SFTPC和SFTPA2突变模型可用于研究内质网应激在特发性肺纤维化中的作用及机制。
端粒是染色体末端的保护性结构。在细胞分裂过程中端粒逐渐变短,当端粒短到特定长度会激活持续的端粒DNA损伤反应,随后诱导细胞死亡或凋亡。而端粒酶能以自身TERC为模板,在TERT催化下,将重复序列合成到染色体末端从而补偿损耗的端粒。当TERT和TERC发生突变时,可导致端粒功能发生紊乱、端粒变短[10]。单独敲除小鼠TERT或TERC不能自发形成肺纤维化,用博来霉素(0.5 mg/kg)处理TERT-/-小鼠可成功诱导肺纤维化形成,而此剂量的博来霉素不足以诱导野生型小鼠出现肺纤维化[11]。因此,这种突变模型可用于研究端粒及端粒酶在特发性肺纤维化中的作用及相关信号转导通路。
2 非基因相关模型
2.1环境因素诱导的肺纤维化动物模型环境因素在肺纤维化的发生发展中起重要作用,通过将动物暴露于不同的环境中诱导产生肺纤维化,主要包括以下三种类型。
2.1.1 高氧 长时间暴露于高氧环境中可导致多器官和组织损伤。肺是高浓度氧吸入后直接作用的靶器官,因此最易受损,形成高氧性急性肺损伤并进一步发展成渐进性肺纤维化[12]。目前,高氧诱导的急性肺损伤动物模型常采用的氧浓度为95%~100%,暴露时间为72~96小时。长时间暴露于50%~85%氧浓度环境中可诱导形成渐进性肺纤维化。例如,将CD-1小鼠(3~4周龄)置于80%高氧环境中168小时,小鼠出现严重肺纤维化[13]。啮齿类动物对高氧的耐受性具品种差异,在>95%氧浓度环境中暴露48~60小时,Fischer大鼠相比于SD大鼠,胸腔积液更多,总蛋白浓度更高。同样地,C57BL/6小鼠比C3H/HeJ小鼠对高氧更敏感[14]。此类模型主要应用于模拟临床氧疗引起的急性肺损伤和肺纤维化。
2.1.2 辐射 在临床上,辐射诱导的肺纤维化是长期体外放射治疗肿瘤过程中产生的副作用。用小鼠造模时通常采用的剂量是10~20 Gy,局部照射(只照射胸腔),给予辐射24周,肺纤维化形成。如给予C57BL/6小鼠胸部16Gy辐射,1~8周,小鼠肺组织炎性细胞浸润逐渐增多,肺泡壁和肺间质增厚,至24周,肺泡结构严重紊乱并出现塌陷,形成纤维化[15]。在辐射诱导的肺纤维化模型中,骨髓源性细胞(尤其是巨噬细胞和成纤维细胞)在肺纤维化区域聚集和增殖,生成自由基和促炎、促纤维化因子如TNF-α、TGF-β进一步促进肺纤维化[16]。这种模型是最早用于阐明骨髓间充质干细胞修复作用的动物模型[17]。同时该模型由于不同品种的小鼠对辐射损伤的敏感性不同从而便于遗传因素和临床的相关性研究,但这种模型造模时间长,实验成本高。
2.1.3 无机粉尘 将无机粉尘如石棉、二氧化硅等滴入啮齿类动物肺中可导致纤维结节形成,模拟接触石棉和二氧化硅的职业人群中出现的石棉肺和矽肺疾病过程。石棉和二氧化硅均可通过吸入途径和气管内滴入途径进入小鼠肺中引起肺纤维化。气管内滴入途径可快速诱导肺纤维化形成,如气管内给予C57BL/6小鼠角闪石纤维0.1 mg,14天后小鼠肺中出现明显纤维化[18]。气管内给予C57BL/6小鼠二氧化硅(0.2 g/kg)14天后,末端支气管-肺泡管区域出现结节样纤维化,28天后,胶原大量沉积[19]。通过吸入途径造模则需较长时间,如将C3H/HeN小鼠置于方石英雾化剂中(70 mg/m3,5 h/天)12天,其肺中出现纤维结节,肺淋巴组织增多,12~16周后纤维化反应明显[20]。相比气管内滴入途径,吸入途径所致纤维化更能模拟人石棉肺和矽肺的病理过程。在此类模型中,不同物质诱导肺纤维化所产生的病理学变化有显著差异,但这些物质在肺部沉积均可引起肺泡巨噬细胞聚集,产生炎症反应并释放促纤维化生长因子,从而诱导肺泡上皮细胞凋亡、成纤维细胞增殖和胶原沉积,最终导致纤维化形成。另外,二氧化硅可激活固有免疫系统,引起巨噬细胞NALP3炎性小体活化,因而常被用于研究肺纤维化过程中的固有免疫调节[21]。石棉纤维和二氧化硅留存在肺中可使纤维化结节围绕其沉积部位生长,因此通过组织学检查可定位纤维化区域。此外,这些无机粉尘不易从肺中被清除,可形成持久的纤维化。但这种模型需特定的吸入腔,产生的纤维化反应具有品种差异,这使其应用受到限制。
2.2药物/毒物诱导的肺纤维化动物模型
2.2.1 博来霉素 博来霉素是一种多肽类抗肿瘤药物,具有肺毒性。在过去几十年中,博来霉素诱导的肺纤维化动物模型是应用最普遍的实验性肺纤维化模型,已在多种动物中应用,如小鼠、大鼠、豚鼠、仓鼠、兔、犬和灵长类动物,其中,小鼠最常用[22]。
博来霉素的给药途径包括肺特异性给药(气管内滴入)和系统性给药(腹腔注射、皮下注射和静脉注射)(表1),可单剂量给药也可多次反复给药。其中,静脉注射和气管内给药是最常用的给药途径[4]。无论那种给药途径,博来霉素均可直接损伤细胞,其机制是通过诱导DNA链断裂、生成自由基并引起氧化应激,随后出现细胞坏死和凋亡、炎症、纤维化[23]。采用不同的给药途径,博来霉素最初损伤的细胞类型不同。因此,在用博来霉素造模时,最初的损伤部位可通过给药途径控制(表1)[22]。博来霉素可以在相对较短的时间内诱导纤维化,气管内滴入需2~4周,系统给药需4~12周[24]。
系统给药方式能模拟人在化疗过程中使用博来霉素产生肺毒性的过程,临床相关性好。肺特异性给药方式(气管内给药)可采用直接气管内注射、注入干粉或气管插管术。这种给药方式单剂量即可使动物在给药后14天出现肺纤维化,21~28天纤维化反应加强至最重。然而,经过这个阶段后,纤维化自发消退[23]。气管内多次给药解决了单剂量给药的局限性,这种给药方式可模拟肺慢性损伤过程,使纤维化反应更持久。如每隔一周给予博来霉素0.04 U,给药8次。在最后一次给予博来霉素后10周,纤维化仍很明显[25]。
表1博来霉素肺纤维化动物模型的不同给药途径比较
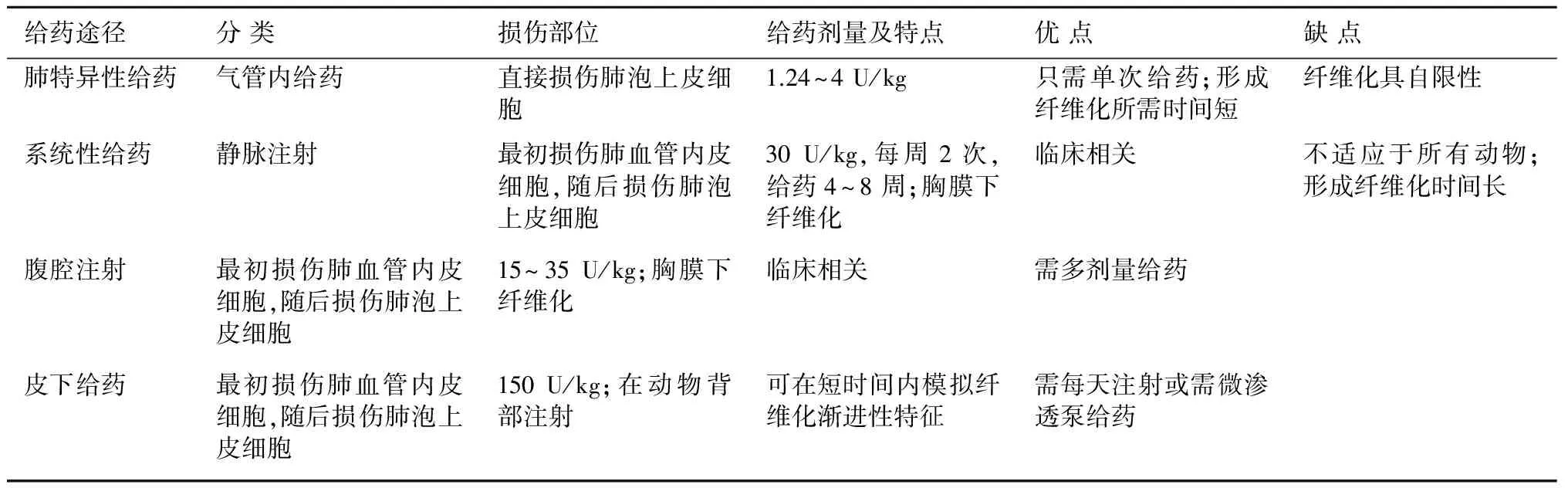
给药途径分类损伤部位给药剂量及特点优点缺点肺特异性给药气管内给药直接损伤肺泡上皮细胞1.24~4U/kg只需单次给药;形成纤维化所需时间短纤维化具自限性系统性给药静脉注射最初损伤肺血管内皮细胞,随后损伤肺泡上皮细胞30U/kg,每周2次,给药4~8周;胸膜下纤维化临床相关不适应于所有动物;形成纤维化时间长腹腔注射最初损伤肺血管内皮细胞,随后损伤肺泡上皮细胞15~35U/kg;胸膜下纤维化临床相关需多剂量给药皮下给药最初损伤肺血管内皮细胞,随后损伤肺泡上皮细胞150U/kg;在动物背部注射可在短时间内模拟纤维化渐进性特征需每天注射或需微渗透泵给药
2.2.2 百草枯 百草枯是一种常用的接触性速效除草剂。肺是百草枯中毒的主要靶器官,继发性损伤产生肺纤维化[26]。百草枯中毒涉及多种机制,现普遍认为氧化应激、炎症损伤是最主要的致病机制[27]。在动物实验研究中,百草枯给药途径主要是灌胃给药和腹腔注射,采用的动物一般为大鼠和小鼠。如:用Wistar雄性大鼠一次性灌胃百草枯溶液(20%)70 mg/kg,给药后7天、14天肺纤维化明显[28]。腹腔注射百草枯造急性肺损伤模型时,剂量可增大(可达30 mg/kg),而造肺纤维化模型时,剂量需略微减少(20 mg/kg或更低)[29]。目前尚无治疗百草枯所致肺纤维化的特效药物,因此,此类动物模型是阐明百草枯中毒发病机制及找寻有效药物的重要工具。
2.2.3 异硫氰酸荧光素 将异硫氰酸荧光素(fluorescein isothiocyanate,FITC)通过气管内给药滴入小鼠肺中,可使小鼠肺泡和血管渗透性增加,在14~21天形成肺纤维化[3]。这种模型常用于研究趋化因子信号受体2(CCR2)与其配体CCL12在招募纤维细胞时的相互作用(这种相互作用可使纤维化加剧)[30]。FITC是一种半抗原,可与肺中薄壁组织蛋白结合,在其沉积部位产生持续刺激,使纤维化反应持久。如气管内滴入FITC 0.007 mg/g,纤维化反应可持续6个月。因此,这种模型可用于长期性肺纤维化研究[31]。 FITC作为一种荧光素,可通过免疫荧光定位纤维化发生的区域。此外,FITC适用于多个品种的小鼠,对Balb/c和C57BL/6小鼠均有明显作用。但这种模型也存在明显的缺点,如无临床相关性、纤维化反应程度可变性大、FITC溶液必须新鲜配置并进行超声处理[3]。
2.3其他肺纤维化模型过继细胞转移模型是将特发性肺纤维化患者肺成纤维细胞静脉注射至免疫缺陷的NOD/SCID/beige(非肥胖糖尿病/重症联合免疫缺陷)小鼠中,小鼠肺部出现病理性重构,并能激活小鼠上皮细胞和成纤维细胞发生病理重构和增殖,这是目前成纤维细胞自发性病理表型的最好证据[32,33]。过继细胞转移模型的优点是转移的成纤维细胞可通过细胞渗透性染料示踪,纤维化发展相对迅速(注射后30~35天)且能持续数月。该模型的出现使研究不同类型肺纤维化患者的细胞成为可能,有助于进一步了解特发性肺纤维化的异质性,同时为研究特异性的抗纤维化药物提供了新的思路[34]。
另外,随着对肺纤维化研究的不断深入,目前出现了更多与临床相关的肺纤维化模型。如年老动物肺纤维化模型促进了肺纤维化的年龄相关性研究[35];用γ-疱疹病毒-68感染FITC入侵的小鼠,可模拟特发性肺纤维化的急性恶化过程[36]。在其他的疾病模型如糖尿病、Hermansky-Pudlak综合征模型中,也可观察到实验动物肺纤维化。研究者可根据研究目的选用不同的肺纤维化动物模型。
3 展望
综上所述,基因相关模型基于单基因或双基因的肺纤维化研究,为肺纤维化的治疗提供了潜在的靶点。非基因相关模型中,环境因素诱导的肺纤维化模型具很好的临床相关性,对阐明发病机制至关重要;药物/毒物性肺纤维化建模方法相对简单且可通过多种途径给药,有利于研究不同因素诱导肺纤维化的相关机制,因此被广泛应用;其他肺纤维化模型如过继细胞转移模型可研究成纤维细胞的自主作用,年龄相关模型、急性恶化模型则能更好的模拟疾病的临床特征。然而,目前对肺纤维化动物模型的研究多集中于小动物,在大动物中的研究甚少。另外,由于人类肺纤维化的病理学进程复杂并具时空异质性,且疾病的形成与发展受遗传、生物化学、环境和表型的相互作用影响,动物模型并不能完全模拟人类肺纤维化过程,还需进一步完善和探索。随着研究的深入,相信肺纤维化动物模型将进一步揭示肺纤维化的发生和发展规律,并更好的服务于临床治疗药物的发现。
[1] Moore BB,Lawson WE,Oury TD,et al.Animal Models of Fibrotic Lung Disease[J].Am J Respir Cell Mol Biol,2013,49(2):167-179.
[2] Margaritopoulos GA,Giannarakis I,Siafakas NM,et al.An update on idiopathic pulmonary fibrosis[J].Panminerva Med,2013,55(2):109-120.
[3] Moore BB,Hogaboam CM.Murine models of pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2008,294(2):L152-L160.
[4] Degryse AL,Lawson WE.Progress toward improving animal models for idiopathic pulmonary fibrosis[J].Am J Med Sci,2011,341(6):444-449.
[5] Rafii R,Juarez MM,Albertson TE,et al.A review of current and novel therapies for idiopathic pulmonary fibrosis[J].J Thorac Dis,2013,5(1):48-73.
[6] Osterholzer JJ,Christensen PJ,Lama V,et al.PAI-1 promotes the accumulation of exudate macrophages and worsens pulmonary fibrosis following type II alveolar epithelial cell injury[J].J Pathol,2012,228(2):170-180.
[7] Sisson TH,Mendez M,Choi K,et al.Targeted injury of type II alveolar epithelial cells induces pulmonary fibrosis[J].Am J Respir Crit Care Med,2010,181(3):254-263.
[8] Kropski JA,Lawson WE,Young LR,et al.Genetic studies provide clues on the pathogenesis of idiopathic pulmonary fibrosis[J].Dis Model Mech,2013,6(1):9-17.
[9] Lawson WE,Cheng DS,Degryse AL,et al.Endoplasmic reticulum stress enhances fibrotic remodeling in the lungs[J].Proc Natl Acad Sci USA,2011,108(26):10562-10567.
[10] Flores I,Cayuela ML,Blasco MA.Effects of telomerase and telomere length on epidermal stem cell behavior[J].Science,2005,309(5738):1253-1256.
[11] Povedano JM,Martinez P,Flores JM,et al.Mice with Pulmonary Fibrosis Driven by Telomere Dysfunction[J].Cell Rep,2015,12(2):286-299.
[12] van Ooij PJ,Hollmann MW,van Hulst RA,et al.Assessment of pulmonary oxygen toxicity:relevance to professional diving;a review[J].Respir Physiol Neurobiol,2013,189(1):117-128.
[13] Chen HL,Yen CC,Wang SM,et al.Aerosolized bovine lactoferrin reduces lung injury and fibrosis in mice exposed to hyperoxia[J].Biometals,2014,27(5):1057-1068.
[14] Matute-Bello G,Frevert CW,Martin TR.Animal models of acute lung injury[J].Am J Physiol Lung Cell Mol Physiol,2008,295(3):L379-L399.
[15] Liu H,Xue JX,Li X,et al.Quercetin liposomes protect against radiation-induced pulmonary injury in a murine model[J].Oncol Lett,2013,6(2):453-459.
[16] Straub JM,New J,Hamilton CD,et al.Radiation-induced fibrosis:mechanisms and implications for therapy[J].J Cancer Res Clin Oncol,2015,141(11):1985-1994.
[17] Epperly MW,Guo H,Gretton JE,et al.Bone marrow origin of myofibroblasts in irradiation pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2003,29(2):213-224.
[18] Robledo RF,Buder-Hoffmann SA,Cummins AB,et al.Increased phosphorylated extracellular signal-regulated kinase immunoreactivity associated with proliferative and morphologic lung alterations after chrysotile asbestos inhalation in mice[J].Am J Pathol,2000,156(4):1307-1316.
[19] Fazzi F,Njah J,Di Giuseppe M,et al.TNFR1/phox interaction and TNFR1 mitochondrial translocation Thwart silica-induced pulmonary fibrosis[J].J Immunol,2014,192(8):3837-3846.
[20] Davis GS,Leslie KO,Hemenway DR.Silicosis in mice:effects of dose,time,and genetic strain[J].J Environ Pathol Toxicol Oncol,1998,17(2):81-97.
[21] Cassel SL,Eisenbarth SC,Iyer SS,et al.The Nalp3 inflammasome is essential for the development of silicosis[J].Proc Natl Acad Sci U S A,2008,105(26):9035-9040.
[22] Mouratis MA,Aidinis V.Modeling pulmonary fibrosis with bleomycin[J].Curr Opin Pulm Med,2011,17(5):355-361.
[23] Della LV,Cecchettini A,Del RS,et al.Bleomycin in the setting of lung fibrosis induction:From biological mechanisms to counteractions[J].Pharmacol Res,2015,97:122-130.
[24] Moeller A,Ask K,Warburton D,et al.The bleomycin animal model:a useful tool to investigate treatment options for idiopathic pulmonary fibrosis[J].Int J Biochem Cell Biol,2008,40(3):362-382.
[25] Degryse AL,Tanjore H,Xu XC,et al.Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2010,299(4):L442-L452.
[26] Baltazar T,Dinis-Oliveira RJ,Duarte JA,et al.Paraquat research:do recent advances in limiting its toxicity make its use safer[J].Br J Pharmacol,2013,168(1):44-45.
[27] Zerin T,Kim YS,Hong SY,et al.Quercetin reduces oxidative damage induced by paraquat via modulating expression of antioxidant genes in A549 cells[J].J Appl Toxicol,2013,33(12):1460-1467.
[28] 曹玉芳,李景辉,欧宗兴,等二烯丙基硫化物可下调百草枯中毒大鼠肺部组织核转录因子-KB蛋白及肿瘤坏死因子-αmRNA表达[J].中华危重病急救医学,2015;27(4):274-279.
[29] Qian J,Ye Y,Lv L,et al.FTY720 attenuates paraquat-induced lung injury in mice[J].Int Immunopharmacol,2014,21(2):426-431.
[30] Moore BB,Murray L,Das A,et al.The role of CCL12 in the recruitment of fibrocytes and lung fibrosis[J].Am J Respir Cell Mol Biol,2006,35(2):175-181.
[31] Christensen PJ,Goodman RE,Pastoriza L,et al.Induction of lung fibrosis in the mouse by intratracheal instillation of fluorescein isothiocyanate is not T-cell-dependent[J].Am J Pathol,1999,155(5):1773-1779.
[32] Pierce EM,Carpenter K,Jakubzick C,et al.Therapeutic targeting of CC ligand 21 or CC chemokine receptor 7 abrogates pulmonary fibrosis induced by the adoptive transfer of human pulmonary fibroblasts to immunodeficient mice[J].Am J Pathol,2007,170(4):1152-1164.
[33] Trujillo G,Meneghin A,Flaherty KR,et al.TLR9 differentiates rapidly from slowly progressing forms of idiopathic pulmonary fibrosis[J].Sci Transl Med,2010,2(57):57r-82r.
[34] Hogenes M,Huibers M,Kroone C,et al.Humanized mouse models in transplantation research[J].Transplant Rev (Orlando),2014,28(3):103-110.
[35] Redente EF,Jacobsen KM,Solomon JJ,et al.Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2011,301(4):L510-L518.
[36] Lok SS,Haider Y,Howell D,et al.Murine gammaherpes virus as a cofactor in the development of pulmonary fibrosis in bleomycin resistant mice[J].Eur Respir J,2002,20(5):1228-1232.
10.15972/j.cnki.43-1509/r.2016.02.025
2016-01-08;
2016-02-14
国家自然科学基金(81473209;91439105).
*通讯作者,E-mail:leefeng@csu.edu.cn.
R563
A
秦旭平)
