粘质沙雷氏菌几丁质酶基因ChiA克隆及生物信息学分析
2016-12-24孟利强沙长青张先成张淑梅赵晓宇
孟利强, 沙长青, 张先成, 张淑梅, 赵晓宇, 曹 旭, 李 晶*
(1.黑龙江省科学院 微生物研究所 生物工程重点实验室,黑龙江 哈尔滨 150010;2.黑龙江省科学院高技术研究院,黑龙江 哈尔滨 150020;3.黑龙江省科学院 条件财务处,黑龙江 哈尔滨 150001)
粘质沙雷氏菌几丁质酶基因ChiA克隆及生物信息学分析
孟利强1,2, 沙长青1,3, 张先成1, 张淑梅1,2, 赵晓宇1,2, 曹 旭1,2, 李 晶1,2*
(1.黑龙江省科学院 微生物研究所 生物工程重点实验室,黑龙江 哈尔滨 150010;2.黑龙江省科学院高技术研究院,黑龙江 哈尔滨 150020;3.黑龙江省科学院 条件财务处,黑龙江 哈尔滨 150001)
通过生物信息学技术对ChiA基因序列进行分析预测,了解ChiA的基因结构及蛋白质性质。从自有菌株(粘质沙雷氏菌SerratiamareescensS68)中克隆到几丁质酶基因ChiA,利用相关软件对ChiA基因序列进行分析预测。ChiA基因全长1 714 bp,开放阅读框编码563个氨基酸,推测其编码的蛋白质分子量为60 983.8 Da,等电点为6.35,是一种稳定的亲水性蛋白质。预测ChiA可能存在信号肽,切割位点在第23~24位氨基酸之间,1~23位氨基酸为其跨膜结构,其余肽链位于细胞外。ChiA主要存在3种二级结构元件,在二级、三级结构中都有体现。该ChiA是一种水溶性蛋白质,结构稳定且可以分泌到胞外。
粘质沙雷氏菌;几丁质酶;基因克隆;生物信息学
几丁质(chitin)又称甲壳素,是由N-乙酰-2-脱氧-D-葡萄糖聚合而成的大分子多糖,广泛存在于自然界藻类、细菌、放线菌等体内的多聚物,是仅次于纤维素居第二位的可再生资源[1]。几丁质酶(chitinase)可以催化水解几丁质的β-1,4糖苷键生成几丁寡糖和N-乙酰-氨基葡萄糖,是非常重要的保健品和医疗原材料[2]。粘质沙雷氏菌(Serratiamarcescens)是一种可以产生几丁质酶的菌株,早在1986年,Jone等[3]就克隆到了粘质沙雷氏菌的ChiA和ChiB基因,并测定了全序列。1999年,Tanaka等[4]从湿热古细菌ThermococcuskodakaraensisKOD1中克隆到了几丁质酶基因ChiA。国内对微生物几丁质酶学的研究比较晚,2003年,张表等[5]构建了含有ChiA基因的克隆载体,并完成测序和序列分析。本研究所用菌株粘质沙雷氏菌S68为本研究室自有菌株,具有较强的几丁质酶活性。通过实验设计引物,克隆到目的基因ChiA,并对其几丁质酶蛋白质结构进行生物信息学分析,为了解微生物几丁质酶系及构建高产几丁质酶工程菌提供参考。
1 材料与方法
1.1 材料
粘质沙雷氏菌(Serratiamarcescens)由本研究室保藏,菌株编号S68;克隆载体pZeroback/ blunt vector及感受态细胞DH5α(140326)购于天根生化科技有限公司。
1.2 方法
1.2.1 引物设计及PCR扩增 分析比对GenBank中10个Serratiamarcescens的ChiA 基因序列,在其共同保守区设计特异性引物:上游引物:5′-GGAATTCATGCGCAAATTTAATAAACCG-3′;下游引物:5′-CCCAAGCTTAACCGATTATTGAACGCCG-3′。PCR反应体系(25μL):模板DNA 1 μL,上下游引物各 1 μL,2×PCR Master Mix (TIANGEN) 12.5 μL,ddH2O 9.5 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性45 s,66.2 ℃复性30 s,72 ℃延伸45 s,30个循环;最后72 ℃延伸10 min。
1.2.2ChiA 基因克隆与序列测定分析 PCR产物的琼脂糖电泳、纯化、连接、转化及阳性克隆子的筛选均参照文献[6]。阳性克隆子由北京三博远志生物技术有限公司完成测序,将测得基因序列提交GenBank进行BLAST比对分析。
1.2.3ChiA 基因生物信息学分析 选用ProtParam软件分析ChiA 的氨基酸组成、序列、分子量及等电点,用ProtScale软件分析其疏水性,ChiA 信号肽的查找和细胞定位分别由SignalP 4.1和TMHMM v. 2.0完成,ChiA 的二级结构和三级结构分别由Psipred v3.3和Phyre2完成,ChiA 的进化分类由Prosite完成,本研究涉及软件的生物信息学网站见表1[7]。

表1 生物信息学软件网站
2 结果与分析
2.1ChiA基因克隆和序列分析
ChiA 基因PCR产物经琼脂糖电泳检测为单一条带,分子量在1 700 bp左右,符合目的片段的大小(图1)。将单一条带回收、连接、转化得到阳性克隆子,并委托三博远志测序,得到ChiA 基因核苷酸序列(GenBank accession number KP065496)如图2。序列全长1 714 bp,用ORF Finder 软件分析,得到1条1 692 bp的开放阅读框(图3),起始密码子ATG位于第8位置,终止密码子TAA位于1699位置,共编码563个氨基酸。

图1 ChiA基因PCR产物电泳

图2 ChiA基因核苷酸序列Fig.2 Nucleotide sequence of ChiA gene
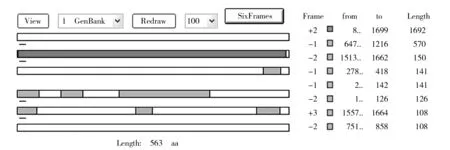
图3 ChiA基因核苷酸开放阅读框分析Fig.3 AnaJysis of open reading frame of ChiA
将ChiA基因序列提交NCBI网站进行BLAST比对,发现该基因序列与GenBank中登录号为DQ990373.1的S.marcescensChiA 基因高度相似,同源性达99%以上,两者仅在196、649、1037和1486位置的4个核苷酸碱基不同(加粗标记),由于氨基酸密码子的兼并性,二者对应的氨基酸序列仅344位置不同,由GenBank中的Thr(T)变成了Ala(A)。2个氨基酸都属于带有极性的中性氨基酸,不会造成ChiA 的蛋白质结构的改变[8]。
2.2ChiA理化性质分析
ChiA基因包含一个全长1 692 bp的完整阅读框,编码563个氨基酸(图4),用ProtParam软件对其进行分析,分子量为60 983.8 Da,等电点为6.35,分子式为C2739H4205N727O822S16。如图5所示,ChiA中含量比较多的氨基酸有甘氨酸Gly(61,10.8%)、丙氨酸Ala(55,9.8%)、亮氨酸Leu(45,8%)及赖氨酸Lys(42,7.5%),含量最少的为半胱氨酸Cys(5,0.9%)。总的带负电荷的氨基酸(Asp+Glu)为56,总的带正电荷的氨基酸(Arg+Lys)为54。在体外环境下ChiA的半衰期为30 h,不稳定指数为15.33(小于40),属于稳定蛋白质。疏水性分析由ProtScale软件完成,如图6所示,ChiA疏水性分析第12和13分值最高为2.178,疏水性最强,第151位的脯氨酸Pro分值最低为-3.178,亲水性最强。计算ChiA的平均疏水性指数为-0.282,此外由疏水性分析曲线也可以看出,基准线(0)的下半部分曲线部分明显多于上半部分,所以预测ChiA为水溶性蛋白质[9]。

图4 ChiA氨基酸序列Fig.4 Amino acid sequence of ChiA gene
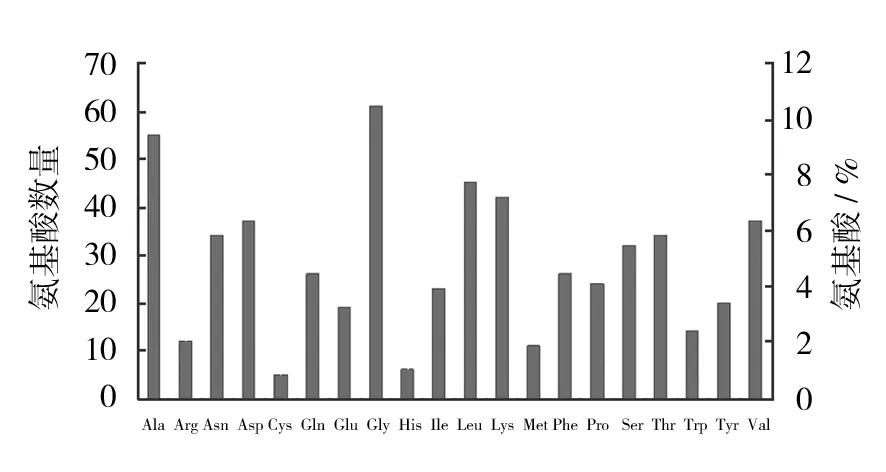
图5 ChiA氨基酸组成及比例Fig.5 Composition and proportion of amino acid of ChiA
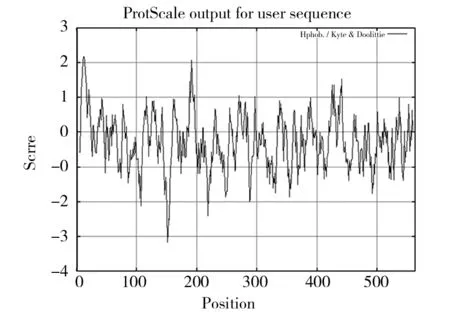
图6 ChiA疏水性分析Fig.6 AnaJysis of hydmphobicity for ChiA
2.3ChiA信号肽分析及细胞定位
信号肽是位于分泌蛋白N端的一段氨基酸序列,将蛋白质导向细胞的正确位置,之后在信号肽酶的作用下被切除[10]。用SignalP 4.1对ChiA信号肽进行分析,结果如图7,ChiA中可能存在信号肽,并且信号肽切割位点在23~24之间(AQA~AA),信号肽存在的可能性为0.846,推测ChiA为一种分泌蛋白。
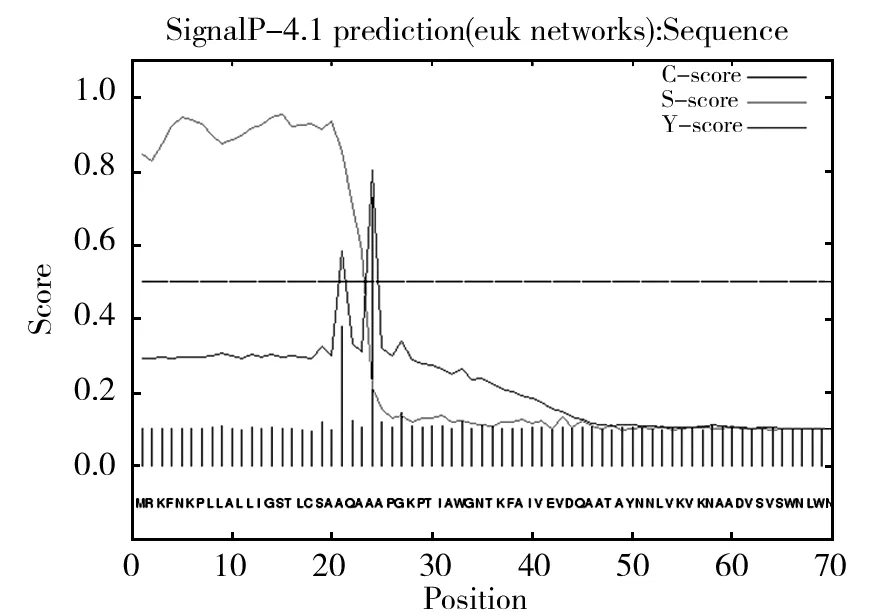
图7 ChiA信号肽分析Fig.7 Analysis of signal peptide for ChiA
分泌蛋白的跨膜结构对其信号转导、细胞识别及最终的细胞定位均具有重要的作用[11],通过TMHMM v. 2.0对ChiA分析发现在1~23之间存在一个跨膜结构(图8),其余整条肽链都位于胞外,这与信号肽预测结果相吻合,推测ChiA的信号肽是具有疏水性的跨膜区,最终将ChiA分泌到胞外。
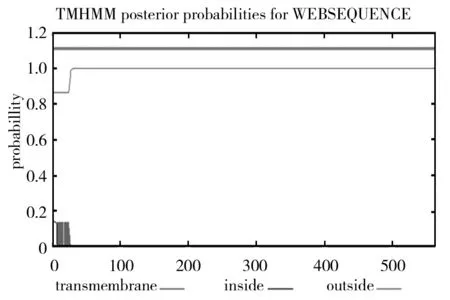
图8 ChiA跨膜结构域分析Fig.8 Analysis of trans-membrane segments for ChiA
2.4ChiA二级结构预测
蛋白质分子的多肽链(一级结构)通常会以多种二级结构折叠、盘曲和延伸成特有的空间构象,并具有自身的理化性质和生物学活性,因此蛋白质二级结构的分析和预测对其空间构象的了解具有重要意义[12-13]。应用SOPMA软件对ChiA的二级结构进行预测,结果如图9,ChiA二级结构中共包含4种结构元件:α螺旋、延伸连、β转角、无规则卷曲,其中无规则卷曲、α螺旋及延伸连是ChiA的主要结构元件,分别占36.94%、27.89%和24.33%,而β转角所占比例最少仅为10.83%。
2.5ChiA三级结构及保守结构域分析
应用Phyre2软件对ChiA的三级结构进行预测,如图10所示,ChiA主要由无规则卷曲、α螺旋及延伸连组成,这和二级结构预测结果相符。通过搜索Prosite家族数据库,ChiA含有1条Chitinase 18保守结构域(307~315),属于几丁质酶18基因家族。

图9 ChiA二级结构预测线性图Fig.9 Linear map of secondary structure prediction for ChiA竖线长度(由长到短)分别表示:α螺旋、延伸连、β转角、无规则卷曲Length of vertical (from long to short) respectively: helix, strand, angle, coil
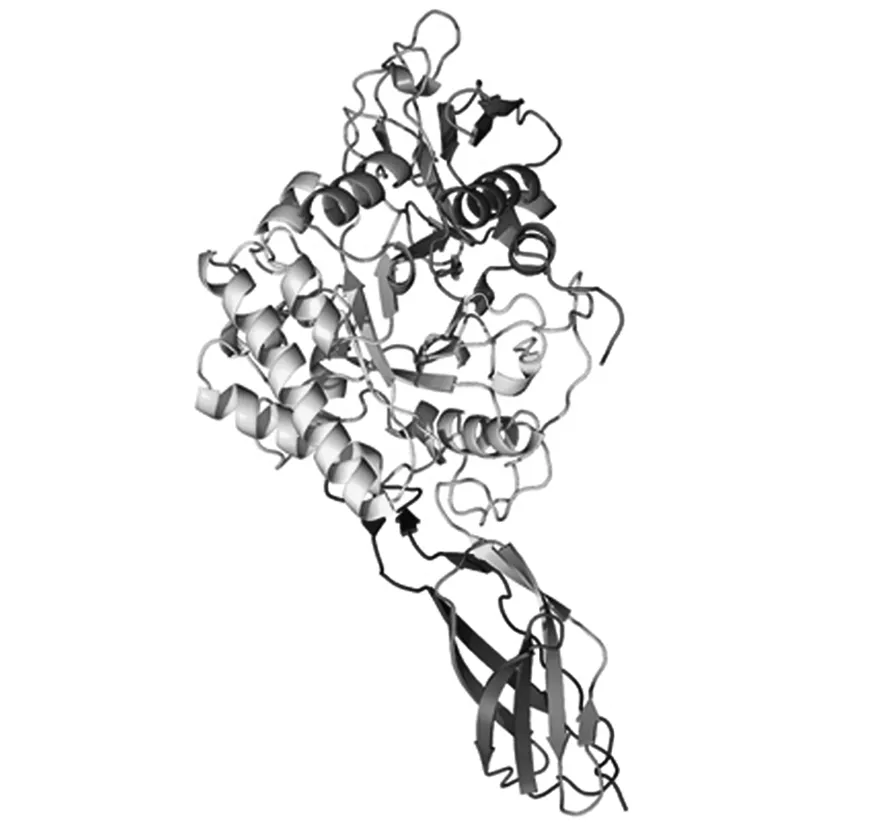
图10 ChiA三级结构Fig.10 Tertiary structure of ChiA
3 讨 论
本研究从菌株粘质沙雷氏菌(Serratiamarcescens) S68克隆到几丁质酶基因ChiA,该基因全长1 714 bp,有1个1 692 bp的开放阅读框,编码563个氨基酸,这与张表等[5]报道的ChiA大小一致。该基因序列与GenBank中登录号为DQ990373.1的S.marcescensChiA基因高度相似(99%),仅有4个碱基发生突变,最终导致了1个氨基酸的突变(Thr-Ala)。但由于这2个氨基酸都属于带有极性的中性氨基酸,不会造成ChiA的蛋白质结构的改变。通过一级结构分析发现ChiA中含量较高的氨基酸有甘氨酸、丙氨酸、亮氨酸和赖氨酸,半胱氨酸含量最少,分子式为C2739H4205N727O822S16,分子量为60 983.8 Da,等电点为6.35。此外,ChiA的不稳定指数和平均疏水性指数分别为15.33和-0.282,说明它属于水溶性的稳定蛋白质。通过蛋白质预测软件分析发现,ChiA可能是一种分泌蛋白,并且存在一个跨膜结构。ChiA的二级结构与三级结构预测结果相符[14-15]。本研究首次对自有菌株粘质沙雷氏菌S68的几丁质酶基因ChiA进行了系统的生物信息学预测,对几丁质酶ChiA的各级结构有了进一步认识,这将为该菌及几丁质酶的研究和应用,如几丁质酶的克隆表达体系的建立及定向进化的研究等方面提供参考。
[1] Dutta J,Tripathi S,Dutta P K,et al.Progress in antimicrobial activities of chitin, chitosan and its oligosaccharides: a systematic study needs for food applications[J].Food Science and Technology International,2012,18(1):3-34.
[2] 李春霞,佟永薇,侯世洁,等.微生物几丁质酶的研究进展[J].食品研究与开发,2008,29(8):155-157.
[3] Jones J D G, Grady K L, Suslow T V, et al. Isolation and characterization of genes encoding two chitinage enzymes fromSerratiamarcescens[J].EMBOJ,1986,5(3):467-473.
[4] Tanaka T,Fukui T,Imanaka T,et al.Different cleavage specificities of the dual catalytic domains in chitinase from the hyperthermophilic archaeonThermococcuskodakaraensisKOD1[J].The Journal of Biological Chemistry,2001,276(38):35629-35635.
[5] 张表,赵晓瑜,乔环宇,等.粘质沙雷氏菌(Serratiamarcescens)几丁质酶基因克隆的筛选及序列分析[J].河北大学学报(自然科学版),2003,23(2):184-187.
[6] Sambrook J, Fritsh E F, Maniat is T. Molecular cloning: a laboratory manual[M].New York, Cold Spring Harbor Laboratory,1989.
[7] 徐建华,朱家勇.生物信息学在蛋白质结构与功能预测中的应用[J].医学分子生物学杂志,2005,2(3):227-232.
[8] 张久敏.例析基因突变与性状的关系[J].试题与研究:新课程论坛, 2012,(13):69-69.
[9] 魏巍,贺淹才,方柏山,等.粘质沙雷氏菌几丁质酶(ChiC)基因克隆及其生物信息学分析[J].江西农业大学学报,2006,28(3):444-448.
[10]Chen W.B,Nie Y,Xu Y,et al.Signal peptide-independent secretory expression and characterization of pullulanase from a newly isolatedKlebsiellavariicolashn-1 inEscherichiacoli[J].Applied Biochemistry and Biotechnology. Part A, enzyme engineering and biotechnology,2013,169(1):41-54.
[11]邱建丁,梁汝萍,谭学才,等.膜蛋白跨膜区段的预测分析[J].高等学校化学学报,2004,25(5):831-836.
[12]Osadchy M,Kolodny R.Maps of protein structure space reveal a fundamental relationship between protein structure and function[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(30):12301-2306.
[13]叶辉,程备久,朱苏文,等.粘质沙雷氏菌几丁质酶chiB基因的克隆与序列分析[J].激光生物学报,2007,16(3):299-303.
[14]Watanabe T, Kimura K, Sumiya T, et al. Genetic analysis of the chitinase system ofSerratiamarcescens2170[J]. J. Bacteriol.,1997,(179):7111-7117.
[15]Francesco M,Sushmita M.Natural computing methods in bioinformatics: A survey[J].Information Fusion,2009,10(3):211-216.
Cloning & Bioinformatics Analysis of Chitinase Gene ChiA from Serratia marcescens
MENG Li-qiang1, 2, SHA Chang-qing1, 3, ZHANG Xian-cheng1, ZHANG Shu-mei1, 2,ZHAO Xiao-yu1, 2, CAO Xu1, 2, LI Jing1,2
(1.KeyLab.ofBiotech.,Inst.ofMicrobiol.ofHeilongjiangAcad.ofSci.,Harbin150010;2.Inst.ofAdvancedTechnol.,HeilongjiangAcad.ofSci.,Harbin150020;3.ConditionandFinancialDiv.,HeilongjiangAcad.ofSci.,Harbin150001)
In order to learn the structure of chitinase gene (ChiA) and the protein properties ofChiA, the sequence ofChiA was analyzed and predicted by bioinformatics techniques.ChiA was cloned fromSerratiamarcescensstrain 41003, its sequence was analyzed and predicted by bioinformatics software. The results showed that the length ofChiA was 1 714 bp having an open reading frame encoding 563 amino acids inferring their encoded protein molecular weight at 60 983.8 Da with isoelectric point at 6.35, it was a stable hydrophilic protein. It was predicted that it might exist a signal peptide inChiA with its cutting site between 23rd to 24th amino acid. 1st to 23rd amino acid might be the transmembrane construction and the rest peptide chains located outside the cell.ChiA mainly existed three kinds of secondary structure elements, which embodied in both secondary structure and tertiary structure. Therefore,ChiA was a hydrosoluble protein with stable structure and could be secreted outside the cell.
Serratiamarcescens; chitinase gene; gene cloning; bioinformatics
黑龙江省科学院学科团队创新能力提升专项(2014ws09)
孟利强 男,副研究员,硕士。研究方向为微生物资源及基因工程。E-mail:mengliqiang83420@163.com
* 通讯作者。女,研究员,博士。主要研究方向为农业微生物及分子生物学。E-mail:lj0706@sohu.com
2014-11-06;
2015-01-02
Q781
A
1005-7021(2016)01-0062-07
10.3969/j.issn.1005-7021.2016.01.011
