酿酒酵母中SSK2基因与其他镉耐受相关基因之间的双基因缺失菌株构建
2016-12-24蒋伶活
熊 兵, 杨 益, 蒋伶活
(江南大学生物工程学院 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
酿酒酵母中SSK2基因与其他镉耐受相关基因之间的双基因缺失菌株构建
熊 兵, 杨 益, 蒋伶活*
(江南大学生物工程学院 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
镉是一种严重的环境污染物,对人体具有致癌性,能蓄积在生物体内影响机体的生长、发育和生殖。有丝分裂原蛋白激酶(Mitogen-activated protein kinase,MAPK)在调节细胞存活、增殖和分化中是重要的信号分子,并能够被镉胁迫激活。酿酒酵母中2个MAPK信号传导途径,高渗透压甘油(High Osmolarity Glycerol,HOG)途径和细胞壁完整性(Cell Wall Integrity,CWI)途径都参与Cd2+胁迫下的细胞应答。为了进一步研究这两条途径在调控Cd2+胁迫方面的相互作用,以HOG途径的蛋白激酶SSK2基因为例,通过合成遗传阵列(Synthetic Genetic Array,SGA)方法,成功构建了SSK2基因与其他52个Cd2+耐受相关基因之间的双基因缺失菌株。为大规模研究Cd2+耐受基因之间在调控镉胁迫方面的遗传学相互作用奠定了基础,也为酿酒酵母的相关研究提供了一个新的遗传学手段。
酿酒酵母;高渗透压甘油(HOG)途径;细胞壁完整性(CWI)途径;合成遗传阵列(SGA);SSK2
镉是一种严重的环境污染物,被国际癌症研究机构定义为I类人体致癌物[1],可以通过饮食和吸烟摄入人体,危害人类健康[2]。镉与各种癌症和心血管疾病的发生有关[3-4],最近的研究表明镉可能是导致茨海默疾病和帕金森综合症等神经性疾病的一个致病因素[5-6]。MAPK信号转导途径在真核生物中广泛存在。MAPK是真核生物应答外界刺激的重要途径之一。当生物感知外界刺激后,体内特异的MAPK途径被激活,从而调整细胞作出反应。有研究表明Cd2+激活哺乳动物细胞c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路,促进活性氧族物质(reactive oxygen species,ROS)形成,介导细胞凋亡[7-8]。在鸡肝癌细胞和白血病细胞中,Cd2+可以诱导p38 和胞外调节蛋白激酶(Extracellular Regulated protein Kinases,ERK1/2)的磷酸化[9-10]。酿酒酵母(Saccharomycescerevisiae)细胞中存在5个MAPK级联系统,由5种MAPK蛋白激酶(Hog1、Slt2、Smk1、Fus3和Kss1)分别控制HOG途径和CWI途径、孢子分化、菌丝形成和侵入生长以及细胞接合过程。前期研究发现,在酿酒酵母细胞中HOG途径7个组分、CWI途径6个组分的基因缺失株对镉敏感[11],说明HOG途径和CWI途径参与了镉胁迫下的细胞应答。合成遗传阵列SGA是由Charles Boone等发明的一种系统性构建双基因突变株的方法,并能够进行合成遗传互作的整体性分析[12],主要用于识别功能性基因,鉴定能够相互作用或影响相同途径的基因。它以细胞的生长表型作为基础,采用图像处理技术,定量分析基因之间正向和负向相互作用,生成复杂的遗传网络。本研究利用SGA方法一次性成功构建了HOG途径SSK2基因与其他52个Cd2+耐受相关基因之间的双基因缺失菌株。
1 材料与方法
1.1 材料
1.1.1 菌株 本研究所用到的酿酒酵母菌株有野生型Y2454(MATαmfa1::MFA1pr-HIS3;can1;ura3;leu2;his3;lys2)[13],以及单倍体BY4741(MATαhis3;leu2;met15;ura3)为背景的对Cd2+敏感的89个单基因缺失株[11](表1)。
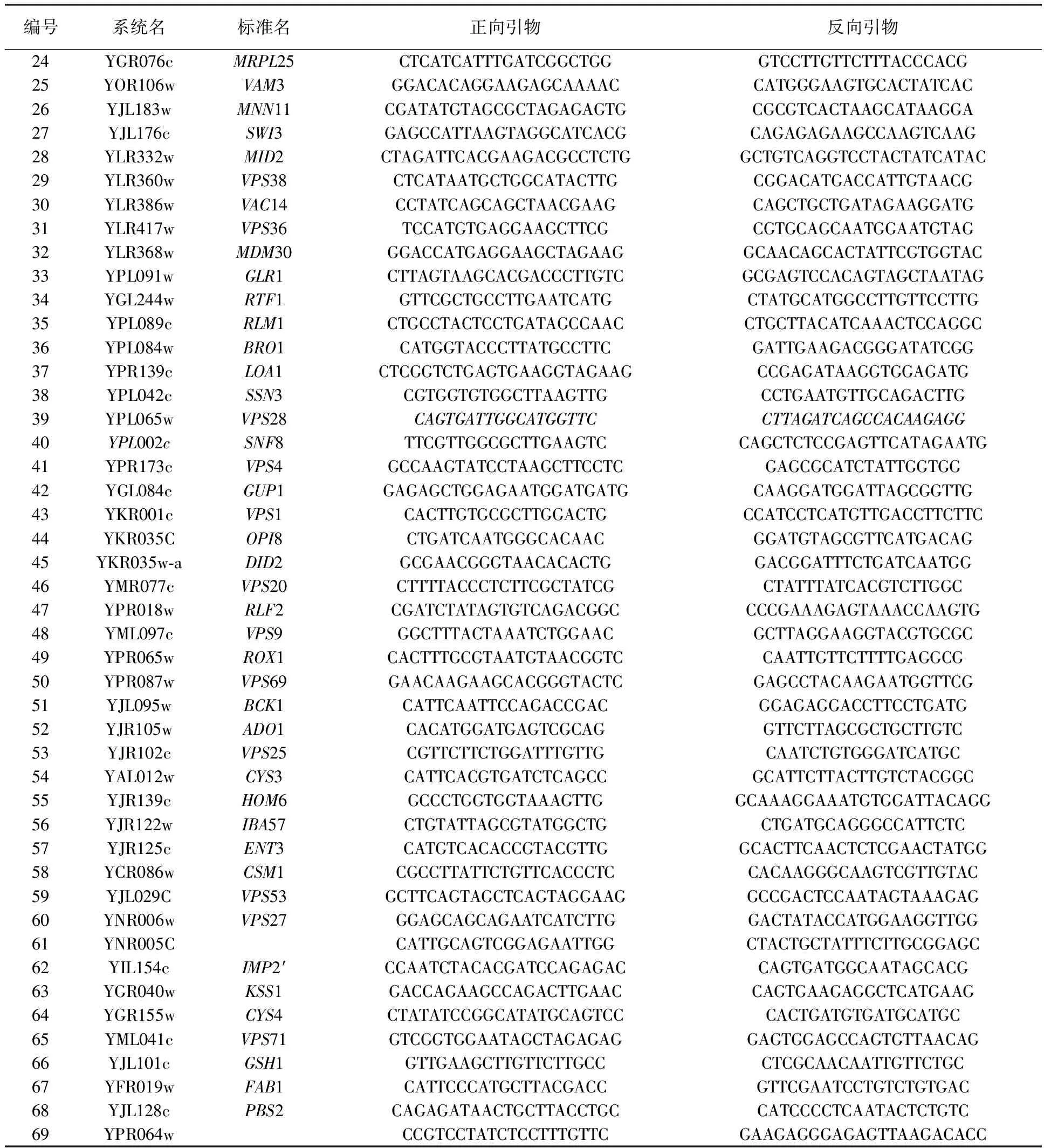
1.1.2 引物 实验所用引物见表1。

表1 酵母89个基因的编号及实验所用引物
续表1

续表1
1.1.2 培养基 ① YPD培养基;② SD-His-Arg培养基(质量分数,%):酵母氮源0.67,葡萄糖2,灭菌后加入过滤灭菌过的10×必需氨基酸混合母液(不含组氨酸和精氨酸);③ 产孢固体培养基(质量分数,%):琼脂2,醋酸钾1,酵母提取物0.1,葡萄糖0.05,添加组氨酸、亮氨酸和尿嘧啶。
1.1.3 主要试剂 酵母转化用ssDNA、LiAc和PEG 3350等试剂购自Sigma公司;SGA实验所用药物NAT、G418和L-Canavanine分别购自Werner BioAgents、上海生工和Sigma公司;TaqDNA聚合酶、限制性内切酶等试剂购自北京全式金公司。
1.1.4 主要仪器及设备 PCR反应仪(德国艾本德公司)、全温摇瓶柜(太仓强乐实验设备厂)、台式冷冻离心机(日本日立公司)、立式压力蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂)、凝胶成像系统(Bio-Rad)、全套384针孔影印板(美国Invitrogen 公司)。
1.2 方法
1.2.1 酵母细胞的转化 挑取活化的酵母单菌落接种于3 mL YPD 液体培养基中,30 ℃过夜培养至饱和。取500 μL过夜培养物接种到4.5 mL 2×YPD中,30 ℃培养3~4 h到对数期。12 000 r/min 瞬时离心10 s收集菌体,用无菌水洗1次,再用100 μL 0.1 mol/L LiAc溶液洗2次。向细胞沉淀中依次加入240 μL质量分数 50%PEG,36 μL 1 mol/L LiAc,10 μL 10 mg/mL ssDNA,目的DNA(5~10 μg),1 mL吸头上下吸3~4次,涡旋充分混匀,置于30 ℃孵育30 min,42 ℃水浴热激30 min。室温3 000 r/min离心1 min收集菌体,用1 mL无菌水水洗菌体,涂布到选择性固体平板上,30 ℃培养3 d,获得酵母转化子。
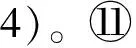
2 结果与分析
2.1 靶菌株ssk2::natMX4的构建
在前期研究中,通过基因缺失株文库的筛选,确定了89个基因缺失后对Cd2+敏感,其中包括7个HOG信号途径的组份和6个CWI信号途径的组分[11]。为了研究HOG和CWI两个途径之间,以及它们和其他Cd2+耐受性相关基因之间,在调控Cd2+胁迫方面的遗传相互作用,需要构建HOG和CWI信号途径组分基因之间以及它们和其他基因之间的双基因缺失突变株。为了建立这个大规模构建双基因缺失突变株的方法,这里仅以SSK2基因为例,拟构建SSK2与其他88个与Cd2+耐受有关的基因之间的双基因缺失株。本研究利用SGA方法[14-15]的原理进行构建。首先获得Y2454背景下的ssk2::natMX4单基因缺失株作为靶菌株,其基因型验证如图1B。

图1 Y2454背景里的靶菌株ssk2::natMX4构建Fig.1 Generation of the ssk2::natMX4 mutant in Y2454 background
A: PCR扩增BY4741背景里ssk2::kanMX4敲除盒(第1泳道);CK:BY4741菌株里野生型SSK2基因片段的PCR;B: Y2454背景里ssk2::natMX4基因型验证(第1泳道);CK:Y2454菌株里缺失基因ssk2::kanMX4片段的PCR
A: PCR amplification of thessk2::kanMX4 cassette from the BY4741 background;CK:PCR amplification of theSSK2 gene from the BY4741 background;B: Genotype verification of thessk2::natMX4 allele in the Y2454 background; CK:PCR amplification of thessk2::kanMX4 allele in the Y2454 background
2.2 SGA缺失株阵列的获得
为了提高菌株构建效率,将88个BY4741背景下的基因缺失株依次点接在影印板的a、b、c和d四个区域,每个区域的菌株及排列顺序都相同(图2)。

图2 88个SGA缺失株阵列分布Fig.2 Distribution of 88 SGA gene deletion mutants arraya、b、c和d四个区域均有96个点接位置,影印板中装有YPD+150 μg/mL G418固体培养基。30 ℃培养1 dEach of four districts of a, b, c and d has 96 spots for inoculation. The plate containing YPD+150 μg /mL G418 solid medium is cultured for one day at 30 ℃
2.3 SGA筛选双基因缺失株
SGA原本是用来进行高通量合成致死型分析的,在这里被用来筛选双基因缺失株(图3)。靶菌株ssk2::natMX4是MATα型的,而带有kanMX4标签的SGA阵列菌株是MATa型的,它们在YPD培养基上进行杂交,产生MATα/a型的双倍体菌株,同时带有kanMX4和natMX4这2个遗传标签。双倍体菌株在产孢培养基上生成四分孢子,孢子有MATa和MATα两种交配型。MFA1pr-HIS3报告子只在MATa型的细胞中才能表达,所以在SD-HIS的培养基上就能够筛选出MATa型的单倍体孢子。此外,CAN1基因编码一种高亲和性通透酶,刀豆氨酸和精氨酸都是通过这种通透酶进入细胞的。因为刀豆氨酸是精氨酸的类似物,对细胞具有毒害作用,所以在缺少精氨酸的SD +刀豆氨酸(L-Canavanine)的培养基中,含有CAN1基因的菌株是致死的,因为它们摄取了刀豆氨酸,刀豆氨酸会代替精氨酸合成蛋白质,由于结构的不同导致蛋白功能出现异常,致使细胞死亡。因此,利用SD-His-Arg+L-Canavanine培养基就能够筛选出不含有亲本的MATa型单倍体孢子。最后利用YPD+G418+NAT培养基筛选出MATa型中的ssk2::natMX4xxx::kanMX4双基因缺失株(图4)。
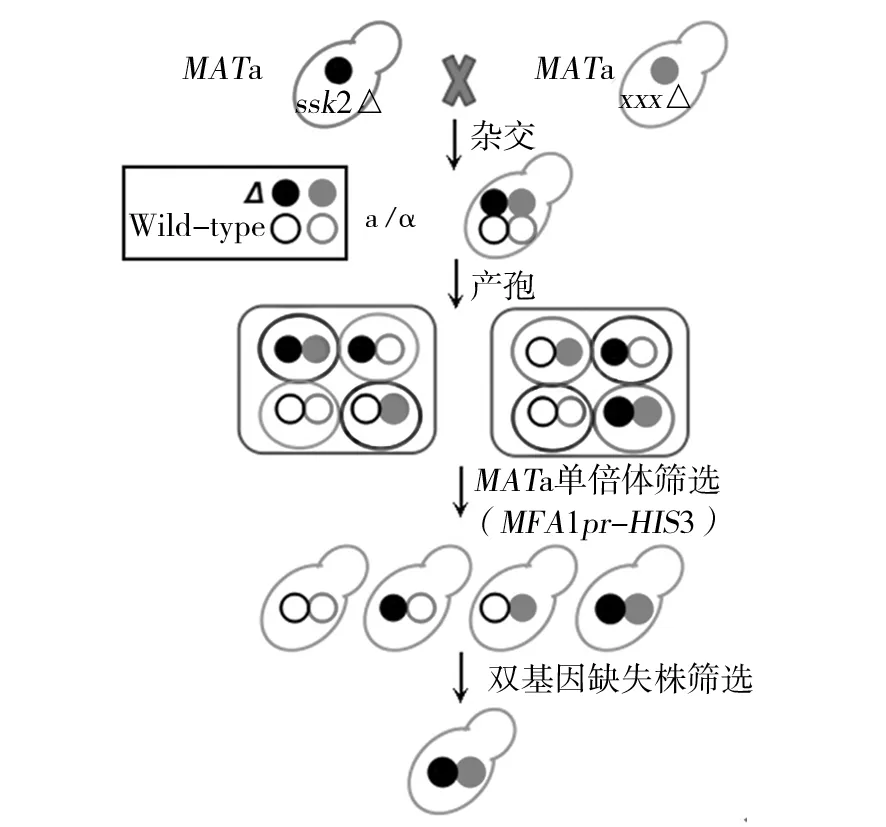
图3 合成遗传阵列(SGA)方法[16]Fig.3 Synthetic genetic array (SGA) mthod[16]黑色实圆,表示ssk2基因缺失;灰色实圆,表示x基因(1-88号)缺失;黑色空圆,表示野生型SSK2基因;灰色空圆,表示野生型X基因(1-88号)Fillied black circle, ssk2 mutation; Fillied gray circle, gene x mutation; Empty black circle, wild type SSK2; Empty gray circle, wild type gne X

图4 YPD+NAT+G418培养基筛选双基因缺失株Fig.4 Double-gene deletion mutant selection on the plate containing YPD+NAT+G418大的面包型菌落为潜在的MATa型双基因缺失菌株,小的不规则菌落为背景菌的生长Big round colonies are potential MATa cells lacking two genes, while small irregular colonies are background cell growth
2.4 双基因缺失菌株的基因型验证
将图4中获得的潜在双基因缺失菌株在YPD+100 μg/mL NAT+150 μg/mL G418培养基上进行纯化,挑取单菌落,提取基因组作为模板,用两对引物进行PCR验证(图5)。上排电泳图是利用引物SSK2-F/SSK2-R检测SSK2基因是否缺失,下排电泳图是利用引物X-F/X-R(X表示1~88号基因中的任何1个)检测另一个基因是否缺失。对照都是待测基因的ORF框扩增。例如,从52、55、59、61、63、65、69和70号菌株的基因组中,除了能够扩增出ssk2::natMX4DNA片段外(图5的上排),还能分别扩增出52、55、59、61、63、65、69和70号基因对应的kanMX4片段(图5的下排),说明它们是正确的双基因缺失株。但是,从56和67号菌株扩增出2个DNA片段(图5的下排),表明这2个菌株是不正确的。此外,虽然能从60和66号菌株扩增出ssk2::natMX4DNA片段(图5的上排),但是它们自己的基因没有被缺失,因为PCR扩增出来它们自己的ORF片段(图5的下排),所以也是错误的。
同理,最终获得SSK2和其他共52个基因的正确双基因缺失菌株(图5未显示;表2),筛选效率达到59%。此外,剩下的41%基因可以通过另外1~2次类似的SGA筛选获得。以上结果说明成功建立了SGA大规模遗传筛选双基因缺失株的方法,为研究HOG和CWI途径在调控Cd2+敏感性方面的相互作用奠定了基础,也为国内同行开展类似的酵母遗传学研究提供了一种新的手段。
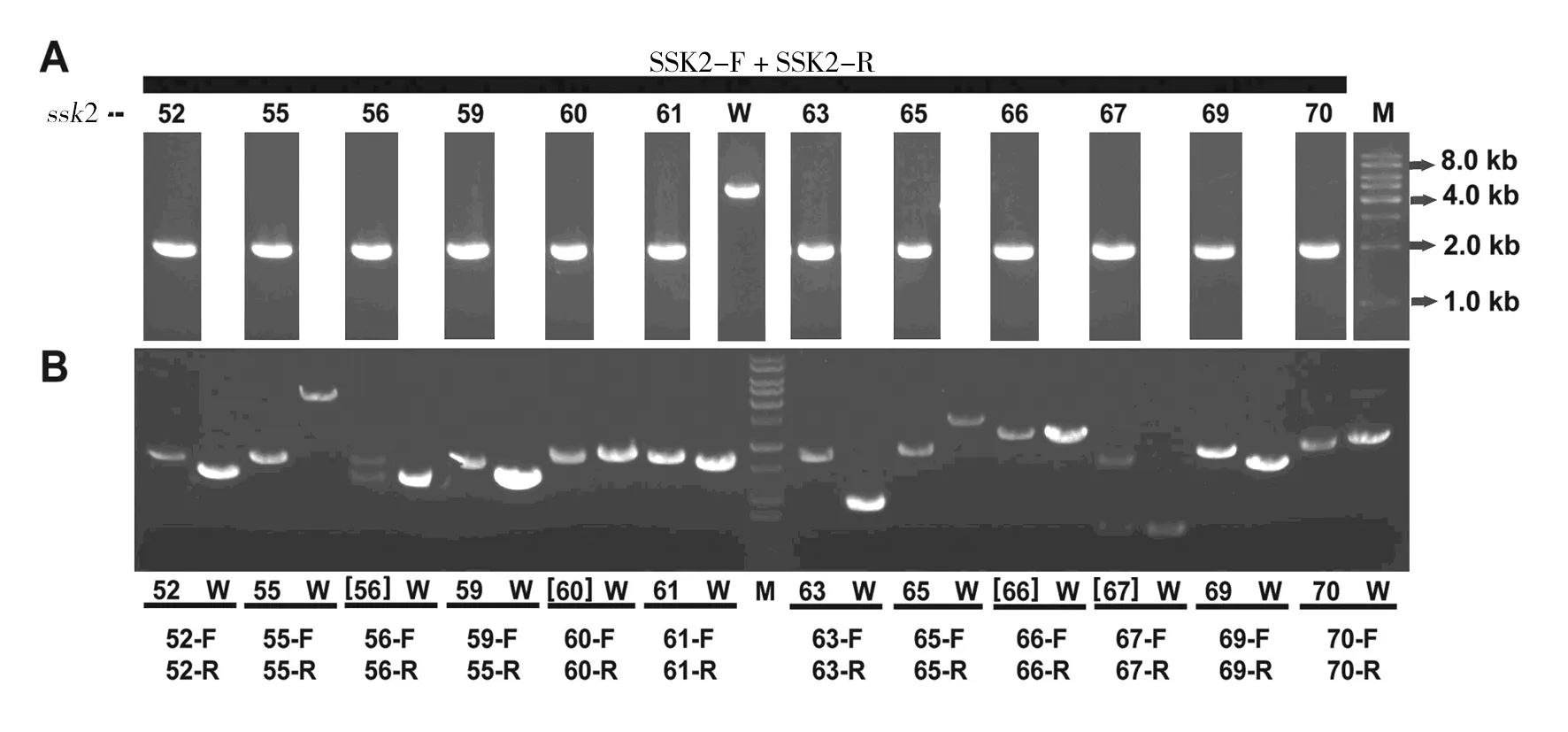
图5 双基因缺失株基因型验证Fig.5 Genotype verification of double-gene deletion mutantsA:利用电泳图上方的引物PCR验证双基因缺失株中的ssk2::natMX4;B:利用黑色短线下方的引物PCR验证双基因缺失株中被kanMX4替换的基因;W表示野生型BY4741菌株;M表示DNA markerA:PCR confirmation of ssk2::natMX4 in double-gene mutants. Primers are indicated above the gel;B:PCR confirmation of kanMX4 alleles in their correspoinding double-gene mutants of genes indicated below the gel (see Table 1 for their gene names). Primers are indicated below black bars;W:is the wild type BY4741 strain;M:DNA size marker

编号菌株名称编号菌株名称编号菌株名称编号菌株名称2ssk2vps822ssk2slt245ssk2gup173ssk2fab13ssk2csf124ssk2ste5046ssk2vps174ssk2pbs25ssk2vps1325ssk2swi650ssk2rlf275ssk2ypr064w7ssk2hog128ssk2vam351ssk2vps976ssk2tps18ssk2srn229ssk2mnn1152ssk2rox178ssk2ydl023c9ssk2fig431ssk2mid255ssk2bck181ssk2rpl37b10ssk2mid132ssk2vps3859ssk2hom683ssk2vps72
续表2
3 讨 论
本研究通过合成遗传阵列(SGA)手段构建了HOG途径的蛋白激酶SSK2基因与其他52个Cd2+耐受相关基因之间的双基因缺失菌株,为进一步研究HOG途径和CWI途径在镉胁迫应答中的相互作用,以及细胞内参与镉胁迫应答的基因的功能和相互关系提供了一种新的方法。同时这一结果对研究Cd2+耐受基因之间在调控镉胁迫方面的遗传学相互作用具有一定科学意义,为深入研究酿酒酵母细胞的Cd2+毒理作用提供了素材。
[1] Hartwig A. Metal interaction with redox regulation: an integrating concept in metal carcinogenesis[J] Free Radic Biol Med, 2013, 55: 63-72.
[2] Thévenod F, Lee WK. Cadmium and cellular signaling cascades: interactions between cell death and survival pathways [J]. Arch Toxicol, 2013, 87(10): 1743-1786.
[3] Person RJ, Tokar EJ, Xu Y, et al. Chronic cadmium exposureinvitroinduces cancer cell characteristics in human lung cells [J]. Toxicol Appl Pharmacol, 2013, 273(2): 281-288.
[4] Lin YS, Caffrey JL, Lin JW, et al. Increased risk of cancer mortality associated with cadmium exposures in older Americans with low zinc intake[J]. J Toxicol Environ Health, 2013, 76(1): 1-15.
[5] Wang B, Du Y. Cadmium and its neurotoxic effects[J]. Oxid Med Cell Longev, 2013, 2013: 898034.
[6] Jiang LF, Yao TM, Zhu ZL, et al. Impacts of Cd(II) on the conformation and self-aggregation of Alzheimer’s tau fragment corresponding to the third repeat of microtubule-binding domain[J]. Biochim Biophys Acta, 2007, 1774(11): 1414-1421.
[7] Chen L, Liu L, Huang S. Cadmium activates the mitogen-activated protein kinase (MAPK) pathway via induction of reactive oxygen species and inhibition of protein phosphatases 2A and 5 [J]. Free Radic Biol Med, 2008, 45(7): 1035-1044.
[8] Qu W, Fuquay R, Sakurai T, et al. Acquisition of apoptotic resistance in cadmium-induced malignant transformation: Specific perturbation of JNK signal transduction pathway and associated metallothionein overexpression[J]. Molecular carcinogenesis, 2006, 45(8): 561-571.
[9] Elbirt KK, Whitmarsh AJ, Davis RJ, et al. Mechanism of sodium arsenite-mediated induction of heme oxygenase-1 in hepatoma cells role of mitogen-activated protein kinases[J]. J Biol Chem, 1998, 273(15): 8922-8931.
[10]Galán A, García-Bermejo ML, Troyano A, et al. Stimulation of p38 mitogen-activated protein kinase is an early regulatory event for the cadmium-induced apoptosis in human promonocytic cells[J]. J Biol Chem, 2000, 275(15): 11418-11424.
[11]Jiang L, Cao C, Zhang L, et al. Cadmium-induced activation of high osmolarity glycerol pathway through its Sln1 branch is dependent on the MAP kinase kinase kinase Ssk2, but not its paralog Ssk22, in budding yeast[J]. FEMS Yeast Res, 2014, 14(8): 1263-1272 .
[12]Baryshnikova A, Costanzo M, Dixon S, et al. Synthetic genetic array (SGA) analysis in Saccharomyces cerevisiae and Schizosaccharomyces pombe[J]. Methods Enzymol, 2010, 470: 145-179.
[13]Jiang L, Niu S, Clines KL, et al. Analyses of the effects of Rck2p mutants on Pbs2pDD-induced toxicity in Saccharomyces cerevisiae identify a MAP kinase docking motif, and unexpected functional inactivation due to acidic substitution of T379 [J]. Mol Genet Genomics,2004, 271(2): 208-219 .
[14]Kuzmin E, Sharifpoor S, Baryshnikova A, et al. Synthetic genetic array analysis for global mapping of genetic networks in yeast[J]. Methods Mol Biol, 2014, 1205: 143-168.
[15]Ooi SL, Pan X, Peyser BD, et al. Global synthetic-lethality analysis and yeast functional profiling[J]. Trends Genet, 2006, 22(1): 56-63.
[16]Tong AH, Lesage G, Bader GD, et al. Global mapping of the yeast genetic interaction network[J]. Science, 2004, 303 (5659): 808-813.
Construction of Double-Gene Deletion Mutants between SSK2 & other Cadmium-Tolerant Genes in Wine-making Yeast
XIONG Bing, YANG Yi, JIANG Ling-huo
(Coll.ofBio-Engin.,JiangnanUni.,StateEngin.Lab.ofGrainFerment’nTechnol. &Tech.,Wuxi,Jiangsu214122)
Cadmium is a serious environmental pollutant, it has carcinogenicity to human body, and it could accumulate in bions affecting their growth, development and reproduction. Mitogen-activate protein (MAP) kinases are important signaling molecules regulating cell survival, proliferation and differentiation, and they can be activated by cadmium stress. Two MAP kinase signaling pathways, the cell wall integrity (CWI) pathway and high-osmolarity and glycerol (HOG) pathway, are involved in the response to cadmium stress inSaccharomycescerevisiae. In order to study their genetic interactions in regulating cadmium stress,SSK2 was used as an example and constructed its double-gene deletion mutants with other 52 cadmium-tolerant genes in the study, using the synthetic genetic array (SGA) method. The study provides a basis for understanding the genetic interaction between cadmium-tolerant genes and a new genetic means for related studies in wine-making yeast.
Saccharomycescerevisiae; HOG; CWI; SGA;SSK2
国家自然科学基金项目 (81371784) ; 江南大学自主研究计划重点项目(JUSRP51313B)
熊兵 男,硕士研究生。研究方向为酵母遗传学与分子生物学。E-mail: 460917014@qq.com
* 通讯作者。男,博士,教授,博士生导师。研究方向为酵母和丝状真菌遗传学与分子生物学。E-mail: linghuojiang@jiangnan.edu.cn
2015-04-09;
2015-04-30
Q939.97
A
1005-7021(2016)01-0049-08
10.3969/j.issn.1005-7021.2016.01.009
