海马可溶性因子体外诱导分化大鼠内源性神经干细胞为胶质样细胞
2016-12-24陈凡帆钟文军涂兰波曹志恺
李 鹏 陈凡帆 谢 伟 张 昊 钟文军 涂兰波 曹志恺 全 伟
广州医科大学附属广州市第一人民医院神经外科(广州 510180)
·论著·
海马可溶性因子体外诱导分化大鼠内源性神经干细胞为胶质样细胞
李 鹏 陈凡帆 谢 伟 张 昊 钟文军 涂兰波 曹志恺 全 伟
广州医科大学附属广州市第一人民医院神经外科(广州 510180)
目的 探索内源性神经干细胞在大鼠海马可溶性因子中的体外发育归宿及分化鉴定。方法 显微镜下分离Wistar大鼠海马组织放置于低温DMEM/12培养基,低温振荡2小时后高速离心(15000 g),获取实验所用海马组织可溶性因子。取材出生1天的Wistar乳鼠海马中的内源性神经干细胞(endogenous neural stem cells,ENSCs),将ENSCs分别于含海马可溶性因子终浓度为0(对照组)、50、100、200、400μl/mL的无血清DMEM/F12培养基中培养6天并每日观察,使用免疫细胞化学、Western Blot印记技术比较各组ENSCs中Nestin、CD133的表达量;同时计量并比较各组ENSCs成球个数,以探索在模拟颅内微环境情况下,ENSCs发育、归宿及分化。进一步于最适宜的海马可溶性因子终浓度中分化神经球,对分化的细胞行神经元特异性蛋白入(如:β-tubullin III、MAP2)及胶质细胞特异性蛋白(如:GFAP、S100及p75 NGFR)免疫细胞化学检测。结果 大鼠ENSCs在培养基中呈单细胞漂浮生长,球形;ENSCs于海马可溶性因子各实验分组中培养第2天呈细胞球状态,对照组中无细胞球形成(与100μl/mL组比较,P1=0.00),100μl/mL组与对照组比较有统计学意义(P1=0.00<0.05);至第6天,在100μl/mL组中的细胞球数量明显多于其余各组(P1’=P2’=P3’=P4’=0.00)。在免疫细胞化学检测中,100μl/mL组中细胞球表达干细胞高亲和蛋白Nestin、CD133阳性,Western Blot免疫印迹检测其中Nestin、CD133蛋白高于对照组。进一步分化试验中,细胞球呈贴壁生长的单细胞状态、有突起伸出、长梭形,免疫细胞化学检测分化的细胞表达胶质细胞特异性蛋白GFAP、S100、p75NGFR阳性,但不表达神经元特异性蛋白β-tubullin III与MAP2。结论 大鼠ENSCs在终浓度为100μl/mL的HSF作用下,可促进ENSCs的增殖分裂;ENSCs在同样浓度下的HSF中可进一步分化为表达GFAP、S100、p75NGFR阳性的胶质样细胞;100μl/mL的HSFS是ENSCs的一种生理性诱导剂或参与促进ENSCs增殖、分化及通过细胞替代或因子分泌等机制修复神经损伤。
海马 可溶性因子 微环境 干细胞 胶质样细胞
内源性神经干细胞(endogenous neural stem cells,ENSCs)是神经系统发育过程中保留的具有自我更新、多向分化潜能的原始细胞,可分化为神经元、星形胶质细胞、小胶质细胞等[1]。因其免疫原性低、无致瘤性等生物学特性,给中枢神经系统疾病的治疗点燃了无限希望。处于干细胞巢(stem cells niche)中的ENSCs在颅内微环境(intrcranial microenviroment)的调节,在颅内微环境中的增殖、分化及迁移等细胞行为学特点一直是神经医学领域研究的热点及难点[2]。本研究分离大鼠脑组织海马结构,通过低温振荡、高速离心、灭菌等方法提取海马可溶性因子(hippocampus soluble factors,HSF)。将ENSCs接种于含HSF不同终浓度的DMEM/F12无血清培养基中,观察在不同浓度的HSF中,ENSCs的形态学发育,并使用免疫细胞化学、western blot免疫印迹技术对发育的细胞进行鉴定,为模拟颅内微环境探索ENSCs于宿主中的发育归宿提供实验基础。
1 资料与方法
1.1 实验动物 实验所需动物均购买于南方医科大学实验动物中心。分别为:体重250 g的Wistar大鼠;出生3天以内的Wistar乳鼠(动物合格证号:NO.44002100005375)。
1.2 实验试剂 3.6%水合氯醛、Neurobasal培养基、DMEM/F12、EDTA、左旋胞嘧啶、木瓜蛋白酶、胰酶抑制剂、胎牛血清、0.01mol/L PBS、0.3%Triton X-100、山羊血清封闭液、兔抗Nestin(1∶200,sigma)、兔抗GFAP(1∶300,abcam)、兔抗 CD133(1∶200,Santa Cruz)、兔抗P75NGFR(1∶300,abcam)、兔抗 S100(1∶400,abcam)、兔抗MAP2(1∶300,sigma)、兔抗β-tubullin III(1∶400,abcam)、Alexa Fluor 488标记羊抗兔IgG(1∶200),Alexa Fluor 594标记羊抗兔IgG(1∶200)、1×Tris-甘氨酸电泳缓冲液、10%脱脂奶粉封闭液、PBST、DAPI防淬灭的封片剂等等。
1.3 海马可溶性因子提取 选择体重为250 g的Wistar大鼠,腹腔注射3.6%水合氯醛(1mL/100 g)后断头。低温环境下将海马结构放置在离心管中,实验过程中按每只大鼠的海马结构浸泡于2mL的冷DMEM/F12,在摇床中低温振荡2小时后,使用高速离心(15000 g,30min,4℃),经过滤灭菌,分装1mL/管,于-20℃保存。该方法已授权为国家发明专利(专利号:NO.201210492449.5.)。
1.4 内源性神经干细胞培养 选取出生1天的Wistar乳鼠1只,在显微镜下无菌取出大脑组织,置于含冷DMEM/高糖培养基的无菌皿内,于显微镊下,切除小脑,尽量去除脑膜及血管,分离海马,将分离所得海马置于灭菌青霉素瓶内;将含DMEM/F12、EDTA及木瓜蛋白酶的消化液加入青霉素瓶内,将海马组织碎片转移到15mL离心管内消化20分钟后;使用胎牛血清及胰酶抑制剂终止消化,通过适当吹打松解细胞,尽量呈现单细胞状态;经500目网筛过滤,收取细胞并离心;弃上清液备用。
1.5 模拟颅内微环境诱导干细胞成球实验 收集上述取材的细胞接种于含海马可溶性因子终浓度分别为0,50,100,200,和400μl/mL的DMEM/F12中培养4天。普通光镜下观察细胞形态学并计算在第2、6天各组细胞球数量。
1.6 神经球免疫荧光鉴定 收集100μl/mL组中培养4天的细胞球移入2mLEP管中,依次进行0.01 mol/L PBS清洗3次,4%多聚甲醛固定30min;0.01 mol/L PBS冲洗3次;0.3%Triton X-100破膜;正常山羊血清封闭1小时。滴加一抗:兔抗Nestin(1∶200,sigma)和兔抗CD133(1∶200,Santa Cruz)后,孵育过夜,经PBS冲洗3次后;使用二抗(Alexa Fluor 488标记羊抗兔IgG(1∶200)和Alexa Fluor 594标记羊抗兔IgG(1∶200)孵育2小时,PBS冲洗3次;DAPI复染细胞核后涂片观察。阴性对照试验是以抗体稀释液代替一抗,镜下不显色,便为阴性结果。
1.7 神经球western blot鉴定 收集100μl/mL组中神经球于2mLEP管内,并加入细胞裂解液,提取细胞总蛋白,将处理好的样品上样并电泳,依次经转膜,封闭,PBST洗膜后,加入兔抗CD133(1∶1000,Santa Cruz)和兔抗Nestin(1∶1000,sigma)孵育2小时,再次同上述洗膜后;加辣根过氧化物酶标记二抗,再一次显影、定影。
1.8 海马可溶性因子分化神经干细胞 收集100μl/mL组中培养4天的神经球,移入含海马可溶性因子100μl/mL、1%胎牛血清的DMEM/F12的24孔培养板中继续培养并观察神经球的形态改变。
1.9 神经干细胞分化后细胞鉴定 吸弃上述24孔板中的培养液,分别经0.01 mol/L PBS冲洗3次,4%多聚甲醛固定30min,破膜,山羊血清封闭1小时后。加入一抗:兔抗GFAP(1∶300,abcam)、兔抗P75NGFR(1∶300,abcam)、兔抗S100(1∶400,abcam)、兔抗 MAP2(1∶300,sigma)和兔抗β-tubullin III(1∶400,abcam),孵育过夜,经PBS冲洗3次后;使用二抗(Alexa Fluor 488标记羊抗兔IgG(1∶200)和Alexa Fluor 594标记羊抗兔IgG(1∶200)孵育2小时,PBS冲洗3次;DAPI复染细胞核后涂片观察。阴性对照试验是以抗体稀释液代替一抗,镜下不显色,便为阴性结果。
1.10 统计学分析 采用SPSS 13.0统计软件包处理,计量数据以均数±标准差表示,内源性神经干细胞于不同浓度海马可溶性因子成球实验结果的分析采用One Way ANOVAs方法统计,以P<0.05为差异有统计学意义。
2 结 果
2.1 神经干细胞形态 Wistar乳鼠的海马组织取材后接种于DMEM/F12无血清培养基时,细胞为球形,悬浮单细胞状态,胞体透亮且小,边缘光滑(图1A,B)。

图1 原代内源性神经干细胞单细胞悬浮状态倒置相差显微镜A:100×,B:200×
2.2 神经干细胞成球实验 ENSCs在含不同浓度(0、50、100、200、400μl/mL)的 HSF的DMEM/F12中培养2天后,对照组(图2A)中无细胞球形成[与100μl/mL组(图2C)比较,P1=0.00(图3A)],与对照组比较,100μl/mL实验组有显著差异(P1=0.00<0.05,图3A);至第6天,在100μl/mL组(图2H)中的神经球数量明显多于其余各组(图2F,J,I,J;图 3B,P1′=P2′=P3′=P4′=0.00)。
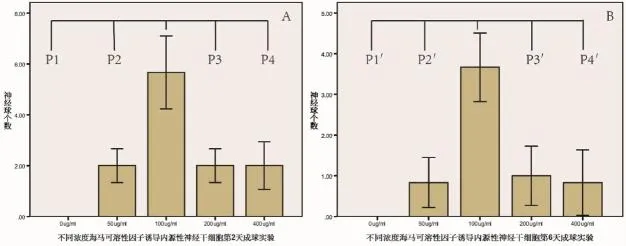
图3 内源性神经干细胞于不同海马可溶性因子中第2天及第6天的成球实验定量条图及统计学分析P1=P2=P3=P4=0.00<0.05,P1′=P2′=P3′=P4′=0.00<0.05
2.3 神经球免疫荧光鉴定 在100μl/mL实验组中形成的神经球经免疫细胞化学检测,可见细胞表达神经干细胞高亲和蛋白 Nestin(图4A)及 CD133(图4B)阳性,而对照组中的细胞表达Nestin蛋白及CD133阴性,同时阴性对照中无Nestin及CD133表达(图4C)。
2.4 神经球western blot鉴定 在100μl/mL实验组形成的神经球与诱导前的ENSCs经Western Blot法鉴定,结果显示,诱导后的细胞可见神经干细胞高亲和蛋白CD133及Nestin高表达的条带,CD133蛋白的分子量为120 kDa,Nestin蛋白的分子量为177 kDa,内参为35kD的GAPDH(图4D)。而未诱导的ENSCs表达的Nestin与CD133蛋白极其微量。
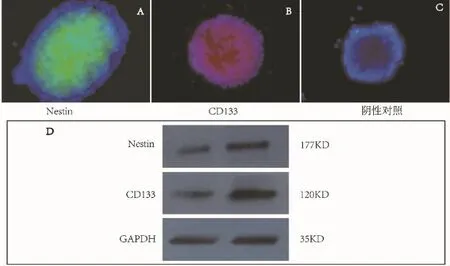
图4 内源性神经干细胞于100μl/mL浓度的海马可溶性因子中成球后荧光鉴定(nestin:A;CD133:B;阴性对照:C,蓝色为DAPI核染)及western blot鉴定(D)
2.5 神经干细胞于HSF中分化及免疫细胞化学鉴定 100μl/mL组中的神经干细胞在终浓度为含100μl/mL的HSF、1%胎牛血清的DMEM/F12中继续分化,接种2小时后,神经球开始贴壁生长并伸出突起,3天后细胞呈细长梭形,突起变长(图5A)。经免疫细胞化学检测,分化的细胞为表达GFAP(图5D)、S100(图5E)、P75 NGFR(图5F)阳性的胶质样细胞,不表达神经元特异蛋白MAP2(图5B)和β-tubullin III(图5C)。
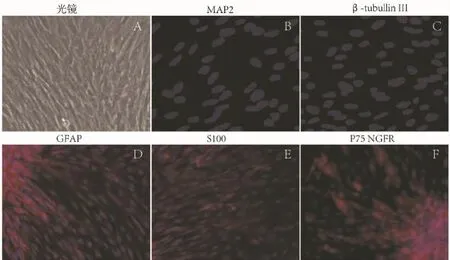
图5 内源性神经干细胞于含血清的100μl/mL浓度的海马可溶性因子中分化为表达GFAP,S100,p75NGFR阳性(红色)的胶质样细胞,不表达神经元特异性抗体MAP2,β-tubullin。蓝色为DAPI核染。荧光显微镜200×
3 讨 论
神经干细胞实验及临床研究一直是神经医学研究领域的热点及难点。大量实验结果证实,成熟的神经系统中存在神经干细胞,这些存在自身的干细胞称为内源性干细胞[3]。内源性干细胞所处的居所称为干细胞巢,而干细胞巢的稳定性有赖于所处的微环境,即由基质细胞、细胞外基质以及各种调控因子等共同构成[4]。生理情况下,巢中干细胞常保持“睡眠”状态,但病理过程时,受一些信号(如Wnt,Notch,bHLH等)激活后,神经干细胞即发生增殖,迁移和分化等细胞行为。内源性神经干细胞对神经系统结构和功能重建具有巨大潜力[5],为治疗各种中枢神经系统疾病提供了广阔前景。
本实验经提取大鼠的海马中HSF体外模拟宿主细胞颅内微环境,跟踪ENSCs在体内的发育及分化等归宿。ENSCs在含HSF100μl/mL无血清DMEM/F12中发育为表达Nestin及CD133阳性的神经干细胞。更重要的是,在该浓度的HSF中发育而成的神经干细胞进一步分化为表达GFAP、S100、P75NGFR阳性且不表达神经元特异蛋白βtubullin III和MAP2的胶质样细胞。故而,我们初步假设,在神经组织受到创伤情况下,其微环境中沉默的单个神经干细胞很可能发育、不断增殖成神经球并进一步分化成胶质样细胞,且胶质样细胞通过细胞替代或分泌营养因子,改善损伤灶周围微环境而参与修复中枢神经系统损伤[6]。
海马组织属于大脑边缘系统的一部分。海马组织的微环境是神经元、星形胶质细胞、小胶质细胞及干细胞均赖以生存的。所以探索ENSCs与颅内微环境的相互作用,为神经干细胞体内增殖、发育及分化过程提供一定的实验证据。近年来的研究主要聚焦在干细胞的迁移、再生、分化以及存活。本实验结果简而概之即:HSF用以模拟颅内的微环境,被认为是一种复合的生理性诱导剂,其作用于ENSCs,能够促进ENSCs分裂增殖,nestin与CD133蛋白的表达,并进一步分化为胶质样细胞[7]。其中潜在的机制可考虑:HSF中存在的某些蛋白或者小分子可激活诱导ENSCs分化为胶质样细胞的信号通路,因此该实验诱导方法可能快速促进ENSCs发育成神经干细胞,或者可考虑将HSF注射神经损伤区域作为修复中枢神经系统及周围神经疾病的一种参考方法[8]。因为分化的细胞是表达GFAP、S100、P75NGFR阳性的胶质样细胞,所以其优势可发挥在修复外周神经系统疾病方面。
本实验的不足之处为实验现象的潜在机制尚不明确,下一步拟对海马HSF行质谱分析,了解其中大部分蛋白质成分,探索某些分子激活ENSCs的信号通路。
综上所述,从海马组织提取的的HSF,尤其是在浓度为100μl/mL作用于ENSCs时,即体外模拟颅内微环境探索及验证ENSCs的发育与归宿;100μl/mL浓度的HSF可促进ENSCs的增殖分裂,且在该浓度中ENSCs可进一步分化为胶质样细胞。
4 结 论
大鼠ENSCs在终浓度为100μl/mL的HSF作用下,可促进ENSCs的增殖分裂,ENSCs在同样浓度下的HSF中可进一步分化为表达GFAP、S100、p75NGFR阳性的胶质样细胞;100μl/mL的HSFS是ENSCs的一种生理性诱导剂或参与促进ENSCs增殖、分化及通过细胞替代或因子分泌等机制修复神经损伤。
[1]YI MIN Z,QIU FU D,WEI HAO C,et al.Effects of acupuncture on cortical expression of Wnt3a,β-catenin and Sox2 in a rat model of traumatic brain injury.Acupunct Med[J].2015,21.pii:acupmed-2014-010742.doi: 10.1136/acupmed-2014-010742.
[2]CHEN L,QIU R,LI L,et al.The role of exogenous neural stem cells transplantation in cerebral ischemic stroke[J].J Biomed Nanotechnol,2014,10(11): 3219-30.
[3]DWAIN I,XIANGPENG Y,ZENG Z,et al.Neural stem cells-a promising potential therapy for brain tumors[J]. Curr Stem Cell Res Ther,2006,1(1):79-84.
[4]DADO O,SAQI M,LEVENBEDG S,et al.Mechanical control of stem cell differentiation[J].2012,7(1): 101-116.
[5]RADTKE C,SCHMITZ B,SPIES M,et al.Peripheral glial cell differentiation from neurospheres derived from adipose mesenchymal stem cells[J].Int J Dev Neurosci,2009,27(8):817-823.
[6]KIM S H,TURNBULL J,GUIMOND S.Extracellular matrix and cell signalling:the dynamic cooperation of integrin,proteoglycan and growth factor receptor[J].J Endocrinol,2011,209(2):139-151.
[7]李鹏,模拟脑内移植环境追踪间充质干细胞移植功能重建体外实验研究[D].南方医科大学,2013.
[8]LI P,DU M,FA Z,et al.Adult rat hippocampus soluble factors:A novel transplantationmodel mimicking intracranialmicroenvironment for tracing the induction and differentiation of adipose-derived stromal cells in vitro[J]. Neurosci Lett,2013,10,542:5-11.
Adult rat hippocampus soluble factors:a novel method mimicking intracranial microenvironment for tracing the induction and differentiation of endogenous neural stem cells in vitro
Li Peng,Chen Fanfan,Xie Wei,et al.Neurosurgery Department of Guangzhou First Hospital Affiliated Guangzhou Medical University
Objective The aim of this study was to explore induction and differentiation of endogenous neural stem cells(ENSCs)in the hippocampus soluble factors(HSF)from the hippocampus of adult Wistar rats by mimicking an intracranial microenvironment. Methods After Wistar rats sacrificed,the hippocampus tissue was obtained in cold DMEM/F12.After centrigued and filtered,the HSF was stored at-20℃.The ENSCs was obtained from the hippocampus tissue of a neonate Wistar rat.Collected the tissue,digested and obtained the ENSCs.After we observed the morphology,the ENSCs were cultured in different concentration(0、50、100、200、400μl/mL)of HSF for 6 days,and compared the expression of Nestin and CD133 by immunocytochemistry.Meanwhile,we compared the Nestin and CD133 protein by western blot.And then we explored the optimal concentration of HSF by the numbers of all groups on the second and sixth day.Furthermore,we did the differentiated experiment using the same concentration of HSF. Results The number of neurospheres in the 100μg/mL group was significantly higher than those in the other groups on the 6th day.Immunofluorescence revealed that the neurospheres from ENSCs in the 100μg/mL group more highly expressed nestin and CD133 than control.This result was confirmed by western blot analysis.The neurospheres can differentiate into glia-like cells in 100μg/mL HSF and 1%FBS expressing GFAP,S100 and P75 NGFR by immunofluorescence. Conclusion These data indicated that HSF alone,mimicking a destination of ENSCs in vitro,could induce and differentiate neurospheres from ENSCs,as a new method to get NSCs and glia-like cells differentiated from ENCs to repair thediseases of center nervous system.
Hippocampal;Soluble factors;Microenvironment;Stem cells;Glia-like cells
10.3969/j.issn.1000-8535.2016.01.001
2015-09-29)
国家自然科学基金(81301098)
全伟,E-mail:zhimeng_li@163.com
