硝苯地平缓释片含量测定及体外释药机理研究
2016-12-24刘壬通陈惠文潘雪刁杨智承
刘壬通,陈惠文,潘雪刁,杨智承
(1.广东省惠东县妇幼保健院,广东 惠州 516300; 2.广东药学院,广东 广州 510006)
硝苯地平缓释片含量测定及体外释药机理研究
刘壬通1,陈惠文1,潘雪刁2,杨智承2
(1.广东省惠东县妇幼保健院,广东 惠州 516300; 2.广东药学院,广东 广州 510006)
目的 建立测定硝苯地平缓释片中硝苯地平含量的高效液相色谱(HPLC)法。方法 色谱柱为Diamonsil C18柱(250 mm×4.6mm,5 m),流动相为甲醇-水(60∶40),检测波长为237 nm,流速为 1 m L/min,柱温为 30℃。结果 硝苯地平对照品溶液质量浓度在4.83~43.55 g/m L(r=0.999 9)范围内与峰面积呈良好线性关系,精密度、重复性试验结果的 RSD分别为0.91%和1.46%(n=6),平均回收率为99.94%,RSD为0.74%(n=9)。结论 该方法简便、快速、灵敏、重复性好,可用于硝苯地平缓释片的质量控制。
硝苯地平;缓释片;高效液相色谱法;含量测定;释放度
硝苯地平是第1代钙拮抗剂,是目前公认的安全有效的一线降压药物[1]。但治疗高血压的药物必须作用持久、效果稳定,而硝苯地平的持续作用时间较短,半衰期为4~5 h,一般常用量为每日2~3次[2-3],且血药浓度波动大,会产生峰谷现象,引起较多不良反应。为减少用药次数,使用药更安全,可通过改变工艺,采用亲水凝胶骨架材料,根据水分透过骨架微孔进而缓慢释放药物的原理[4],研制出硝苯地平缓释剂型,使药物平缓释放,达到理想效果。但2010年版《中国药典(二部)》并未对该缓释剂型含量的检测进行规定。为更好地控制和评价该剂型的质量,本研究中采用高效液相色谱(HPLC)法测定硝苯地平缓释片中硝苯地平的含量,并考察其体外释放行为,方法准确、灵敏度高、快速简便,现报道如下。
1 仪器与试药
仪器:Agilent1100 Series型高效液相色谱仪(美国Agilent公司);UV-2450型紫外可见分光光度计(日本岛津公司);80-2型离心沉淀机(上海手术器械厂);AB265-S型分析天平(梅特勒托利多公司)。
试药:硝苯地平对照品(中国药品生物制品检定所,批号为100338-200502);硝苯地平缓释片(广东环球制药有限公司,批号为 111003-2,120815-2,121010-1,规格为每片5mg);甲醇(广州化学试剂厂,色谱纯),水为超纯水(美国Milipore公司),其余试剂均为分析纯。
2 方法与结果
2.1 含量测定
2.1.1 色谱条件[5]
色谱柱:Diamonsil C18柱(250 mm×4.6 mm,5μm);流动相:甲醇-水(60∶40);检测波长:237 nm;流速:1m L/min;柱温:30℃;进样量:20μL。
2.1.2 溶液制备
对照品溶液:避光操作。精密称取硝苯地平对照品适量,置50m L棕色容量瓶中,加甲醇溶解并稀释至刻度制成每1mL含20μg的溶液,摇匀,即得。
供试品溶液:避光操作,取本品20片,精密称定,研细,精密称取适量(约相当于硝苯地平10mg),置50mL容量瓶中,加甲醇适量,超声处理使硝苯地平溶解,放冷,用甲醇稀释至刻度,摇匀,滤过,精密量取续滤液5m L,置50m L容量瓶中,用甲醇稀释至刻度,摇匀,即得。
阴性对照品溶液:按硝苯地平缓释片处方取处方中除硝苯地平外的其他辅料,按制备工艺制成阴性供试品,并依法制得。
2.1.3 方法学考察
检测波长选择:精密称取硝苯地平对照品适量,加适量甲醇溶解配制成20μg/mL的溶液,在210~400 nm波长范围内扫描,紫外扫描图谱见图1。结果在237 nm和233 nm波长处均有吸收峰,为提高检测灵敏度,最终选择 237 nm为检测波长。

图1 硝苯地平紫外吸收光谱图
专属性试验:分别取2.1.2项下硝苯地平对照品溶液、供试品溶液和阴性对照品溶液适量,按拟订色谱条件进样20μL,记录色谱图,见图2。结果,在供试品溶液相同色谱峰处,阴性对照品溶液无吸收峰,表明硝苯地平对测定结果无干扰,方法专属性强。
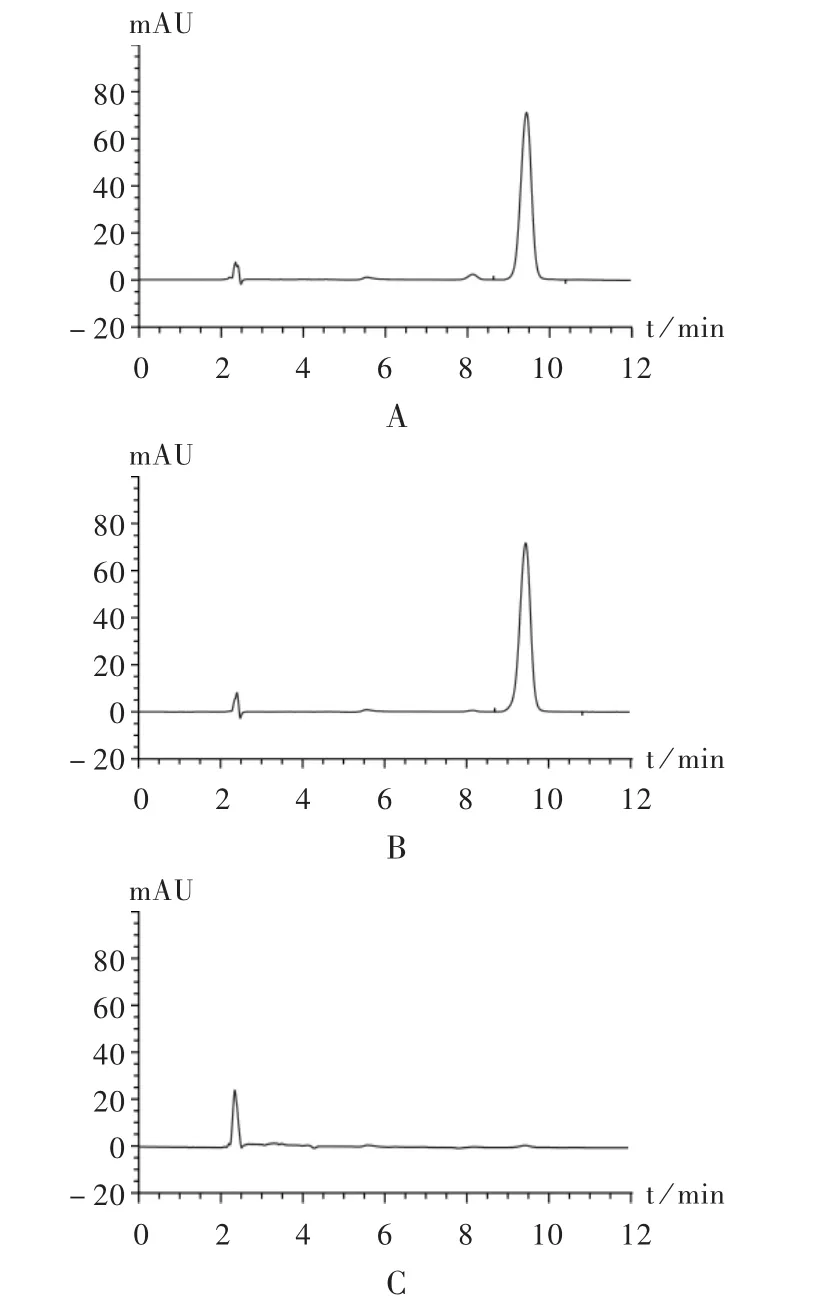
图2 高效液相色谱图
标准曲线制备:避光操作。精密称取硝苯地平对照品7mg,置25mL棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,分别精密量取0.4,0.9,1.8,2.7,3.6mL置25m L棕色容量瓶中,加甲醇稀释至刻度,摇匀,配制成每1mL含硝苯地平4.83,10.89,21.77,32.66,43.55μg的系列溶液。精密量取上述系列溶液各20μL注入高效液相色谱仪,按拟订色谱条件分别进样测定,记录色谱图。以硝苯地平质量浓度(C,μg/mL)为横坐标、峰面积(A)为纵坐标进行线性回归,得回归方程 A=57.522C+22.987,r=0.999 9(n=5)。结果表明,硝苯地平对照品溶液质量浓度在4.83~43.55μg/m L范围内与峰面积线性关系良好。
精密度试验:精密吸取同一对照品溶液20μL,重复进样6次,测定峰面积。结果的 RSD为0.91%(n=6),表明仪器精密度良好。
稳定性试验:取同一供试品溶液,分别于0,1,2,6,12,24 h时进样 20μL,测定峰面积。结果的 RSD为1.02%(n=6),表明供试品溶液在24 h内稳定。
重复性试验:取同一批样品,按2.1.2项下方法平行制备供试品溶液6份,分别进样20μL。结果的 RSD为1.46%(n=6),表明方法重复性良好。
回收率试验:称取已知硝苯地平含量的供试品适量(约相当于硝苯地平7mg)9份,精密称定,置25m L棕色容量瓶中,分别加入硝苯地平对照品的量为80%,100%,120%各3份,加甲醇适量,超声处理使溶解,放冷,用甲醇稀释至刻度,精密吸取2mL置25mL棕色容量瓶中,用甲醇稀释至刻度,摇匀,滤过。按拟订色谱条件,进样20μL测定,计算回收率。结果见表1。

表1 硝苯地平回收率试验结果(n=9)
2.1.4 样品含量测定
分别取3批硝苯地平缓释片,按2.1.2项下方法制备供试品溶液,按拟订色谱条件进样测定,计算样品含量。结果批号为111003-2,120815-2,121010-1的样品中硝苯地平平均含量分别为101.91%,100.26%,100.06%(n=3)。
2.2 体外释药机理研究
取本品,照2010年版《中国药典(二部)》附录ⅩD第二法的释放度测定法,采用第二法装置,以水(含1%的十二烷基硫酸钠)为释放介质,体积为900mL,转速为100 r/min,依法操作,分别于4,8,12,16,24 h时各取溶液5mL,并及时补充相同温度、相同体积的水,用0.45μm的滤膜滤过,取续滤液作为供试品溶液,按拟订色谱条件进样检测,计算不同时间的累积释放率。结果见图3。

图3 硝苯地平缓释片释放曲线(n=6)
为更直观地描述硝苯地平缓释片的体外释药机理,根据上述释放度测定结果,分别用不同释放模型(零级方程、一级方程、Higuchi方程、Ritger-Peppas方程、Weibull方程)进行线性拟合。结果见表2。可见,硝苯地平缓释片的体外释药符合Weibull释放模型,呈两相释药,前期快速释药,后期缓慢释药。
3 讨论
硝苯地平遇光不稳定,易分解成硝基苯吡啶衍生物和亚硝基吡啶衍生物,为避免影响测定结果,在整个操作过程中需注意避光。
本方法采用甲醇-水(60∶40)为流动相,有效地使硝苯地平与上述2种分解产物得到分离,保证了结果的准确性。另外,本试验中曾试用不同的柱温进行测定,主峰保留时间和与分解产物的分离度基本无变化,但柱压变动较大,最后发现柱温为30℃时最佳。试验结果显示,用HPLC法检测硝苯地平缓释片中硝苯地平的含量,方法回收率高、精密度好、简便、稳定可靠,可有效控制本品的质量,为该剂型确立质量标准提供了可靠依据。
本研究的另一目的在于探索硝苯地平缓释片的体外释药规律,为其体内释药行为提供一定的理论依据。由表2可见,Weibull分布拟合的相关系数最大,说明该方程能很好地描述硝苯地平缓释片的体外释药特征。另外,Ritger-Peppas方程拟合的相关系数也较大,Ritger-Peppas方程变换前的形式为 Q=ktn,其中 n为释放参数,是该方程中表征释放机制的特征参数。当n<0.45时,药物释放机制为Fick′s扩散;当 n>0.89时为骨架溶蚀;当0.45<n<0.89时,则为扩散和溶蚀的协同作用。比较上述拟合结果可知,溶出参数 n=1.199 5,表明主药以骨架溶蚀方式释药。

表2 不同释药模型的拟合方程和相关度
[1]陈光亮,王滨燕,戴小华,等.控释硝苯地平对不同证型高血压病的降压疗效的研究[J].时珍国医国药,2012,23(2):421-423.
[2]段官平,李 霞,杨成之.硝苯地平对人体平滑肌的作用研究进展[J].中国现代医生,2010,48(1):12-13.
[3]凌 俐,王 东.缓释与控释硝苯地平对高血压患者的降压作用比较[J].中国药房,2012,23(12):1 116-1 117.
[4]唐东霞,陈洪轩,和 平.硝苯地平缓释片的研究[J].中国现代药物应用,2007,1(4):21-22.
[5]王志强,吴继禹,夏锦泉.RP-HPLC法测定硝苯地平缓释片中硝苯地平的含量及分解产物[J].安徽医药,2007,11(2):132-133.
Content Determ ination and Release M echanism of Nifedipine Sustained Release Tab lets
Liu Rentong1,Chen Huiwen1,Pan Xuediao2,Yang Zhicheng2
(1.Huidong Women and Children Hospital,Huizhouo,Guangdong,China 516300; 2.Guangdong Pharmaceutical University,Guangzhou,Guangdong,China 510006)
Objective To establish a method for the content determination of nifedipine in Nifedipine Sustained Release Tablets by HPLC.M ethods The chromatographic separation condition of determination was as follows:Diamonsil C18column(250 mm×4.6 mm,5μm).The mobile phase consisted of methanol-water(60∶40)with the flow rate of 1.0 mL/min.The wave length of detection was 237 nm and the column temperature was maintained at 30℃.Resu lts The standard curve of nifedipine was linear within range of 4.83-43.55μg/mL(r=0.999 9).RSD of precision and reproducibility were 0.91% and 1.46%(n=6),respectively.Average of recovery was 99.94% with RSD of 0.74%(n=9).Conclusion The determination method of content by HPLC is simple,quick,sensitive,fine reproducibility,which could be used to control the quality of nifedipine sustained release tablets.
nifedipine;Sustained Release Tablets;HPLC;content determination;dissolution
R969.1;R972+.4
A
1006-4931(2016)06-0055-04
2015-08-13)
