亚麻花蕾发育中MS2-F基因的原位杂交
2016-12-24伊六喜斯钦巴特尔侯建华张辉高风云周宇
伊六喜,斯钦巴特尔,侯建华,张辉,高风云,周宇
(1.内蒙古农业大学农学院,呼和浩特010019;2.内蒙古农牧业科学院,呼和浩特010031)
亚麻花蕾发育中MS2-F基因的原位杂交
伊六喜1,2,斯钦巴特尔2,侯建华1,张辉2,高风云2,周宇2
(1.内蒙古农业大学农学院,呼和浩特010019;2.内蒙古农牧业科学院,呼和浩特010031)
本研究采用常规石蜡切片方法和原位杂交技术,以雄性可育株和雄性不育株亚麻为材料,利用T7和SP6引物对体外转录合成地高辛标记的MS2-F基因特异cRNA探针,并与亚麻花蕾切片进行原位杂交,观察MS2-F mRNA在亚麻花蕾内的时空表达信号。结果发现:亚麻MS2-F在四分体时期和小孢子发育早期的花蕾绒毡层中有杂交信号,而在四分体时期之前的绒毡层细胞中,没有MS2-F杂交信号;该基因从四分体时期开始到形成小孢子早期的绒毡层细胞中表达,进一步证明了该基因在亚麻花蕾发育过程中起着非常重要的作用,但是否具有关键性的作用需要进一步的深入研究。
亚麻;花蕾;基因;原位杂交
亚麻(Linum musitatissimum)MS2-F基因是亚麻中首次克隆的核雄性不育相关基因。该基因与玉米、油菜、小麦、甜菜等多种植物雄性不育基因具有同源性,其中同源性最高是油菜的基因MS2Bnap和拟南芥MS2(male sterility 2),分别为59.65%、59.16%。另外水稻和小麦等作物的脂酞辅酶A还原酶的基因具有较高的同源性。诸多研究报道该基因具有脂酞辅酶A还原酶的作用[1]。其cDNA大小为1709 bp,该基因开放阅读框架为1608 bp,编码535个氨基酸,5′端非编码区为70 bp,3′端非编码区为3l bp。MS2-F基因含有两个雄性不育保守区:NAD结合区的氨基酸序列从第52到第354;雄性不育C-末端区的氨基酸序列是从第468到第526。8个内含子的大小分别为:385 bp,75 bp,76 bp,75 bp,69 bp,88 bp,130 bp和89 bp,共计990 bp。此基因的内含子两端均有明显的GT/AG结构[1]。Northern杂交结果表明,该基因只在花蕾中表达,而在根、茎、叶中未见表达。
组织原位杂交包括取材、固定、制片、RNase灭活、杂交和检测等主要过程。组织原位杂交探针制备与Southern和Northern杂交相同。取材时应取便于观察细胞分裂的材料,如植物幼叶、茎尖、胚乳及花蕾等,有必要时可以用化学或物理方法对对材料进行预处理。植物原位杂交石蜡切片中通常选择4%的多聚甲醛、卡尔诺氏和FFA固定液。样品的固定时间和固定剂的量为样品的大小以及固定剂的穿透速度而决定,一般植物组织器官的固定时间为24 h左右。固定后制片,用DEPC水处理实验用具,尽量降低RNA的降解。杂交和自显影过程中关键点多、程序复杂,通常出现灵敏性不高和非特异性等问题[2-4]。
地高辛是目前非放射性标记物中应用最多的一种。需注意探针制备过程必须在超净工作台上进行并所有地高辛试剂保持冰浴,避免RNA的降解。地高辛标记的探针杂交体的检出是利用抗地高辛抗体与地高辛发生免疫结合,抗地高辛抗体上带有酶标记可通过酶反应检出[5]。一个酶标记抗体占据20个核甘酸的空间位置,所以标记时要选取适宜的反应条件,使每隔20~25个核苷酸掺入一个标记的核苷酸[6]。
1 实验材料
1.1 植物材料
供试材料为“亚麻(H919)”,将亚麻种子播种,在开花期,采集不同发育阶段的幼花蕾,投入新配制的4%多聚甲醛(PFA)进行固定。
1.2 引物
T7引物,序列为:5′-TAA TAC GAC TCA CTA TAG GG-3′
SP6引物,序列为:5′-ATT TAG GTG ACA CTA TAG AA-3′
由上海生工生物工程技术服务有限公司合成。
2 实验方法
2.1 RNA酶的灭活
防止RNase污染是整个实验成功与否的关键,实验操作之前(包括样品的固定、预杂交和杂交)杂交所用具和溶液都要进行RNase灭活。
2.2 花蕾切片的制作
采集亚麻花蕾迅速放入小瓶中,加入花蕾体积25倍左右的4%多聚甲醛。将盖好瓶塞,用注射器多次抽气直至花蕾全部沉入瓶底为止,除去气泡。4℃固定过夜。脱水、透明、包埋:50%乙醇2 h→70%乙醇2 h→80%乙醇2 h→95%乙醇2 h→无水乙醇2 h→无水乙醇2 h→无水乙醇:二甲苯(3:1)2 h→无水乙醇:二甲苯(1:1)2 h→无水乙醇:二甲苯(1:3)2 h→二甲苯1 h→二甲苯1 h→二甲苯:石(1:1)60℃12 h,使二甲苯充分蒸发→纯石蜡两次。然后按常规石蜡包埋程序包埋。切片,切片厚度8 μm。切片用DEPC-H2O45℃展片和贴片,37℃烘烤过夜。
2.3 探针模板的制备
PCR扩增反应:以亚麻MS2-F基因重组质粒为模板,先扩增出两端带有T7和SP6启动子的线性DNA(约1600 bp)为作探针合成与标记的模板。PCR反应体系:重组质粒DNA 2 μl、2xTaq PCR Master Mix 25 μl、T7引物1 μl、Sp6引物1 μl、ddH2O21 μl、终体积50 μl。扩增参数为:94℃预变性2 min;94℃30 s,46.5℃30 s,72℃2 min,35个循环;72℃延伸5 min。
2.4 PCR产物的回收与体外转录
PCR产物需经回收纯化。扩增产物经1.2%琼脂糖凝胶电泳,切下1600 bp处条带,用凝胶DNA回收试剂盒回收纯化。以增出两端带有T7和SP6启动子的线性DNA(约1600 bp)为作探针合成与标记的模板,用T7和SP6 RNA聚合酶分别合成地高辛标记的反义和正义MS2-F cRNA探针。转录体系:线性DNA模板10 μl、DEPC水3 μl、10xNTP标记混合液2 μl、10x转录缓冲液2 μl、RNase抑制剂1 μl、T7或SP6RNA聚合酶2 μl、终体积20 μl。
2.5 原位杂交
原位杂交技术不断的完善和技术革新亦有了很大的发展,组织原位杂交日益受到广泛重视,以往以Southern和Northern杂交为主的逐渐转向以组织原位杂交,并继续完善组织原位杂交技术的操作步骤,原位杂交实验周期长,程序复杂,且关键点多,
本实验参考国内外其他研究人员相关研究方法[7-10],并结合本实验具体情况摸索调整。
具体操作步骤如下:
1)预处理取出切片复温干燥至室温后,经二甲苯和不同梯度的乙醇脱蜡并复水,用DEPC水处理;PBS洗2次,每次3 min;然后用含2%TritonX-100的PBS处理10 min,再用PBS洗2次;再用含0.5%H2O2的甲醇室温处理30 min,DEPC水清洗3次后于37℃用蛋白酶K消化15 min,PBS洗3次,每次5 min,室温晾干。
2)预杂交和杂交每张切片滴加150 μl预杂交缓冲液,45℃避光温育30 min;甩去预杂交缓冲液,每片滴加探针/杂交工作液100 μl,轻轻盖上硅化的盖玻片,置入盛有2×SSC缓冲液的湿盒内,42℃过夜(16~18 h)。
3)杂交后处理杂交后的切片于37℃的2×SSC中漂洗,去除盖玻片,然后于2×SSC中洗2次,每次5 min,0.5×SSC洗1次,每次15 min,0.2×SSC洗2次,每次15 min。
4)免疫反应及显色每片加100 μl封阻溶液37℃封阻30 min;去净封阻溶液后,每片滴加100 μl兔抗地高辛-BSA抗体溶液,放入湿盒中,37℃避光温育60 min。以0.05 mol/L的PBS洗4次,每次5 min;然后每片滴加100 μl AP-羊抗兔IgG溶液,放入湿盒中,37℃避光温育60 min,0.05mol/L的PBS洗4次,每次5 min。每片滴加200 μl的NBT/BCIP显色液于标本上,37℃湿盒中避光显色20 min,然后充分水洗。
5)封片及观察将切片快速经梯度乙醇脱水(30%、50%、70%、95%和100%),二甲苯透明,中性树胶封片,显微镜观察拍摄。
3 结果与分析
3.1 亚麻MS2-F cRNA探针的合成及标记结果
以亚麻MS2-F基因重组质粒DNA为模板,用T7和SP6接头引物与质粒中目的基因两端的T7和SP6启动子序列结合进行PCR扩增,产生两端带有T7和SP6启动子的线性DNA(1600 bp),以此DNA作为探针合成与标记的模板,经1.2%琼脂糖凝胶电泳后结果如图1所示,扩增出的条带清晰明亮,在其上方没有明显的非特异性条带,对实验结果不产生影响。利用PCR扩增得到的线性DNA作为模板,回收纯化后通过体外转录技术,用T7和SP6 RNA聚合酶分别合成地高辛标记的反义和正义MS2-F探针。转录后产物的电泳图2,A泳道为转录后的初始产物,其中含有线性的DNA摸板;B泳道为经无RNase的DNaseI消化后的转录产物,已去除了质粒DNA摸板。由图可知,转录出的mRNA量大且农度较高。
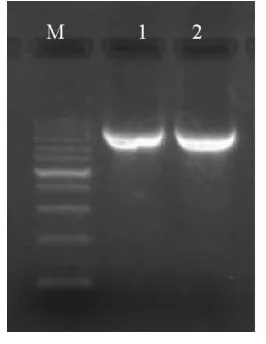
图1 探针模板PCR扩增Fig.1 PCR amplification of probe template
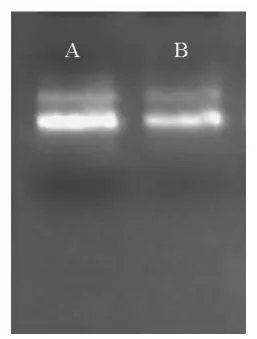
图2 RNA探针电泳图Fig.2 Electrophoresis analysis of RNA probe
3.2 原位杂交结果
用地高辛标记的亚麻MS2-F cRNA探针与亚麻花蕾切片进行原位杂交,检测MS2-F mRNA在亚麻花蕾的时空表达。观察杂交的结果发现:MS2-F基因在亚麻花粉发育的四分体时期之前花蕾中没有表达信号,在四分体时期(图3)和小孢子早期(图4)绒毡层中有特异性表达信号。
从图3a中可以看出,在四分体时期花蕾中有阳性杂交信号,信号主要分布在绒毡层细胞中;同步进行的阴性对照,即正义探针对照(图3b)和空白对照(图3c)未见杂交信号,说明阳性信号是特异性杂交的结果。
从图4a中可以看到,在小孢子早期时的花蕾绒毡层中也有阳性杂交信号,信号分布在绒毡层,同步进行的阴性对照,即正义探针对照(图4b)和空白对照(图4c)未见杂交信号,说明阳性信号是特异性杂交的结果。
原位杂交结果表明,该基因在亚麻花粉发育过程中起着非常重要的作用,Aarts等人从拟南芥克隆出核雄性不育基因MS2之后在野生拟南芥花蕾切片组织原位杂交结果基本一致。但是否具有关键性的作用需要进一步的深入研究。
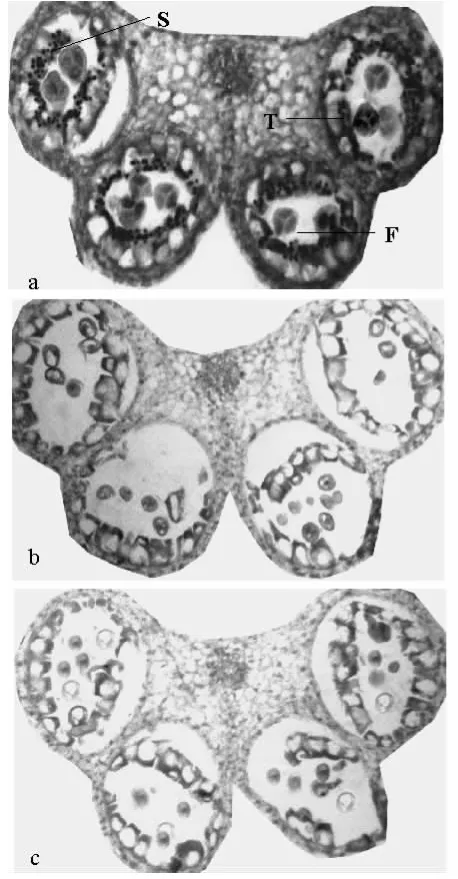
图3 四分体时期杂交结果Fig.3 Expression of MS2-F mRNA in tetrad period
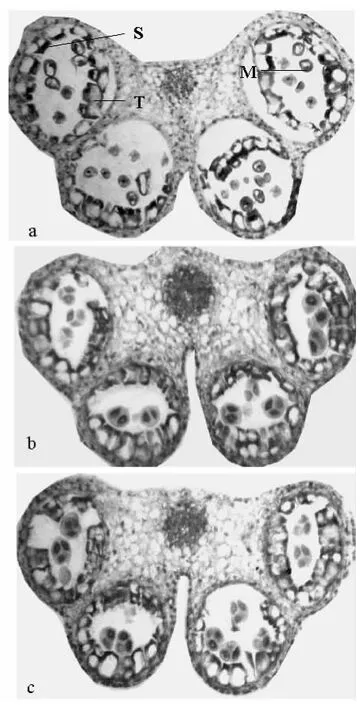
图4 小孢子早期杂交结果Fig.4 Expression of MS2-F mRNA in microspore period
4 讨论
亚麻是自花授粉作物,天然异交率很低,一般为1%左右。但可育株亚麻花由于颜色鲜艳、花冠张开,容易引诱昆虫菜花,促进异花授粉;田间花粉也可以借助风力进行花间传送,造成异花授粉。而雄性不育亚麻的花瓣不能充分展开,几乎没有天然异交率,因而难以用于杂交种的生产[7-9]。近几年,随着分子生物技术的不断发展,促进了分子水平上研究亚麻雄性不育。1975年显性雄性核不育亚麻发现之后又首次克隆亚麻雄性不育基因MS2-F,为获得转雄性不育基因亚麻提供了珍贵的材料,将进一步广泛应用于亚麻遗传育种方面[10]。利用组织原位杂交技术进一步检测研究在亚麻花蕾与其他组织细胞内雄性不育相关基因的表达模式,为杂交优势以及亚麻改良中奠定理论依据[11,12]。
为了深入了解MS2-F基因的生物学功能,本研究用地高辛标记的亚麻MS2-F RNA探针杂交体的检出亚麻花蕾中的具体表达部位和时间,从亚麻花粉母细胞发育到成熟花粉过程中的MS2-F mRNA进行杂交,结果发现,亚麻MS2-F在四分体时期和小孢子早期的花蕾绒毡层中有特异性表达,而表达量在花蕾的不同发育阶段有所不同,具有阶段性:在四分体时期之前的绒毡层细胞中,没有MS2-F杂交信号;从四分体时期开始到形成小孢子早期,信号主要分布在绒毡层细胞中,且逐渐减弱。从MS2-F时空表达信号上看,本研究与Aarts等人从拟南芥克隆出核雄性不育基因MS2之后在野生拟南芥花蕾切片组织原位杂交结果即绒毡层和四分体时期与刚从四分体释放的小孢子时期表达结果基本一致[13]。原位杂交结果表明,该基因在亚麻花粉发育过程中起着非常重要的作用,但是否具有关键性的作用需要进一步的研究。
5 结论
了解了MS2-F基因的在亚麻花蕾中的具体表达模式,亚麻MS2-F基因在四分体时期和小孢子早期的花蕾中有特异性表达,信号主要分布在绒毡层细胞中。该基因在亚麻花粉发育过程中起着非常重要的作用。通过对常规石蜡切片技术和组织原位杂交的熟练掌握和对RNA探针合成体系及原位杂交体系的摸索优化,总结建立了一套完整的从切片到探针合成,再到原位杂交的技术体系,为其它基因的表达研究提供了很好的借鉴。
[1]斯琴巴特尔,李强,张辉,等.显性核不育亚麻可育、不育花蕾mRNA差异表达研究及差异片段分析[J].生物技术通报,2009,(8):67-70
[2]向正华,刘厚奇.核酸探针与原位杂交技术[M].上海:第二军医大学出版社,2001:29-30
[3]Bischoff F,Vahlkamp L,Molendijk A,et al.Localiza-tion of AtROP4 and AtROP6 and interaction with the guanine nucleotide dissociation inhibitor AtRhoGDI1 from Arabidopsis[J].Plant Mol Biol,2000,42(3):515-530
[4]Nadeau J A,Zhang X S,Li J,et al.Ovule development identification of stage-specific and tissue-specific cDNAs[J].Plant Cell,1996,(8):213-239
[5]Liang W H,Tang C R,Wu N H,et al.Cloning and characterization of a new actin gene from Oryza sativa L[J].Progress in Natural Science,2004,14(10):867-874
[6]Coen E S,Romero J M,Doyle S,et al.Floricaula:a homeotic gene required for flower development in Antirrhinum majus[J].Cell,1990,63:1311-1322
[7]Dang Z H,Zhang J P,She X C,et al.Induction male sterility in linseed by Antibiotics treatment[J].Chinese Journal of Oil Crop Sciences,2000,22(1):46-48
[8]Worrall D,Hird D L,Hodge R,et al.premature dissolution of the micr-Osporocyte callose wall cause male sterility in transgenic tobacco[J].Plant cell,1992(4):759-771
[9]Colcombet J,Boisson D A,Ros P R,et al.Arabidopsis SOMATIC EMBRYOGENESIS RECEPTOR KINASES1 and 2 are essential for tapetum development and microspore maturation[J].Plant Cell,2005,17(12):3350-3361
[10]Sorensen A M,Krober S,Unte U S,et al.The Arabidopsis A BORTED MICROSPORES(A M S)gene encodes a M Y C class transcription factor[J].Plant J,2003,33(2):413-423
[11]李雪林,杨书化,张泽民,等.植物杂种优势遗传机制的分子遗传学研究进展[J].植物学通报,2003,23(3):62-65
[12]姜文,伊六喜,高凤云,等.亚麻花蕾发育相关基因的表达研究[J].华北农学报,2015,30(5):104-107
[13]Aarts M,Dirksc W G,Stekema W J,et al.Transposon tagging of a male sterility gene in Arabidopsis[J],Nature,1993,(363):715-717
Hybridization of Gene MS2-F in Flax Anther
YI Liuxi1,2,SIQIN Bateer2,HOU Jianhua1,ZHANG Hui2,GAO Fengyun2,ZHOU Yu2
(1.Institute of Agronomy,Inner Mongolia Agriculture University,Huhhot 010019,China;2.Inner Mongolia Academy of Agricultural and Husbandry Sciences,Hohhot 010031,China;)
In the study,the conventional paraffin method was applied to explore the period and process of pollen aborsion in dominant nuclear sterile flax using male fertile and male sterile flax separated from the dominant nuclear sterile flax line as material.Temporal and spatial expression of male sterility related gene MS2-F in flax anther was studied.Digoxin labeled MS2-F specific cRNA probe was synthesized in vitro using T7 and SP6 primers,and was hybridized with flax anther slice.Strong hybridization signal was observed in the tapetum from the period of tetrad to the early period of microspore development,and no hybridization signal was observed during pre-tetrad period,proving that MS2-F was specifically expressed in tapetum during the period of tetrad and microspore early development.
flax;flower bud;gene;in situ hybridization
S563.2
A
1671-3532(2016)06-0263-05
2016-8-30
内蒙古农牧业科技创新基金(2011CXJJM01-2);国家自然科学基金(31160288)
伊六喜(1986-),男,助理研究员,在读博士,主要从事植物分子生物学研究。yiliuxivip@163.com
*通讯作者:斯钦巴特尔(1965-),研究员,男,博士,主要从事植物分子生物学研究。nmgbaater@163.com
