强化神经营养方案对急性脑出血患者的影响研究
2016-12-23赵雄飞赵志茹徐家萍张芮娟
赵雄飞,赵志茹,徐家萍,张芮娟,宋 宵,王 玉
·论著·
强化神经营养方案对急性脑出血患者的影响研究
赵雄飞,赵志茹,徐家萍,张芮娟,宋 宵,王 玉
目的 探讨强化神经营养方案对急性脑出血患者的影响。方法 选取2013年2月—2016年2月延安大学咸阳医院收治的急性脑出血患者140例,按照随机数字表法分为对照组和观察组,每组70例。对照组患者在对症治疗基础上予以单唾液酸四己糖神经节苷脂钠治疗,观察组患者在对照组基础上予以注射用鼠神经生长因子治疗;两组患者均连续治疗4周。比较两组患者临床疗效及治疗前后美国国立卫生研究院卒中量表(NIHSS)评分、水肿面积、血肿体积、Barthel指数(BI)评分、炎性因子〔基质金属蛋白酶9(MMP-9)、N末端B型脑钠肽前体(NT-proBNP)、白介素8(IL-8)、肿瘤坏死因子α(TNF-α)〕水平、氧化应激指标〔丙二醛(MDA)、超氧化物歧化酶(SOD)〕和髓鞘碱性蛋白(MBP)水平。结果 观察组患者临床疗效优于对照组(P<0.05)。治疗前两组患者NIHSS评分、水肿面积、血肿体积、BI评分比较,差异无统计学意义(P>0.05);治疗后观察组患者NIHSS评分低于对照组,水肿面积、血肿体积小于对照组,BI评分高于对照组(P<0.05)。治疗前两组患者MMP-9、NT-proBNP、IL-8、TNF-α水平比较,差异无统计学意义(P>0.05);治疗后观察组患者MMP-9、NT-proBNP、IL-8、TNF-α水平低于对照组(P<0.05)。治疗前两组患者MDA、SOD水平比较,差异无统计学意义(P>0.05);治疗后观察组患者MDA、SOD水平低于对照组(P<0.05)。治疗前两组患者MBP水平比较,差异无统计学意义(P>0.05);治疗后观察组患者MBP水平低于对照组(P<0.05)。结论 强化神经营养方案可有效提高急性脑出血患者临床疗效,改善患者神经功能,促进脑血肿及水肿消退,提高患者日常生活能力,调节炎性因子、氧化应激状态及MBP水平。
脑出血;糖苷神经鞘脂类;神经生长因子;治疗结果
赵雄飞,赵志茹,徐家萍,等.强化神经营养方案对急性脑出血患者的影响研究[J].实用心脑肺血管病杂志,2016,24(10):46-49.[www.syxnf.net]
ZHAO X F,ZHAO Z R,XU J P,et al.Impact of intensive nerve nutrition scheme on acute cerebral hemorrhage[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(10):46-49.
急性脑出血是神经外科常见的急重症之一,具有起病急,病情进展迅速、复杂及临床预后差等特点。近年来,随着我国人口老龄化进程加剧,人们生活、工作节奏加快及习惯改变,急性脑出血发病率呈逐年上升趋势,已严重影响中老年人的生活质量[1]。研究表明,血肿区域局部脑循环改变、血-脑脊液屏障损伤、炎性反应加重及受损神经元凋亡在急性脑出血患者病情进展过程中发挥着重要作用[1]。目前,神经保护剂早期治疗急性脑出血的临床效果已被证实。神经节苷脂是常用的神经保护剂,但其治疗急性脑出血的临床效果不理想,且对神经损伤患者的病情控制不佳,无法有效满足临床需求[2]。神经生长因子是一种新型神经营养剂,其可有效促进急性脑出血患者受损神经元修复,提高患者的日常生活质量[3]。本研究旨在探讨强化神经营养方案对急性脑出血患者的影响,现报道如下。
1 资料与方法
1.1 纳入与排除标准 纳入标准:(1)符合中华医学会全国第四次脑血管病学术会议制定的“各类脑血管病诊断要点”中急性脑出血的诊断标准[4];(2)经颅脑CT及MRI检查确诊为脑出血;(3)发病后24 h内手术;(4)血肿量<30 ml;(5)参与研究前4周内未服用过神经营养剂;(6)本研究经医院伦理委员会审核批准;(7)患者家属签署知情同意书。排除标准:(1)有小脑、脑干及蛛网膜下腔出血患者;(2)有混合型脑出血患者;(3)有脑动脉瘤患者;(4)有脑血管畸形患者;(5)有脑疝或存在深度昏迷患者;(6)有血液系统疾病患者;(7)有严重脏器功能障碍患者;(8)临床资料不全患者。
1.2 一般资料 选取2013年2月—2016年2月延安大学咸阳医院收治的急性脑出血患者140例,按照随机数字表法分为对照组和观察组,每组70例。对照组中男44例,女26例;年龄57~68岁,平均年龄(62.7±4.3)岁;发病至入院时间4~11 h,平均发病至入院时间(7.1±1.6)h;出血部位:丘脑5例,脑叶11例,壳核25例,基底核29例;合并疾病:原发性高血压51例,糖尿病29例,冠心病20例。观察组中男47例,女23例;年龄58~70岁,平均年龄(62.9±4.4)岁;发病至入院时间4~12 h,平均发病至入院时间(7.2±1.7)h;出血部位:丘脑7例,脑叶12例,壳核23例,基底核28例;合并疾病:原发性高血压47例,糖尿病28例,冠心病22例。两组患者性别(χ2=0.72)、年龄(t=1.14)、发病至入院时间(t=1.02)、出血部位(χ2=1.43)、原发性高血压发生率(χ2=0.69)、糖尿病发生率(χ2=0.88)、冠心病发生率(χ2=1.02)比较,差异无统计学意义(P>0.05),具有可比性。
1.3 方法 两组患者入院后均予以对症治疗,包括控制颅内压、降血压、降血糖、持续氧疗及纠正水电解质紊乱等,对照组患者在此基础上予以单唾液酸四己糖神经节苷脂钠(齐鲁制药有限公司生产,国药准字H20046213,规格:2 ml∶20 mg)治疗,治疗第1周单唾液酸四己糖神经节苷脂钠100 mg加入5%葡萄糖溶液100 ml中静脉滴注、1次/d,治疗第2~4周单唾液酸四己糖神经节苷脂钠30~40 mg加入5%葡萄糖溶液30~40 ml中静脉滴注、1次/d;观察组患者予以强化神经营养方案治疗,单唾液酸四己糖神经节苷脂钠用法用量同对照组,加用注射用鼠神经生长因子(丽珠集团丽珠制药厂生产,国药准字S20100005,规格:30 μg)30 μg/d肌肉注射。两组患者均连续治疗4周。
1.4 观察指标 比较两组患者临床疗效及治疗前后美国国立卫生研究院卒中量表(NIHSS)评分、水肿面积、血肿体积、Barthel指数(BI)评分、炎性因子〔基质金属蛋白酶9(MMP-9)、N末端B型脑钠肽前体(NT-proBNP)、白介素8(IL-8)、肿瘤坏死因子α(TNF-α)〕、氧化应激指标〔丙二醛(MDA)、超氧化物歧化酶(SOD)〕和髓鞘碱性蛋白(MBP)。采用NIHSS评分评估神经功能损伤程度,分值越高表明神经功能损伤程度越严重[4];采用多田氏法计算水肿面积和血肿体积,计算公式:π/6×长轴×短轴×水肿层面(出血层面)[4],仪器采用德国西门子公司生产的128排双源CT ;采用BI评分评估日常生活质量,分值越高表明日常生活质量越好[4];采用酶联免疫吸附法检测炎性因子(MMP-9、NT-proBNP、IL-8、TNF-α)、MDA及MBP水平;采用黄嘌呤氧化法检测SOD水平。
1.5 临床疗效判定标准 根据“脑卒中患者临床神经功能缺损程度评分标准(1995)”[5]进行判定,基本治愈:患者病残程度为0级,NIHSS评分降低>90%;显著进步:患者病残程度为1~3级,NIHSS评分降低51%~90%;好转:患者病残程度为4~6级,NIHSS评分降低21%~50%;无效:患者未达上述标准。

2 结果
2.1 临床疗效 观察组患者临床疗效优于对照组,差异有统计学意义(u=8.67,P<0.05,见表1)。
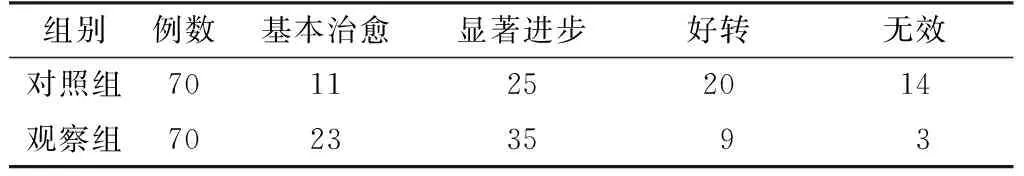
表1 两组患者临床疗效比较(例)
2.2 NIHSS评分、水肿面积、血肿体积、BI评分 治疗前两组患者NIHSS评分、水肿面积、血肿体积、BI评分比较,差异无统计学意义(P>0.05);治疗后观察组患者NIHSS评分低于对照组,水肿面积、血肿体积小于对照组,BI评分高于对照组,差异有统计学意义(P<0.05,见表2)。
2.3 炎性因子 治疗前两组患者MMP-9、NT-proBNP、IL-8、TNF-α水平比较,差异无统计学意义(P>0.05);治疗后观察组患者MMP-9、NT-proBNP、IL-8、TNF-α水平低于对照组,差异有统计学意义(P<0.05,见表3)。
2.4 氧化应激指标 治疗前两组患者MDA、SOD水平比较,差异无统计学意义(P>0.05);治疗后观察组患者MDA、SOD水平低于对照组,差异有统计学意义(P<0.05,见表4)。

表4 两组患者治疗前后氧化应激指标比较
2.5 MBP 治疗前对照组患者MBP水平为(18.0±4.2)mg/L,观察组为(18.1±4.3)mg/L;治疗后对照组患者MBP水平为(12.5±3.1)mg/L,观察组为(8.4±2.1)mg/L。治疗前两组患者MBP水平比较,差异无统计学意义(t=1.27,P>0.05);治疗后观察组患者MBP水平低于对照组,差异有统计学意义(t=2.56,P<0.05)。

表2 两组患者治疗前后NIHSS评分、水肿面积、血肿体积及BI评分比较

表3 两组患者治疗前后炎性因子比较
3 讨论
急性脑出血患者会出现结构性缺血改变,导致局部脑血流量下降并进一步加重神经功能损伤;同时血肿可压迫毗邻脑组织,导致血管床容量缩小,使血管活性物质释放增多,从而诱发血管痉挛,导致缺血脑组织增多[6]。流行病学调查结果显示,脑出血患者病死率约为60%,偏瘫、失语等神经功能损伤发生率为75%~80%[7]。近年来研究表明,急性脑出血继发病灶形成及周围组织炎性反应是导致神经功能损伤加重的危险因素[8]。目前,临床治疗急性脑出血以促进神经功能恢复、控制局部炎性反应及延缓病情进展为基本原则。
神经节苷脂主要分布于哺乳动物中枢神经系统细胞膜内,具有促神经组织生长和结构重塑作用[9]。研究表明,神经功能损伤时神经节苷脂水平明显下降,继而诱发Ca2+内流,相关钙蛋白水解加剧,导致神经元凋亡;神经节苷脂作为神经元组成的必需物质之一,可调控生长因子受体、细胞膜离子通道等,提高神经元Na+-K+-ATP 酶和Ca2+-Mg2+-ATP 酶活性,抑制兴奋性氨基酸毒性,稳定细胞膜功能及神经功能;神经节苷脂能促进神经轴突和突触形成,发挥营养、修复神经作用[10-12]。神经生长因子是机体内最常见的神经营养因子之一,可发挥营养神经元和刺激突触生长的作用。本研究采用的注射用鼠神经生长因子是自小鼠颌下腺中提取获得,由两条各含118个氨基酸的肽链组成。研究表明,注射用鼠神经生长因子能提高神经递质合成量和活性、加快神经元分化成熟、修复受损神经纤维及轴索,还可通过抑制神经元Ca2+超载而减轻机体氧化应激反应,降低局部炎性反应,抑制神经元凋亡,促进受损神经功能恢复等[13-14]。故强化神经营养方案治疗急性脑出血患者在营养受损神经元、保护脑组织功能方面具有协同作用。
本研究结果显示,观察组患者临床疗效优于对照组;治疗后观察组患者NIHSS评分低于对照组,水肿面积、血肿体积小于对照组,BI评分高于对照组,MMP-9、NT-proBNP、IL-8、TNF-α、MDA、SOD、MBP水平低于对照组。提示注射用单唾液酸四己糖神经节苷脂钠联合注射用鼠神经生长因子可降低急性脑出血患者炎性因子、氧化应激指标及MBP水平。研究表明,MMP-9异常表达可导致神经元外基质降解增加,从而加重血管源性水肿,扩大血肿面积;NT-proBNP水平与脑卒中患者神经功能损伤程度有关;IL-8和TNF-α在炎性反应进展中具有关键作用,可导致血肿周围炎性因子异常聚集,血管通透性增加及多种炎性递质释放,进而加重脑水肿及神经功能损伤[15-16]。氧化应激参与急性脑出血患者病理生理变化过程,其是出血后脑组织损伤的影响因素之一;中枢神经髓鞘组成蛋白MBP水平变化是反映神经功能损伤的指标之一。
综上所述,强化神经营养方案有助于提高急性脑出血患者临床疗效,改善患者神经功能,促进脑血肿及水肿消退,提高患者日常生活能力,调节炎性因子、氧化应激状态及MBP水平,值得临床推广应用。但本研究由于观察时间短、纳入样本量不足及为单中心研究等限制,研究结果仍有待扩大样本量行随机对照研究证实。
作者贡献:赵雄飞进行实验设计与实施、资料收集后整理、撰写论文、成文并对文章负责;赵志茹、徐家萍、张芮娟、宋霄、王玉进行实验实施、评估、资料收集;赵雄飞进行质量控制及审校。
本文无利益冲突。
[1]BEHROUZ R,HAFEEZ S,MILLER C M.Admission Leukocytosis in Intracerebral Hemorrhage:Associated Factors and Prognostic Implications[J].Neurocrit Care,2015,23(3):370-373.
[2]游潮,李浩.进一步重视和规范高血压脑出血的外科治疗[J].中华神经外科杂志,2011,27(8):757-758.
[3]IKRAM M A,WIEBERDINK R G,KOUDSTAAL P J.International epidemiology of intracerebral hemorrhage[J].Curr Atheroscler Rep,2012,14(4):300-306.
[4]中华医学会全国第四次脑血管病学术会议.各类脑血管病诊断要点[J].中华神经科杂志,1996,29(6):379-381.
[5]脑卒中患者临床神经功能缺损程度评分标准(1995)[J].中华神经科杂志,1996,29(6):62-64.
[6]KERNAN W N,OVBIAGELE B,BLACK H R,et al.Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2014,45(7):2160-2236.
[7]刘晓静,张拥波,李继梅.炎症与脑出血的靶向治疗[J].中国卒中杂志,2013,8(4):272-276.
[8]吴有志,罗良生,张健,等.高血压脑出血患者诊疗及预后的影响因素[J].中国老年学杂志,2013,33(14):3328-3329.
[9]李峰,朱少伟,朱树干,等.脑出血后神经炎症与干细胞交互调控的研究进展[J].中华神经医学杂志,2012,11(11):1175-1178.
[10]熊劲,江显萍.疏血通、神经节苷脂、依达拉奉联合治疗老年急性脑梗死的疗效[J].中国老年学杂志,2013,33(20):5109-5110.
[11]丁忠阳,张家明,黄国荣,等.单唾液酸神经节苷脂对创伤性脑水肿大鼠水通道蛋白4表达的影响[J].中国现代医学杂志,2012,13(20):37-39.
[12]ZHANG Z L,LIU Y G,HUANG Q B,et al.Nuclear factor-κB activation in perihematomal brain tissue correlates with outcome in patients with intracerebral hemorrhage[J].J Neuroinflammation,2015(12):53.
[13]JAUCH E C,PINEDA J A,HEMPHILL J C.Emergency Neurological Life Support:Intracerebral Hemorrhage[J].Neurocrit Care,2015(2):S83-93.
[14]盛鑫,黄晓江.鼠神经生长因子联合奥拉西坦注射液治疗脑出血的疗效观察[J].内科急危重症杂志,2014,20(3):162-163,172.
[15]ZHAO H,GARTON T,KEEP R F,et al.Microglia/Macrophage Polarization After Experimental Intracerebral Hemorrhage[J].Transl Stroke Res,2015,6(6):407-409.
[16]孟令秋,赵玉军,陈谦,等.神经生长因子治疗脑出血的临床疗效观察[J].中华老年心脑血管病杂志,2013,15(1):46-48.
(本文编辑:李洁晨)
Impact of Intensive Nerve Nutrition Scheme on Acute Cerebral Hemorrhage
ZHAOXiong-fei,ZHAOZhi-ru,XUJia-ping,ZHANGRui-juan,SONGXiao,WANGYu.DepartmentofCerebrovascularDisease,XianyangHospitalofYan′anUniversity,Xianyang712000,China
ZHAOXiong-fei,DepartmentofCerebrovascularDisease,XianyangHospitalofYan′anUniversity,Xianyang712000,China;E-mail:zhaoxf577@126.com
Objective To investigate the impact of intensive nerve nutrition scheme on acute cerebral hemorrhage.Methods A total of 140 patients with acute cerebral hemorrhage were selected in Xianyang Hospital of Yan′an University from February 2013 to February 2016,and they were divided into control group and observation group according to random number table,each of 70 cases.Patients of control group received monosialotetrahexosyl ganglioside sodium based on symptomatic treatment,while patients of observation group received mouse nerve factor injection based on that of control group;both groups continuously treated for 4 weeks.Clinical effect,NIHSS score,edema area,hematoma volume,Barthel index,inflammatory cytokines(including MMP-9,NT-proBNP,IL-8 and TNF-α),index of oxidative stress(including MDA and SOD)and MBP before and after treatment were compared between the two groups.Results The clinical effect of observation group was statistically significantly better than that of control group(P<0.05).No statistically significant differences of NIHSS scroe,edema area,hematoma volume or Barthel index was found between the two groups before treatment(P>0.05);after treatment,NIHSS score of observation group was statistically significantly lower than that of control group,edema area and hematoma volume of observation group were statistically significantly smaller than those of control group,while Barthel index of observation group was statistically significantly higher than that of control group(P<0.05).No statistically significant differences of MMP-9,NT-proBNP,IL-8 or TNF-α was found between the two groups before treatment(P>0.05),while MMP-9,NT-proBNP,IL-8 and TNF-α of observation group were statistically significantly lower than those of control group after treatment(P<0.05).No statistically significant differences of MDA or SOD was found between the two groups before treatment(P>0.05),while MDA and SOD of observation group were statistically significantly lower than those of control group after treatment(P<0.05).No statistically significant differences of MBP was found between the two groups before treatment(P>0.05),while MBPof observation group was statistically significantly lower than that of control group after treatment(P<0.05).Conclusion Intensive nerve nutrition scheme can effectively improve the clinical effect,neurological function and activity of daily living of patients with acute cerebral hemorrhage,promote the extinction of hematoma and edema,adjust the inflammatory cytokines,oxidative stress state and MBP level.
Cerebral hemorrhage;Glycosphingolipids;Nerve growth factor;Treatment outcome
712000陕西省咸阳市,延安大学咸阳医院脑血管病科
赵雄飞,712000陕西省咸阳市,延安大学咸阳医院脑血管病科;E-mail:zhaoxf577@126.com
R 722.151
A
10.3969/j.issn.1008-5971.2016.10.013
2016-07-17;
2016-10-15)
