马钱苷通过抑制蛋白磷酸酶2A催化亚基C磷酸化降低tau蛋白过度磷酸化
2016-12-23杨翠翠李雅莉
杨翠翠 李 林 张 丽 李雅莉 张 兰
(首都医科大学宣武医院药物研究室 北京市神经药物工程研究中心 北京脑重大疾病研究院 神经变性病教育部重点实验室,北京 100053)
· 神经系统疾病的基础研究 ·
马钱苷通过抑制蛋白磷酸酶2A催化亚基C磷酸化降低tau蛋白过度磷酸化
杨翠翠 李 林 张 丽 李雅莉 张 兰*
(首都医科大学宣武医院药物研究室 北京市神经药物工程研究中心 北京脑重大疾病研究院 神经变性病教育部重点实验室,北京 100053)
目的 探讨马钱苷对tau蛋白过度磷酸化的影响及其作用机制。方法 马钱苷(500、1 000 μmol/L)与人神经母细胞瘤细胞株(SK-N-SH细胞)预孵育24 h,之后加入PI3K抑制剂Wortmannin(WT)及PKA抑制剂GF-109203X(GFX)与SK-N-SH细胞孵育3 h,采用Western blotting方法观察马钱苷对tau蛋白在Thr205、Thr217、PHF-1位点的磷酸化,GSK-3β-Ser9、GSK-3β、PP2A催化亚基C(protein phosphatase 2A catalytic subunit C,PP2Ac)磷酸化/甲基化及PP2Ac的表达。结果 WT/GFX明显抑制p-GSK-3β-ser9的表达,引起GSK-3β活性增高,从而导致tau蛋白Thr205、Thr217、PHF-1位点高度磷酸化。马钱苷能够明显抑制模型细胞tau蛋白在Thr205、Thr217、PHF-1位点的过度磷酸化,但是不能增高p-GSK-3β-ser9的表达,提示马钱苷抑制tau蛋白磷酸化的作用不是通过影响GSK-3β通路实现的。但是实验显示马钱苷能够抑制PP2A催化亚基C Tyr307位点的磷酸化,但对Leu309位点甲基化无影响。结论 马钱苷能够抑制tau蛋白过度磷酸化,机制可能与其抑制PP2A催化亚基C Tyr307位点的磷酸化,提高PP2A活性有关,与GSK-3β通路无关。
马钱苷; tau蛋白过度磷酸化;糖原合成酶激酶-3β;蛋白磷酸酯酶2A;阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)又称老年性痴呆,是老年人中发病率最高的原发性神经退行性疾病,且是痴呆的最常见类型,在成人痴呆中约占60%[1-2]。临床上主要表现为记忆力和其他认知功能减退。
近年来研究[3]显示,AD患者脑内神经元纤维缠结NFTs 的数量与其临床症状呈正相关。异常过度磷酸化的tau蛋白是组成NFTs的主要成分[4]。Tau蛋白的磷酸化主要由蛋白磷酸激酶及蛋白磷酸酯酶系统调节。参与 tau 磷酸化的蛋白磷酸激酶主要包括糖原合成酶激酶-3 (glycogen synthase kinase-3,GSK-3)、周期蛋白依赖性蛋白激酶-5(cyclin-dependent protein kinase 5,Cdk5),应激激活的蛋白激酶和钙/钙调蛋白依赖性的蛋白激酶Ⅱ(calcium, calmodulin-dependent protein kinase Ⅱ,CaMKⅡ),cAMP依赖性蛋白激酶 (cyclic AMP-dependent protein kinase, PKA)[5-7]。其中GSK-3是一种导致tau蛋白过度磷酸化的重要的丝氨酸/苏氨酸类蛋白激酶。蛋白磷酸酶(protein phosphatases, PPs)可催化tau蛋白脱磷酸基,降低tau的磷酸化水平,使NFTs的结构松解,释放游离的tau蛋白[8]。蛋白磷酸酶PP2A和PP2B在抑制AD患者脑中tau蛋白过度磷酸化方面起关键作用,PP2A是最具活性的蛋白磷酸酶,其活性占总活性的70%[9]。PP2A的表达量和活性的下降会导致tau 蛋白异常过度磷酸化最终导致 AD 的发生[10]。目前发现拮抗tau蛋白磷酸化的有效药物成为主要的研究方向[11]。
祖国医学认为“肾生髓,脑为髓海”,通过补肾填髓防治衰老引起的记忆力下降,中医临床应用补肾中药防治痴呆已有数千年历史。山茱萸作为传统补肾中药,具有抗炎、抗氧化、抗衰老等作用,对于AD疾病的治疗具有较大优势。马钱苷为山茱萸有效成分之一,其用于治疗AD疾病鲜有报道。本实验通过tau蛋白过度磷酸化拟AD细胞模型初步探讨马钱苷对tau蛋白过度磷酸化的影响及其作用机制。
1 材料与方法
1.1 药物、试剂及仪器
1)药物:马钱苷购自中国药品生物制品检定研究院,实验中采用干粉剂量,溶解于蒸馏水,制成药液应用。
2)主要试剂:Wortmannin(WT,Enzo Life Sciences公司,美国);GF-109203X(GFX)、Aprotinin、leupeptin、多聚赖氨酸Poly-D-lysine(PDL)、兔抗-β-tubulin 抗体、Triton X-100(Sigma-Aldrich公司,美国);Cock tail(Roche公司,美国);DMEM(1:1)基础培养液、胎牛血清、胰蛋白酶(Gibco BRL公司,美国);Opti-MEM(Invitrogen公司,美国);Alexa Fluor 488结合的羊抗小鼠IgG荧光二抗(Jackson公司,美国);RC-DC protein assay(500-0122-MSDS,Bio-Rad公司,美国);主要抗体详见表1。
表1 本实验中的主要抗体
Tab.1 Primary antibodies used in this study
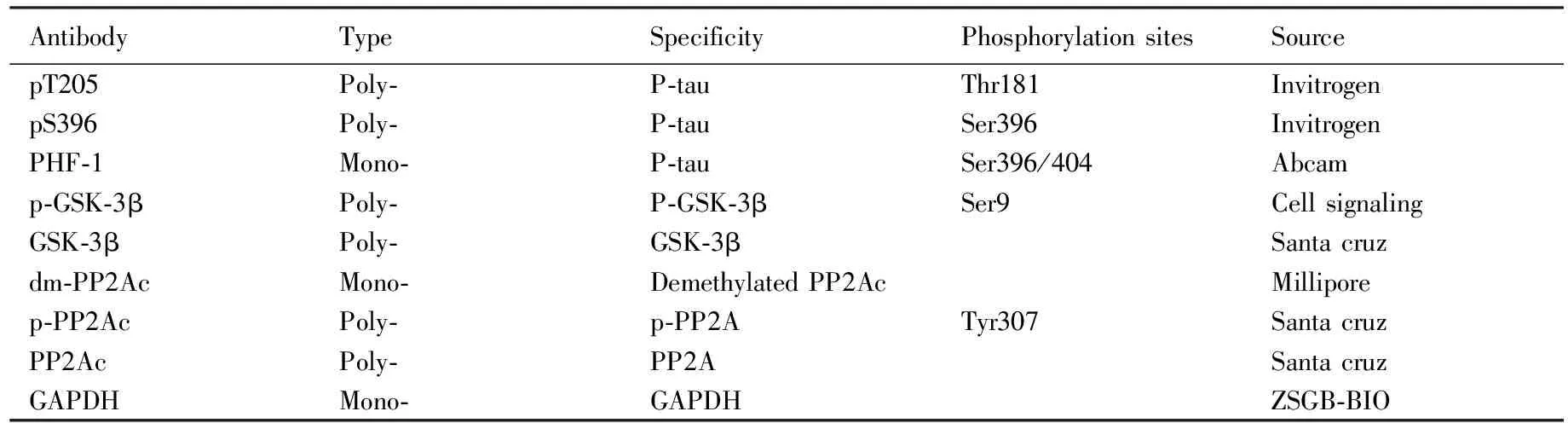
AntibodyTypeSpecificityPhosphorylationsitesSourcepT205Poly⁃P⁃tauThr181InvitrogenpS396Poly⁃P⁃tauSer396InvitrogenPHF⁃1Mono⁃P⁃tauSer396/404Abcamp⁃GSK⁃3βPoly⁃P⁃GSK⁃3βSer9CellsignalingGSK⁃3βPoly⁃GSK⁃3βSantacruzdm⁃PP2AcMono⁃DemethylatedPP2AcMilliporep⁃PP2AcPoly⁃p⁃PP2ATyr307SantacruzPP2AcPoly⁃PP2ASantacruzGAPDHMono⁃GAPDHZSGB⁃BIO
3)主要仪器:二氧化碳培养箱(Tc2323 型,美国SHELL/JB公司);超净工作台(北京半导体设备一厂);超低温冰箱(MDFU5410型,日本三洋公司);全波长酶标仪(Multiskan Spectrum,法国巴德斯公司);电子天平(BS210S,北京赛多利斯天平有限公司);高压蒸汽灭菌器(YXQ-SG41-280,上海医用仪器厂);低温高速台式离心机(Beckman 22R,美国);旋转式恒温振荡器(DSHZ-300A,江苏太苍市实验设备厂);电泳仪、转膜仪、垂直型电泳槽、凝胶电泳分析系统(Bio-Rad公司,美国)。
1.2 实验方法
1)细胞培养:人神经母细胞瘤细胞株(SK-N-SH细胞)在5%(体积分数)CO2,37 ℃培养箱内进行培养,每2~3 d更换一次培养基。培养基[90%(体积分数)DMEM, 10%(体积分数)FBS]用蔡氏滤器真空负压过滤除菌。细胞接种于12孔培养板中,细胞生长至60%~70%丰度时,传代或用于实验。将不同浓度马钱苷(500、1 000 mmol/L)与人神经母细胞瘤细胞株SK-N-SH细胞预孵育24 h后弃去药液,加入WT及GF-109203X(浓度均为10 μmol/L)处理SK-N-SH细胞3 h后,收集细胞进行裂解,备后续实验使用。
2)免疫印迹:将12孔板中的培养基吸出,加入PBS将培养基冲洗干净,加入RIPA裂解液轻轻吹打培养好的SK-N-SH细胞使其悬浮,吸出细胞悬液进行裂解,之后采用RC-DC protein assay测定样品蛋白质的量。蛋白经 SDS 聚丙烯酰胺凝胶电泳分离,转至 PVDF 膜上,与上述一抗、二抗孵育后,在暗室将超级化学发光底物A液与B液等量混合,立即加到膜上,0.8 mL/膜,滴匀液体,反应2 min,然后用滤纸吸去多余荧光剂,将膜放到化学发光凝胶成像仪中曝光10 s~5 min。将图片存为TIFF格式。选择曝光度适中,条带较为清晰的TIFF图片采用TINA软件进行分析,计算出各组对应条带整合灰度值同GAPDH的相对百分比。
1.3 统计学方法
2 结果
2.1 马钱苷对WT/GFX模型细胞tau蛋白过度磷酸化的影响
马钱苷500、1 000 μmol/L与SK-N-SH细胞共同孵育24 h后弃去药液,之后给予WT/GFX(浓度分别为10 μmol/L)处理3 h后,收集细胞,采用Western blotting检测tau蛋白的磷酸化水平。tau蛋白在Thr205、Thr217、PHF-1(特异识别磷酸化的Ser396/404位点)等位点发生磷酸化增高(P<0.05)。马钱苷500 μmol/L与细胞孵育24 h能够明显降低模型细胞内tau在Thr217、PHF-1位点的磷酸化水平(P<0.05);马钱苷1 000 μmol/L能够明显降低模型细胞tau蛋白在上述位点的磷酸化水平(P<0.05)(图1)。
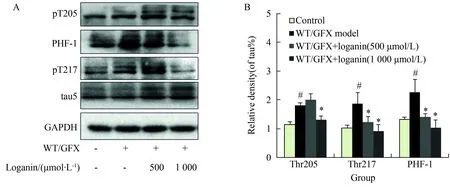
图1 马钱苷对WT/GFX模型细胞tau蛋白多个位点磷酸化的影响
Fig.1 Loganin inhibits tau hyperphosphorylationinduced by WT/GFX in SK-N-SH cells

2.2 马钱苷对WT/GFX模型细胞GSK-3β磷酸化的影响
与对照组相比,WT/GFX能够明显抑制GSK-3β的磷酸化(P<0.01)。马钱苷与细胞预孵育24 h,未能增高WT/GFX模型细胞AKT/GSK-3β磷酸化水平;提示马钱苷降低tau蛋白磷酸化并非通过作用GSK-3β-ser9磷酸化而实现(图2)。
2.3 马钱苷对WT/GFX模型细胞PP2A亚基C(PP2Ac)甲基化及磷酸化修饰的影响
SK-N-SH细胞经WT/GFX处理3 h后,细胞内PP2Ac Leu309位点去甲基化无明显变化,但其磷酸化明显增加(P<0.05)。马钱苷500、1 000 μmol/L预孵育24 h能够明显抑制模型细胞PP2Ac的磷酸化(P<0.05),但对PP2Ac的甲基化水平无明显影响(图3)。
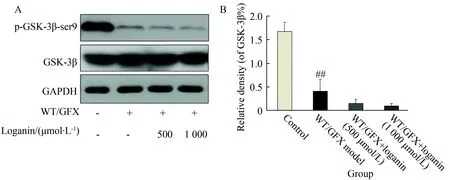
图2 马钱苷对WT/GFX模型细胞GSK-3β表达及其磷酸化的影响
Fig.2 Loganin did not alter the phosphorylation level of GSK-3β in SK-N-SH cells
##P<0.01vscontrol.SK-N-SH cells were pre-treated with Loganin (500、1 000 μmol/L) for 24 h, and then exposed to 10 μmol/L WT/GFX for 3 h after washing out Loganin. A: Western blotting analysis was used for determination of the levels of phosphorylated-GSK-3β at Ser9 and GSK-3β. B: Semi-quantitative analysis of the levels of phosphorylated-GSK-3β at Ser9 and GSK-3β. GAPDH was used as an internal control. Data were expressed as themean±SEof 3 experiments.

图3 马钱苷对WT/GFX模型细胞PP2Ac甲基化及磷酸化修饰的影响
Fig.3 Loganininhibits phosphorylation level of PP2Ac in SK-N-SH cells but not demethylation of PP-2Ac
#P<0.05vscontrol;*P<0.05 vs the WT/GFX model group. A: The representative Western blotting image of phosphorylation (p) of PP-2Ac at Tyr307, demethylation (DM) of PP-2Ac at Leu307 and total PP2Ac. B: Semi-quantitative analysis of the levels of phosphorylation and demethylation of PP-2Ac and total PP2Ac.GAPDH was used as an internal control. Data were expressed as themean±SEof 3 experiments.
3 讨论
糖原合成酶激酶-3β (glycogen synthase kinase-3β,GSK-3β)可促进tau在多个位点的磷酸化[12-13]。GSK-3β的活性主要由Ser9位点的磷酸化调节,Ser9为其负调节因子,其磷酸化的降低能够增加GSK-3β的活性[14-15]。GSK-3β-Ser9位点的磷酸化主要由蛋白激酶A(protein kinase A, PKA)、蛋白激酶B(protein kinase B,PKB;又称为Akt)、蛋白激酶C(protein kinase C,PKC)、p90Rsk等进行调节。Wortmannin(WT;PI3K的抑制剂)与GF-109203X(GFX;PKC的抑制剂)联合应用造模,可以导致GSK-3β活性增加(>12 h),引起tau蛋白在ser396/ser404和ser199/ser202等位点的磷酸化增高[16-17]。本实验显示WT/GFX能够明显抑制GSK-3β-Ser9的磷酸化,与报道[15-16]一致。但是马钱苷并未逆转WT/GFX引起的GSK-3β-Ser9的磷酸化减少,但是笔者发现马钱苷对tau蛋白多个位点的磷酸化水平仍然有明显的抑制作用。提示马钱苷抑制tau蛋白磷酸化的作用不是通过影响GSK-3β相关通路实现的。
近年来研究[18]显示,GSK-3β与PP2A之间存在交互作用。马钱苷是否通过作用于PP2A而降低tau蛋白的过度磷酸化呢?本实验进一步探讨马钱苷对PP2A活性及表达的影响。PP2A活性主要受PP2A催化亚基C(PP2Ac)翻译后修饰调节。催化亚基C的翻译后修饰主要包括其Leu309位点的去甲基化及Tyr307位点的磷酸化,二者表达上调均能降低PP2A的活性[19-20]。已有研究[20-21]表明,GSK-3β活性的增加能够下调PP2A活性。因此,在WT/GFX损伤细胞模型上,笔者发现PP2Ac磷酸化明显增加,去甲基化水平没有明显变化,因此推断GSK-3β可能通过增加PP2Ac的磷酸化抑制PP2A活性。马钱苷能够明显抑制PP2Ac在Tyr307位点的磷酸化水平,对其Leu309位点的甲基化无明显影响,因此,马钱苷抑制tau蛋白过度磷酸化,可能是通过抑制PP2A催化亚基C的磷酸化,提高PP2A活性而实现,与GSK-3β活性及表达的调节无关。本实验初步明确了马钱苷对PP2A催化亚基C的调节作用及在降低tau蛋白过度磷酸化中的作用,这为进一步探讨马钱苷拮抗tau蛋白磷酸化机制奠定了基础,也为研发治疗AD的药物提供了可靠的临床前实验数据。
[1] Nussbaum R L, Ellis C E. Alzheimer’s disease and Parkinson’s disease[J]. N Engl J Med, 2003,348(14):1356-1364.
[2] Sankaranarayanan S, Barten D M, Vana L, et al. Passive immunization with phospho-tau antibodies reduces tau pathology and functional deficits in two distinct mouse tauopathy models[J].PLoS One, 2015, 10(5):e0125614.
[3] Chang E, Congdon E E, Honson N S, et al. Structure-activity relationship of cyanine tau aggregation inhibitors[J]. J Med Chem, 2009, 52(11): 3539-3547.
[4] Miller E C, Teravskis P J, Dummer B W, et al. Tau phosphorylation and tau mislocalization mediate soluble Aβoligomer-induced AMPA glutamate receptor signaling deficits[J]. Eur J Neurosci,2014,39(7):1214-1224.
[5] Bennecib M, Gong C X, Grundke-Iqbal I, et al. Inhibition of PP-2AupregulatesCaMKⅡ in rat forebrain and induces hyperphosphorylation of tau at Ser262/356[J]. FEBS Lett, 2001,490(1-2): 15-22.
[6] Pei J J, Gong C X, An W L, et al. Okadaic-acid-induced inhibition of protein phosphatase 2A produces activation of mitogen-activated protein kinases ERK1/2, MEK1/2, and p70S6, similar to that in Alzheimer’s disease[J]. Am J Pathol, 2003, 163(3):845-858.
[7] Liu S J, Zhang J Y, Li H L, et al. Tau becomes a more favorable substrate for GSK-3 when it is prephosphorylated by PKA in rat brain[J]. J Biol Chem, 2004, 279(48):50078-50088.
[8] Wang J Z, Gong C X, Zaidi T, et al. Dephos-phorylation of Alzheimer paired helical ?laments by protein phosphatase-2A and -2B[J]. J Biol Chem,1995, 270(9): 4854-4860.
[9] Liu F, Grundke-Iqbal I, Iqbal K, et al. Contributions of protein phosphatases PP1, PP2A, PP2B and PP5 to the regulation of tau phosphorylation[J]. Eur J Neurosci, 2005, 22(8):1942-1950.
[10]魏群, 于大禹, 吴和珍.阿尔茨海默病与 tau 蛋白的磷酸化及去磷酸化[J]. 中国航天医药杂志,2004, 6(2) : 1-5.
[11]Bakota L, Brandt R. Tau biology and tau-directed therapies for Alzheimer’s disease[J]. Drugs, 2016, 76(3):301-313.
[12]Qian W, Shi J, Yin X, et al. PP2A regulates tau phosphorylation directly and also indirectly via activating GSK-3beta[J]. J Alzheimers Dis, 2010, 19(4): 1221-1229.
[13]刘迎新, 邹大威,耿建国,等. 糖肾宁对自发性2型糖尿病KK-Ay小鼠肾组织HGF表达的影响[J]. 首都医科大学学报,2015,36(5) :747-750.
[14]Saltiel A R, Kahn C R. Insulin signalling and the regulation of glucose and lipid metabolism[J]. Nature, 2001,414(6865):799-806.
[15]Lizcano J M, Alessi D R. The insulin signallingpathway[J]. Curr Biol,2002, 12(7): R236-238.
[16]Elliott E, Atlas R, Lange A, et al. Brain-derived neurotrophic factor induces a rapid dephosphorylation of tau protein through a PI-3Kinase signallingmechanism[J]. Eur J Neurosci, 2005, 22(5):1081-1089.
[17]Xu G G, Deng Y Q, Liu S J,et al. Prolonged Alzheimer-like tau hyperphosphorylation induced by simultaneous inhibition of phosphoinositol-3 kinase and protein kinase C in N2acells[J]. Acta Biochim Biophys Sin(Shanghai),2005,37(5):349-354.
[18]Wang Y X, Yang R Y, Gu J L, et al. Cross talk between PI3K-AKT-GSK-3β and PP2A pathways determines tau hyperphosphorylation[J]. Neurobiol Aging, 2015, 36(1): 188-200.
[19]Chen J, Martin B L, Brautigan D L, et al. Regulation of protein serine-threonine phosphatase type-2A by tyrosine phosphorylation[J]. Science,1992, 257(5074) :1261-1264.
[20]Bryant J C, Westphal R S, Wadzinski B E. Methylated C-terminal leucine residue of PP2A catalytic subunit is important for binding of regulatory Balpha subunit[J]. Biochem J, 1999, 339(Pt2): 241-246.
[21]Yao X Q, Li X C, Zhang X X, et al. Glycogen synthase kinase-3beta regulates leucine-309 demethylation of protein phosphatase-2A via PPMT1 and PME-1[J]. FEBS Lett, 2012, 586(16): 2522-2528.
编辑 陈瑞芳
Loganin attenuates tau hyper-phosphorylation by inhibiting phosphorylation of PP2A catalytic subunit C
Yang Cuicui, Li Lin, Zhang Li, Li Yali, Zhang Lan*
(DepartmentofPharmacology,XuanwuHospital,CapitalMedicalUniversity,BeijingEngineeringResearchCenterforNerveSystemDrugs,BeijingInstituteforBrainDisorders,KeyLaboratoryforNeurodegenerativeDiseasesofMinistryofEducation,Beijing100053,China)
Objective To investigate the effects and mechanisms of Loganin on tau phosphorylation.Methods Human neuroblastoma SK-N-SH cells were pre-incubated with Loganin (500 μmol/L,1 000 μmol/L, respectively) for 24 h, and then exposed to 10 μmol/L WT and 10 μmol/L GFX for 3 h after washing out Loganin. Western blotting was used to measure the phosphorylation level of tau protein at Thr205, Thr217, PHF-1 sites, glycogen synthase kinase 3β (GSK-3β), protein phosphatase 2A catalytic subunit C (PP2Ac) and the related proteins in the signaling pathway. Results WT/GFX inhibited the phosphorylation of GSK-3β-ser9, increased tau phosphorylation in SK-N-SH cells. Pre-incubation with Loganin significantly attenuated hyperphosphorylation of tau at Thr205,Thr217,PHF-1 sites in the model cells. Loganin did not reverse the decrease in p-GSK3β-ser9 induced by WT/GFX, suggesting that the effect of Loganin’s inhibiting tau hyperphosphorylation may be independent of GSK-3β pathway. However, Loganin reduced the phosphorylation of PP2Ac at Tyr307, but not demethylation of PP2Ac at Leu309 in the WT/GFX-treated cells. Conclusion Loganin attenuated the hyperphosphorylation of tau at multiple sites by reducing the phosphorylation of PP2Ac in Alzheimer’s disease-like cell model, independent of regulating GSK-3β.
Loganin; tau hyperphosphorylation; glycogen synthase kinase-3β; protein phosphatase 2A; Alzheimer’s disease
国家自然科学基金项目(81473373),北京市自然科学基金项目(7164315),北京市卫生系统高层次卫生技术人才(2014-2-014),北京市新世纪百千万人才工程(008-0014)。This study was supported by National Natural Science Foundation of China (81473373), Natural Science Foundation of Beijing (7164315), Beijing Health and Technical Personal of High-Level Plan (2014-2-014), Beijing New Century Talented Person Project(008-0014).
时间:2016-12-14 20∶13
http://www.cnki.net/kcms/detail/11.3662.r.20161214.2013.020.html
10.3969/j.issn.1006-7795.2016.06.014]
R 749.1
2016-10-14)
*Corresponding author, E-mail:lanizhg@126.com
