异丙肾上腺素诱导的心功能不全中自噬的变化
2016-12-23徐文丽吕婷婷马新亮刘慧荣
白 燕 徐文丽 吕婷婷 武 烨 王 丽 王 雯 马新亮 刘慧荣
(1.首都医科大学基础医学院生理学与病理生理学系,北京 100069;2.代谢紊乱相关心血管疾病北京市重点实验室,北京100069;3.山西医科大学病理教研室,太原 030001)
· 心血管疾病的病理生理机制 ·
异丙肾上腺素诱导的心功能不全中自噬的变化
白 燕1,2徐文丽1,2吕婷婷1,2武 烨1,2王 丽3王 雯1,2马新亮1*刘慧荣2*
(1.首都医科大学基础医学院生理学与病理生理学系,北京 100069;2.代谢紊乱相关心血管疾病北京市重点实验室,北京100069;3.山西医科大学病理教研室,太原 030001)
目的 探讨在异丙肾上腺素诱导的心功能不全中自噬的变化。方法 用异丙肾上腺素腹腔注射法建立小鼠心功能不全模型;小动物超声影像系统检测心功能指标射血分数(ejection fraction, EF)、左室缩短率(fractional short, FS)、舒张早期充盈峰值/房缩期充盈峰值(ratio of early peak flow velocity and atrium peak flow velocity,E/A)和室间隔厚度(interventricular septum,IVS)的变化;尾压法间接检测血流动力学指标——心率(heart rate, HR)、收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP)和平均动脉压(mean blood pressure, MBP)的变化;心质量体质量比法即心脏质量(heart weight, HW)/体质量(body weight, BW)检测心脏质量指数的变化;Western blotting印迹法检测心脏组织中自噬标志物LC3、p62的变化。结果 与对照组相比,异丙肾上腺素模型组在4周后,小鼠心功能下降,EF下降、FS下降、IVS增加,差异具有统计学意义;同时模型组小鼠HR和DBP低于对照组,差异具有统计学意义;心脏质量指数指标(HW/BW)显示模型组较对照组增高;自噬标志物检测显示,异丙肾上腺素注射1 d和3 d后,LC3Ⅱ/LC3Ⅰ比值升高,p62蛋白的相对量降低;连续注射4周后,LC3Ⅱ/LC3Ⅰ比值与p62蛋白的相对量恢复至对照组水平。结论 异丙肾上腺素诱导的心功能不全过程中,心肌自噬早期升高,晚期恢复至正常水平。
异丙肾上腺素;心功能不全;自噬
近年来我国心血管病的患病率和病死率逐年上升,心血管病已成为我国居民的首位死亡原因[1]。心功能不全是许多心血管疾病的终末或严重阶段,其发病机制复杂,多种致病因素和病理生理改变都能诱导或加重心功能不全的发生、发展。其中交感神经系统的过度持续激活,被广泛认为是介导心功能由代偿阶段进展为失代偿阶段的重要病理因素[2],许多心功能不全的患者体内,都可检测到血浆儿茶酚胺浓度升高,临床上应用肾上腺素受体阻断剂如美托洛尔、卡维地洛等,能够有效地改善患者的临床症状。自噬是生物体内的一种分解代谢途径,生理情况下存在低水平的细胞自噬,其可以降解细胞内受损的细胞器、错误折叠的蛋白质、清除氧自由基等,维持细胞内环境的稳定[3]。有研究[4]显示,在不同的心血管疾病中自噬水平不同,在同一疾病的不同阶段也存在着自噬不足或自噬过度现象,提示自噬作为一种应激性反应,可能在心功能不全的过程中动态改变,发挥保护或损伤作用。本实验旨在建立心功能不全的动物模型,观察自噬在心肌组织中的时序性变化,为进一步研究自噬在心功能不全中的作用积累实验基础。
1 材料和方法
1.1 实验动物
SPF级健康雄性BALB/c小鼠30只,8周,购自北京维通利华实验动物中心,实验动物许可证号:SCXK(京)2012-0001。实验动物使用计划和实验方案均已通过首都医科大学伦理委员会许可。
1.2 主要试剂
盐酸异丙肾上腺素(isoprenaline hydrochloride, ISO),购自美国Sigma公司;RIPA裂解液(C1053)购自北京普利莱公司,PMSF(P0100)购自北京索莱宝公司;兔源LC3单克隆抗体(12741S)、兔源p62单克隆抗体(D5E2)购自美国CST公司;山羊抗小鼠IgG/辣根酶标记(ZB-2305)、山羊抗兔IgG/辣根酶标记(ZB-2301)购自北京中杉金桥公司;Western blotting试剂购自北京普利莱公司。
1.3 主要仪器
小动物超声仪Vevo2100(Visual Sonics公司, 加拿大);鼠尾血压仪(BP-98A, Softron Biotechnology公司, 日本);凝胶成像系统(Bio-Rad公司, 美国)。
1.4 动物模型的建立
模型组采用ISO腹腔注射法,5μg/g溶解在300μL 0.9%(质量分数)的氯化钠注射液中,每日1次,分为ISO给药1天组(n=5)、3天组(n=5)、4周组(n=10),断颈处死小鼠,取其心脏放入液氮中冻存,用于后续实验。对照组(n=10)采用同等方法注射等剂量 0.9%(质量分数)氯化钠注射液。
1.5 心功能的检测
两组小鼠在4周末时,于1.5%(体积分数)异氟烷吸入麻醉,备皮,用超声仪对小鼠心脏进行扫描,检测指标有射血分数(ejection fraction, EF)、左室缩短率(fractional short, FS)、舒张早期充盈峰值/房缩期充盈峰值(ratio of early peak flow velocity and atrium peak flow velocity,E/A)和室间隔厚度(interventricular septum,IVS),所有数据均测量3次并取其平均值。
1.6 血流动力学的检测
为使小鼠适应测血压(blood pressure,BP)过程,先预测5 d左右,待平稳后开始正式测量。首先进行尾套和仪器的测漏检查,然后将小鼠放在专用鼠笼内,将尾套套在小鼠尾巴上,打开仪器,待小鼠状态稳定且脉搏稳定后,开始测压,在测压过程中,可根据小鼠状态适当测压并记录(>6次):心率(heart rate, HR)、收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP)和平均动脉压(mean blood pressure, MBP),取平均值作为该小鼠的最后血流动力学参数。
1.7 心脏质量指数的测定
用预冷的0.9%(质量分数)氯化钠注射液洗去心脏残留血液,剪去周围结缔组织和血管,滤纸吸干水分,称量心脏质量,心质量指数=心脏质量(heart weight,HW)/ 体质量(body weight,BW)
1.8 Western blotting法检测自噬标志物
取-80 ℃冻存的心肌组织置于冰上,称取适量组织,按1 mg组织∶10 μL的比例,加入RIPA与PMSF的混合物,机械匀浆,超声破膜,4 ℃、12 000 r/min 离心15 min,取上清。BCA法蛋白定量,取50 μg的蛋白加入上样缓冲液, 100 ℃变性7 min ,SDS-PAGE凝胶电泳后, 电转移至PVDF膜,5%(质量分数)脱脂奶粉室温封闭1.5 h,加入相应的一抗4 ℃过夜、次日加入辣根过氧化物酶标记的相应二抗,室温孵育2 h, TBST缓冲液洗涤6次,每次5 min,加入化学发光试剂后显影摄像。
1.9 统计学方法
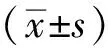
2 结果
2.1 ISO致心功能不全模型建立成功
4周末时检测心功能指标,结果显示,与对照组相比,ISO处理的模型组小鼠,EF降低(45.69±4.16vs34.20±3.37,P=0.066);FS降低(22.63±2.36vs16.26±1.75,P=0.061);IVS降低[(0.68±0.02)mmvs(0.59±0.01)mm,P=0.010];E/A比值差异无统计学意义(3.19±0.52vs5.01±0.81,P=0.110)(图1),提示ISO连续腹腔注射法建立心功能不全小鼠模型成功。
2.2 ISO致模型组小鼠血流动力学异常
4周末时用尾压法检测血流动力学,结果显示,与对照组相比,模型组小鼠的HR降低 [(473.30±12.37) min-1vs(428.70±9.52) min-1,P=0.004];DBP降低[(58.09±2.63) mmHgvs(49.31±2.82) mmHg,P=0.030]; SBP无显著变化[(97.61±1.62) mmHgvs(101.00±4.09) mmHg,P=0.500];MBP无明显改变[(71.26±2.12) mmHgvs(66.54±2.77) mmHg,P=0.210],进一步提示模型建立成功,用ISO模拟临床上心功能不全的发病过程有效(图2)。
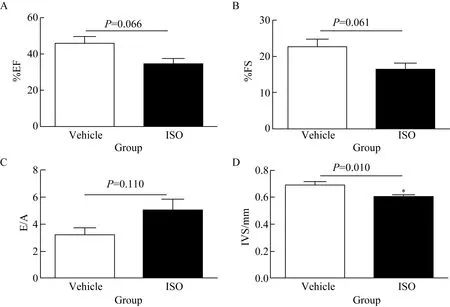
图1 4周末时,两组小鼠各心功能指标变化比较
Fig.1 Cardiac function declined in ISO group compared with the vehicle group at the 4th week
*P<0.05vsvehicle group,n=5. Cardiac function declined in ISO group compared with the vehicle group at the 4th week. EF(A), FS(B) and IVS(D) decreased significantly; No significant change was observed in E/A(C) between two groups; ISO:isoprenaline hydrochloride; EF:ejection fraction; FS:fractional short;IVS:interventricular septum;E/A:ratio of early peak flow velocity and atrium peak flow velocity.

图2 4周末时,两组小鼠血流动力学变化
Fig.2 Abnormal hemodynamic changes were observed in ISO group compared with the vehicle group at the 4th week
*P<0.05vsvehicle group,n=10. Abnormal hemodynamic changes were observed in ISO group compared with the vehicle group at the 4th week. HR(A) and DBP(B) reduced in ISO group. No significant change was observed in SBP(C) and MBP(D) between two groups; ISO:isoprenaline hydrochloride;HR:heart rate;DBP:diastolic blood pressure;SBP:systolic blood pressure;MBP:mean blood pressure;△1 mmHg=0.133 kPa.
2.3 ISO致模型组小鼠心脏质量指数增加
4周末时,ISO处理组的心脏质量指数较对照组增高(0.005 518±0.000 195 9vs0.006 232±0.000 508 8,P=0.040),提示ISO诱导心脏质量相对增加。
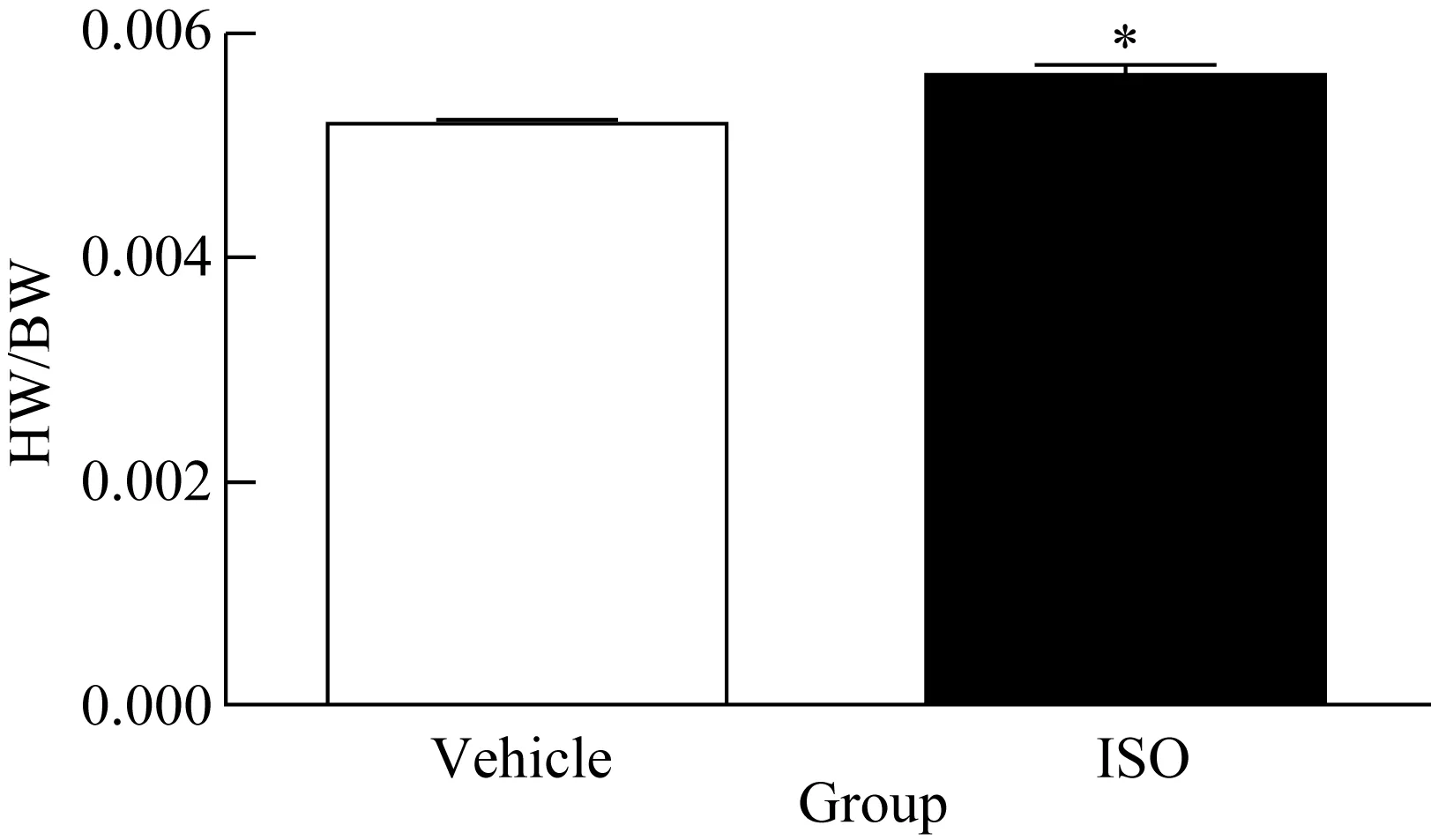
图3 4周末时,两组小鼠心脏质量指数比较
Fig.3 The ratio of HW/BW increased in ISO group compared with the vehicle group at the 4th week
*P<0.05vsvehicle group,n=5. The ratio of HW/BW increased in ISO group compared with the vehicle group at the 4th week. ISO:isoprenaline hydrochloride; HW/BW:ratio of heart weight and body weight.
2.4 ISO致模型组小鼠心肌自噬水平异常
用Western blotting 法检测自噬标志物LC3与p62的表达水平,结果显示,ISO腹腔注射1 d后,LC3Ⅱ/LC3Ⅰ的比值升高即LC3Ⅱ的转化率增加(0.243 8±0.024 5vs0.366 1±0.041 2,P=0.030),p62的相对表达量呈降低趋势(0.299 0±0.068 0vs0.215 7±0.018 1,P=0.080);ISO腹腔注射3 d后,LC3Ⅱ/LC3Ⅰ比值仍高于对照组水平(0.316 1±0.032 7vs0.422 9±0.043 1,P=0.080),即LC3Ⅱ的转化率增加,p62的相对表达量降低(2.599 0±1.037 0vs0.807 5±0.206 7,P=0.090);ISO腹腔注射4周后,LC3Ⅱ的转化率(0.301 1±0.042 8vs0.311 3±0.036 3,P=0.862)和p62的相对表达量(0.680 2±0.194 6vs0.629 1±0.158 3,P=0.845)恢复至对照组水平,提示ISO诱导心功能不全过程中,早期阶段心肌自噬升高,随着时间变化逐渐恢复至正常水平。
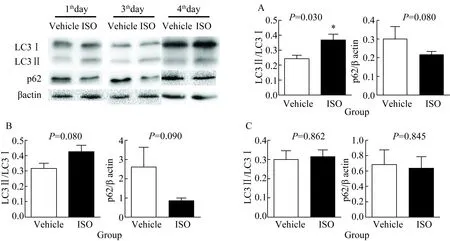
图4 ISO刺激1 d(A)、3 d(B)和4周(C)后,LC3Ⅱ/LC3Ⅰ比值与p62/βactin比值的变化
Fig.4 The ratio of LC3Ⅱ/LC3Ⅰincreased and the relative protein expression of p62 decreased in ISO group compared with the control group at the 1th day(A), 3th day(B) and 4th week(C)
*P<0.05,n=5. No significant change was observed between the two groups at the 4th week(C); ISO:isoprenaline hydrochloride.
3 讨论
异丙肾上腺素(isoprenaline, ISO)可以非特异性的兴奋心肌表面的β肾上腺素受体,激活cAMP系统,开放钙通道,产生正性变力与变时效应,使心肌收缩加强,心率加快,致使心肌耗氧量增加,造成心肌弥漫性坏死,并逐渐进展为慢性心力衰竭[5]。这种心力衰竭模型在原发性给予ISO诱导心肌损伤后,因为没有其他损伤因素(如瓣膜疾病、冠状动脉结扎、病毒等)的持续存在,所以能够更好地反映心力衰竭的自然病理过程[6]。ISO的持续注射可诱导心脏长期处于过度兴奋状态,与临床上心功能不全初期,患者血浆中儿茶酚胺类物质增多,心功能处于代偿阶段的状态相似。ISO持续作用4周后,射血分数和左室缩短率明显降低,E/A比值升高,同时心率降低,舒张压降低,与文献[7-8]报道的ISO对心血管的作用相一致。目前建立动物心功能不全模型的方法主要有缩窄腹主动脉法、结扎冠状动脉法、药物诱导及快速起搏法等[9],这些方法可以不同程度的引起心功能及血流动力学的改变,如EF、FS降低,E/A升高,HW/BW升高,HR降低等。本实验通过注射异丙肾上腺素,成功诱导出了心功能的降低和血流动力学的异常,可以代表其他心功能不全的动物模型,且本方法操作简便,可重复性好,安全有效,在实验过程中未发生动物死亡。本实验在ISO注射1 d和3 d时也进行了心功能和血流动力学的检测,但与对照组相比无明显改变,故数据未予以给出,分析原因可能是机体神经体液调节机制和多种血管活性物质的功能代偿,而导致短期注射ISO引起的心血管效应被掩饰。
自噬是将细胞内受损、变性或衰老的蛋白质以及细胞器运输到溶酶体内进行消化降解的过程[10]。自噬既是一种广泛存在的正常生理过程,又是细胞对不良环境的一种防御机制,参与多种疾病的病理过程[11],正常水平的自噬可以保护细胞免受环境刺激的影响,但自噬过度和自噬不足却均可能导致疾病的发生。在多种心脏疾病中,均伴有心肌细胞自噬的改变,且影响着疾病的发生发展。在心力衰竭中,细胞自噬增强可导致心肌细胞自噬性死亡[12];在心肌肥厚中,细胞自噬程度降低,加剧心肌肥厚;而在心肌梗死中,细胞自噬增强可减小梗死面积[13],提示在不同的病理状态下,自噬水平的增强或减弱,可以对疾病的发展和转归产生不同的效应,缓解或加重病程[14]。本实验观察到在ISO诱导的心功能不全模型中,心肌自噬水平异常:ISO注射1 d和3 d后,反映自噬水平的指标LC3Ⅱ/LC3Ⅰ的比值升高、p62的相对表达量降低;但ISO持续注射4周后,心肌自噬水平又恢复至与对照组相同,LC3Ⅱ/LC3Ⅰ的比值和p62的相对表达量在两组之间差异无统计学意义,提示在ISO诱导心功能不全发展的4周时间窗内,心肌自噬经历了先升高,最后恢复至正常水平的动态过程。心脏在ISO的刺激下,早期自噬升高可能是作为一种应激性保护反应,加速心肌细胞的分解代谢,清除损伤的蛋白和细胞器,清除氧自由基,提供能量,对心肌细胞发挥保护作用,但在ISO持续作用一段时间,诱发明显的心功能不全后,心肌自噬却恢复至正常水平。本实验中,心功能不全发生时,这种与基础生理状态下差异无统计学意义的较低水平的自噬,对心肌细胞究竟是保护性还是损伤性作用,仍有待于进一步的研究[15-16]。本实验仍然存在一些不足之处,如ISO诱发心血管疾病时,自噬由升高到恢复这个过程中,是否存在自噬水平的降低等许多问题仍有待深入探讨。明确自噬的动态变化,需要进一步优化时间窗的设计,以捕捉到自噬水平由升到降发生变化的关键时间点。对心肌自噬动态变化的研究,将有利于从自噬的角度探讨心脏疾病的发生发展机制[17],确定自噬的动态变化是否与临床上患者心功能状态由代偿阶段进入失代偿阶段有着密切关系,由此开发出在心脏疾病的不同阶段靶向调节自噬的治疗药物,丰富临床上心功能不全患者的药物治疗手段。
[1] 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2015》概要[J]. 中国循环杂志, 2016,31(6):521-528.
[2] Reed B N, Sueta C A. A Practical guide for the treatment of symptomatic heart failure with reduced ejection fraction (HFrEF)[J]. Curr Cardiol Rev, 2015,11(1):23-32.
[3] Li Y, Zhang J, Chen X, et al. Molecular machinery of autophagy and its implication in cancer[J]. Am J Med Sci, 2012,343(2):155-161.
[4] Gatica D, Chiong M, Lavandero S, et al. Molecular mechanisms of autophagy in the cardiovascular system[J]. Circ Res, 2015,116(3):456-467.
[5] Teerlink J R, Pfeffer J M, Pfeffer M A, et al. Progressive ventricular remodeling in response to diffuse isoproterenol-induced myocardial necrosis in rats[J]. Circ Res, 1994,75(1):105-113.
[6] Takeshita D, Shimizu J, Kitagawa Y, et al. Isoproterenol-induced hypertrophied rat hearts: does short-term treatment correspond to long-term treatment[J]. J Physiol Sci, 2008,58(3):179-188.
[7] Brooks W W, Conrad C H. Isoproterenol-induced myocardial injury and diastolic dysfunction: structural and functional correlates[J]. Comp Med, 2009,59(4):339-343.
[8] Krenek P, Kmecova J, Kucerova D, et al. Isoproterenol-induced heart failure in the rat is associated with nitric oxide dependent functional alterations of cardiac function [J]. Eur J Heart Fail, 2009,11(2):140-146.
[9] Wang J J, Rau C, Avetisvan R, et al. Genetic dissection of cardiac remodeling in an isoproterenol-induced heart failure mouse model[J]. PLoS Genet, 2016,12(7):e1006038.
[10]Ravikumar B, Sarkar S, Davies J E, et al. Regulation of mammalian autophagy in physiology and pathophysiology[J]. Physiol Rev, 2010,90(4):1383-1435.
[11]Russell R C, Tian Y, Yuan H, et al. ULK1 induces autophagy by phosphorylating Beclin-1 and activating VPS34 lipid kinase[J]. Nat Cell Biol, 2013,15(7):741-750.
[12]Thomas R L, Roberts D J, Kubli D A, et al. Loss of MCL-1 leads to impaired autophagy and rapid development of heart failure[J]. Genes Dev, 2013,27(12):1365-1377.
[13]Lavandero S, Troncoso R, Rothermel B A, et al. Cardiovascular autophagy: concepts, controversies, and perspectives[J]. Autophagy, 2013,9(10):1455-1466.
[14]Li Z L, Lerman L O. Impaired myocardial autophagy linked to energy metabolism disorders[J]. Autophagy, 2012,8(6):992-994.
[15]Cao D J, Hill J A. Titrating autophagy in cardiac plasticity[J]. Autophagy, 2011,7(9):1078-1079.
[16]Nemchenko A, Chiong M, Turer A, et al. Autophagy as a therapeutic target in cardiovascular disease[J]. J Mol Cell Cardiol, 2011,51(4):584-593.
[17]谢凤,柳威,陈临溪. 自噬参与心脏疾病调控的研究进展[J]. 生物化学与生物物理进展, 2012,39(3):224-233.
编辑 陈瑞芳
Change of autophagy in the isoprenaline-induced cardiac dysfunction
Bai Yan1,2, Xu Wenli1,2, Lyu Tingting1,2, Wu Ye1,2, Wang Li3, Wang Wen1,2, Ma Xinliang1*, Liu Huirong2*
(1.DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China;2.KeyLaboratoryofMetabolicDisordersRelatedCardiovascularDisease,Beijing100069,China; 3.DepartmentofPathology,ShanxiMedicalUniversity,Taiyuan030001,China)
Objective To observe the change of myocardial autophagy during the isoprenaline-induced mice cardiac dysfunction. Methods The mice model of cardiac dysfunction was established by intraperitoneal injection of isoprenaline persistently for 4 weeks. Cardiac function was monitored by ultrasonic imaging system; hemodynamic changes were measured via tail-cuff method; autophagy-related protein expressions of LC3Ⅱ/LC3Ⅰand p62 were detected by Western blotting. Results After treatment with isoprenaline for 4 weeks, ejection fraction and fractional short reduced, interventricular septum increased, the ratio of early peak flow velocity and atrium peak flow velocity (E/A) tended to be elevated, suggesting declined cardiac function in model group compared with control group. Correspondingly, the heart rate and diastolic blood pressure decreased in model group compared with control group. After the injection of isoprenaline for 1 day and 3 days, the level of LC3Ⅱ/LC3Ⅰincreased and relative expression of p62 increased, but both returned to normal levels at the 4th week. Conclusion In the progress of isoprenaline-induced cardiac dysfunction, myocardial autophagy increased at an early stage, then returned to the normal level appearing to be a dynamic trend.
isoprenaline; cardiac dysfunction; autophagy
国家自然科学基金(31401006),北京市自然科学基金重点项目(7151001),973计划前期研究专项(2014CB560704)。This study was supported by National Natural Science Foundation of China (31401006), Natural Science Foundation of Beijing (7151001), 973 Special Preliminary Study Plan (2014CB560704).
时间:2016-12-14 20∶19
http://www.cnki.net/kcms/detail/11.3662.r.20161214.2019.028.html
10.3969/j.issn.1006-7795.2016.06.001]
R 541
2016-10-03)
*Corresponding author, E-mail:xin.ma@jefferson.edu; liuhr2000@126.com
