水稻内生固氮菌分离鉴定、生物特性及其对稻苗镉吸收的影响
2016-12-23谭适娟孙建光
袁 梅,谭适娟,孙建光
水稻内生固氮菌分离鉴定、生物特性及其对稻苗镉吸收的影响
袁 梅1,谭适娟2,孙建光1
(1中国农业科学院农业资源与农业区划研究所/农业部农业微生物资源收集与保藏重点实验室,北京100081;2湖南省郴州桂阳县农业局,湖南郴州 424400)
【目的】分离鉴定湖南水稻内生固氮菌,研究水稻内生固氮菌的系统发育,分析测定分离菌株的生物学特性,探讨接种水稻内生固氮菌对稻苗镉(Cd)吸收的影响。【方法】表面灭菌水稻植株样品后采用低氮培养法分离水稻内生细菌,采用PCR扩增、测序检测菌株基因确认分离物是固氮菌,通过16S rRNA基因序列测定、比对初步鉴定菌株,分析菌株系统发育,通过温室盆栽试验探讨接种水稻内生固氮菌对稻苗Cd吸收的影响。【结果】从8个湖南水稻植株样品中分离到19株内生固氮菌,这些菌株在系统发育地位上属于4属13种。分离到的19株内生固氮菌中有大约1/3的菌株产生蛋白酶和纤维素酶的能力较强,在48℃生长良好,在产孢液体培养基上生长良好(OD>1.0),在固体产孢培养基上产孢率高(60%—90%),产碱能力也相对较强(pH 8.5—9.0)。有1/6的内生固氮菌(3个菌株)分别对立枯丝核菌、禾谷镰孢、拟枝孢镰孢具有拮抗性,抑菌率为42%—55%。有大约2/3的菌株对抗生素相对比较敏感,对杀菌剂耐性强。测定的4个代表菌株对检测过的78种碳源中的7种利用较好,它们是乳酸钠、蔗糖、葡萄糖、甘油、苹果酸、丙氨酸、葡萄糖醛酰胺。试验的19株内生固氮菌中有6个菌株促进水稻苗期Cd吸收,与对照相比植株Cd含量增加6.41%—38.45%;其他13个菌株抑制水稻苗期Cd吸收,与对照相比植株Cd含量减少2.06%—34.46%。【结论】从湖南水稻分离到19株内生固氮菌,系统发育地位属于、、、4属13种。部分菌株产碱能力强,产孢率高,可在48℃高温下生长,产蛋白酶、纤维素酶,拮抗立枯丝核菌、禾谷镰孢、拟枝孢镰孢,具有良好应用前景。接种水稻内生固氮菌可以显著影响水稻苗期Cd吸收,提示采用微生物方法阻控稻田Cd污染是一个非常值得研究、探讨的途径。
水稻;内生固氮菌;生物特性;Cd
0 引言
【研究意义】水稻植株体内栖息着大量内生菌,对于植株健康生长起着重要作用[1]。内生固氮菌是植物内生菌的一个主要类群,不仅有固氮作用,还能促进植物生长,提高植物抗病、抗逆[2]。矿山开采、不洁肥料等原因造成了稻田Cd污染,影响食品安全和生态安全[3-4]。研究发现内生菌能够提高水稻幼苗对Cd胁迫的抗性[5],探索内生固氮菌对稻苗Cd吸收的影响,对于防控稻田Cd污染具有积极意义。【前人研究进展】水稻是内生固氮菌研究相对较多的作物,许多年前人们就已经建立了有效的水稻内生固氮菌分离方法,并且测得水稻内生固氮菌的数量在105—108cfu/g DW[6]。近年来,水稻内生菌成为研究热点,水稻内生固氮菌的分离鉴定工作得到加强,新的水稻内生固氮菌也不断被发现[7-8],接种固氮菌对于水稻氮素营养改善等具有生产实际意义的研究结果得到证实[9]。目前,对水稻内生固氮菌进行批量分离鉴定和较为系统的生物特性研究较少,也未见到内生固氮菌对水稻植株Cd吸收的报道。【本研究切入点】从Cd污染较重的地区湖南郴州桂阳县采集水稻植株样品,批量分离、鉴定内生固氮菌,分析菌株间的系统发育关系,系统研究菌株产碱、产孢、高温生长,产蛋白酶、纤维素酶,拮抗病原真菌,对抗生素、杀菌剂耐性,碳源发酵利用等与农业生产应用密切的生物特性,探索菌株对水稻苗期生长及植株Cd吸收的影响。【拟解决的关键问题】探讨水稻内生固氮菌的系统发育关系、生物特性及其对水稻苗期Cd吸收的影响。
1 材料与方法
试验于2014年1月至2015年12月在北京和湖南省郴州桂阳县完成。
1.1 样品、试剂、培养基
1.1.1 样品、试剂 2014年9月17日从湖南省郴州桂阳县水稻田采集到水稻植株样品8份,水稻为当地品种明珠丝苗,处于近成熟期。采样方法为选择不同水稻田块的健壮植株带根土整穴拔起,每个田块采集2份,装入塑料袋带回实验室保存在4℃,尽快进行菌株分离。
病原真菌靶标菌株立枯丝核菌()ACCC36246、禾谷镰孢()ACCC36249、拟枝孢镰孢()ACCC37402由中国农业科学院农业资源与农业区划研究所邓晖提供。
试验所用试剂购自北京化学试剂公司和Sigma公司。
1.1.2 培养基 分离固氮菌多碳源低氮培养基(CCM)[10]:溶液Ⅰ:KH2PO40.2 g,NaCl 0.1 g,K2HPO40.8 g,Na2FeEDTA 28 mg,钼酸钠25 mg,酵母浸膏100 mg,甘露醇5 g,蔗糖5 g,乳酸钠0.5 mL,蒸馏水900 mL。溶液Ⅱ:MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.06 g,蒸馏水100 mL。将溶液Ⅰ、Ⅱ分别灭菌,冷却至50℃左右混合,加入生物素(5 µg·L-1)和维生素(10 µg·L-1)各0.5 mL。分离固氮菌无氮培养基[11]:蔗糖10 g,NaCl 0.12 g,K2HPO4·3H2O 0.5 g,CaCO31 g,MgSO4·7H2O 0.2 g,蒸馏水1 L,pH 7.2。LB培养基:酵母膏5 g,蛋白胨10.0 g,NaCl 10.0 g,蒸馏水1 L,pH 7.0。牛肉膏蛋白胨培养基(液体):牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,蒸馏水1 L,pH 7.0。产孢液体培养基:(NH4)2SO42 g,NaCl 1 g,K2HPO41 g,MgSO4·7H2O 1 g,MnSO40.2 g,淀粉10 g,CaCO31 g,蒸馏水1 L,pH 7.0。产孢固体培养基:麦麸1 kg,豆粉400 g(预先混合),牛肉膏200 g,可溶淀粉10 g,酵母粉3 g,蔗糖20 g,磷酸二氢钾20 g,尿素3 g(用400 mL蒸馏水溶解后加入),MnSO42 g(用100 mL蒸馏水单独溶解后加入),蒸馏水2.5 L,pH 7.2。测定蛋白酶脱脂牛奶培养基:脱脂奶粉5 g溶于50 mL蒸馏水,琼脂1.5 g溶于50 mL蒸馏水,两者分别灭菌。待冷至45—50℃时,两液混匀倒平板。测定纤维素酶CMC培养基:(NH4)2SO42 g,MgSO40.5 g,KH2PO4l g,NaCl 0.5 g,CMC-Na 10 g,琼脂20 g,蒸馏水1 L,自然pH。耐药性检测培养基:蔗糖10 g,NaCl 0.12 g,K2HPO4·3H2O 0.5 g,CaCO31 g,MgSO4·7H2O 0.2 g,酵母粉0.5 g,蒸馏水1 L,pH 7.2。
1.2 水稻内生固氮菌分离
采用上述多碳源低氮培养基和无氮培养基对采自湖南郴州桂阳县的水稻植株样品进行了内生固氮菌分离,方法参考文献[12]。
1.3 菌株16S rRNA基因序列测定与初步鉴定
固氮菌分离物的16S rRNA基因扩增方法参考文献[13],序列测定委托北京博迈德生物技术公司完成,基于16S rRNA基因序列的初步鉴定采用EzTaxon和NCBI数据库在线比对完成。
1.4 菌株基因检测与序列测定
方法参考文献[14],序列测定委托生工生物工程(上海)股份有限公司完成。
1.5 水稻内生固氮菌系统发育分析
在上述16S rRNA基因序列测定和基因检测的基础上,采用Mega软件分析水稻内生固氮菌的系统发育[15]。
1.6 菌株产碱、产孢、高温生长测定
采用牛肉膏蛋白胨培养基测定菌株产碱和高温生长能力。方法如下:首先在LB培养基平板上培养活化备测菌株,然后将备测菌株接种在盛有5 mL牛肉膏蛋白胨培养基的试管中,每种培养基3次重复(设置不接种空白对照),然后分别放置在28和48℃恒温培养箱中静置培养。48 h后观察记录菌株生长情况,同时用精确试纸测定培养液pH。
采用液体和固体2种产孢培养基测定菌株产生芽孢的能力。液体培养测定方法:用LB平板培养基培养活化备测菌株,然后将备测菌株接种在盛有5 mL产孢液体培养基的试管中,3次重复(设置不接种空白对照),28℃恒温摇床振荡培养。6 d后镜检观察菌体形态和芽孢形成情况,记录视野中芽孢比例。固体培养测定方法:首先用LB平板培养基培养活化备测菌株,然后接种在50 mL LB液体培养基中28℃恒温摇床振荡培养24 h制成种子液。将配制好的产孢固体培养基放入布袋,湿热灭菌后趁热加入预先干热灭菌的500 mL烧杯中,装量300 mL,双层纱布封口,冷至室温后接种50 mL上述种子液,置于30℃恒温培养箱中静置培养。72 h后检测芽孢形成:称取固体培养物50 g放入匀浆机中,加水250 mL,匀浆2 min,吸取100 μL菌液,涂片,染色,镜检观察菌体形态和芽孢形成情况,记录视野中芽孢比例。
1.7 菌株产蛋白酶、纤维素酶测定
定性测定了菌株产生蛋白酶和纤维素酶的能力。测定菌株产生蛋白酶的方法:用LB平板培养基培养活化备测菌株,然后将备测菌株接种在脱脂牛奶培养基平板上,28℃培养3 d后,观察、记录菌落周围透明圈大小,判断菌株产蛋白酶能力。测定菌株产生纤维素酶的方法:用LB平板培养基培养活化备测菌株,然后将备测菌株接种在CMC培养基平板上,28℃培养3 d后,在长出菌落的培养基上覆盖浓度4 mg·mL-1的刚果红溶液,1 h后倾去,加入浓度l mol·L-1的NaCl溶液,1 h后倾去,加入5%的醋酸。此时,产生纤维素酶的菌落周围出现透明圈。观察、记录菌落周围透明圈大小,判断菌株产生纤维素酶能力。
1.8 菌株拮抗病原真菌
采用两点对峙法测定了分离菌株对立枯丝核菌ACCC36246、禾谷镰孢ACCC36249、拟枝孢镰孢ACCC37402这3株病原真菌的拮抗特性,方法参考文献[16]。抑制率(%)=(对照半径r0-对峙培养病原真菌菌落半径r1)/对照半径r0×100。
1.9 菌株对抗生素、杀菌剂耐性
用平板培养法测定了分离菌株对抗生素、杀菌剂的耐性。测试的抗生素和杀菌剂有氨苄青霉素、噻孢霉素、氯霉素、硫酸卡那霉素、硫酸新霉素、青霉素G钠盐、硫酸链霉素、盐酸四环素,戊唑醇、敌克松、甲霜灵、咯菌腈、恶霜灵、福美双等。测试方法为:将抗生素和杀菌剂配成母液,加入到灭菌后正处于冷却阶段(50℃左右)的耐药性检测培养基中,使抗生素终浓度为0.25 g·L-1(杀菌剂终浓度1.0 g·L-1),充分混匀,倒于灭菌平皿中制成检测平板。用LB平板培养基培养活化备测菌株,然后接种在50 mL LB液体培养基中28℃恒温摇床振荡培养24 h制成种子液。用无菌水调节种子液浓度为OD600=1.0,接种20 μL至耐药性检测平板,28℃培养4 d,记录菌株生长情况。
1.10 菌株对碳源发酵利用测定
采用BIOLOG试剂盒(美国Biolog公司,仪器型号:GENⅢ)测定了分离菌株对碳源的发酵利用,测定碳源共计78种,方法参照BIOLOG实验手册。
1.11 菌株对水稻苗期生长及植株Cd吸收的影响
试验于2015年4月15日至7月7日在温室完成。供试菌株为上述19株水稻内生固氮菌,试验土壤取自湖南省郴州桂阳县,含Cd约6 mg·kg-1。水稻品种为湖南省郴州桂阳县当地品种明珠丝苗2号。育秧盘为4×8孔,面积0.125 m2,购自中国农业科学院蔬菜花卉研究所。步骤:将土壤风干,磨碎,过2 mm筛,按照1﹕10加入生物有机肥(市售),同时按照每平方米育秧盘加入185 g水稻育秧调理剂(调理剂组成:磷酸一铵65 g,过磷酸钙100 g,硫酸铵422 g,硫酸钾40 g,硫酸锌7 g,填料366 g),混匀装盘,每盘装土3.3 kg。挑选饱满种子,浸种5 d,每穴播种20粒种子。出苗后,在2叶期接种固氮菌,每穴接种OD600=1.0的固氮菌培养液1 mL,设置不接菌处理为阴性对照,每个处理8次重复。日常管理按常规进行。2个月后收获,测定稻苗根长、株高、鲜重等生长性状,同时将样品送普尼测试中心测定Cd含量。采用SAS软件进行统计分析。
2 结果
2.1 水稻内生固氮菌分离、检测及基于16S rRNA基因序列的初步鉴定
采用多碳源低氮培养基和无氮培养基从8个水稻植株样品的根、茎、叶共分离到内生固氮菌19株,全部菌株检测到了固氮基因,经过16S rRNA基因序列分析比对确定了菌株的分类地位。新分离菌株的编号、来源及最大相似性模式种如表1所示。

表1 新分离水稻内生固氮菌及其最大相似性模式种
2.2 新分离水稻内生固氮菌的系统发育分析
16S rRNA基因序列比对结果显示,从湖南水稻植株分离到的19株内生固氮菌与已知模式种的最大相似性均在99%以上(sd194为98.83%),说明新分离内生固氮菌的科学分类地位比较明确。按照16S rRNA基因序列相似性,19株水稻内生固氮菌在系统发育地位上属于4属13种,分别为。它们的系统发育关系如图1所示。
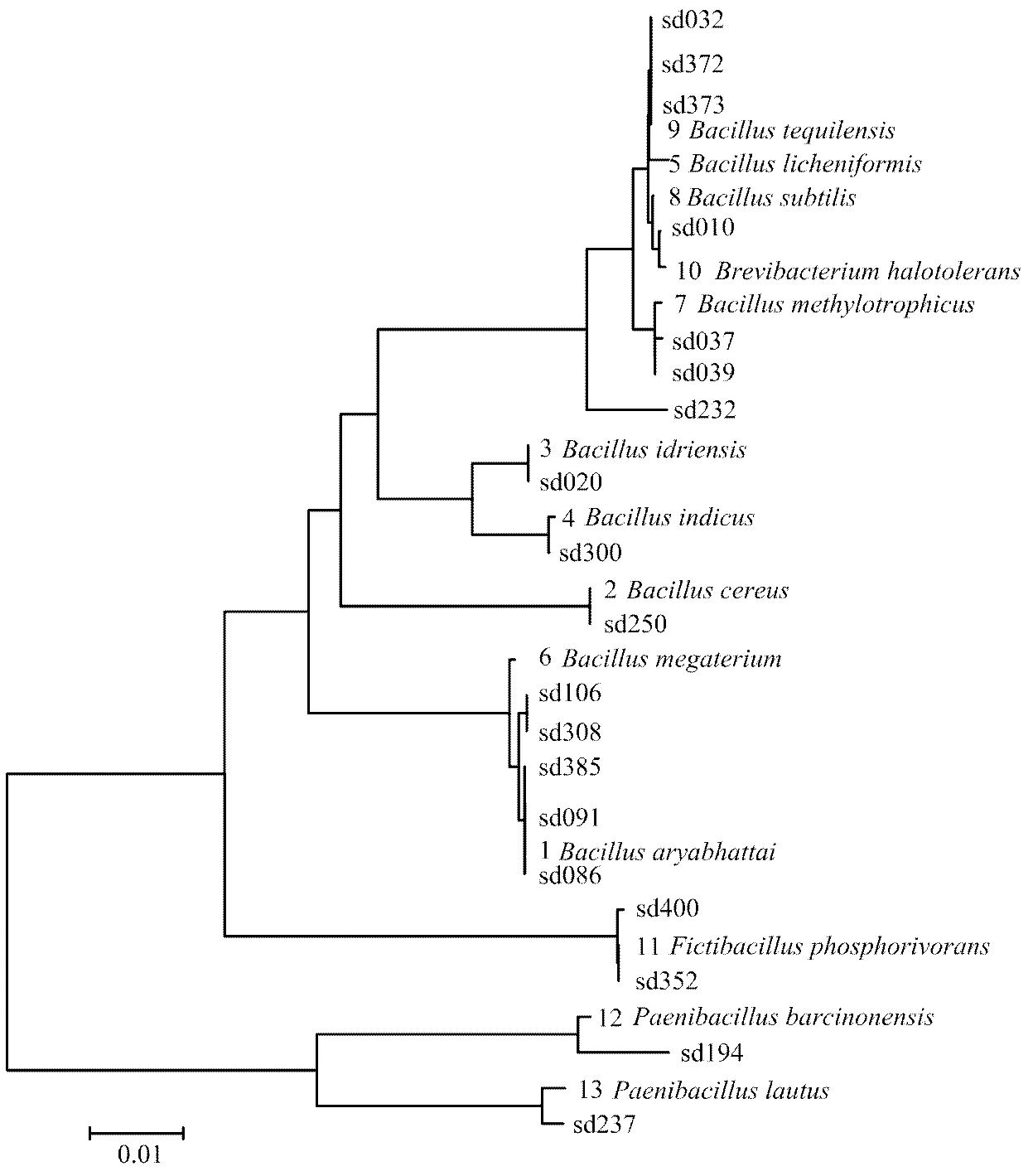
图1 新分离19株水稻内生固氮菌系统发育树(与参比模式种比较)
2.3 菌株产碱、产孢、高温生长性能
分离到的19株水稻内生固氮菌在细菌常规培养基牛肉膏蛋白胨上生长良好,细胞密度均在OD 1.0以上,多数菌株具有产碱能力,培养液最终pH在7.0—9.0。高温生长试验结果显示sd010、sd032、sd037、sd039、sd232、sd372 6株菌能够在48℃生长,细胞密度达到OD 1.0以上,而且这些菌株的产碱能力相对强于其他菌株。产孢试验结果显示,菌株在产孢液体培养基上产孢较少,多数菌株的芽孢形成率不足10%;而在产孢固体培养基是生长良好,菌数密度达到2.0×109cfu/g以上,多数菌株的芽孢形成率达到了60%—90%(表2)。
2.4 菌株产蛋白酶、纤维素酶性能及其对病原真菌的拮抗
蛋白酶和纤维素酶测定结果显示,菌株sd032、sd037、sd039、sd250、sd372、sd373具有较好的产酶能力,其他菌株产酶能力较弱,或者不产生。同时发现,菌株产生蛋白酶和纤维素酶二者之间存在一致性(表2)。抗病原真菌试验显示,菌株sd037、sd039同时对3株靶标病原真菌具有拮抗作用,抑菌率为42%—55%,sd010对ACCC37402、sd373对ACCC36249分别具有拮抗性,其他菌株不具有拮抗病原真菌的能力。菌株拮抗病原真菌的能力和菌株产蛋白酶、纤维素酶的能力二者之间存在明显的一致性(表2)。

表2 新分离菌株的生物特性测定
a描述菌株液体培养生长情况。“-”表示菌液浓度<OD 0.3,“+”表示菌液浓度OD 0.3—0.6,“++”表示菌液浓度OD 0.6—1.2,“+++”表示菌液浓度>OD 1.2aBacterial growth in liquid medium, “-” meant bacterial liquid<OD 0.3, “+” meant bacterial liquid between OD 0.3 and 0.6, “++” meant bacterial liquid between OD 0.6 and 1.2, “+++” meant bacterial liquid >OD 1.2;b描述菌株固体培养生长情况。“++”表示细菌浓度2.0×109—3.0×109cfu/g,“+++”表示细菌浓度>3.0×109cfu/gbBacterial growth in solid medium, “++” meant bacterial density between 2.0×109and 3.0×109cfu/g, “+++” meant bacterial density >3.0×109cfu/g;c透明圈法定性描述菌株产酶情况。“-”表示透明圈带宽<1 mm,“+”表示透明圈带宽 1—3 mm,“++”表示透明圈带宽 3—6 mm,“+++”表示透明圈带宽>6 mmcQualitative description of protease and cellulose, “-” meant transparent ring bandwidth <1 mm, “+” meant transparent ring bandwidth between 1 and 3 mm, “++” meant transparent ring bandwidth between 3 and 6 mm, “+++” meant transparent ring bandwidth >6 mm
2.5 菌株对抗生素、杀菌剂的耐性
检测了18株新分离菌株对8种抗生素和6种杀菌剂的耐药性,结果显示多数菌株对氨苄青霉素、噻孢霉素、青霉素G钠盐、盐酸四环素、甲霜灵、咯菌腈、恶霜灵具有不同程度的耐性,对氯霉素、硫酸卡那霉素、硫酸新霉素、敌克松、福美双则相对比较敏感。从单个菌株的耐药性来看,sd032、sd039、sd086、sd372、sd373的耐药性相对较强,这也正是那些产碱、产酶、产孢、高温生长能力较强的菌株(表3)。
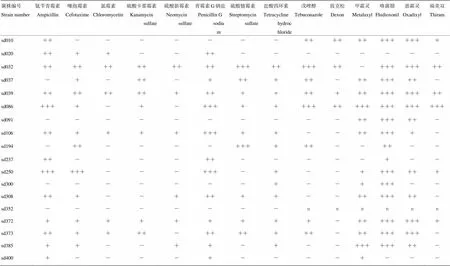
表3 新分离菌株对抗生素、杀菌剂的耐性
“-”表示未形成菌落No colony formation;“+”表示初步形成菌落Initial formation of colony;“++”表示形成典型菌落Typical formation of colony;“+++”表示形成旺盛生长菌落Formation of actively growing colony;“n”表示未测定No test
2.6 菌株对碳源的发酵利用
选取了4菌株sd037、sd106、sd194、sd372 为代表,测定了新分离水稻内生固氮菌对78种碳源的发酵利用。整体来看菌株对碳源的利用种类不多。乳酸钠、蔗糖、葡萄糖、甘油、苹果酸、丙氨酸、葡萄糖醛酰胺是菌株利用较多的碳源,其他碳源则较少被利用(表4)。

表4 新分离菌株对碳源的发酵利用
“-”表示不利用No utilization;“+”表示利用Utilization;“±”表示少量利用Slightly utilization
2.7 菌株对水稻苗期生长及植株Cd含量的影响
从根长来看,菌株sd385显著促进根生长,而菌株sd039、sd237、sd372则表现出对根生长的抑制作用。从株高来看,接种分离菌株后稻苗普遍低于对照,5个处理达到统计显著水平。从植株鲜重来看,接种分离菌株后稻苗生物量普遍高于对照处理,5个处理sd086、sd232、sd308、sd385、sd400均显著高于对照,说明接种水稻内生固氮菌可以显著提高稻苗生物量(表5)。菌株sd385使稻苗根系显著伸长,生物量显著增加,株高增加,值得进一步研究。
有6个菌株促进水稻苗期Cd吸收,与对照相比植株Cd含量增加6.41%—38.45%。其他13个菌株抑制水稻苗期Cd吸收,与对照相比植株Cd含量减少2.06%—34.46%(表5)。
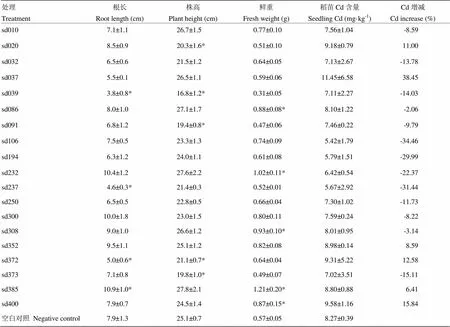
表5 接种水稻内生固氮菌对水稻苗期生长及植株Cd吸收的影响
“*”表示统计学差异达到0.05显著水平Significant differences at 5% level
3 讨论
学术上较严格的植物内生菌(endophytic bactcria)概念是指从经过表面消毒的植物组织器官或植物体内分离提取出来的对植物本身有益无害的细菌[17]。现在这个概念有了一些扩大,通常认为植物内生菌泛指生活史或某个生命阶段生活在健康植物体内,不引起宿主植物外在病症的细菌、真菌或放线菌[18],但不包括在植物体内定殖,引起寄生植物病害的致病菌,也不包括菌根真菌[19]。
水稻内生固氮菌是指从水稻体内分离、并且检测到固氮基因()或者检测到固氮酶活性的细菌。从文献资料来看,目前关于水稻内生菌的研究报道较多[1,20-23],水稻内生菌固氮菌的研究报道相对少一些。关于内生固氮菌的研究大多集中在高效菌株分离鉴定与促生特性研究[8,24-26],分离到的菌株有等。关于水稻内生固氮菌系统发育的研究报道是分离鉴定了25株水稻内生固氮菌,这些菌株的系统发育地位分别属于芽孢杆菌()、伯克霍尔德氏菌()、肠杆菌()、黄杆菌()、草螺菌()、克雷伯氏菌()、类芽孢杆菌()、泛菌()、根瘤菌(),共计9属16种[15]。本文分离鉴定了19株水稻内生固氮菌,在系统发育地位上分别属于芽孢杆菌()短杆菌()()类芽孢杆菌(),其中短杆菌()和()是未曾报道过的水稻内生固氮菌属种,同时丰富了内生固氮菌的芽孢杆菌新类群。
菌株的生物学特性,特别是与环境适应性和微生物肥料生产应用相关的特性,是菌株在自然界生存、在农业生产中发挥作用的基础。本文检测了分离菌株的产碱、产孢、高温生长、产蛋白酶、产纤维素酶等特性。菌株的产碱能力与菌株对土壤重金属Cd的钝化有关,原理是菌株产碱引起土壤pH升高,减少了Cd在土壤溶液中的溶解性,从而减少植株对Cd的吸收,本试验结果支持这一观点。对19个菌株产碱能力测定的结果显示,其中4个菌株sd010、sd039、sd232、sd373的发酵液终pH为8.5—9.0,它们对应的稻苗Cd含量增减百分比分别为-8.59%、-14.03%、-22.37%、-15.11%,全部是减少稻苗Cd含量。菌株sd106、sd194、sd237发酵液终pH 7.0,没有显示出产碱性能,对应的稻苗Cd含量增减百分比为分别为-34.46%、-29.99%、-31.44%。考虑到土壤环境和实验室纯培养环境的巨大差异,笔者认为这个试验结果还是显示了菌株的产碱能力与减少稻苗Cd含量存在相关性,是一个值得深入研究的现象。
芽孢(spore)是指某些细菌在一定的环境条件下,在菌体内部形成一个圆形或卵圆形小体,是细菌的休眠方式,称为内芽孢(endospore),简称芽孢。菌株的产孢能力强,对不良环境的耐受能力也强。菌株的高温生长能力反映了菌株对较高温度的适应性,这一性状对于微生物肥料的生产应用很重要,比如菌剂的工厂化生产和堆肥发酵等就涉及到50℃甚至更高的温度。菌株产蛋白酶和纤维素酶的能力反映了菌株对蛋白质和纤维素类物质的分解代谢能力,也是菌株生存竞争能力的重要指标。试验中也发现一个有趣的现象,菌株sd032、sd037、sd039、sd372、sd373产生蛋白酶和纤维素酶的能力较强,在48℃的生长能力也较强,在产孢液体培养基上生长好,在固体产孢培养基上产孢率高,产碱能力也相对较强,似乎显示出一种强者恒强的特性。
病害是水稻生产中的一大问题,多年来主要依靠抗病育种和农药防治。生物防治开辟了一条预防水稻病害的新途径。因此,水稻病害的生物防治一直是水稻内生菌研究的热点之一[27-30]。仔细分析就会发现,水稻内生菌研究报道中的细菌有很多就是固氮菌,只是研究者没有研究菌株的生物固氮特性,或者说没有从水稻内生固氮菌的角度进行研究和分析讨论,比如在Mano发表的一篇水稻内生细菌综述中所列举的很多细菌属种就是作者分离、鉴定过的固氮菌[1,13,15,31]。事实上,生物固氮特性只是固氮菌的基本特性,很多固氮菌都有提高植物抗病、抗逆等多种特性[12,16,31],这使得内生固氮菌研究更有意义。本文以3株病原真菌立枯丝核菌ACCC36246、禾谷镰孢ACCC36249、拟枝孢镰孢ACCC37402作为靶标,测试分离到的19株水稻内生固氮菌的拮抗性能,结果3株内生固氮菌对立枯丝核菌具有抗性,3株内生固氮菌对禾谷镰孢菌具有抗性,3株内生固氮菌对拟枝孢镰孢菌具有抗性。说明在自然生长的水稻体内有大约1/6的内生固氮菌对真菌病害具有天然的抗性。同时,这个结果也提示研究者,这些抗病菌株具有很大的潜能,如果把这些功能菌株做成菌剂接种水稻秧苗,可能对预防水稻病害起到很好的作用。
抗生素和杀菌剂有共同点,也有不同点。共同点在于它们都是用于杀灭病原微生物,不同点在于抗生素主要用于人、畜等动物,杀菌剂主要用于农业种植、养殖如农田、养殖场。研究菌株对抗生素和杀菌剂耐性的意义也是不同的。菌株对抗生素的耐性越强,菌株就越是难以被控制,传播耐药性的机率就越大,环境风险也就越大。所以,笔者在筛选功能菌株时希望菌株的耐药性小,最好是抗生素敏感菌株,这样在使用时环境风险小,便于控制菌株传播。而对于杀菌剂的耐性则希望筛选到耐药性较强的菌株。原因是水稻种植过程中病害严重,特别是在中国北方寒地水稻早春育秧过程中苗床发病率很高,水稻生产离不开杀菌剂。目前能做的就是将化学杀菌剂与生物防治(抗病功能菌剂)措施配合使用,逐渐减少化学杀菌剂的用量。要做到与化学杀菌剂配合使用,就需要功能菌株具有较强的杀菌剂耐性。本文检测了18株新分离菌株对8种抗生素和6种杀菌剂的耐药性,发现了一些对抗生素敏感,对杀菌剂耐性强的菌株,这对于基础数据积累和应用技术开发都有积极意义。
细菌对不同碳源的发酵利用能力是菌株的基本特性,具有种属特点,因此BIOLOG测定常用于菌株鉴定。本文进行分离菌株的BIOLOG测定,不仅是积累基础数据,更多地希望了解菌株对多种碳源的发酵利用能力。因为这些数据作为基础研究,有助于了解水稻内生固氮菌的碳源利用特点和菌株鉴定等;作为应用研究,有助于筛选功能菌株,以及设计工厂化菌剂生产配方等。本文测定了菌株对多种碳源的发酵利用,结果显示4个代表菌株对78种碳源的利用种类较少,这也许正是水稻内生固氮菌的特异之处,需要将来扩大菌株数量继续研究。
将进入土壤的重金属元素剥离土壤非常困难,科学工作者发明了物理、化学、生物、工程等多种方法来阻控土壤Cd污染[32]。比较彻底的修复方法是植物修复法[33],通过种植Cd高积累植物把土壤中的Cd剥离出来[34-35]。另一种研究较多的方法是原位修复法[36],通过大量施用生物炭等有机物料[37],或者海泡石、黏土等矿物类物料[38],改变土壤理化性状,阻止Cd进入稻米。
采用植物内生菌修复重金属污染土壤是近年来的一个新的研究热点[39],植物-微生物联合修复技术展示出良好的应用前景[40-41]。耐Cd微球菌sp. TISTR2221显著促进玉米对Cd的吸收积累,使试验土壤中Cd含量大大降低[42]。田间试验表明,接种罗尔斯顿菌sp. TISTR 2219和节杆菌sp. TISTR 2220的丁香()移栽2个月后体内Cd积累量与不接种对照相比增加了20%—40%[43]。国内学者的大量研究工作也验证了微生物在植物-微生物联合修复土壤Cd污染中的巨大作用[44-47]。本试验结果也显示出接种水稻内生固氮菌可以显著影响水稻苗期Cd吸收,19株内生固氮菌中有1/3菌株促进水稻苗期Cd吸收,2/3菌株抑制水稻苗期Cd吸收。
4 结论
从湖南郴州桂阳农田水稻上分离到19株内生固氮菌,菌株的系统发育地位属于4属13种。部分菌株产蛋白酶、纤维素酶能力强,48℃生长良好,产孢率高(60%—90%),产碱(pH 8.5—9.0),对立枯丝核菌、禾谷镰孢、拟枝孢镰孢具有拮抗性,对抗生素相敏感,对杀菌剂耐性强,具有良好应用前景。试验的19株内生固氮菌中有13个菌株抑制水稻苗期Cd吸收,与对照相比植株Cd含量减少2.06%—34.46%,提示采用微生物方法阻控稻田Cd污染是一个非常值得研究、探讨的途径。
References
[1] Mano H, Morisaki H. Endophytic bacteria in the rice plant., 2008, 23(2): 109-117.
[2] 李龚程, 张仕颖, 肖炜, 龙智勇, 张乃明. 水稻中内生菌研究进展. 中国农学通报, 2015, 31(12): 157-162.
Li G C, Zhang S Y, Xiao W, Long Z Y, Zhang N M. Research progress on endophytes in rice., 2015, 31(12): 157-162. (in Chinese)
[3] Wang M E, Chen W P, Peng C. Risk assessment of Cd polluted paddy soils in the industrial and township areas in Hunan, Southern China., 2016, 144: 346-351.
[4] Liu Y B, Xia T F, Baveye P C, Zhu J M, Ning Z P, Li H J. Potential health risk in areas with high naturally-occurring cadmium background in southwestern China., 2015, 112: 122-131.
[5] 尹艺, 赵颖, 马莲菊, 卜宁. 碱蓬内生真菌对镉胁迫水稻幼苗生长及生理生化指标的影响. 贵州农业科学, 2014, 42(3): 23-26.
Yi Y, Zhao Y, Ma L J, Bu N. Effects of endophyte isolated fromon growth and physiclogical and biological indexes of rice seedlings., 2014, 42(3): 23-26. (in Chinese)
[6] Barraquio W l, Revilla L, Ladha J k. Isolation of endophytic diazotrophic bacteria from wetland rice., 1997, 194: 15-24.
[7] Zhang G X, Peng G X, Wang E T, Yan H, Yuan Q H, Zhang W, Lou X, Wu H, Tan Z Y. Diverse endophytic nitrogen-fixing bacteria isolated from wild riceand description ofgen. nov. sp. nov., 2008, 189: 431-439.
[8] Chaudhary H J, Peng G X, Hu M, He Y M, Yang L J, Luo Y, Tan Z Y. Genetic diversity of endophytic diazotrophs of the wild rice,and identification of the new diazotroph,sp. nov., 2012, 63: 813-821.
[9] Govindarajan M, Balandreau J, Kwon S W, Weon H Y, Lakshminarasimhan C. Effects of the inoculation ofand related endophytic diazotrophic bacteria on grain yield of rice., 2008, 55(1): 21-37.
[10] 李倍金, 罗明, 周俊, 孔德江, 张铁明. 几种禾草内生固氮菌的分离及固氮活性测定. 草业学报, 2008, 17(5): 37-42.
Li B J, Luo M, Zhou J, Kong D J, Zhang T M. Isolation of endophytic diazotrophic bacteria from several gramineae grasses and determination of their nitrogenase activity., 2008, 17(5): 37-42. (in Chinese)
[11] 孙建光, 张燕春, 徐晶, 胡海燕. 高效固氮芽孢杆菌选育及其生物学特性研究. 中国农业科学, 2009, 42(6): 2043-2051.
Sun J G, zhang Y C, Xu J, Hu H Y. Isolation and biological characteristic investigation on efficient nitrogen-fixing bacilli.,2009, 42(6): 2043-2051. (in Chinese)
[12] 秦宝军, 罗琼, 高淼, 胡海燕, 徐晶, 周义清, 孙建光. 小麦内生固氮菌及其ACC脱氨酶测定. 中国农业科学, 2012, 45(6): 1066-1073.
Qin B J, Luo Q, Gao M, Hu H Y, Xu J, Zhou Y Q, Sun J G. Isolation of wheat endophytic diazotrophs and determination of 1-aminocyclopropane-1-carboxylate deaminase., 2012, 45(6): 1066-1073. (in Chinese)
[13] 孙建光, 徐晶, 胡海燕, 张燕春, 刘君, 王文博, 孙燕华. 中国十三省市土壤中非共生固氮微生物菌种资源研究. 植物营养与肥料学报, 2009, 15(6): 1450-1465.
Sun J G, Xu J, Hu H Y, Zhang Y C, Liu J, Wang W B, Sun Y H. Collection and investigation on asymbiotic nitrogen-fixing microbial resources from 13 provinces over China., 2009, 15(6): 1450-1465. (in Chinese)
[14] Gao M, Zhou J J, Wang E T, Chen Q, Xu J, Sun J G. Multiphasic characterization of a plant growth promoting bacterial strain,sp. 7016 and its effect on tomato growth in the field.,2015, 14(9): 1855-1863.
[15] 孙建光, 罗琼, 高淼, 胡海燕, 徐晶, 周义清. 小麦、水稻、玉米、白菜、芹菜内生固氮菌及其系统发育研究. 中国农业科学, 2012, 45(7): 1303-1317.
Sun J G, Luo Q, Gao M, Hu H Y, Xu J, Zhou y Q. Isolation and phylogeny of nitrogen-fixing endophytic bacteria in wheat, rice, maize, Chinese cabbage and celery., 2012, 45(7): 1303-1317. (in Chinese)
[16] 陈倩, 高淼, 胡海燕, 徐晶, 周义清, 孙建光. 一株拮抗病原真菌的固氮菌sp. GD812. 中国农业科学, 2011, 44(16): 3343-3350.
Chen Q, Gao M, Hu H Y, Xu J, Zhou Y Q, Sun J G. A nitrogen-fixing bacteriumsp. GD812 antagonistic against plant pathogenic fungi., 2011, 44(16): 3343-3350. (in Chinese)
[17] Saharan B S, Nehra V. Plant growth promoting rhizobacteria: a critical review., 2011, 2011: LSMR-21.
[18] Stone J K, Bacon C W, White J F. An overview of endophytic microbes: endophytism defined., 2000, 3: 29-33.
[19] Kloeppe J W, Rodriguez-Kabana R, Zehnder G W, Murphy J F, Sikora E, Fernández C. Plant rootbacterial interactions in biological control of soilborne diseases and potential extension to systemic and foliar diseases., 1999, 28(1): 21-26.
[20] Chaudhry V, Baindara P, Pal V K, Chawla N, Patil P B, Korpole S.sp. nov., a facultative methylotrophic bacterium isolated from rice seed., 2016, 39: 25-32.
[21] Lin L, Wei C, Chen M, Wang H, Li Y, Li Y, YANG L, AN Q. Complete genome sequence of endophytic nitrogen-fixingstrain DX120E., 2015, 10: 22.
[22] Chung E J, Hossain1 M T, Khan1 AQ, Kim K H, Jeon C O, Chung Y R.sp. nov., an endophytic bacterium isolated from the roots of rice with antimicrobial, plant growth promoting, and systemic resistance inducing activities in rice.,2015, 31(2): 152-164.
[23] Zhang X X, Gao J S, Cao Y H, Sheirdil R A, Wang X C, Zhang L.sp. nov., potential plantgrowth- promoting endophytic bacteria isolated from rice roots., 2015, 65: 2931-2936.
[24] 王秀呈, 曹艳花, 唐雪, 马晓彤, 高菊生, 张晓霞. 水稻内生固氮菌DX35的筛选及其促生特性. 微生物学报, 2014, 54(3): 292-298.
Wang X C, Cao Y H, Tang X, Ma X T, Gao J S, Zahng X X. Rice endogenous nitrogen fixing and growth promoting bacteriumDX35.,2014, 54(3): 292-298. (in Chinese)
[25] Ji S H, Gururani M A, Chuna S C. Isolation and characterization of plant growth promoting endophyticdiazotrophic bacteria from Korean rice cultivars., 2014, 169: 83-98.
[26] Jha B, Thakur M C, Gontia I, Albrecht V, Stoffels M, Schmid M, Hartmann A. Isolation, partial identification and application of diazotrophic rhizobacteria from traditional Indian rice cultivars., 2009, 45: 62-72.
[27] Gimenez C, Cabrera R, Reina M, González-Coloma A. Fungal endophytes and their role in plant protection., 2007, 11(8): 707-720.
[28] Su Z Z, Mao L J, Li N, Feng X X, Yuan Z L, Wang L W, Lin F C, Zhang C L. Evidence for biotrophic lifestyle and biocontrol potential of dark septate endophyteto rice blast disease., 2013, 8(4): e61332.
[29] 杨海莲, 孙晓璐, 宋未. 植物根际促生细菌和内生细菌的诱导抗病性的研究进展. 植物病理学报, 2000, 30(2): 106-110.
Yang H L, Sun X L, SONG W. Current development on induced resistance by plant growth promoting and endophytic bacteria., 2000, 30(2): 106-110. (in Chinese)
[30] 陈夕军, 胡长松, 童蕴慧, 纪兆林, 徐敬友. 水稻内生枯草芽孢杆菌对稻瘟病菌和稻恶苗病菌的抑制作用. 中国生物防治, 2008, 24(4): 339-344.
Chen X J, Hu C S, Tong Y H, Ji Z L, Xu J Y. Inhibition of rice endophyticonand, 2008, 24(4): 339-344. (in Chinese)
[31] 孙建光, 胡海燕, 刘君, 陈倩, 高淼, 徐晶, 周义清. 农田环境中固氮菌的促生潜能与分布特点研究. 中国农业科学, 2012, 45(8): 1532-1544.
Sun J G, Hu H Y, Liu J, Chen Q, Gao M, Xu J, Zhou Y Q. Growth promotion potential and distribution features of nitrogen- fixing bacteria in field environments., 2012, 45(8): 1532-1544. (in Chinese)
[32] Wang w Z, Xu W H, Zhou K, Xiong Z T. Research progressing of present contamination of Cd in soil and restoration method.,2015, 20(5): 430-444.
[33] 苏慧, 魏树和, 周启星. 镉污染土壤的植物修复研究进展与展望. 世界科技研究与发展, 2013, 35(3): 315-319.
Sun H, Wei S H, Zhou Q X. Advances in phytoremediation of cadmium contaminated soil.,2013, 35(3): 315-319. (in Chinese)
[34] 李廷强, 董增施, 姜宏, 李冰, 杨肖娥. 东南景天对镉-苯并[a]芘复合污染土壤的修复效果. 浙江大学学报 (农业与生命科学版) , 2011, 37(4): 465-472.
Li T Q, Dong Z S, Jiang H, Li B, Yang X E. Remediation efficiency of Ca-B[a] P combined polluted soil by., 2011, 37(4): 465-472. (in Chinese)
[35] 唐皓, 李廷轩, 张锡洲, 余海英, 陈光登. 水稻镉高积累材料不同生育期镉积累变化特征研究. 农业环境科学学报, 2015, 34(3): 471-477.
Tang H, Li T X, Zhang X Z, Yu H Y, Chen G D. Cadmium accumulation in high cadmium-accumulating rice cultivars at different growth stages., 2015, 34(3): 471-477.(in Chinese)
[36] 韩君, 梁学峰, 徐应明, 徐愿坚, 雷勇, 蒋荣辉. 黏土矿物原位修复镉污染稻田及其对土壤氮磷和酶活性的影响. 环境科学学报, 2014, 34(11): 2853-2860.
Han J, Liang X F, Xu Y M, Xu Y J, Lei Y, Jiang R H. In-situ remediation of Cd-polluted paddy soil by clay minerals and their effects on nitrogen, phosphorus and enzymatic activities.,2014, 34(11): 2853-2860. (in Chinese)
[37] Bian R J, Chen D, Liu X Y, Cui L Q, Li L Q, Pan G X, Xie D, Zheng J W, Zhang X H, Zheng J F, Chang A. Biochar soil amendment as a solution to prevent Cd-tainted rice from China: Results from a cross-site field experiment., 2013, 58: 378-383.
[38] 孙约兵, 徐应明, 史新, 王林, 梁学峰. 海泡石对镉污染红壤的钝化修复效应研究. 环境科学学报, 2012, 32(6): 1465-1472.
Sun Y B, Xu Y M, Shi X, Wang L, Liang X F. The effects of sepiolite on immobilization remediation of Cd contaminated red soil., 2012, 32(6): 1465-1472.(in Chinese)
[39] Rajkumar M, Ae N, Freitas H. Endophytic bacteria and their potential to enhance heavy metal phytoextraction., 2009, 77: 153-160.
[40] Ullah A, Sun H, Munis M, Fahad S, Yang X Y. Phytoremediation of heavy metals assisted by plant growth promoting (PGP) bacteria: A review., 2015, 117: 28-40.
[41] Aryal M, Liakopoulou-Kyriakides M. Bioremoval of heavy metals by bacterial biomass.,2015, 187: 4173.
[42] Sangthong C, Setkit K, Prapagdee B. Improvement of cadmium phytoremediation after soil inoculation with a cadmium- resistantsp., 2016, 23(1): 756-764.
[43] Prapagdee B, Khonsue N. Bacterial-assisted cadmium phytoremediation byL. in polluted agricultural soil: a field trial experiment., 2015, 12: 3843-3852.
[44] 刘莉华, 刘淑杰, 陈福明, 杨小龙, 杨春平, 赵晶晶, 吴秉奇. 两株镉抗性奇异变形杆菌对龙葵修复镉污染土壤的强化作用. 环境工程学报, 2013, 7(10): 4109-4115.
Liu L H, Liu S J, Chen F M, Yang X L, Yang C P, Zhao J J, Wu B Q. Efects of two cadmium-resistant strains ofon enhanced remediation efficiency ofL. in serious cadmium polluted soil., 2013, 7(10): 4109-4115. (in Chinese)
[45] 江春玉, 盛下放, 何琳燕, 马海艳, 孙乐妮, 张艳峰. 一株铅镉抗性菌株WS34的生物学特性及其对植物修复铅镉污染土壤的强化作用. 环境科学学报, 2008, 28(10): 1961-1968.
Jiang C Y, Sheng X F, He L Y, Ma H Y, Sun L N, Zhang Y F. Isolation and characteristics of heavy metal-resistant strain WS34 and its effects on the phytoremediation of soils contaminated with lead and cadmium., 2008, 28(10): 1961-1968. (in Chinese)
[46] 胡振琪, 杨秀红, 高爱林, 危向峰. 镉污染土壤的菌根修复研究. 中国矿业大学学报, 2007, 36(2): 237-240.
Hu Z Q, Yang X H, Gao A L, Wei X F. Remediation of mycorrhezae on Cd contaminated soil., 2007, 36(2): 237-240. (in Chinese)
[47] 马文亭, 滕应, 凌婉婷, 李振高, 吴龙华, 骆永明. 里氏木霉FS10-C对伴矿景天吸取修复镉污染土壤的强化作用. 土壤, 2012, 44(6): 991-995.
Ma W T, Teng Y, Ling W T, Li Z G, Wu L H, Luo Y M. Enhancing remediation ofin cadmium contaminated soils byFS10-C., 2012, 44(6): 991-995. (in Chinese)
(责任编辑 岳梅)
Isolation and Biological Properties of Endophytic Diazotrophs from Rice and Their influences on Rice seedling Cd Accumulation
YUAN Mei1, TAN Shi-juan2, SUN Jian-guang1
(1Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences/Key Laboratory of Microbial Resources, Ministry of Agriculture, Beijing 100081;2Guiyang Agricultural Bureau, Chenzhou 424400, Hunan)
【Objective】The objective of this study is to isolate, identify and analyze phylogenetics of endophytic diazotrophs from rice planted in Hunan province, test the biological characteristics of the isolates, and to explore the influences of diazotroph inoculation on rice seedlings Cd accumulation. 【Method】Surface sterilization and low nitrogen medium were used to isolate endophytic diazotrophs.detection was conducted based on PCR amplification to confirm the isolates as nitrogen-fixing bacteria. 16S rRNA was amplified with PCR, blasted in EzTaxon after sequencing, and analyzed with Clustalx-MEGA to make phylogenetic tree. Greenhouse trials were conducted to investigate the influence of diazotroph inoculation on rice seedling Cd accumulation. 【Result】Nineteen endophytic diazotrophs were isolated from root, stem and leaf of 8 rice samples. These 19 strains phylogenetically belong to4genus 13 species of,,,,,,,,,.,,,. Biological tests showed that about 1/3 of the 19 strains produce protease and cellulose, grow well at 48℃, form spores well with percentage 60%-90%, produce alkali with final pH 8.5-9.0. About 1/6 of the 19 strains are antagonistic against plant pathogenicACCC36246,ACCC36249 andACCC37402 with rate of 42%-55%. About 2/3 of the 19 strains showed sensitive to antibiotics and resistant to fungicide. Four representative strains of the 19 could utilize 7 of the 78 carbon sources, sodium lactate, sucrose, dextrose, glycerol, malic acid, alanine and glucuronic acid amide. Greenhouse trials showed that 6 of the 19 strains promoted rice seedling Cd absorption with increase of 6.41%-38.45%, and other 13 strains decreased rice seedling Cd absorption with 2.06%-34.46% compared with control.【Conclusion】Nineteen endophytic diazotrophs were isolated from rice planted in Hunan. These 19 strains phylogenetically belong to 4 genus 13 species of,,and. Partial strains produce protease and cellulose, grow well at 48℃, form spores well, antagonistic against plant pathogenic,andhave good prospects of application. Inoculation of diazotroph can significantly affect rice seedling Cd absorption. The results suggest that application of microbial method to control paddy Cd is a very worthwhile pathway.
rice; endophytic diazotrophs; biological property; Cd
2016-04-13;接受日期:2016-04-25
国家公益性行业(农业)科研专项(201203045)
袁梅,E-mail:yuanmei1010@163.com。通信作者孙建光,Tel:010-82108701;E-mail:jgsun@caas.ac.cn
