马铃薯晚疫病菌对氟吡菌胺抗性突变体的获得及其生物学性状
2016-12-23罗彦涛孟润杰赵建江韩秀英马志强王文桥张小风
罗彦涛,孟润杰,赵建江,韩秀英,马志强,王文桥,张小风
马铃薯晚疫病菌对氟吡菌胺抗性突变体的获得及其生物学性状
罗彦涛1,2,孟润杰1,赵建江1,韩秀英1,马志强1,王文桥1,张小风1
(1河北省农林科学院植物保护研究所,河北保定 071000;2河北农业大学植物保护学院,河北保定 071000)
【目的】研究抗氟吡菌胺突变体对不同杀菌剂的交互抗性并评估马铃薯晚疫病菌对氟吡菌胺的抗性风险。【方法】通过紫外线照射菌丝体、紫外线照射孢子囊和药剂驯化的方法获得抗氟吡菌胺的马铃薯晚疫病菌突变体,计算突变体的突变频率,测定抗性突变体的抗性水平,研究突变体在无药条件下继代培养10代后抗性能否稳定遗传,测定突变体在RSA培养基和离体叶片上的适合度(菌丝生长速率、产孢子囊能力及复合适合度指数),比较抗性菌株与其亲本敏感菌株的竞争力,分析对氟吡菌胺表现不同敏感性的菌株对不同药剂的交互抗性,并通过笔者实验室建立的抗性风险量化标准评定马铃薯晚疫病菌对氟吡菌胺的抗性风险。【结果】共获得21个抗性菌株,抗性水平介于61—3 157倍,紫外线诱导孢子囊的突变率为2.78×10-7;大多数抗性突变体的适合度与其亲本菌株无显著性差异;竞争力测定试验中,2株突变体的第1、3、7代的共18次抗药频率测定中,有3次测定的抗药频率显著低于初始频率,有4次测定的抗药频率显著高于初始频率,其余11次测定的抗药频率与初始频率均无显著性差异;所有突变菌株的抗药性均能稳定遗传;抗氟吡菌胺菌株及其亲本菌株对氟吡菌胺的lgEC50与这些菌株对嘧菌酯、吡唑醚菌酯、霜脲氰、烯酰吗啉、双炔酰菌胺、甲霜灵、氟醚菌酰胺的lgEC50之间的相关系数()分别为0.104(=0.654)、0.311(=0.170)、0.228(=0.081)、0.376(=0.093)、0.214(=0.351)、0.122(=0.599)、0.963(=0.000);致病疫霉对氟吡菌胺基本抗性风险值为15。【结论】氟吡菌胺与氟醚菌酰胺之间存在交互抗性,与嘧菌酯、吡唑醚菌酯、霜脲氰、烯酰吗啉、双炔酰菌胺、甲霜灵之间无交互抗性,马铃薯晚疫病菌对氟吡菌胺的固有抗性风险为高度,应加强马铃薯晚疫病菌对氟吡菌胺的抗性风险管理,建议生产上将氟吡菌胺与其他类药剂交替或混合使用。
马铃薯晚疫病菌;氟吡菌胺;抗性突变体;生物学性状;交互抗性;基本风险
0 引言
【研究意义】马铃薯是世界上第四大粮食作物,在保障粮食安全、促进农民增收、消除贫困方面具有重要的战略意义。中国逐步推进的马铃薯主粮化战略推动了马铃薯产业的发展[1-2]。由致病疫霉()引起的马铃薯晚疫病是一种毁灭性的病害,每年在全世界范围内造成的经济损失约为67亿美元[3-4],曾造成历史上著名的爱尔兰大饥荒[5],是阻碍中国马铃薯产业发展的重要因素。化学防治是目前的马铃薯生产上控制马铃薯晚疫病的重要手段。氟吡菌胺在马铃薯晚疫病防治中广泛应用,且效果良好[6-7]。通过评估马铃薯晚疫病菌对氟吡菌胺的抗性风险,进而指导氟吡菌胺在马铃薯晚疫病防治中的合理使用,对减缓抗性产生,延长农药生命周期具有重要意义。【前人研究进展】氟吡菌胺是拜耳公司研发的新型药剂,对卵菌纲特效,对病菌的各生长期均有抑制作用,其作用机理为通过作用于一种特异性蛋白——类血影蛋白,影响细胞的有丝分裂,破坏病原菌细胞结构而表现杀菌活性[8-10]。马铃薯晚疫病菌经风雨传播,再侵染频繁,被杀菌剂抗性行动委员会(FRAC)划定为高抗药性风险病原菌,已对甲霜灵产生了严重的抗性,因此需重视马铃薯晚疫病的抗药性研究和治理工作[11-13]。FRAC尚未确定氟吡菌胺抗性风险的高低[14-15]。Wang等[16]发现黄瓜霜霉病菌()对氟吡菌胺存在中到高度抗性风险,Lu等[17-18]发现辣椒疫霉()对氟吡菌胺存在中到高度抗性风险。黄瓜霜霉病菌、辣椒疫霉和马铃薯晚疫病菌都有不同交配型[19-22],有性生殖为病原菌提供了遗传变异的重要来源。由于寄主作物的种植模式、用药习惯、生长条件等各不相同,且病原菌具有不同遗传特性,因此,研究马铃薯晚疫病菌对氟吡菌胺的抗性风险具有重要意义。Gisi等[23]将杀菌剂的抗性风险分为基本风险和治理风险,并分别赋予相应的风险值,靶标菌对杀菌剂的全部抗性风险值为基本风险值与治理风险值之积。该评分标准过于复杂,实用性较差。Brent等[24]简化了Gisi的方法,认为植物病原菌对杀菌剂的基本抗性风险由药剂和病害决定,并提出由药剂和病害决定的抗性风险特征,并根据药剂基本风险和病害决定的基本风险严重程度赋予相应的风险值,病害对杀菌剂的基本风险值为病害基本风险值与药剂基本风险值之积。该方法将杀菌剂和病原菌进行分类概括,不便于评估特定病原菌对特定药剂的风险。【本研究切入点】目前尚无马铃薯晚疫病菌对氟吡菌胺抗性风险评估的报道,很少有氟吡菌胺与其他药剂存在交互抗性的报道。【拟解决的关键问题】在实验室条件下获得抗氟吡菌胺突变体,研究所获抗性突变体的生物学性状以及氟吡菌胺与其他杀菌剂的交互抗性,并量化评估马铃薯晚疫病菌对氟吡菌胺的抗性风险,为氟吡菌胺的合理使用和制定其抗药性治理策略提供理论依据。
1 材料与方法
试验于2014年6月至2015年12月在河北省农林科学院植物保护研究所杀菌剂组完成。
1.1 试验材料
1.1.1 供试亲本菌株(野生敏感菌株) 马铃薯晚疫病菌从田间采集并分离(表1)。

表1 供试亲本菌株的采集时间及地点
1.1.2 供试药剂 95%氟吡菌胺原药,拜耳作物科学公司;95%嘧菌酯原药,南京金土地化工有限公司;98%氟醚菌酰胺原药,山东联合农化有限公司;98%吡唑醚菌酯原药,巴斯夫欧洲公司;98%霜脲氰原药,杜邦公司;95%双炔酰菌胺原药,先正达作物保护有限公司;97%甲霜灵原药,沈阳化工研究院;97.6%烯酰吗啉原药,河北冠龙农化有限公司。
1.1.3 供试培养基 黑麦蔗糖琼脂培养基(rye sucrose agar,RSA):黑麦80 g,琼脂10 g,蔗糖20 g,蒸馏水定容至1 L。
1.1.4 供试仪器 恒温生化培养箱,超净工作台,电热恒温水浴锅,移液枪等。
1.2 试验方法
1.2.1 抗氟吡菌胺突变菌株的获得 UV诱导菌丝体:黑暗条件下将预培养好的敏感菌株置于紫外灯(15 W,254 nm,预热30 min)下方垂直距离25 cm处照射亚致死时间(30 min),红光条件下从菌落边缘切取10 mm×10 mm×3 mm的菌块,移入含最低抑制浓度(MIC,15 mg·L-1)氟吡菌胺的RSA平板上,每个菌株转接10皿,每皿4块,18℃黑暗培养7—10 d,若能在含MIC及以上浓度氟吡菌胺的RSA平板上生长,表明该野生敏感菌株对供试药剂产生了抗药性,按公式(1)计算抗性突变频率[25]。
抗性突变频率(%)=(出现突变的菌饼数/供试的菌饼总数)×100 (1)
UV诱导孢子囊:将野生敏感菌株在RSA平板上培养7 d后产生大量孢子囊,用无菌水洗下,用双层纱布过滤,在显微镜下调至5×105个/mL的孢子囊悬浮液。在无菌操作条件下,取上述孢子囊悬浮液5 mL置于距紫外灯(15 W,254 nm,预热30 min)下方垂直距离25 cm处,振荡条件下照射亚致死时间(3 min),红光条件下将照射后的孢子囊悬浮液涂布在含MIC氟吡菌胺的直径9 cm的RSA平板上,每菌株接种20皿,每皿0.1 mL,黑暗18℃培养7—10 d,若能在含MIC及以上浓度氟吡菌胺的RSA平板上生长,表明该野生敏感菌株对供试药剂产生了抗药性,按公式(2)计算突变频率[26]。
抗性突变频率=抗性突变菌株数/受紫外线照射的孢子囊数 (2)
药剂驯化:将敏感菌株接种到含系列浓度氟吡菌胺的RSA平板上,培养观察菌丝生长情况,确定氟吡菌胺对马铃薯晚疫病菌的“亚致死浓度”为10 mg·L-1。在含10 mg·L-1氟吡菌胺的RSA培养基平板上培养对氟吡菌胺敏感的菌株,每隔10 d将菌丝生长相对较快的菌株转移至含度氟吡菌胺的平板上,逐渐加大氟吡菌胺的浓度,直至其能在含有大于或等于最低抑制浓度氟吡菌胺的RSA培养基上生长。
1.2.2 抗氟吡菌胺突变体的抗性水平测定 采用菌丝生长速率法[27]分别测定抗药性突变体和亲本菌株的EC50。用丙酮溶解氟吡菌胺原药,分别配制为500、250、125、62.5、31.25 mg·L-1和100、50、10、5、1 mg·L-1的系列浓度,分别用于测定不同抗性水平的突变体,各处理及对照含等浓度的丙酮;测定亲本敏感菌株EC50的系列浓度为10、5、1、0.5、0.1 mg·L-1,设空白对照。将培养好的菌株用打孔器沿菌落边缘打取直径为5 mm的菌块,分别移到含系列浓度氟吡菌胺的培养基平板中央,每处理浓度接种3皿,18℃左右黑暗培养8 d,当对照(即不含杀菌剂的培养基平板)的菌落直径至少达3 cm时,用十字交叉法测量菌落直径,计算抑制率,求出各菌株的毒力回归方程、相关系数和EC50,然后求出各抗药突变体的抗性倍数(resistance ratio,RR),即RR=EC50(抗药突变体)/ EC50(亲本敏感菌株)。
1.2.3 抗氟吡菌胺突变体的稳定性测定 将得到的抗性突变体在无药RSA平板上通过菌丝体连续转接10代,然后测定第10代的EC50,根据敏感性变化指数(第10代EC50与第1代EC50的比值)来判断其抗药稳定性。
1.2.4 抗氟吡菌胺突变体适合度的测定 参照朱志峰[28]的方法,测定各抗药突变体及其亲本菌株在RSA平板上的菌丝生长速率,并用血球计数板测定各抗药突变体及其亲本菌株的产孢子囊总数。
参照侯淑英等[29]的方法,将供试抗性突变体及其亲本菌株接种在RSA培养基上,18℃黑暗培养15 d,用无菌水洗下孢子囊制成1×105个/mL孢子囊悬浮液,4℃诱发游动孢子释放,制成游动孢子悬浮液,备用。采摘马铃薯植株中部长势一致、大小适中的叶片,摆放在铺有湿滤纸的培养皿(φ=15 cm)中,每皿中放置一片复叶(5个小叶),每个处理重复3次。在叶背主叶脉旁接种10 μL游动孢子悬浮液,18℃(16 h光照,8 h黑暗)保湿培养4 d,检查叶片发病情况、病斑大小、产孢量,计算侵染率、病斑面积、产孢能力和复合适合度指数。
1.2.5 抗氟吡菌胺突变体的竞争力测定 参照Kadish等[30-31]的方法,将抗性菌株与敏感菌株的孢子囊以不同比例(4﹕1、1﹕1、1﹕4)混合成孢子囊悬浮液(5×104个/mL),在未用药的叶片上继代培养。采用液滴法将1、3、7代的孢子囊悬浮液分别接种于未经药剂处理和经亲本敏感菌株MIC浓度氟吡菌胺处理的叶片背面,每个处理10个叶片,重复3次,18℃(16 h光照,8 h黑暗)保湿培养4—6 d,检查叶片发病情况,按(3)式估算1、3、7代的抗性菌株频率[32]。
抗药性突变体的频率(%)=(药剂处理叶片上的发病面积/未用药剂处理叶片的发病面积)×100 (3)
1.2.6 抗氟吡菌胺突变体对不同药剂的交互抗性测定 选取15个突变菌株及其6个亲本敏感菌株,采用菌丝生长速率法分别测定这些菌株对霜脲氰、嘧菌酯、吡唑醚菌酯、烯酰吗啉、双炔酰菌胺、甲霜灵及氟醚菌酰胺的敏感性,分析抗性突变体对7种药剂的交互抗性情况。使用SPSS软件分析对氟吡菌胺敏感和抗性的各供试菌株EC50的对数值与供试各菌株对嘧菌酯、吡唑醚菌酯、霜脲氰、烯酰吗啉、双炔酰菌胺、甲霜灵、氟醚菌酰胺EC50的对数值之间的相关性,如果>0.05,即在=0.05的水平下差异不显著,则两种药剂之间无相关性,不存在交互抗性关系;如果<0.05,表明两种药剂有相关性,此时相关系数()越高,相关性越大,通常认为>0.75时,两种药剂之间存在交互抗性关系。
1.2.7 马铃薯晚疫病菌对氟吡菌胺抗性风险的量化评估 本实验室在前人的研究基础上,建立了新的抗性风险量化评估体系,将基本风险分为7个风险因素,分别赋予0、1、2、3个风险值,各风险值之和即为病原菌对药剂的基本风险值。基本风险值为0—7为低度风险,8—14为中度风险,15—21为高度风险。具体标准见表2。

表2 植物病原菌对杀菌剂的基本抗性风险量化评估标准
1.3 数据分析
采用DPS 7.05、SPSS 21.0及Microsoft Excel软件对试验数据进行统计分析。
2 结果
2.1 抗氟吡菌胺突变体的获得
通过紫外线诱导菌丝体共获得13个抗氟吡菌胺突变体,突变频率为1.8%;通过紫外线诱导孢子囊共获得5个抗氟吡菌胺突变体,突变频率为2.78×10-7;通过药剂驯化共获得3个抗氟吡菌胺突变体,药剂驯化的抗性水平变化见图1。

图1 马铃薯晚疫病菌经药剂驯化18代对氟吡菌胺抗性水平变化
2.2 抗氟吡菌胺突变体的抗性水平
获得的21个抗氟吡菌胺突变体的抗性水平较高,介于61—3 157倍(表3)。

表3 马铃薯晚疫病菌对氟吡菌胺抗性突变体的抗性水平
*:亲本敏感菌株parental isolates;UVM:紫外线诱导菌丝块所得突变菌株resistant mutants acquired by UV irradiating sporangia;UVS:紫外线诱导孢子囊所得突变菌株Mutants acquired by UV irradiating mycelium;FT:药剂驯化所得突变菌株Resistant mutants acquired by fungicide taming。下同The same as below
2.3 抗氟吡菌胺突变体的抗性稳定性
所得抗氟吡菌胺的突变体在不含药的RSA平板上继代培养10代后,测定其对氟吡菌胺的敏感性。结果表明,抗性突变体DD10UVM2、DD10FT、DD18UVM1、DD18UVM2、ZC10UVM1、ZC10UVM2、NL12UVM1、NL12UVS、NL12UVS2、DG21UVM1、DG21UVM2、DG21UVS继代培养10代后对氟吡菌胺敏感性无明显变化,表明其对氟吡菌胺的抗药性可以稳定遗传;抗性突变体DD8UVM1、DD10UVM1、DD10UVS、DD18UVM3、DD18UVS、NL12FT、NL12UVM2、NL12UVM3、ZC10FT继代培养10代后对氟吡菌胺敏感性上升明显,但抗性水平依然很高(表4)。
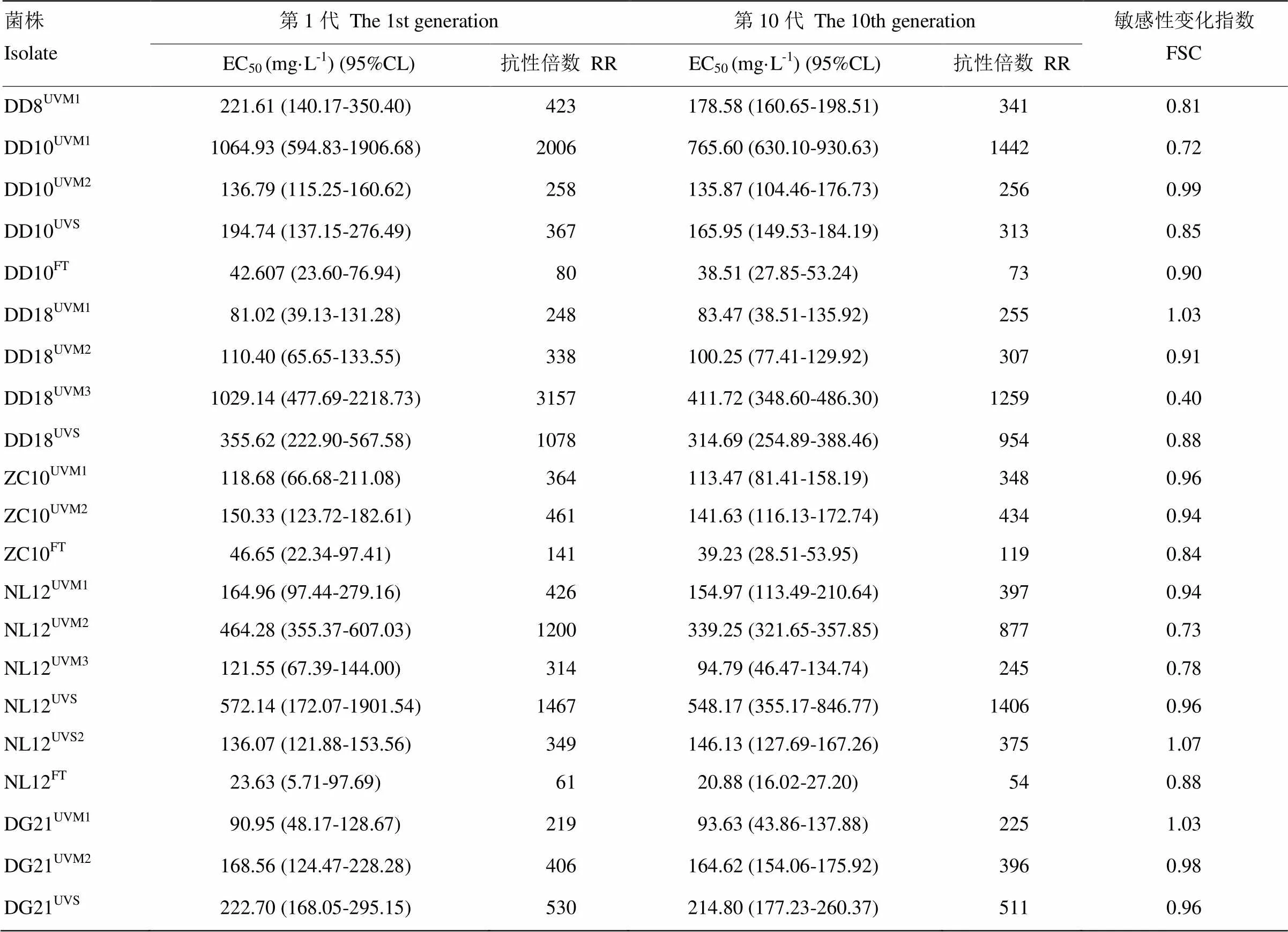
表4 马铃薯晚疫病菌对氟吡菌胺抗性突变体的抗性稳定性
FSC是第10代EC50与第1代EC50的比值 FSC=factor of sensitivity change for fluopicolide mutants, a ratio of EC50values of the10th /1st transferred culture
2.4 抗氟吡菌胺抗性突变体的适合度
抗性菌株DG21UVM和DG21UVS的菌丝生长速率显著大于其亲本菌株DG21,亲本菌株DD10、DD18、ZC10和NL12的菌丝生长速率分别显著大于其抗性突变体DD10FT、DD18UVS、ZC10UVM、ZC10FT、NL12UVS2和NL12FT,其余抗性菌株菌丝生长速率与亲本菌株无显著差异;亲本菌株DD10、ZC10和NL12的产孢子囊能力分别显著大于其抗性菌株DD10FT、ZC10FT、NL12UVS2、NL12FT,抗性菌株DD18UVM和DD18UVS的产孢子囊能力显著大于亲本菌株DD18,其余抗性菌株的产孢子囊能力与其亲本菌株无显著差异(表5)。

表5 抗氟吡菌胺突变体及亲本菌株的菌丝生长速率及产孢子囊能力
根据DMRT分析,表中同列数据后相同小写字母表示在=0.05的水平下差异不显著。下同Figures in the same column followed by the same lowercases were not significantly different using DMRT (=0.05). The same as below
马铃薯晚疫病菌的亲本敏感菌株和抗氟吡菌胺突变体在马铃薯叶片上的侵染率均为100%;亲本菌株ZC10、NL12、DD10和DG21的病斑面积分别显著大于其抗性菌株 ZC10FT、NL12UVM、NL12UVS2、NL12FT、DD10FT和DG21UVM,抗性菌株DD18UVM和DD10UVM分别显著大于其亲本菌株DD18和DD10,其余抗性菌株的病斑面积与其亲本菌株无显著性差异;亲本菌株ZC10、DD18、NL12、DD10和DG21的产孢子囊能力分别显著强于其抗性菌株 ZC10FT、DD18UVM、NL12FT、DD10UVM、DD10UVS、DD10FT、DG21UVS,抗性菌株DG21UVM的产孢子囊能力显著强于其亲本菌株DG21,其余抗性菌株的产孢子囊能力与亲本菌株无显著性差异;亲本菌株ZC10、DD18、NL12、DD10、DG21的复合适合度指数显著高于ZC10FT、 DD18UVS、NL12UVM、NL12FT、NL12UVS2、DD10UVS、DD10FT、DG21UVS,其余抗性菌株的复合适合度指数与其亲本菌株无显著性差异(表6)。
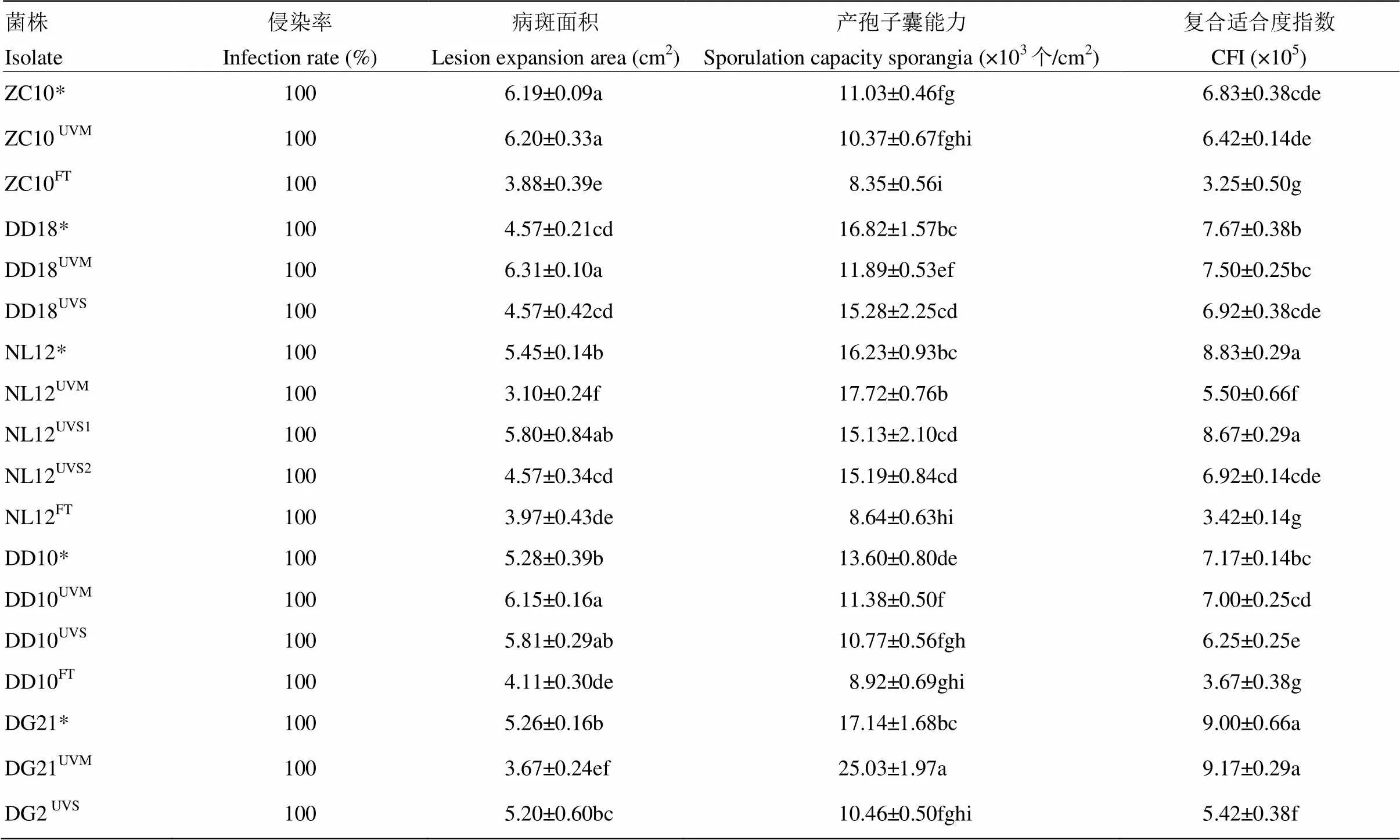
表6 抗氟吡菌胺抗性突变菌株及亲本菌株的复合适合度指数
2.5 抗氟吡菌胺突变体的竞争力
抗性菌株ZC10UVM1和 NL12UVS1分别与其亲本敏感菌株以不同比例混合接种,在第1、3、7代的共18次抗药频率测定中,有3次测定的抗药频率显著低于初始频率,有4次测定的抗药频率显著高于初始频率,其余11次测定的抗药频率与初始频率均无显著性差异(表7)。
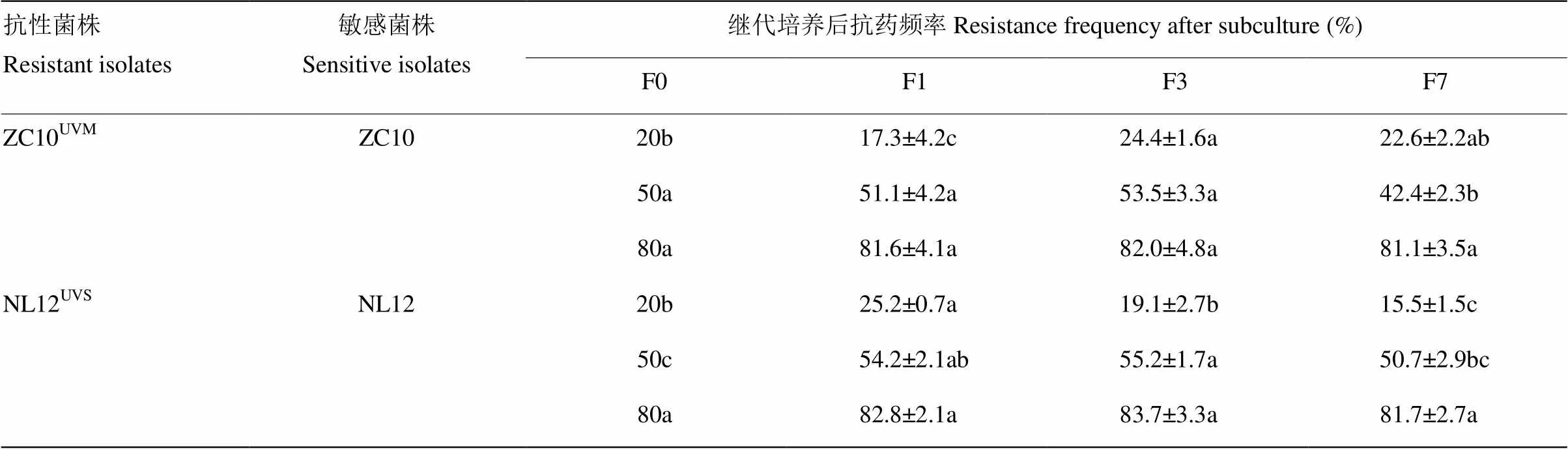
表7 抗性突变菌株及其亲本菌株竞争力的比较
同行数据后不同字母表示同一菌株各代敏感性之间存在显著差异(<0.05)
The different letters in the same row indicated significant differences in different progenies of the same isolate (<0.05)
2.6 氟吡菌胺与其他药剂的交互抗药性
通过SPSS软件计算不同马铃薯晚疫病菌对氟吡菌胺的抗性突变体及其亲本菌株的lgEC50与这些菌株对嘧菌酯、吡唑醚菌酯、霜脲氰、烯酰吗啉、双炔酰菌胺、甲霜灵、氟醚菌酰胺的lgEC50之间的相关系数()分别为0.104(=0.654)、0.311(=0.170)、0.228(=0.081)、0.376(=0.093)、0.214(=0.351)、0.122(=0.599)、0.963(=0.000),表明氟吡菌胺与嘧菌酯、吡唑醚菌酯、霜脲氰、烯酰吗啉、双炔酰菌胺、甲霜灵无交互抗性关系,与氟醚菌酰胺之间存在交互抗性关系(图2)。
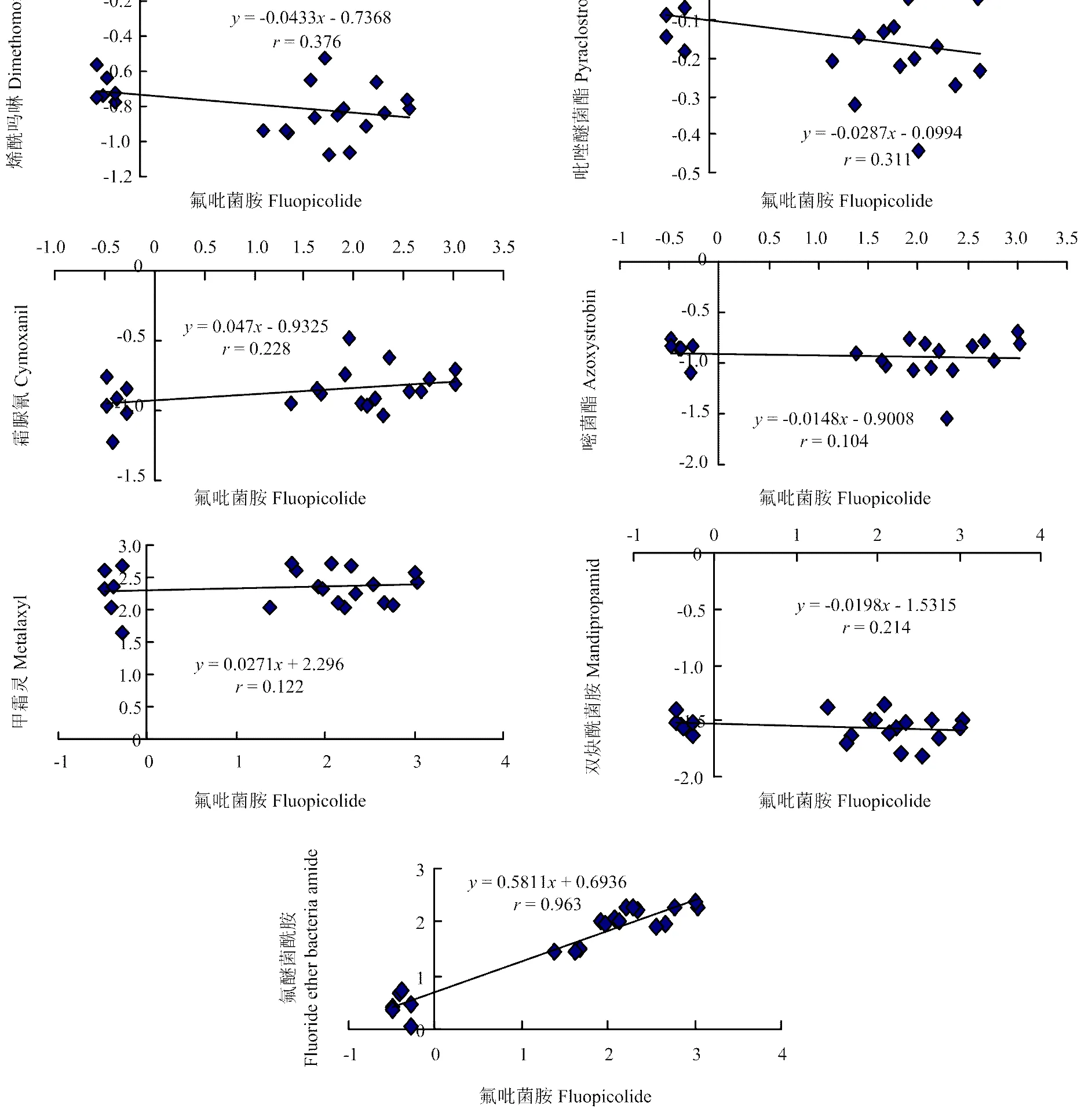
坐标值均为lgEC50值 Coordinate values were lgEC50 values
2.7 马铃薯晚疫病菌对氟吡菌胺的抗性风险量化评估
根据笔者实验室建立的标准,马铃薯晚疫病菌对氟吡菌胺的抗性风险值量化如下:(1)田间能检测到低抗菌株,田间抗性菌株出现引起的风险值为1;(2)氟吡菌胺与氟醚菌酰胺存在正交互抗性,交互抗性引起的风险值为1;(3)实验室条件下通过紫外线诱导和药剂驯化均获得抗氟吡菌胺突变体,紫外线诱导孢子囊的突变频率为2.78×10-7,实验室抗性突变引起的风险值为3;(4)实验室获得的抗性突变体抗性水平介于61—3 157倍,以高抗菌株为主,抗药性符合单基因突变特征,引起的抗性风险值为3;(5)大部分抗性突变体适合度不下降,少数抗性菌株适合度下降,抗性菌株适合度引起的风险值为2;(6)大多数抗性突变体竞争力强,少数竞争力较弱,抗性菌株竞争力引起的风险值为2;(7)所有抗性菌株在无药条件下继代培养后,其抗药性均能稳定遗传,抗性菌株遗传稳定性引起的风险值为3。上述7个方面的风险值累加得到致病疫霉对氟吡菌胺的全部基本抗性风险值为15,因此,马铃薯晚疫病菌对氟吡菌胺的基本抗性风险为高度。
3 讨论
按照本文中的抗性风险量化评估标准,氟吡菌胺的全部基本抗性风险值为15,是高度风险的最下限。室内抗药性风险评估是抗药性风险评价的重要组成部分,但不能完全取代田间抗药性风险评价,本标准更侧重于实验室条件下的抗性风险,即固有风险,药剂的使用方式、年限、次数等因素对田间抗性的发生发展有重要的作用,因此应加强田间抗药性的发展动态,笔者实验室连续多年监测了多个地区田间马铃薯晚疫病菌对氟吡菌胺的敏感性(结果待发表)。由于氟吡菌胺的制剂为混剂,且当前有多种化学药剂用于防治马铃薯晚疫病,减缓了田间抗性的发生和发展趋势,因此,虽然田间尚未发现中高抗菌株,但是必须高度重视马铃薯晚疫病菌对氟吡菌胺的抗性风险管理工作。
适合度是抗性菌株和亲本敏感菌株单独存在时生存或致病能力的反映,竞争力反映了抗性菌株与敏感菌株共存时彼此的消长或竞争情况。本试验中多数突变体的菌丝生长速率、产孢子囊能力、复合适合度指数和竞争力与其亲本菌株无显著差异,部分突变体的适合度和竞争力强于或弱于其亲本菌株,因此,抗性菌株有在田间发展成优势种群的可能,需加强抗性的监测和治理。
当前的抗药性风险评估中主要通过紫外线诱导和药剂驯化来获得抗性突变体。本文通过紫外线诱导菌丝体、紫外线诱导孢子囊和药剂驯化分别获得13、5和3个抗性突变体。3种方法各有利弊:紫外线诱导菌丝体试验中,由于菌饼中含有的菌丝及孢子囊数量很大,菌丝有一定的厚度且表面参差不齐,因此不同部位的菌丝和孢子囊受接收到紫外线照射的能量也各不相同,产生突变体的可能性就相对较大,缺点在于所得出的突变频率误差较大,不能量化的评价病菌产生抗性的难易程度;紫外诱导孢子囊试验中,需要较准确的找出紫外线照射孢子囊的亚致死时间,且由于孢子囊悬浮液的浓度相对较小,需要很大的工作量才能得到足够数量的突变体,优点在于能够准确得出突变频率,能够量化的评价病菌产生抗性的难易程度;药剂驯化试验中,需要找出药剂对病菌的亚致死浓度且浓度需要逐步提高,且需连续驯化多代,所需时间较长,而且无法准确得出突变频率,优点在于与实际田间用药情况更相似,更接近于田间抗药性的发生情况。
氟醚菌酰胺是山东省联合农药工业有限公司与山东农业大学合作,于2010年创制的一种新型含氟苯甲酰胺类杀菌剂,2015年获药检所临时登记。与氟吡菌胺相比,氟醚菌酰胺在结构上减少了2个氯原子,增加了4个氟原子和 1个甲氧基[33],是一种广谱高效的杀菌剂。本研究证明氟吡菌胺与氟醚菌酰胺存在较强的正交互抗性,这对以后研究这两种药剂的作用机制或病菌的抗药机制以及开展抗药性治理具有重要的参考价值。由于马铃薯晚疫病菌对氟吡菌胺存在高度抗性风险,且氟吡菌胺与氟醚菌酰胺之间存在交互抗性,因此建议在应用中避免氟吡菌胺与氟醚菌酰胺同时或交替使用,并限制此2种药剂在同一生长季节的用药次数不超过2次,应与其他类药剂(如烯酰吗啉、嘧菌酯、双炔酰菌胺、霜脲氰等)混用或交替使用,以减缓病菌抗药性的产生。
翟明涛等[18]通过紫外诱导和药剂驯化各获得1个抗氟吡菌胺的辣椒疫霉突变体,并通过这2株突变体分析与其他药剂的交互抗性,得出抗氟吡菌胺突变体与甲霜灵和霜脲氰之间存在交互抗性的结论,与本文结果不同,究其原因有以下两点:第一,翟明涛的试验中获得的抗性菌株数量少,得出结论的误差可能性较大;第二,翟明涛的试验中直接通过2株突变体对不同药剂的抗性倍数得出结论,与本文的比较方法不同。
当前的马铃薯防治中,多次重复使用单一药剂和随意增加用药量的现象普遍发生,这样容易导致药剂对病菌的选择压力居高不下,加快了抗性的产生。因此,应当混用和交替使用不同作用机理的农药,减小药剂的选择压力,减缓抗性的产生,延长药剂的使用寿命。
4 结论
氟吡菌胺与氟醚菌酰胺之间存在交互抗性,应避免2种药剂的混用或交替使用。根据笔者实验室建立的抗性风险量化评估标准,评估马铃薯晚疫病菌对氟吡菌胺存在高度抗性风险,在使用氟吡菌胺防治马铃薯晚疫病时应控制同一生长季的使用次数不超过2次,并严格按照药剂的推荐用量使用。
References
[1] 王希卓, 朱旭, 孙洁, 孙海亭, 张凯, 沈瑾. 我国马铃薯主粮化发展形势分析. 农产品加工, 2015(2): 52-55.
WANG X Z, ZHU X, SUN J, SUN H T, ZHANG K, SHEN J. The potato staple foods development situation analysis in China., 2015(2): 52-55. (in Chinese)
[2] 卢肖平. 马铃薯主粮化战略的意义、瓶颈与政策建议. 华中农业大学学报 (社会科学版), 2015(3): 1-7.
LU X P. Strategy of potato as staple food: significance, bottlenecks and policy suggestions., 2015(3): 1-7. (in Chinese)
[3] Nowicki M, Foolad M R, Nowakowska M, Kozik E U. Potato and tomato late blight caused by: An overview of pathology and resistance breeding., 2012, 96(1): 4-17.
[4] Chowdappa P, Nirmal Kumar B J, Madhura S, Mohan Kumar S P, Myers K L, Fry W E, Cooke D. Severe outbreaks of late blight on potato and tomato in South India caused by recent changes in thepopulation.,2015, 64(1): 191-199.
[5] Fry W E, Goodwin S B. Re-emergence of potato and tomato late blight in the United States., 1997, 81(12): 1349-1357.
[6] 杨兰芳, 吴德喜, 赵剑锋, 任国敏, 陈齐斌. 不同杀菌剂对马铃薯晚疫病的田间防效试验. 中国马铃薯, 2014, 28(3): 172-174.
YANG L F, WU D X, ZHAO J F, REN G M, CHEN Q B. Control efficacy of different fungicides on potato late blight in field., 2014, 28(3): 172-174. (in Chinese)
[7] 殷红清, 吴承金, 瞿勇, 李大春. 不同药剂对马铃薯晚疫病的防治效果. 植物保护, 2012, 38(5): 179-183.
YIN H Q, WU C J, QU Y, LI D C. The control efficacy of different fungicides to potato late blight.,2012, 38(5): 179-183. (in Chinese)
[8] Toquin V, Barja F, Sirven C, Beffa R. Fluopicolide, a new anti-oomycetes fungicide with a new mode of action inducing perturbation of a spectrin-like protein//Kramer W, Schirmer U.. weinheim: WILEY-VCH Verlag GmbH & Co. KGaA, 2007: 675-682.
[9] Tafforeau S, Bardsley E, Latorse M P, Fabrèges C, SCHIRRINGS A, Wegmann T. Infinito: profile of a novel potato late blight fungicides. Summary of three years of development trials in Europe//Westerdijk C E, Schepers H T., 2006: 77-88.
[10] 杨吉春, 吴峤, 刘允萍, 刘长令. 含氟农药开发的新进展. 农药, 2011, 50(4): 289-295.
YANG J C, WU Q, LIU Y P, LIU C L. Recent advance of flourine-containing pesticides., 2011, 50(4): 289-295. (in Chinese)
[11] Bradshaw N J, Vaughan T B. The effect of phenylamide fungicides on the control of potato late blight () in England and Wales from 1978 to 1992., 1996, 45(2): 249-269.
[12] Davidse L C, Looijen D, Turkensteen L J, Van der Wal D. Occurrence of metalaxyl-resistant isolates ofin dutch potato fields.,1981, 87(2): 65-68.
[13] 罗彦涛, 孟润杰, 赵建江, 韩秀英, 马志强, 王文桥, 张小风. 马铃薯晚疫病菌对不同药剂敏感性及相应药剂田间防效验证. 农药, 2016, 55(2): 134-137.
LUO Y T, MENG R J, ZHAO J J, HAN X Y, MA Z Q, WANG W Q, ZHANG X F. Sensitivity to fungicides ofand controlling efficacy of corresponding fungicides against potato late blight., 2016, 55(2): 134-137. (in Chinese)
[14] Fishel F M, Dewdney M M. Fungicide resistance action committee’s (FRAC) classification scheme of fungicides according to mode of action.PI94. University of Florida. 2012.
[15] Kuck K H, Gisi U. FRAC mode of action classification and resistance risk of fungicides//Kramer W, Schirmer U.. weinheim: WILEY-VCH Verlag GmbH & Co. KGaA, 2007: 415-432.
[16] Wang W Q, Yan L, Meng R J, Zhao J J, Zhang X F, Han X Y, Ma Z Q. Sensitivity to fluopicolide of wild type isolates and biological characteristics of fluopicolide-resistant mutants in., 2014, 55: 119-126.
[17] Lu X H, Hausbeck M K, Liu X L, Hao J J. Wild type sensitivity and mutation analysis for resistance risk to fluopicolide in., 2011, 95(12): 1535-1541.
[18] 翟明涛, 王开运, 许辉, 唐剑锋, 刘杰. 抗氟吡菌胺辣椒疫霉菌株的诱导及其生物学特性的研究. 植物病理学报, 2014, 44(1): 88-96.
ZHAI M T, WANG K Y, XU H,TANG J F, LIU J. Induction and characteristics ofisolates resistant to fluopicolide., 2014, 44(1): 88-96. (in Chinese)
[19] 闫磊. 黄瓜霜霉病菌对氟吡菌胺的抗性风险研究[D]. 保定: 河北农业大学, 2013.
YAN L. Studies on risk of resistance into fluopicolide[D].Baoding: Agricultural University of Hebei, 2013. (in Chinese)
[20] 张志铭, 李玉琴, 田世民, 朱杰华, 王军, 宋伯符. 中国发生马铃薯晚疫病菌 () A2交配型. 河北农业大学学报,1996, 19(4): 62-65.
ZHANG Z M, LI Y Q, TIAN S M, ZHU J H, WANG J, SONG B F. The occurrence of potato late blight pathogen () A2mating type in China.,1996, 19(4): 62-65. (in Chinese)
[21] Hohl H R, Iselin K. Isolates offrom Switzerland with A2 mating type behavior.,1984, 83(3): 529-530.
[22] 戚仁德, 汪涛, 李萍, 丁建成, 高智谋. 安徽省辣椒疫霉交配型的分布及在无性后代的遗传. 植物病理学报, 2012, 42(1): 45-50.
QI R D, WANG T, LI P, DING J C, GAO Z M.Distribution of mating types ofand inheritance in asexual progenies in Anhui Province., 2012, 42(1): 45-50. (in Chinese)
[23] GIsi U, Staehle-Csech U. Resistance risk evaluation of phenylamide and EBI fungicides., 1988: 359-366.
[24] Brent K J, Hollomon D W.Fungicide Resistance Action Committee, 2007.
[25] 赵卫松. 辣椒疫霉对双炔酰菌胺抗药性风险评估及抗药性生理生化机制研究[D]. 保定: 河北农业大学, 2011.
ZHAO W S. Risk evaluation of resistance to mandipropamid ofand studies on its physiological and biochemical mechanism[D]. Baoding: Agricultural university of Hebei, 2011. (in Chinese)
[26] van Tuyl J M.. H. Veenman & Zonen BV, 1977.
[27] 河北省质量技术监督局. 马铃薯晚疫病菌抗药性检测技术规程: DB13/T 1420-2011[S]. 2011-07-07[2016-05-06].
Hebeiprovincial Administration of Quality and Technical Supervision. Technological rules for detecting fungicide resistance inon potato. DB13T/1420-2011[S]. 2011-07-07[2016-05-06]. (in Chinese)
[28] 朱志峰. 马铃薯晚疫病菌对嘧菌酯的敏感性基线建立及其抗性风险初探[D]. 长春: 吉林农业大学, 2007.
ZHU Z F. Establishment of the baseline sensitivity ofto azoxystrobin and preliminary study on it’s resistance risk[D]. Changchun: Agricultural University of Jilin, 2007. (in Chinese)
[29] 侯淑英, 魏长拴, 徐扩, 朱杰华. 中国部分地区马铃薯晚疫病菌寄生适合度的研究. 河北农业大学学报, 2005, 28(2): 71-75.
HOU S Y, WEI C S, XU K, ZHU J H. Parasitic fitness ofisolates from some potato areas of China., 2005, 28(2): 71-75. (in Chinese)
[30] Kadish D, Cohen Y. Competition between metalaxyl-sensitive and metalaxyl-resistant isolates ofin the absence of metalaxyl., 1988, 37(4): 558-564.
[31] Cohen Y, Samoucha Y. Competition between oxadixyl-sensitive and-resistant field isolates ofon fungicide- treated potato crops., 1990, 9(1): 15-20.
[32] 王岩, 冯明鸣, 朱书生, 刘西莉. 黄瓜霜霉病菌烯肟菌酯敏感基线的建立及其室内抗药性风险评估. 中国农业大学学报, 2006, 11(5): 25-29.
WANG Y, FENG M M, ZHU S S, LIU X L. Baseline-sensitivity and assessment of resistance risk ofto enostrobilurin.,2006, 11(5): 25-29. (in Chinese)
[33] 张化霜, 翟明涛, 王开运, 许辉, 唐剑锋, 王红艳. 新化合物氟醚菌酰胺的抑菌活性及其对棉花立枯丝核菌的作用方式研究. 农药学学报, 2013, 15(4): 405-411.
ZHANG H S, ZHAI M T, WANG K Y, XU H, TANG J F, WANG H Y. Study on fungicidal activity and mode of action of a novel fungicidal agent LH-2010A against.,2013, 15(4): 405-411. (in Chinese)
(责任编辑 岳梅)
Acquisition and Biological Characteristics of Fluopicolide-resistant Isolates in
LUO Yan-tao1,2, MENG Run-jie1, ZHAO Jian-jiang1, HAN Xiu-ying1, MA Zhi-qiang1, WANG Wen-qiao1, ZHANG Xiao-feng1
(1Institute of Plant Protection, Hebei Academy of Agricultural&Forestry Sciences, Baoding 071000, Hebei;2College of Plant Protection, Agricultural University of Hebei, Baoding 071000, Hebei)
【Objective】The objectives of this study are to research the cross resistance between fluopicolide and the other fungicides and assess the resistance risk ofto fluopicolide. 【Method】The fluopicolide-resistant mutants were acquired by UV irradiating sporangia, UV irradiating mycelia and fungicide taming. The mutation frequency was calculated, the resistance levels were measured, whether the resistance could be inherited stably under the condition of no fungicide after 10 generations was studied, the fitness (includingmycelial growth rates,sporulation capacity, andcomprehensive fitness index) on RSA medium and detached leaves were measured and the competitiveness of those resistant mutants and their parental isolates were studied. Cross resistance between fluopicolide and other fungicides were analyzed. The resistance risk ofto fluopicolide was assessed by the resistance risk quantitative evaluation criteria which was created by the authors’ lab. 【Result】Twenty-one fluopicolide-resistant mutants were acquired in this study. The resistance levels of those resistant mutants ranged from 61 to 3 157 and the mutation frequency of UV irradiating sporangia was 2.78×10-7. The fitness of most of the tested resistant mutants showed no significant difference with their respective parental isolates. In the test of competitiveness, among the 18 resistance frequency measurements of 1st, 3rd and 7th generations of two fluopicolide-resistant mutants, 3 were significantly lower than their parental isolates, 4 were significantly higher than their parental isolates, while the other 11 showed no difference. The resistance of all those 21 fluopicolide-resistance mutants could be inherited stably. The resistance of all those 21 fluopicolide-resistance mutants could be inherited stably. The correlation coefficient () between the lgEC50of the fluopicolide-resistant mutants and the fluopicolide-sensitive isolates to fluopicolide and the lgEC50of those isolates to azoxystrobin, pyraclostrobin, cymoxanil, dimethomorph, mandipropamid, metalaxyl and fluoride ether bacteria amide were 0.104 (=0.654), 0.311 (=0.170), 0.228 (=0.081), 0.376 (=0.093), 0.214 (=0.351), 0.122 (=0.599), 0.963 (=0.000). The inherent resistance risk value ofto fluopicolide was 15.【Conclusion】The cross-resistance relationship was found between fluopicolide and fluoride ether bacteria amide. No cross-resistance relationship was found between fluopicolide and azoxystrobin, pyraclostrobin, cymoxanil, dimethomorph, mandipropamid and metalaxyl. There could be high inherent risk ofdeveloping resistance to fluopicolide. The risk management ofto fuopicolide should be enhanced. It is suggested that the fluopicolide should be used alternately or in mixture with other not cross-resistant fungicides.
; fluopicolide; resistant mutants; biological characteristics; cross resistance; inherent risk
2016-05-06;接受日期:2016-08-10
国家公益性行业(农业)科研专项(201303018,201303023)
罗彦涛,E-mail:yantaoluo@sina.cn。通信作者王文桥,Tel:0312-5915659;E-mail:wenqiaow@163.com。通信作者张小风,E-mail:zbs1103@163.com
