光敏剂喜泊分对H22肝癌小鼠移植瘤的放射增敏效果
2016-12-23王英芳许文华
刘 伟 徐 鑫 王英芳 许文华
(河北中医学院护理学院,河北 石家庄 050200)
光敏剂喜泊分对H22肝癌小鼠移植瘤的放射增敏效果
刘 伟 徐 鑫1王英芳 许文华
(河北中医学院护理学院,河北 石家庄 050200)
目的 观察光敏剂喜泊分对H22肝癌小鼠移植瘤的放射增敏效果。方法 建立H22肝癌细胞小鼠移植瘤模型,将荷瘤小鼠随机分为对照组、放疗1组、联合治疗1组、放疗2组、联合治疗2组、放疗3组、联合治疗3组,观察第14天瘤体积、抑瘤率、增敏系数、小鼠生存时间、病理、细胞凋亡等指标。结果 喜泊分联合放疗能够抑制小鼠移植瘤生长,尤其联合治疗2组,第14天瘤体积明显减小、增敏系数>1,有最佳增敏效果,能够明显延长小鼠生存时间,病理HE染色显示,联合治疗2组肿瘤细胞坏死数量最多,坏死范围最大,流式细胞仪检测细胞凋亡显示联合治疗2组凋亡率最高。结论 喜泊分联合放疗可以有效减小瘤体积,提高抑瘤率,延长小鼠生存时间,促使细胞凋亡,具有良好的放射增敏效果。
肝癌;喜泊分;抑瘤率;放射增敏;凋亡
目前治疗肝癌的方法不断改进,主要有手术切除、放化疗、肝脏移植、细胞免疫等治疗方法,但总体来说,对肝癌的治疗仍然是很局限的,在预防方面和治疗手段的选择上都不太成熟〔1,2〕。本实验通过对H22肝癌细胞小鼠移植瘤模型的研究,测试国产光敏剂血卟啉衍生物喜泊分对X线照射的抑瘤增敏作用,阐明其与放疗结合增加射线对肝癌放射敏感性的潜在意义及增敏程度。
1 材料与方法
1.1 实验材料 小鼠H22腹水型肝癌细胞株,由河北医科大学提供;6周龄健康雄性SPF级昆明小鼠,体重20~25 g,购于河北医科大学实验动物中心;DMEM 培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);电子分析天平JA5003(上海精科水平厂);CO2恒温培养箱 TC2323(美国SHELDON公司);普通光学显微镜 BX-50(日本Olympus);细胞凋亡试剂盒购自南京凯基生物科技公司;放疗设备由河北省人民医院肿瘤放疗科提供,直线加速器:SIMENS PRIMUS型。
1.2 细胞株复苏及传代培养 将小鼠H22肝癌细胞从液氮中取出,置入37℃水浴中复苏,置于DMEM培养液中离心,磷酸盐缓冲液(PBS)洗涤细胞2次,在37℃、5%CO2和饱和湿度条件下恒温培养箱中培养。根据显微镜下细胞生长状况进行细胞换液与传代,每2~3 d换液1次。待细胞铺满80%培养瓶底时,1∶3分瓶传代。
1.3 小鼠腹水传代及模型建立 体外培养传代生长良好的H22小鼠肝癌细胞以无菌生理盐水配成浓度为1.0×107/ml,取健康昆明小鼠3只,腹部用75%酒精严格消毒,腹腔内接种肿瘤细胞悬液0.5 ml/只,接种后8 d可见小鼠腹部增大,抽取小鼠腹水,用生理盐水稀释至5×106个瘤细胞/ml后小鼠腹腔3次传代,腹水形成后,于无菌条件下收集肿瘤细胞生长良好的腹水,参照有关文献〔3,4〕,台盼蓝拒染实验细胞生存率>99%、HE 染色见大量肿瘤细胞时可用。用生理盐水将腹水稀释至约 2×106个瘤细胞/ml,取健康昆明小鼠80只,75%酒精消毒小鼠右前肢皮肤后皮下注射肿瘤细胞悬液0.2 ml,可见局部有黄豆大小皮丘隆起,观察1 min,如无瘤液溢出,送回饲养笼。接种后第3天注射部位可触及肿瘤结节,第7天结节平均体积可达到0.8 cm左右,视为模型制作成功,模型制作成功率为100%。选取肿瘤长径为5.5~6.5 mm结节形状较规则、与肌肉皮肤无粘连小鼠用于实验。
1.4 荷瘤小鼠随机分组及处理 将H22皮下移植肝癌荷瘤小鼠按随机数字法分为对照组、放疗1组(5 Gy组)、联合治疗1组(5 Gy+15 mg/kg喜泊分组)、放疗2组(10 Gy组)、联合治疗2组(10 Gy+15 mg/kg喜泊分组)、放疗3组(15 Gy组)、联合治疗3组(15 Gy+15 mg/kg喜泊分组)共7组,每组10只,共80只予背部皮肤墨水标记,分笼饲养。具体处理如下。
1.5 观察肿瘤体积变化、计算肿瘤生长抑制率并绘制肿瘤生长曲线 治疗开始后动态观察各组肿瘤外观、质地、活动度等生长情况。用游标卡尺每隔1 d测量各处理组肿瘤的最长径(LD)及最短径(SD)并详细记录,直至治疗开始后第14天。按照Steel经验公式计算肿瘤体积如下:肿瘤体积(mm3)V=LD×SD2/2。根据各组平均体积绘制肿瘤生长曲线。
1.6 肿瘤生长延缓时间与增敏系数 计算肿瘤生长3倍倍增时间(TGT3):肿瘤体积生长至放射治疗前3倍所需时间为3倍倍增时间。肿瘤生长延迟时间(TGD):不同实验组与空白对照组的TGT3之差为肿瘤生长延迟时间。增敏系数(EF)=给药照射组TGD/单纯照射组TGD,EF>1表示有放射增敏效应,EF>1.6说明有较好的放射增敏效应。
1.7 荷瘤小鼠生存期观察并绘制生存曲线 治疗第14天各组剩余6只荷瘤小鼠不处死,继续常规喂养,让其无干预病死,观察各组小鼠生存期,计算其生命延长率,并根据生存时间绘制小鼠生存曲线。生命延长率计算公式如下:生命延长率=(治疗组平均生存天数-对照组平均生存天数)/对照组平均生存天数×100%。
1.8 荷瘤小鼠肿瘤组织病理学检查 将小鼠肿瘤组织保存、固定、浸蜡、包埋,制作成蜡块,连续切片制作成厚度约5 μm 的石蜡切片,HE 常规染色,显微镜下观察各组切片肿瘤组织坏死情况。
1.9 流式细胞仪检测肿瘤细胞凋亡情况 将每组剥离肿瘤部分组织剪成黄豆大小肿瘤组织小块(约8×8 mm3大小),置于于70%酒精4℃冰箱中保存,检测时将组织取出(出血坏死部分切除)研磨-过滤-离心-弃上清液-上机分析,处理后上流式细胞仪检测肿瘤组织凋亡情况。
1.10 统计学分析 采用SPSS13.0软件行单因素方差分析、LSD-t检验、非参数检验,生存分析采用Kaplan-Meier法。
2 结 果
2.1 各组第14天肿瘤体积及生长抑制率 各治疗组瘤体积控制及肿瘤生长抑制率均优于对照组(P<0.05),以联合治疗2组效果最明显,见表1,图1。
2.2 肿瘤生长延缓时间与EF 3个联合治疗组EF均大于1,使单独放疗的敏感性提高1.722 5倍,联合治疗2组>联合治疗1组>联合治疗3组。说明3组均能延缓肿瘤生长,具有放疗增敏作用。其中联合治疗2组EF最大。见表2。
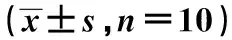

组别瘤体积(mm3)生长抑制率(%)对照组5827.1±191.104650放疗1组4400.7±311.0284224.481)联合治疗1组4098.0±245.665081)2)29.671)2)放疗2组3797.6±212.754011)34.831)联合治疗2组2923.9±177.38561)2)49.821)2)放疗3组2962.9±202.122321)49.151)联合治疗3组2798.9±171.118191)52.121)
与对照组比较:1)P<0.05;与同剂量放疗组比较:2)P<0.05

图1 各组移植瘤生长曲线

组别TGT3(d)TGD(d)EF对照组5.110-放疗1组7.0421.932-联合治疗1组7.92092.81091.4549放疗2组8.79593.6859-联合治疗2组11.458956.348951.7225放疗3组12.102466.992-联合治疗3组13.231368.121361.16152
2.3 荷瘤小鼠生存期及生命延长率 各治疗组均能提高生命延长率,联合治疗2组效果最明显,见表3。
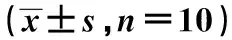

组别平均生存天数(d)生命延长率(%)对照组18.00±1.825740放疗1组22.00±2.1602522.201)联合治疗1组27.00±2.449491)50.001)放疗2组30.75±1.50001)70.831)联合治疗2组43.25±2.753791)2)140.281)2)放疗3组39.50±2.081671)119.401)联合治疗3组37.00±2.708011)105.601)
与对照组比较:1)P<0.05;与其他各组比较:2)P<0.05
2.4 荷瘤小鼠肿瘤组织病理学检查 处理组小鼠H22实体瘤细胞形态镜下观察,与对照组比较,出现肿瘤细胞减少,坏死,染色质固缩浓染,有的呈半月形,紧贴于核膜周边,部分细胞裂解为碎片状,以联合治疗2组最为明显,肿瘤细胞坏死数量最多,坏死范围最大。见图2。
2.5 流式细胞仪检测肿瘤细胞凋亡情况 放疗组、联合治疗1组、放疗2组、联合治疗2组、放疗3组、联合治疗3组凋亡率分别为7.72%、17.73%、26.39%、32.89%、31.84%、31.67%,较对照组凋亡率(3.37%)增加,均出现亚二倍体峰(凋亡峰),且联合治疗2组凋亡峰值最高。

图2 各组移植瘤病理观察(HE,×400)
3 讨 论
目前手术切除仍是肝癌的治疗首选方案,然而,多数肝癌患者就诊时已属中晚期,手术难以完全切除。即使根治性切除,5 年存活率仅为50%~62.7%,10年存活率为6.3%〔5〕,术后5年复发率在50%以上〔6〕,且仍以每年25%的速度递增,复发高峰多在术后1~2年〔7〕。20世纪90年代中期后三维适形放疗(3DCRT)和调强适形放疗(IMRT)等现代放疗技术逐渐成熟,为放疗在肝癌治疗中的应用提供了新的机会和可能性。关于采用3DCRT和IMRT技术治疗不能手术切除的原发性肝癌的研究层出不穷,局限于肝内的原发性肝癌患者行放疗结合介入治疗3年生存率为25%~30%〔8〕。国外文献报道对同时存在肝内和肝外病灶(肺、肾上腺、软组织转移)者,每位患者平均3. 5个病灶,使用螺旋断层放疗中位生存期为12. 3个月,接受放疗的病灶1 年内局部控制率为79%,且没有Ⅳ级的不良反应〔9〕。放射治疗已成为治疗肝癌的重要手段之一。
放射治疗是在保存器官的情况下用来控制局部肿瘤的一种治疗手段〔10〕。60%~70%以上肿瘤病人在病情的不同阶段需要作放射治疗。单独的放疗只对辐射敏感的部分肿瘤有比较好的疗效,但是大部分肿瘤对辐射并不十分敏感〔11~13〕。放射增敏剂可提高肿瘤细胞对放疗的敏感性及放射线对肿瘤细胞的杀伤率,增强放疗疗效,成为肿瘤放射治疗的一个重要研究课题。放射增敏剂一词现已被辐射的化学修饰剂所取代〔14~18〕,然而目前还没有令人满意的放疗增敏药物应用于临床。
本研究的光敏剂喜泊分易溶于水,便于给药;可被电磁波激发发挥杀伤癌细胞的作用;同时具有对肿瘤的选择性浓集作用;且对重要脏器无明显毒副反应,预期对肿瘤有更好的放射增敏效果。其肿瘤放射增敏作用的研究则是本次实验的重点。因其应用尚未被广泛认可,在进行该研究时有必要先采用动物实验的方法探索合适的联合方式及安全的用药剂量。
本实验结果提示喜泊分可以促使细胞从放射最不敏感的S 期进入G2/M期,并将细胞阻滞在放射敏感性最高的G2/M期,使肿瘤细胞更易进入X射线诱导的凋亡途径,具有良好的放射增敏效果。
1 El-Serag HB. Hepatocellular carcinoma〔J〕. N Engl J Med,2011;365(12):1118-27.
2 赵荣荣.甘露聚糖肽联合5-氟尿唆淀对肝癌HepG2细胞增殖及凋亡的影响〔J〕.中国肿瘤临床,2010;37 (1):40-1.
3 Tan Q, Ren XY, Li J,etal. Correlation of plasma thioredoxin reductase activity to growth of H22 primary hepatic carcinoma xenografts in Kunming mice〔J〕. Chin J Cancer, 2009;28(5):472-7.
4 Deng W, Sun HX, Chen FY,etal. Immunomodulatory activity of 3beta,6beta-dihydroxyolean-12-en-27-oic acid in tumor-bearing mice〔J〕. Chem Biodivers, 2009;6(8):1243-53.
5 彭海燕,章永红,王 梦.龙枝提取物对小鼠H22和S180移植瘤的抑制作用〔J〕. 中西医结合学报, 2004;2(3):213-5.
6 Fenton BM, Lord EM, Paoni SF,etal.Enhancement of tumor perfusion and oxygenation by earbogen and nicotinamide during single and multifraction irradiation〔J〕.Radiat ReS,2000;153(1):75-83.
7 樊 嘉,史颖弘,高 强.小肝癌的规范化治疗路径〔J〕. 中国实用外科杂志, 2011;31(1):36-8.
8 Weng DS,Zhou J,Zhou QM,etal. Minimally invasive treatment combined with cytokine-induced killer cells therapy lower the short-term recurrence rates of hepatocellular carcinomas〔J〕. J Immunother,2008;31(1):63-71.
9 McGlynn KA,London WT. The global epidemiology of hepatocel-lular carcinoma: present and future〔J〕. Clin Liver Dis,2011;15(2):223-43.
10 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组. 原发性肝癌规范化诊治的专家共识〔J〕. 临床肝胆病杂志,2009;25(2):83-92.
11 Jang JW,Kay CS,You CR,etal.Simultaneous multitarget irradiation using helical tomotherapy for advanced hepatocellular carcinoma with multiple extrahepatic metastases〔J〕.Int J Radiat Oncol Biol Phys,2009;74(2):412-8.
12 Michellel Mierzwa,Mukeshk Nyati,Mereditha Morgan. Recent advancesin combined modality theraPy〔J〕.The Oncologist,2010;15:372-81.
13 Ali R, Mirza Z, Ashraf GM,etal. New anticancer agents: recent developments in tumor therapy〔J〕. Anticancer Res,2012;32(7):2999-3005.
14 Cruz FD, Matushansky I. Solid tumor differentiation therapy-is it possible〔J〕. Oncotarget,2012;3(5):559-67.
15 Tian J, Zhao H, Nolley R,etal. Darinaparsin: solid tumor hypoxic cytotoxin and radiosensitizer〔J〕. Clin Cancer Res, 2012;18(12):3366-76.
16 Mauceri HJ, Sutton HG, Darga TE,etal. Everolimus exhibits efficacy as aradiosensitizer in a model of non-small cell lung cancer〔J〕. Oncol Rep,2012;27(5):1625-9.
17 Xiong H, Lee RJ, Haura EB,etal. Intranuclear delivery of a novel antibody-derived radiosensitizer targeting the DNA-dependent protein kinase catalytic subunit〔J〕. Int J Radiat Oncol Biol Phys,2012;83(3):1023-30.
18 Werner ME, Copp JA, Karve S,etal. Folate-targeted polymeric nanoparticle formulation of docetaxel is an effective molecularly targeted radiosensitizer with efficacy dependent on the timing of radiotherapy〔J〕. ACS Nano,2011;5(11):8990-8.
〔2014-10-17修回〕
(编辑 赵慧玲/曹梦园)
河北省科技计划项目(152777124);河北省中医药管理局科研计划项目(2014159);河北中医学院青年基金项目(17)
1 河北省人民医院
许文华(1980-),女,硕士,讲师,主要从事护理学及教育学研究。
刘 伟(1980-),女,硕士,讲师,主要从事肿瘤综合防治研究。
R73;R592
A
1005-9202(2016)23-5841-04;
10.3969/j.issn.1005-9202.2016.23.030
