硫酸锌对糖尿病皮肤损伤的修复作用
2016-12-23张海峰王洪莎雷嫚嫚郭蔚莹
张海峰 吕 游 王洪莎 魏 祺 雷嫚嫚 郭蔚莹
(吉林大学第一医院介入治疗科,吉林 长春 130021)
硫酸锌对糖尿病皮肤损伤的修复作用
张海峰 吕 游1王洪莎1魏 祺1雷嫚嫚1郭蔚莹1
(吉林大学第一医院介入治疗科,吉林 长春 130021)
目的 研究硫酸锌对糖尿病伴有皮肤创面愈合的影响。方法 采用链脲佐菌素(STZ)腹腔注射制备糖尿病大鼠模型(48只),成模1个月后,进行背部9 cm2锐器皮肤损伤。尔后分2组:1组在伤愈过程中局部涂抹硫酸锌,另1组局部涂抹生理盐水自然愈合。以正常大鼠皮肤损伤为对照组(48只)。在创面愈合的不同时间点,采用创面愈合百分率计算大鼠皮肤创面愈合速度;通过免疫组织化学染色、实时定量PCR检测动态观察糖尿病创面愈合的过程及其组织学变化特征。 结果 第15天时,糖尿病硫酸锌组较盐水组愈合面积更大, 创面组织微血管密度(MVD)相比更大(均P<0.05);增殖性细胞核抗原(PCNA)阳性细胞在糖尿病硫酸锌组较盐水组表达增高(P<0.05);糖尿病硫酸锌组的基质金属蛋白酶(MMP)-2在第5天和第10天时间点减少,且低于盐水组(P<0.05)。糖尿病硫酸锌组的基质金属蛋白酶组织抑制剂(TIMP)-1 mRNA含量在第5天和第10天时约为盐水组的2倍,15 d时下降低于盐水组(P<0.05)。 结论 硫酸锌对于糖尿病大鼠皮肤创面具有良好的促进愈合作用,其机制与创面MMPs表达和基质重建有关。
糖尿病;硫酸锌;伤口愈合;MMPs
由于代谢和微循环障碍的原因,很多糖尿病(DM)患者可同时合并多种皮肤疾病〔1〕,主要表现为皮肤一旦出现破溃后创面难以愈合、局部感染和糖尿病足等,而这些病变的发生与神经病变、血管病变以及DM皮肤组织的创面愈合能力低下等因素有密切关系。创伤愈合是多因素参与的病理生理过程,主要分为止血、炎症、增殖和塑形4个阶段〔2〕。除了炎症细胞、修复细胞、多种细胞因子、微量元素外,细胞外基质共同参与此过程。任何一个环节的调控异常均可导致创面愈合延迟〔3〕。锌是人体内重要的微量元素之一,是维持人体各种酶系统的必需成分。锌不仅作为酶的辅助因子参与糖、蛋白质代谢,同时还参与某些酶的激活〔4〕。当机体锌缺乏时,会出现皮肤黏膜损伤的愈合延迟,说明锌能够促进皮肤及组织损伤的生长和促进伤口愈合。此外还有数据表明,锌能够拮抗氧化应激、稳定抗氧化酶活性,在清除氧自由基的过程中发挥重要作用。锌缺乏导致抗氧化酶的抗氧化能力下降,从而导致机体内氧化应激增加〔5〕。笔者拟探讨硫酸锌对糖尿病皮肤损伤修复的影响及机制。
1 材料与方法
1.1 主要试剂 链脲佐菌素(STZ)和硫酸锌购于美国Sigma公司,Trizol试剂盒及cDNA合成试剂购于美国Life公司,增殖性细胞核抗原(PCNA)和CD34抗体购于北京博奥森生物技术公司,SP试剂盒和DAB显色剂购于福州迈新公司,荧光定量qPCR试剂盒购于北京博奥生物公司。
1.2 动物 Wistar大鼠96只,雄性,体重180~220 g,由吉林大学基础医学院实验动物中心提供。
1.3 DM大鼠模型的建立 实验组:以50 mg/kg STZ行腹腔一次性注射。注射72 h,尾静脉取血,测血糖。出现多饮、多食、多尿现象者,且血糖>16.7 mmol/L确定为DM大鼠。成模大鼠常规饲养,每周称量体重,隔周检测血糖,持续监测8 w。非DM组大鼠用等量枸橼酸-枸橼酸钠液注射。
1.4 皮肤创伤模型的建立与分组 大鼠成模1个月之后,采用2.5%戊巴比妥钠(35 mg/kg)进行腹腔注射麻醉,脊背去毛,无菌条件下切除面积为9 cm2(直径约3.4 cm)圆形皮肤,切口深度达皮下组织全层。为避免感染,大鼠单笼饲养。大鼠随机分为锌处理组(DM/Zn组)、盐水对照组(DM/SA组)、非糖尿病组(NDM组)、非糖尿病锌组(NDM/Zn组)。每组24只。
1.5 免疫组织化学 在创伤后5、10、15 d时间点,每组分别处死8只大鼠。取少许周围正常组织和创面肉芽组织,固定,包埋。石蜡切片制成厚度为3 μm的切片,4℃条件下保存备用。采用SP试剂盒并按说明操作:切片水化后,0.01 mol/L 的PBS洗涤3 min×3;然后置于柠檬酸缓冲液中92℃~95℃保温20 min,在室温条件下自然冷却至37℃;加入50 μl 3%的H2O2室温下孵育10 min,阻断内源性过氧化酶。PBS洗涤3 min×3;加50 μl 5%山羊血清,室温下孵育10 min;切片滴加50 μl抗体PCNA 或CD34(免抗-CD34,兔抗-PCNA);4℃孵育过夜。PBS冲洗3 min×3次,加50 μl生物素标记的二抗,室温孵育10 min,PBS洗,3 min×3次;然后滴加50 μl 链霉菌抗生物素-过氧化酶溶液,室温孵育10 min,PBS洗,3 min×3;加入DAB溶液显色,苏木精复染,酒精梯度脱水,二甲苯透明,中性树胶封固。设有PBS(代替一抗)的阴性对照。结果判定采用KS400图像分析系统(德国Kaiser公司)分析。
1.6 数据分析 显微图像采集及分析创面微血管密度(MVD)计数:采用抗CD34抗体标记皮肤切片组织中的血管内皮细胞,以孤立的棕黄色血管内皮细胞或细胞簇为1条单独的微血管,参考Pareek等〔6〕的计数方法进行计数,取平均值。创面愈合面积百分比计算:采用Adobe Image Ready7.0和Osiris软件进行面积计算。在伤后24 h进行创面面积第1次测量为初始创伤面积;于取材时测量各时相点创面面积,愈合面积=初始创面面积-各时相点面积。创面愈合面积百分比=愈合面积/初始创面面积×100%。创缘局部PCNA的表达测定采取KS400图像分析系统(德国Kaiser公司)分析:切片置于光学显微镜低倍镜下观察,以细胞核呈现明确的棕黄色颗粒状染色为阳性细胞,细胞核蓝染的细胞为苏木精复染的阴性细胞,随机在镜下选择均匀视野,计数100个细胞中阳性细胞所占的比例。
1.7 实时qPCR检测基质金属蛋白酶(MMP)-2、MMP-9、基质金属蛋白酶组织抑制剂(TIMP)-1在转录水平的变化 通过Trizol法提取皮肤组织中的总RNA,从提取得到的总RNA中取10 μl进行逆转录。得到的cDNA产物,使用晶芯RT-Cycler实时荧光定量PCR仪进行PCR扩增,引物序列:MMP-2上游引物5′-ACC ATC GCC CAT CAT CAA GT-3′,下游引物5′-CGA GCA AAA GCA TCA TCC AC-3′;MMP-9,上游引物5′-AGT TTG GTG TCG CGG AGC AC-3′,下游引物5′-TAC ATG AGC GCT TCC GGC AC-3′;TIMP-1上游引物 5′-CCA CCT TAT ACC AGC GTT ATG-3′,下游引物5′-GGC AAA GTG ATC GCT CTG-3′;内参β-actin上游引物5′-ACCACAGCTGAGAGGGAAATCG-3′,下游引物5′-AGAGGTCTTTACGGATGTCAACG-3′ 。扩增程序:预变性95℃、10 min;94℃、1 min,60℃、30 s,72℃、50 s, 40个循环;每个循环在延伸75℃时读板,收集荧光值。得到的结果以β-actin基因作为内参照,计算PCR产物相对量。mRNA的相对表达根据公式Fold change=2-ΔΔCt,ΔCt = Ct(target)- Ct(β-actin),Δ(ΔCt)=ΔCt(treated)-ΔCt(untreated)。
1.8 统计学方法 采用SPSS11.0软件做单因素方差分析。
2 结 果
2.1 各组大鼠干预治疗前后愈合能力的比较 损伤后15 d,DM组大鼠皮肤创面大部分尚未愈合,非DM组大鼠皮肤创面已基本愈合。定量分析愈合面积,在损伤后5、10、15 d,创面愈合面积百分比显著减少(P<0.05),表明DM大鼠创面存在难以愈合及愈合延迟的现象。在15 d,硫酸锌处理组的愈合率明显高于盐水组(P<0.05)。正常大鼠皮肤创面应用硫酸锌处理与未处理组无明显差别(P>0.05)。见表1。
2.2 免疫组化PCNA、CD34阳性细胞的表达 CD34和PCNA主要表达在皮肤创面组织的间质细胞和毛细血管内皮细胞,DM/Zn组CD34表达阳性细胞数量与DM/SA组比较明显增加(见图1)。DM组大鼠皮肤创面MVD值在伤后5、10和15 d均明显低于非DM组(P<0.05);第15天时,锌处理组与盐水组MVD值相比较更多(P<0.05)。见表2。在DM/Zn组中PCNA的表达阳性细胞数增多,与DM/Zn组相比具有统计学差异(P<0.05)。正常大鼠皮肤创面应用硫酸锌处理与未处理组无明显差别(P>0.05)。见表3。


组别5d10d15dDM/Zn组11.48±3.5138.73±6.101)2)59.05±8.601)2)DM/SA组11.31±2.6133.24±5.1748.78±8.56NDM/Zn组28.98±6.0574.34±8.5086.88±9.30NDM组27.64±5.6472.15±10.9985.45±7.53
与DM/SA组比较:1)P<0.05;与5 d比较:2)P<0.05;下表同
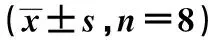

组别5d10d15dDM/Zn组8.00±2.0011.67±1.531)2)15.33±1.531)2)DM/SA组5.67±1.157.67±0.589.67±0.58NDM/Zn组13.86±3.2026.88±2.9620.86±1.02NDM组12.00±2.6524.00±2.0021.00±1.00
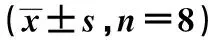

图1 CD34和PCNA在DM大鼠皮肤损伤创面组织中的表达(Bar=50 μm)
2.3 DM皮肤缺损愈合过程中MMP-2、MMP-9及TIMP-1基因转录水平的变化 非DM组中第5天时,MMP-2和MMP-9转录增强,10 d时下降,至第15天时显著下降;TIMP-1在第5天和第10天保持恒定,第15天显著下降。DM/Zn组的MMP-2在第5天和第10天保持恒定,第15天显著下降;MMP-9在第5天、第10天时呈现逐渐增加趋势,而至第15天时则显著减少,低于DM/SA组(P<0.05)。DM/Zn组的TIMP-1 mRNA含量在第5天和第10天时约为DM/SA组的2倍,15 d时下降低于DM/SA组(P<0.05)。见图2~图4。

图2 MMP-2 mRNA在大鼠皮肤创面组织的表达变化

图3 MMP-9 mRNA在大鼠皮肤创面组织的表达变化

图4 TIMP-1 mRNA在大鼠皮肤创面组织的表达变化
3 讨 论
创面愈合是一个错综复杂的生物学过程〔7〕,对于皮肤创面的愈合过程影响最大的主要有三方面:血管病变、神经病变和高血糖所导致的氧化应激,其中任何一个环节的协调不稳定均可以导致创面愈合的延迟。
微量元素锌不仅能够参与脂质和蛋白质代谢酶的辅助因子,同时锌也是许多葡萄糖代谢酶的构成部分,在能量代谢过程中起重要作用。锌在胰岛素中含量很高,能够增强胰岛素稳定性,锌还能在受体水平调控胰岛素信号转导,增强降血糖作用〔8〕。Miranda等〔9〕发现锌通过增强胰岛素受体的酪氨酸磷酸化过程,使葡萄糖摄取与利用明显增加;同时,锌具有一定的类胰岛素样活性,在不依赖于胰岛素的条件下,锌同样可使胰岛素受体发生酪氨酸磷酸化。本研究表明,硫酸锌可部分降低血糖浓度。
有研究表明,锌作为清除氧自由基过程中的重要因子,能够维持抗氧化酶稳定性〔10〕。Soinio等〔11〕的临床研究显示,血清中与含锌水平正常的DM患者相比较,含锌水平较低的DM患者患心血管疾病的风险要更高,而且单独补锌对于含锌水平较低的DM患者提高血清中含锌水平,控制血糖水平有显著效果。金属硫蛋白(MT)是一种重要的内源性细胞保护蛋白,具有清除氧自由基的作用,是体内重要的抗氧化物质。Tang等〔12〕将MT siRNA沉默的心肌细胞用锌处理与对照组的抗氧化能力并无显著差别,表明锌的抗氧化作用是通过其诱导产生的金属硫蛋白实现,而不是依靠锌本身实现的。本研究结果表明,硫酸锌外用可促进局部细胞增殖和微血管增生,对糖尿病大鼠皮肤创面具有良好的促进愈合作用。
以往研究证明,MMP/TIMP的动态平衡在创口愈合的过程中对控制创伤修复的结局至关重要。TIMPs作为MMPs的抑制因子,能有效抑制MMPs诱导的细胞外基质降解,进而调控基质重塑和促进新生血管生成。TIMPs的不足可导致创面迁延不愈或慢性的伤口形成〔13〕。本研究显示,锌可能通过调控皮肤创面局部组织的MMP/TIMP的表达变化参与皮肤损伤修复。
尽管目前锌促进DM患者创面愈合的机制仍不明,但是本实验以及前人的结果证实,作为人体必需的微量元素,锌对DM患者创伤愈合具有非常重要的意义。
1 Miracle LS,Barreda BF.Cutaneous manifestations of diabetes mellitus,a clinic manner for identify the disease〔J〕.Rev Endocrinol Nutr,2005;13(2):75-87.
2 Smith PD,Kuhn MA,Franz MG,etal.Initiating the inflammatory phase of incisional healing prior to tissue injury〔J〕.J Surg Res,2000;92(1):11-7.
3 Pastar I,Stojadinovic O,Yin NC,etal.Epithelialization in wound healing:a comprehensive review〔J〕.Adv Wound Care,2014;3(7):445-64.
4 Giacone F,Condorelli RA,Mongioi LM,etal.In vitro effects of zinc,D-aspartic acid,and coenzyme-Q10 on sperm function〔J〕.Endocrine,2016〔Epub a head of print〕.
5 D′Autreaux B,Toledano MB.ROS as signalling molecules:mechanisms that generate specificity in ROS homeostasis〔J〕.Nat Rev Mol Cell Biol,2007;8(10):813-24.
6 Pareek G,Shevchuk M,Armenakas NA,etal.The effect of finasteride on the expression of vascular endothelial growth factor and microvessel density:a possible mechanism for decreased prostatic bleeding in treated patients〔J〕.J Urol,2003;169(1):20-3.
7 彭瑞云,王德文.创伤愈合中血管再生及其调控研究进展〔J〕.现代康复,2001;53:48.
8 孙家贤.糖尿病与微量元素铬、铜、锌、镁〔J〕.哈尔滨医科大学学报,1989;23(4):283.
9 Miranda ER,Dey CS.Effect of chromium and zinc on insulin signaling in skeletal muscle cells〔J〕.Biol Trace Elem Res,2004;101(1):19-36.
10 Faure P.Protective effects of antioxidant micronutrients(vitamin E,zinc and selenium)in type 2 diabetes mellitus〔J〕.Clin Chem Lab Med,2003;41:995-8.
11 Soinio M,Marniemi J,Laakso M,etal.Serum zinc level and coronary heart disease events in patients with type 2 diabetes〔J〕.Diabetes Care,2007;30(3):523-8.
12 Tang Y,Yang Q,Lu J,etal.Zinc supplementation partially prevents renal pathological changes in diabetic rats〔J〕.J Nutr Biochem,2010;21(3):237-46.
13 Fiorentino L,Cavalera M,Mavilio M,etal.Regulation of TIMP3 in diabetic nephropathy:a role for microRNAs〔J〕.Acta Diabetologica,2013;50(6):965-9.
〔2016-09-28修回〕
(编辑 曲 莉)
国家自然科学基金(81300660);吉林省发改委(2013C029-3);吉林省(白求恩专项)自然科学基金(20160101035JC)
1 吉林大学第一医院内分泌科
郭蔚莹(1974-),女,副教授,主要从事内分泌代谢学研究。
张海峰(1975-),男,副教授,主要从事介入治疗学研究。
R587
A
1005-9202(2016)23-5777-04;
10.3969/j.issn.1005-9202.2016.23.004
