二陈汤加味对慢性阻塞性肺疾病氧化应激、沉默信息调节因子1表达的影响
2016-12-23陈四清谢文英尚立芝潘晓丽胡文豪
陈四清 谢文英 尚立芝 季 书 潘晓丽 刘 坦 胡文豪
(河南中医药大学基础医学院,河南 郑州 450046)
二陈汤加味对慢性阻塞性肺疾病氧化应激、沉默信息调节因子1表达的影响
陈四清 谢文英 尚立芝 季 书 潘晓丽 刘 坦 胡文豪
(河南中医药大学基础医学院,河南 郑州 450046)
目的 探讨二陈汤加味对慢性阻塞性肺疾病(COPD)大鼠氧化应激及沉默信息调节因子(Sirt)1表达的影响。方法 50只SD大鼠随机分为正常组、模型组、二陈汤加味20、10、5 g/kg剂量组,10只/组。香烟烟熏加脂多糖制备COPD动物模型,造模30 d。第31天起,对正常组、模型组灌胃(ig)生理盐水10 ml/kg,3个二陈汤加味组分别以20、10、5 g/kg剂量ig,连续14 d。检测肺功能、血清谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性,丙二醛(MDA)含量;酶联免疫法(ELISA)测定外周血单个核细胞中Sirt1浓度,酶联免疫荧光法测定外周血单个核细胞中Sirt1活性,实时荧光定量PCR检测外周血单个核细胞中Sirt1 mRNA表达,光镜观察炎细胞及肺组织病理形态。结果 与正常组比较,模型组肺匀浆中SOD和GSH-Px活性均显著降低(均P<0.01),MDA含量显著增加(P<0.05),支气管肺泡灌洗液(BALF)中炎细胞总数和中性粒细胞数均显著增高(均P<0.01),模型组外周血单个核细胞中Sirt1 mRNA表达,Sirt1含量及其活性均显著减低(P<0.05或P<0.01)。与模型组比较,二陈汤加味10、20 g/kg剂量组BALF中炎细胞计数、中性粒细胞和巨噬细胞数显著减少(P<0.05或P<0.01);GSH-Px和SOD活性均显著增高,MDA含量显著降低(P<0.05或P<0.01),二陈汤加味10、20 g/kg剂量组外周血单个核细胞中Sirt1 mRNA表达,Sirt1含量及其活性均显著升高(P<0.05或P<0.01)。结论 二陈汤加味有抗氧化损伤作用,其可能通过增加SOD和GSH-Px活性,减少MDA生成,增强Sirt1基因的表达,提高Sirt1活性,发挥抗氧化损伤而保护肺的结构与功能。
慢性阻塞性肺疾病;支气管肺泡灌洗液;氧化应激,沉默信息调节因子1
慢性阻塞性肺疾病(COPD)发生与氧化损伤、炎症反应等有关〔1,2〕。沉默信息调节因子(Sirt)1是一种组蛋白去乙酰化酶,通过去乙酰化调节多种蛋白酶和转录因子的活性,参与多种基因的遗传调控,在氧化损伤、炎症、肿瘤等过程中发挥重要作用〔3~5〕。研究显示Sirt1与COPD密切相关〔6〕,Sirt1表达与氧化损伤产物呈负相关〔7〕。二陈汤源于宋代《太平惠民和剂局方》,具有燥湿化痰、理气和中的功效,但其作用机制有待深入研究。本研究观察二陈汤加味对COPD肺功能、氧化应激、Sirt1基因表达及其活性的影响,探讨二陈汤加味对COPD抗氧化损伤的作用及分子机制。
1 材料与方法
1.1 药物 二陈汤加味方药物组成:炙麻黄6 g(批号1403125s)、姜半夏10 g(批号1309001H)、葶苈子10 g(批号1308001s)、茯苓15 g(批号1309001H)、陈皮10 g(批号1302001H)、党参10 g(批号1407002w)、白术10 g(批号1403003s)、苦杏仁10 g(批号1402001w)、甘草6 g(批号1302001S)等均为三九医药生产中药配方颗粒。
1.2 动物 SD雄性大鼠50只,6月龄,体质量230~270 g,SPF级。河南省动物实验中心出售,河南省动物质量监督监测站(质量合格证:No.41003100001905),许可证号:SYXK(豫)2010-0001。
1.3 仪器 inspira小动物用呼吸机(日本,光电),TopScan小动物肺功能测量系统(吉安德尔科技有限公司),SF-3000动物用血液分析仪(EHSY),ABL80型血气分析仪(丹麦,Radiometer公司),DU640型紫外分光光度仪(美国,BECKMAN),VCX500型超声处理仪(美国,SONICS),Powerwave XS全波长扫描酶标议(美国,Bio-tek),伯乐1575全自动酶标洗板机(美国,伯乐公司)。ETTAN IPGPHOR3双向电泳仪(美国,GE),ABI9700普通PCR仪(美国,ABI公司),PT2100匀浆机(POLYTRON),272007028实时荧光定量PCR仪(美国,Applied biosystem)。U-CMAD3型显微镜(日本,Olympus),20486型显微摄像仪(日本,Olympus)。
1.4 试剂 红旗渠牌香烟(烤烟型,焦油含量14 mg/支,尼古丁1.1 mg/支,河南安阳卷烟厂)。脂多糖(LPS,701c034,L8880,solarbio公司),血气分析仪试剂盒(wi80521,美国)。谷胱甘肽过氧化物酶(GSH-Px,比色法,A005)、丙二醛(MDA,TBA法,A003-1)、超氧化物歧化酶(SOD,WST-1法,A003-3)测定试剂盒均为南京建成生物工程研究所。抗Sirt1多克隆抗体(Santa Cruz公司,美国),Sirt1 ELISA试剂盒(Abnova产品),Sirt1 活性检测试剂盒(Sigma公司,美国)。总RNA提取试剂盒(RNA-50)、逆转录试剂盒(R211-01)、染料法qPCR试剂(Q141-02)、Oligo合成(D12540)均为南京诺唯赞生物科技有限公司产品。
1.5 方法
1.5.1 动物分组 大鼠随机分为正常组、模型组、二陈汤加味5 g/kg,10 g/kg,20 g/kg剂量组,每组10只。
1.5.2 模型制备 ①参照文献〔8〕制备熏香烟加脂多糖诱导COPD大鼠模型。在造模第1、14天,所有动物均经气管注入溶于生理盐水的脂多糖 200 μl(1 g/L);除第14天外,第2~30天将大鼠置入熏箱内,熏香烟烟雾染毒,2次/d,香烟8支/次,30 min/次。
1.5.3 给药方案 3个二陈汤加味治疗组分别予5 g/kg、10 g/kg、20 g/kg二陈汤加味,灌胃(ig),正常组、模型组生理盐水10 ml/kg,ig,连续14 d。
1.5.4 指标检测
1.5.4.1 肺匀浆SOD和GSH-Px活性、MDA含量测定 按照试剂盒说明书,分光光度仪测定SOD和GSH-Px活性、MDA含量。在532 nm、412 nm、550 nm,分别比色测MDA、GSH-Px、SOD各管吸光度值。
1.5.4.2 检测Sirt1含量 严格按照说明书操作,ELISA法酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中大鼠外周血单个核细胞中Sirt1含量。
1.5.4.3 支气管肺泡灌洗液(BALF)中炎细胞分类及计数 BALF中的细胞总数=细胞数(个/ml)×BALF毫升数,瑞氏-姬姆萨染色进行细胞分类,计算巨噬细胞总数及所占的百分数。
1.5.4.4 外周血单个核细胞分离 用单个核细胞分离液,采用密度梯度离心法分离单个核细胞〔9〕。
1.5.4.5 Sirt1活性检测 使用活性荧光分析试剂盒,严格按照试剂盒说明书进行操作。
1.5.4.6 实时荧光定量聚合酶链反应检测细胞内Sirt1 mRNA表达量 第一步:提取总RNA。将分离的外周血单个核细胞放入PE管中,加入250 μl×2次 RL Solution溶液(组织、细胞裂解液)。加40 μl氯仿萃取剂,充分混匀后,离心12 000 r/min,3 min。抽取300 μl上清液,置于1.5 ml的Tube管中,再加入等体积无水乙醇。将匀液加入Spin columin 管中,离心12 000 r/min,1 min,弃滤液。配制提取洗脱液:80 ml无水乙醇+20 ml提取洗脱液=100 ml,抽取600 μl提取洗脱液加入Spin columin 管中,12 000 r/min,1 min离心,弃滤液。Spin空管,12 000 r/min,2 min离心,彻底去除废液。将Spin管放入新的DEPC处理过的1.5 ml Tube管中。抽取40 μl DEPC水加到白色膜状RNA上,室温放置1~2 min后,12 000 r/min,1 min离心。收集滤液,扔掉白色膜状物,得到总RNA提取液。第二步:反转录cDNA。反应条件:Hiscript II Enzyme MIX 2 μl,2×RT Mix 10 μl,Oligo dT 1 μl,Random hexamers 1 μl,提取的总RNA 3 μl,ddH2O 3 μl共 20 μl。第三步:qPCR 反应体系。(1)配制染料和引物的混合液:Master Mix 10 μl,上、下游引物各0.4 μl,共10.8 μl。(依照上述方法,分别配出Sirt1,GADPH)。(2)配制cDNA混合液:模板cDNA 1 μl,DECP 8.2 μl,共9.2 μl。使用实时荧光定量PCR仪进行PCR扩增。Sirt1的上游引物5′-CAGGTTGCGGGAATCCAA-3′,下游引物5′-CAGGCAAGATGCTGTTGCA-3′,扩增片段长度 95 bp;GAPDH 上游引物5′-AGGGCTGTTCGTGAGCACA-3′,下游引物5′-GAGCCCCAGCCTTCTCCATG-3′,扩增片段长度 159 bp。采用20 μl反应体系。反应条件为95℃ 30 s,95℃ 5 s,60℃ 20 s,共40个循环。计算各组Sirt1 mRNA相对表达量。
1.6 统计学方法 应用SPSS13.5软件,计量资料多组间比较采用方差分析。
2 结 果
2.1 大鼠一般状况 实验结束时,正常组一般状况好,体重增长,处死2只。模型组处死2只用于组织病理。低剂量组死亡2只。二陈汤加味10、20 g/kg组各死亡1只,存活大鼠体重增加。
2.2 肺匀浆中SOD、GSH-Px、MDA结果 模型组肺组织匀浆中SOD和GSH-Px活性均显著低于正常组(均P<0.01),MDA含量显著高于正常组(P<0.05);与模型组比较,二陈汤10、20 g/kg剂量组中SOD和GSH-Px活性均显著高于模型组、MDA含量显著低于模型组,差异均有统计学意义(P<0.05,或P<0.01)。见表1。
2.3 BALF中炎细胞计数和分类比较 与正常组比较,模型组BALF中炎细胞总数和中性粒细胞数均显著增高(均P<0.01)。与模型组比较,二陈汤加味10、20 g/kg剂量组炎细胞总数、中性粒细胞和巨噬细胞数显著减少(P<0.05,或P<0.01)。见表2。
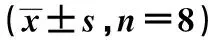
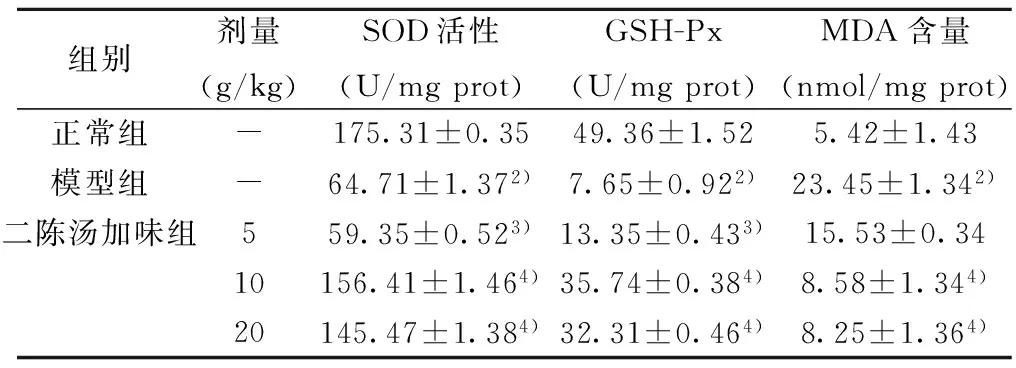
组别剂量(g/kg)SOD活性(U/mgprot)GSH-Px(U/mgprot)MDA含量(nmol/mgprot)正常组-175.31±0.3549.36±1.525.42±1.43模型组-64.71±1.372)7.65±0.922)23.45±1.342)二陈汤加味组559.35±0.523)13.35±0.433)15.53±0.3410156.41±1.464)35.74±0.384)8.58±1.344)20145.47±1.384)32.31±0.464)8.25±1.364)
与正常组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01;下表同
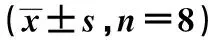
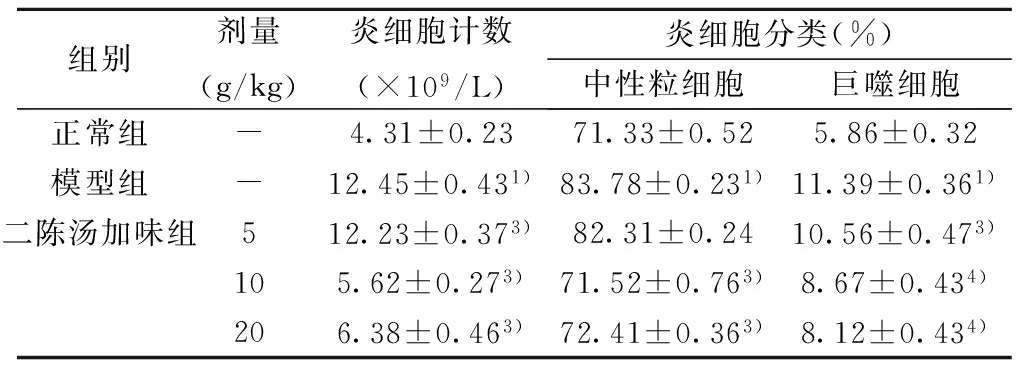
组别剂量(g/kg)炎细胞计数(×109/L)炎细胞分类(%)中性粒细胞巨噬细胞正常组-4.31±0.2371.33±0.525.86±0.32模型组-12.45±0.431)83.78±0.231)11.39±0.361)二陈汤加味组512.23±0.373)82.31±0.2410.56±0.473)105.62±0.273)71.52±0.763)8.67±0.434)206.38±0.463)72.41±0.363)8.12±0.434)
2.4 外周血单个核细胞中Sirt1 mRNA表达、Sirt1含量及其活性 与正常组比较,模型组Sirt1 mRNA表达、Sirt1含量及Sirt1活性均显著降低(P<0.05或P<0.01)。与模型组比较,二陈汤加味10、20 g/kg剂量组Sirt1 mRNA表达、Sirt1含量及Sirt1活性显著增加(P<0.05或P<0.01)。见表3。
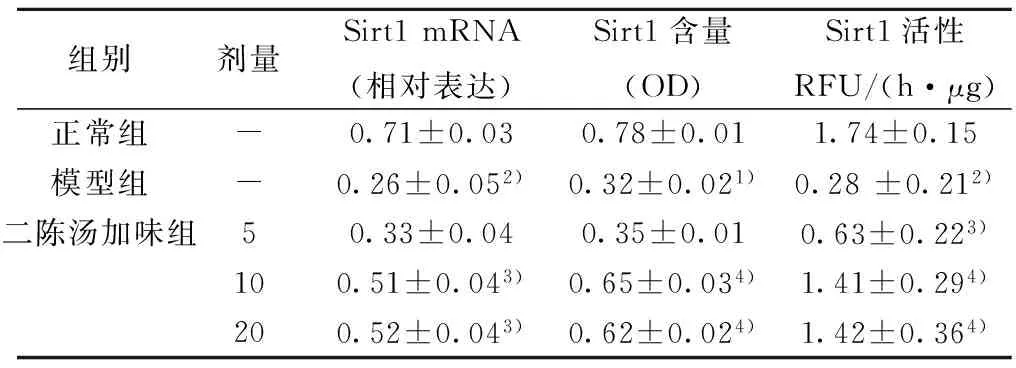
组别剂量Sirt1mRNA(相对表达)Sirt1含量(OD)Sirt1活性RFU/(h·μg)正常组-0.71±0.030.78±0.011.74±0.15模型组-0.26±0.052)0.32±0.021)0.28±0.212)二陈汤加味组50.33±0.040.35±0.010.63±0.223)100.51±0.043)0.65±0.034)1.41±0.294)200.52±0.043)0.62±0.024)1.42±0.364)
3 讨 论
COPD是常见的以气道气流受限为特征的慢性炎症性疾病,气流受阻呈进行性发展。氧化/抗氧化失衡是COPD的重要病理生理机制。COPD时过多的自由基可直接降低SOD和GSH-Px活性,使肺组织防御过氧化的能力下降〔10〕。COPD的临床表现属中医“痰饮”、“喘证”等范畴。二陈汤源于宋代《太平惠民和剂局方》,由半夏、陈皮、茯苓、甘草组成,有理气化痰,燥湿和中之效。本方在二陈汤基础上加杏仁、炙麻黄以祛痰止咳平喘;加党参、白术、健脾和胃、活血祛瘀,加葶苈子以泻肺降气。诸药合用,共奏宣肺降气、止咳平喘、活血化瘀等功。
氧化应激和炎症是COPD发病的关键。COPD病变过程中氧化损伤增加中性粒细胞、嗜酸性粒细胞、巨噬细胞和T淋巴细胞渗出,炎细胞释放的细胞因子增加。本研究结果显示,中性粒细胞浸润在COPD中起重要作用。与文献报道相近〔11〕,二陈汤加味通过抑制中性粒细胞和巨噬细胞浸润起到抗感染作用。
氧化应激可致组织过氧化损伤。SOD和GSH-Px都是机体内源性清除氧自由基的酶,MDA是脂质过氧化产物,测定SOD、GSH-Px和MDA可以反映细胞的氧化应激水平。本研究显示,模型组存在明显的氧化损伤,二陈汤加味可能通过抗氧化损伤而发挥保护肺组织的作用。
Sirtuins 是近年来发现的组蛋白去乙酰化酶,Sirt1是Sirtuins家族主要成员,Sirt1通过组蛋白的赖氨酸残基去乙酰化,恢复组蛋白正电荷,与带负电荷的DNA紧密结合,稳定核小体的结构,染色质更加卷曲致密,构型不易发生变化,阻碍DNA与转录因子结合,基因的转录受到抑制而致基因沉默〔12〕。抑制炎症因子的转录和合成,对抗炎症反应〔13〕。Sirt1参与调控DNA修复、氧化应激、细胞凋亡和细胞衰老等多种病理生理过程,在抗衰老、糖脂代谢、肿瘤和心血管系统中发挥重要作用〔14〕。
本研究发现,模型组外周血单个核细胞中Sirt1 mRNA表达、Sirt1含量及其活性均显著减低。COPD的氧化/抗氧化失衡,过氧化物使Sirt1活性降低甚至失去活性,对炎症因子基因的抑制作用减弱,炎症因子释放增多〔15〕。烟草中的成分能下调支气管上皮细胞和肺泡巨噬细胞中Sirt1的表达及活性,影响其下游基因的表达,导致COPD的发生发展〔16,17〕。Sirt1激活剂能诱导线粒体减少氧自由基生成〔18〕。Sirt1表达与氧化损伤产物负相关〔19〕。COPD患者存在抗氧化能力降低,提高Sirt1活性有望成为治疗呼吸系统疾病的新的治疗靶点〔20〕。在Sirt1转基因小鼠模型中,适度上调Sirt1,可促进过氧化氢酶表达,抑制机体氧化应激〔21〕,提示二陈汤加味可能通过增强Sirt1表达,激活Sirt1活性对抗氧化应激,保护肺组织。但其机制有待深入研究。
1 钟南山.慢性阻塞性肺疾病在中国〔J〕.中国实用内科杂志,2011;31(5):321-3.
2 Vlahos R,Bozinovski S.Recent advances in pre-clinical mouse models of COPD〔J〕.Clin Sci,2014;126(4):253-6.
3 Bordone L,Guarente L.Calorie restriction,SIRT1 and metabolism:understanding longevity 〔J〕.Nat Rev Mol Cell Biol,2005;6(4):298-305.
4 Brooks CL,Gu W.How does SIRT1 affect metabolism,senescence and cancer〔J〕.Nat Rev Cancer,2009;9(2):123-8.
5 方明明,吴晓燕,戚晓红.缺氧状态下去乙酰化酶 SIRT1 对 MHCⅡ的反式激活因子的调控机制〔J〕.南京医科大学学报(自然科学版),2011;31(12):1772-6.
6 Corbi G,Bianco A,Turchiarelli V,etal.Potential mechanisms linking atherosclerosis and increased cardiovascular risk in COPD:focus on sirtuins〔J〕.Int J Mol Sci,2013;14(6):12696-713.
7 陈 刚.慢性阻塞性肺疾病中Sirtuins的研究进展〔J〕.基础医学与临床,2014;34(7):1010-3.
8 尚立芝,张紫娟,谢文英,等.爱罗咳喘宁对慢性阻塞性肺疾病大鼠肿瘤坏死因子-α、巨噬细胞炎性蛋白-2、髓过氧化物酶及肺组织病理变化的影响〔J〕.中国老年学杂志,2015;35(20):5705-8.
9 刘金生,印 澄,季晓辉,等.SLE患者外周血单核细胞LTβR 的异常表达及其影响因素初探〔J〕.南京医科大学学报(自然科学版),2010;30(12):1722-8.
10 赵蜀军,蔡圣荣,方志斌,等.慢性支气管炎肺气虚证大鼠血清IL-8、MDA、SOD变化特征〔J〕.安徽中医学院学报,2005;24(2):21-3.
11 Fisman ez,Motro M,Tenenbaum A.Cardiovascular diabetology in the core of a novel interleukins classification the bad the good and the aloof〔J〕.Cardiovasc Diabetol,2003;2(1):11-5.
12 Ropero S,Esteller M.The role of histone deacetylases (HDACs)in human cancer〔J〕.Mol Oncol,2007;1(1):19-25.
13 Bai B,Wang Y.Methods to investigate the role of SIRT1 in endothelial senescence cell senescence〔J〕.Methods Mol Biol,2012;965(1):327-39.
14 Mimura T,Kaji Y,Noma H,etal.The role of SIRT1 in ocular aging〔J〕.Exp Eye Res,2013;116(7):17-26.
15 Adcock IM,Ito K,Barnes PJ.Histone deacetylation:an important mechanism in inflammatory lung diseases〔J〕.COPD,2005;2(4):445-55.
16 Caito S,Hwang JW,Chung S,etal.PARP-1 inhibition does not restore oxidant-mediated reduction in SIRT1 activity〔J〕.Biochem Biophys Res Commun,2010;39(2):264-70.
17 Hu YX,Cui H,Fan L,etal.Resveratrol attenuates left ventricular remodeling in old rats with COPD induced by cigarette smoke exposure and LPS instillation〔J〕.Can J Physiol Pharmacol,2013;91(12):1044-54.
18 Li YG,Zhu W,Tao JP,etal.Resveratrol protects cardiomyocytes from oxidative stress through SIRT1 and mitochondrial biogenesis signaling pathways〔J〕.Biochem Biophys Res Commun,2013;438(2):270-6.
19 叶 婷,宁 勇.沉默信息调节因子1 在肾脏衰老中的作用〔J〕.中国老年学杂志,2014;34(20):5768-70.
20 Barnes PJ.New therapies for chronic obstructive pulmonary disease〔J〕.Med Princ Pract,2010;19(5):330-8.
21 Salminen A,Huuskonen J,Ojala J,etal.Activation of innate immunity system during aging:NF-κB signaling is the molecular culprit of inflammaging〔J〕.Ageing Res Rev,2008;7(2):83-105.
〔2016-03-17修回〕
(编辑 袁左鸣)
Effect of supplemental Erchen decoction on role of oxidative stress and Sirt1 in rats with chronic obstructive pulmonary disease
CHEN Si-Qing, XIE Wen-Ying, SHANG Li-Zhi,et al.
Henan University of Traditional Chinese Medicine,Zhengzhou 450008, Henan, China
Objective To study the effect of supplemental Erchen decoction on Sirt1 levels in serum,the activity of Sirt1in rats with chronic obstructive pulmonary disease (COPD).Methods COPD was made by smoke combined with LPS. Rats were randomly divided into normal, model, Supplemental Erchen decoction groups (5,10,20 g/kg). Enzyme-linked immunosorbent assay was used to determine serum Sirt1 level in rat. The activity of Sirt1 was determined by enzyme-linked immune fluorescence. Real-time quantitative PCR method was used to detect the expression of Sirt1 mRNA.Results The levels of SOD and GSH-Px in lung tissue were significantly lower and MDA was higher in model group than those of normal group (P<0.01). The total number of neutrophils and inflammatory cells were significantly increased in model group than those of normal group in bronchoalveolar lavage fluid (BALF)(P<0.01). mRNA, content and activity of Sirt1 in model group were higher than those in normal group significantly (P<0.01). Compared with model group, the inflammatory cells counts, neutrophils, macrophages were decreased(P<0.01,P<0.05), SOD, GSH-Px activity were increased, MDA content was decreased (P<0.01,P<0.05), mRNA, content and activity of Sirt1 in 10, 20 g/kg Supplemental Erchen decoction groups.Conclusions Supplemental Erchen decoction has anti-oxidative effect, which may be related with increasing SOD, GSH-Px activities, reducing MDA, increasing expression of Sirt1 gene and enhancing activity of Sirt1 so that protecting lung structure and function by anti-oxidative injury.
Chronic obstructive pulmonary disease; Bronchial alveolar lavage fluid (BALF); Oxidative stress; Sirtuins(Sirt)1
国家自然科学基金面上项目(81573881);郑州市科技领军人才项目(121PLJRC535);河南省高等学校重点科研项目(15A360030);河南省科支重点攻关(152102310337);河南省教育厅资助项目(2010A360024);河南省科技攻关项目(112102310314);河南中医学院研究生教育研究课题(2014YJX001);河南中医学院基础医学院教学项目(2015JCJX10);河南省中医药科学研究专项课题(2013ZY02070);河南中医学院大学生创新学习项目(CXXM〔2015〕0017,CXXM〔2015〕0063)
尚立芝(1966-),女,教授,主要从事中医药作用机制研究。
陈四清(1966-),男,副教授,主要从事中医药基础研究。
R285.5
A
1005-9202(2016)23-5774-04;
10.3969/j.issn.1005-9202.2016.23.003
