复方蜥蜴散不同微粒组合剂对溃疡性结肠炎大鼠血清IL-4和结肠组织COX-2的研究
2016-12-22朱西杰叶景阳安婷婷
张 蔷,朱西杰,2*,孔 娟,叶景阳,安婷婷
(1.宁夏医科大学,银川 750004;2.宁夏医科大学附属回医中医院,银川 750004)
复方蜥蜴散不同微粒组合剂对溃疡性结肠炎大鼠血清IL-4和结肠组织COX-2的研究
张 蔷1,朱西杰1,2*,孔 娟1,叶景阳1,安婷婷1
(1.宁夏医科大学,银川 750004;2.宁夏医科大学附属回医中医院,银川 750004)
目的 探讨复方蜥蜴散不同微粒组合剂(XY)抑炎、修复、调节免疫的作用机理。方法 将84只SPF级雄性大鼠随机分为空白组、模型组、复方蜥蜴散80目组、100目组、80目+100目混合组、柳氮磺胺吡啶组,除空白组外,其他组均采用2,4,6-三硝基苯磺酸(TNBS)-乙醇复合法诱导UC模型。造模成功后做相应治疗,光镜观察肠黏膜病理组织学变化,检测血清IL-4的含量和结肠组织COX-2的表达水平。结果 各治疗组与模型组比较,IL-4含量明显升高,COX-2表达明显降低,差异有统计学意义(P<0.05)。复方蜥蜴散80目+100目组与其他治疗组比较,IL-4含量明显升高,COX-2表达明显降低,差异有统计学意义(P<0.05)。结论 复方蜥蜴散不同微粒组合剂可能通过升高IL-4的含量,减少COX-2的合成而抑制炎性细胞,调节免疫,改善血液流变性和微循环,促进结肠溃疡的修复。
复方蜥蜴散;溃疡性结肠炎;COX-2;IL-4
溃疡性结肠炎(UC)是一种慢性非特异性结肠炎症,是公认的引起结肠癌的高危因素,可通过慢性炎症-不典型增生-癌变模式最终发展为结肠癌[1]。研究[2]表明,UC患者最终发展为结肠癌的发病率约为3.7%,因此阻断UC作为结肠癌的一个预防措施,受到了国内外医学界的关注。UC发病机制复杂,细胞因子和炎症介质以及二者相互影响形成的复杂网络占有核心地位,尤以细胞因子失衡和花生四烯酸代谢紊乱为主[3]。环氧合酶(COX)是体内催化花生四烯酸转化为前列腺素的关键酶,参与机体炎症反应,当其被多种细胞因子和炎症递质诱导时则明显表达[4],白细胞介素-4(IL-4)是来源于T细胞的细胞因子,具有抑制炎症,维持肠道免疫的作用。笔者通过采用TNBS和乙醇混合液建立UC大鼠模型,探究复方蜥蜴散不同微粒组合剂治疗后对IL-4和COX-2水平的影响,以期深入了解该方作用机制。
1 材料
1.1 动物 SPF级SD大鼠84只,4~6周龄,雄性,体质量(200±20)g,批号:SCXK(宁)2011-0001,由宁夏医科大学实验动物中心提供。1.2 药品、试剂和仪器 复方蜥蜴散:宁夏密点麻蜥、半枝莲、黄芪、黄芩、葛根、地榆、白及等组成,由宁夏医科大学附属回医中医院提供;柳氮磺胺吡啶肠溶片0.25 g×60片/盒,批号:H31020557,上海信谊天平药业有限公司;TNBS,批号:X4947,成都格雷西亚化学有限公司;75%乙醇:500 mL/瓶,德州乐康消毒制品有限公司;0.9%氯化钠溶液:250 mL/瓶,四川科伦药业股份有限公司;IL-4ELISA试剂盒,北京普尔伟业生物科技有限公司;兔抗大鼠多克隆COX-2抗体,批号:BA0738,武汉博士德生物工程有限公司;PBS磷酸盐缓冲液、SABC试剂盒和DAB显色试剂盒均购于北京中杉金桥生物技术有限公司。YD5A-WS台式离心机:长沙湘仪离心仪器有限公司出品;550酶标仪:美国Bio-Rad公司;TEC2800病理组织包埋机:常州郝思琳医用仪器有限公司;漂烘片机YABO200,常州雅博电子设备有限公司;电热恒温培养箱DNP-9162:上海跃进医用光学仪器厂;VITLAB微量移液枪:德国生产;孵育盒:福州迈新生物技术开发有限公司;图像采集系统显微镜BH2-RFCA:日本OLYMPUS公司,均由宁夏医科大学总院肿瘤医院病理科提供。
2 方法
2.1 动物分组 84只SPF级SD雄性大鼠,随机分为空白组、模型组、复方蜥蜴散80目(XY80)组、100目(XY100)组、80目+100目等量混合(XY80+100)组、柳氮磺胺吡啶(SASP)组,共6组,编为A~F组,每组14只,相同条件下分笼饲养。
2.2 药物配制 复方蜥蜴散混悬液:XY80、XY100、XY80+100等量混合物经过粉碎、高温灭菌、蒸2.5 h,晾干后,用双蒸水分别配成0.14 g/mL混悬液。SASP混悬液:SASP研磨,用蒸馏水配成0.03 g/mL的混悬液保存备用。
2.3 造模及给药方法 大鼠购进后适应性喂养1周,除A组外,其余大鼠禁食24 h后,用10%水合氯醛(3 mL/kg)麻醉,根据文献[5-6]造模,用石蜡油润滑的橡胶软管(外径2 mm),插入大鼠肛门上段8 cm结肠内,用注射器将混合液(100 mg/kg TNBS+50%乙醇0.25 mL)缓慢注入橡胶软管,再注入长约0.3 mL的空气,提起大鼠尾部,持续倒置1 min,使造模剂充分进入大鼠肠腔,待自然苏醒后正常饲养。A组注入相应体积的生理盐水灌肠,造模第3天,从各组随机抽取1只,取肠黏膜做HE染色检测造模符合UC的病理诊断。A组和B组大鼠开始给予0.9%氯化钠溶液,C、D、E组大鼠分别给予XY80、XY100、XY80+100等量混合混悬液,F组大鼠给予0.3 g/kg SASP每只均按10 mL/(kg ·d)灌胃,连续用药14 d。
2.4 标本采集及处理 治疗第14天末,将各组大鼠禁食水24 h,麻醉腹主动脉取血后注入离心管,经3 000 r/min,低温离心10 min,取上清液于EP管放到-80 ℃冰箱保存,ELISA试剂盒检测IL-4含量。分离出结肠,截取距肛门8 cm处的部分结肠沿肠系膜剪开后冲洗,用10%福尔马林溶液固定24 h后,梯度脱水,石蜡包埋备用,常规HE染色做病检,邻近切片做免疫组化染色。免疫组化步骤按照试剂盒说明书进行,COX-2抗体使用浓度为1∶500。采用Image-ProPlus 6.0图像分析系统,每张切片选择5个有代表性的阳性细胞表达最强染色部位,测定阳性区域平均光密度AOD。
2.5 观察指标 观察各组大鼠的精神状态、进食量、体质量、大便性状、存活情况;疾病活动指数(DAI)评分:根据DAI评分标准[7],将体质量下降的百分比、大便性状和便血情况进行评分,取其平均数作为最后得分。
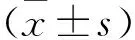
3 结果
3.1 造模后大鼠一般情况 造模成功率94%,A组大鼠饮食饮水及大便正常,精神状态好,毛色光亮,反应灵敏;其余各组大鼠造模后第1天开始精神萎靡,懒动,被毛干枯,食水量减少,体质量减轻,大便稀溏甚则伴有脓血,尿黄,尿少;B组造模后症状无明显自愈现象,在第3天DAI达到高峰;各治疗组上述表现均不同程度好转,平均8d后血便消失,腹泻减轻,大便逐渐成形,以E组为最佳,进食进水量增加,毛色光亮,主动觅食,体质量逐渐增加,大便呈颗粒状,见表1。
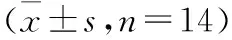
表1 各组大鼠DAI评分
注:与A组比较,#P<0.05;与B组比较,△P<0.05;与E组比较,▲P<0.05
3.2 光镜下结肠病理组织学观察 A组:镜下结肠结构完整,腺体排列整齐,未见充血、水肿以及溃疡的发生。B组:各层组织结构消失,细胞间隙增宽,腺体破坏,杯状细胞减少,黏膜层及黏膜下层有大量中性粒细胞、淋巴细胞、嗜酸性粒细胞及浆细胞浸润。各治疗组与B组相比,病理结果均有不同程度的改善,而E组为最佳,各层结构基本清晰,腺体排列整齐,可见散在炎性细胞。
3.3 免疫组织化学结果 COX-2主要在细胞浆内表达,在A组表达较弱,在B组肠上皮细胞、血管内皮细胞及其间质细胞呈明显棕色强表达,而在其他组中表达明显减弱,呈散在分布染色结果,尤以E组表达最少,其他各组表达介于A组与B组之间。
3.4 统计结果 各组与A组比较,IL-4含量降低,AOD值升高,差异有统计学意义(P<0.05),说明其他各组大鼠均有不同程度的炎症性损伤;各治疗组与B组比较,IL-4含量均升高,AOD值均降低(P<0.05);E组与C、D、F组比较,IL-4含量明显升高,AOD值明显降低(P<0.05);C组、D组和F组比较,差异无统计学意义(P>0.05)。说明XY80+100等量混合组疗效最佳,优于单用XY80、XY100以及SASP,而XY80、XY100及SASP疗效相差不明显。见表2。
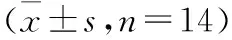
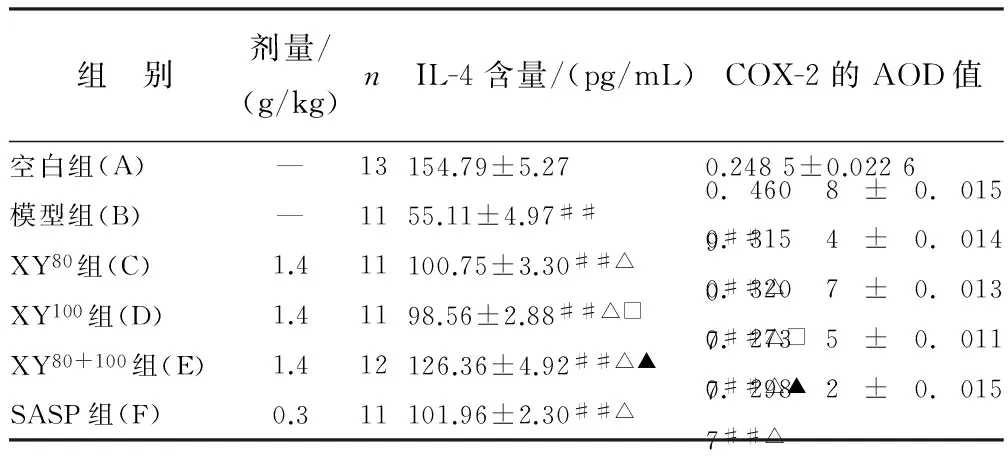
组 别剂量/(g/kg)nIL-4含量/(pg/mL)COX-2的AOD值空白组(A)—13154.79±5.27 0.2485±0.0226 模型组(B)—1155.11±4.97## 0.4608±0.0159## XY80组(C)1.411100.75±3.30##△ 0.3154±0.0140##△ XY100组(D)1.41198.56±2.88##△□0.3207±0.0137##△□XY80+100组(E)1.412126.36±4.92##△▲0.2735±0.0117##△▲SASP组(F)0.311101.96±2.30##△ 0.2982±0.0157##△
注:与A组比较,## P<0.01;与B组比较,△ P<0.05;与F组比较,▲ P<0.05;与E组比较,□ P<0.05
4 讨论
IL-4[8]由T淋巴细胞产生,是B细胞生长因子,通过刺激B细胞和T细胞,在结肠中发挥免疫抑制效应,对维持肠道免疫起重要作用,并且能抑制前列腺素和IL-8的产生,具有抗炎作用。COX-2[9]是体内催化花生四烯酸转化为前列腺素的酶,正常肠黏膜表达较少,当受到炎性介质、细胞因子、内毒素等刺激时表达量迅速上调,从而催化花生四烯酸合成多种过量的前列腺素类物质,导致炎细胞浸润、充血、水肿等,并可影响肠管运动和肠血流量,使炎症反应持久化。殷刚峰等[10]研究证明:当IL-4升高时,COX-2下调;当IL-4下调时,COX-2上升,据此推断:IL-4可能通过抑制前列腺素合成关键酶COX-2的表达,导致前列腺素合成减少,从而使肠黏膜炎症减轻,病情好转。
本实验表明,UC大鼠模型组IL-4含量明显低于空白组,COX-2表达明显高于空白组,提示,UC大鼠发病与IL-4低含量,COX-2高表达有关。经复方蜥蜴散不同微粒组合剂治疗后,IL-4含量上升,COX-2表达下调,并优于其他组,推断因机体对颗粒大小不同的药物分解吸收时间不同而延长药效,有效的干预UC进一步发展。
导师认为UC发病因浊毒内蕴,阻滞脉络,伤及肠道脂膜气血,腐败成脓,肠道传导失司而形成,治以解毒排毒、祛瘀化湿、敛疮生肌。方中以宁夏密点麻蜥为君药,具有解毒、活血化瘀、修复、免疫抑制[11];臣以半枝莲和黄芩清热燥湿、泻火解毒,其提取物黄芩苷元可抑制COX-2的活性和蛋白表达[12],配以焦山楂、焦乌梅消食化瘀,促进肠蠕动,防止毒邪羁留损伤肠膜,黄芪、金银花托毒生肌,促进溃疡愈合,葛根活血化瘀、收敛涩肠,地榆炭凉血止血、解毒敛疮;佐以海螵蛸收敛止血、制酸敛疮,能保护胃肠黏膜细胞的完整性和减少炎症细胞的浸润[13],白及粉可消除局部炎症水肿保护黏膜溃疡面;使药甘草在调和诸药的同时,可增强半枝莲清热解毒之效。诸药合用,临床疗效明显、安全性好、毒副作用小,充分发挥中医多靶点的优势。
[1]KRAUSS,ARBERN.Inflammationandcolorectalcancer[J].CurrentOpinioninPharmacology,2009,9(4):405-410.
[2]RIZZOA,PALLONEF,MONTELEONEG,etal.Intestinalinflammationandcolorectalcancer:adouble-edgedsword?[J].WorldJournalofGastroenterology,2011,17(26):3092-3100.
[3]刘波,许春梅.HIF-1α、COX-2在溃疡性结肠炎中的表达及与疾病活动性的关系[J].临床消化病杂志,2008,20(3):172-175.
[4]LIMEIHUA,JANGJH,SURHYJ.NitricoxideinducesapoptosisviaAP-1-drivenupregulationofCOX-2inratpheochromocytomacells[J].FreeRadicalBiology&Medicine,2005,39(7):890-899.
[5]张涛,谢建群.大鼠溃疡性结肠炎模型的实验研究[J].中国中西医结合消化杂志,2006,14(4):240-242.
[6]贺海辉,沈洪,朱宣宣,等.2,4,6-三硝基苯磺酸/乙醇法诱导建立溃疡性结肠炎大鼠模型[J].中国老年学杂志,2015,35(15):4138-4140.
[7]JACKSONLN,ZHOUY,QIUSUIMIN,etal.Alternativemedicineproductsasanoveltreatmentstrategyforinflammatoryboweldisease[J].TheAmericanJournalofChineseMedicine,2008,36(5):953-965.
[8]口锁堂,吴焕淦,施达仁.白介素与溃疡性结肠炎[J].世界华人消化杂志,2006,14(4):405-411.
[9]LEEDONGHEE,KIMNR,LIMBS,etal.EffectsofTEGDMAandHEMAontheexpressionofCOX-2andiNOSinculturedmurinemacrophagecells[J].DentalMaterials:OfficialPublicationoftheAcademyofDentalMaterials,2009,25(2):240-246.
[10]殷刚峰,卜平,朱海航.白头翁加味汤调节溃疡性结肠炎大鼠血清白介素-4和肠黏膜环氧合酶-2的研究[J].中国实验方剂学杂志,2009,15(12):84-86.
[11]朱西杰,杨利侠,梁岩.蜥蜴临证辨析[J].山西中医,2002,18(4):45-46.
[12]朱伟,孙红光,朱迅.黄芩苷元对炎症反应的影响[J].中国药理学通报,2009,25(2):194-197.
[13]郭一峰,周文丽,张建鹏,等.海螵蛸多糖对小鼠胃黏膜保护作用的研究[J].第二军医大学学报,2008,29(11):1328-1332.
Different combinations of compound lizards powder on serum IL-4 and colonic COX-2 in rats with ulcerative colitis
ZHANG Qiang1,ZHU Xijie1,2*,KONG Juan1,YE Jingyang1,AN Tingting1
(1.Ningxia Medical University,Yinchuan 750004,China;2.Affiliated Hui Medicine Hospital of Ningxia Medical University,Yinchuan 750004,China)
Objective To explore the mechanism of different combinations of compound lizards powder (XY) anti inflammation,repair,regulation of immunity.Methods The 84 SPF male SD rats were randomly divided into blank group,model group,compound lizards powder 80 mesh group,100 mesh group,80 mesh + 100 mesh group,sulfasalazine group,except blank group,other groups were collected 2,4,6 trinitrobenzene sulfonic acid (TNBS)-ethanol compound method induced rat UC model.After success of model,rats were treated accordingly,light microscope was used to observe pathological,to detect content of serum IL-4 and expression level of COX-2 in colonic tissues of rats in each group.Results Compared with model group,IL-4 content was significantly increased,COX-2 expression was significantly lower,significant difference(P<0.05).Comparison of compound lizards powder 80 mesh+100 mesh group with other treatment groups,IL-4 content was significantly increased,COX-2 expression was significantly reduced,significant difference (P<0.05).Conclusion Different combinations of compound lizards powder may be by elevated IL-4 content,reduce synthesis of COX-2 and inhibition of inflammatory cells,immune regulation,improve blood rheology and microcirculation,promote repair of colonic ulcers.
compound lizards powder;ulcerative colitis;COX-2;IL-4
10.13463/j.cnki.cczyy.2016.06.008
国家自然科学基金“复方蜥蜴散不同微粒组合剂对胃癌前病变大鼠Stat3、Wnt、核因子κB通路的影响及疗效评价研究”(81160482)。
张 蔷(1991-),女,硕士研究生,主要从事中医药治疗消化系统疾病的研究。
R285.5
A
2095-6258(2016)06-1122-04
2016-16-02)
*通信作者:朱西杰,男,硕士研究生导师,电话-13007992491,电子信箱-zhuxijie2010@163.com
