芪苈强心胶囊改善柔红霉素心脏毒性的体外实验
2016-12-22李晓辉王亚君张国利张剑白
李晓辉,王亚君,张国利,张剑白
(哈尔滨医科大学附属第一医院儿科,哈尔滨 150001)
芪苈强心胶囊改善柔红霉素心脏毒性的体外实验
李晓辉,王亚君,张国利,张剑白
(哈尔滨医科大学附属第一医院儿科,哈尔滨 150001)
目的 探讨芪苈强心对柔红霉素心脏毒性的预防和治疗作用研究。方法 收集32只体外分离培养乳鼠心肌细胞,显微镜下观察心肌细胞形态学变化,凋亡试剂盒检测心肌细胞凋亡率;TUNEL法检测细胞凋亡率,采用蛋白免疫印迹(Western blot)法检测乳酸脱氢酶(LDH)、α-羟丁酸脱氢酶(HBDH)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、超氧化物歧化酶(SOD)、丙二醛(MDA)等蛋白的表达;采用电化学发光免疫分析法测定血清脑钠肽(BNP)。结果 芪苈强心的体外实验中4组研究对象的心肌细胞凋亡率存在明显差异(P<0.05);4组研究对象的LDH、HBDH、CK、CK-MB、SOD、MDA存在明显差异(P<0.05);芪苈强心对DNR心脏毒性预防作用中4组研究对象的心肌和血清中LDH、HBDH、CK、CK-MB、SOD、MDA存在明显差异(P<0.05);芪苈强心对DNR心脏毒性治疗中的3组研究对象的LVESD、LVEDD、LVEF、FS存在明显差异(P<0.05);且3组研究对象的BNP存在明显差异(P<0.05)。结论 芪苈强心可以有效的预防和治疗柔红霉素心脏毒性,对儿童急性淋巴细胞白血病的辅助治疗起到重要作用。
芪苈强心;红霉素;心脏毒性;细胞凋亡率;血清脑钠肽
急性白血病是造血系统的恶性疾病,在我国小儿恶性肿瘤中以白血病的发病率最高[1]。柔红霉素(DNR)、阿霉素等蒽环类抗肿瘤药物被广泛的应用于儿童白血病的治疗,对于改善儿童白血病病情起到重要的作用[2],但易诱发心脏毒性导致心肌功能损伤[3]。本研究分析芪苈强心对DNR诱导心肌损伤的保护和治疗作用。以期进一步证实芪苈强心具有预防和治疗DNR心脏毒性、保护心肌的作用,进一步为芪苈强心应用于白血病的辅助治疗提供实验依据。
1 材料与方法
1.1 材料 选取雄性大鼠80只,体质量(201.2±18.9) g,购于第三军医大学实验动物中心。DMEM培养液(广州市左克生物技术有限公司提供);胎牛血清(赛业生物科技集团提供);Ⅱ型胶原酶(上海玉博生物科技有限公司提供);胰蛋白及酶基质胶与Mdivi-1(美国Sigma公司);LDH、HBDH、CK、CK-MB、SOD、MDA、BNP试剂盒(上海玉博生物科技有限公司提供);芪苈强心、柔红霉素购于杭州海瑞化工有限公司。
1.2 方法
1.2.1 心肌细胞的分离培养 取1~3 d SD大鼠,消毒皮肤,取出心脏,PBS液清洁2次后剪成1 mm3大小的组织块,加胰酶反复消化5次,加入含5%胎牛血清的DMEM培养基中,制成细胞悬液,按细胞常规培养方法,心肌细胞在含20%胎牛血清的DMEM培养液中于37 ℃、体积分数5% CO2的饱和湿度条件下培养[4]。
1.2.2 芪苈强心的体外实验 取处于对数生长期的心肌细胞分别加入4个培养瓶中,每瓶各10 mL,调整细胞浓度为2×105/mL,实验分4组:空白对照组、DNR组、芪苈强心干预组(DNR+芪苈强心),芪苈强心对照组,其中对照组为心肌细胞中加入2 mL无血清培养液。光镜下观察心肌细胞形态学变化。按试剂盒操作步骤进行细胞凋亡检测。1.2.3 SD大鼠的饲养和分组给药[5]选择8~10周,健康雄性SD 大鼠,分为4组,每组8只。对照组:经尾静脉注射生理盐水1.0 mL/kg,1次/3 d,共6次。柔红霉素组:经尾静脉注射柔红霉素2.0 mg/kg,1次/3 d,共6次。芪苈强心组:给予芪苈强心胶囊生药(1 g/kg。以0.9%氯化钠溶液溶为2.0 g/mL悬浊液)灌胃,1次/d,共18次。柔红霉素+芪苈强心组:给药同柔红霉素组和芪苈强心组。于柔红霉素注射前(第0天)及注射后第6、12、18天,即在柔红霉素累计0、4、8、12 mg/kg时,经眶静脉取血测定各实验组大鼠血浆心肌酶谱活性及MDA含量、SOD活性。
1.2.4 芪苈强心对DNR心脏毒性治疗研究 随机将16只SD大鼠造模[6]。造模的大鼠在2周内,分6 次对大鼠进行腹腔注射阿霉素215 mg/kg (阿霉素用0.9%氯化钠溶液溶解为2 mg/mL的溶液);正常对照组的大鼠进行腹腔注射同等剂量的0.9%氯化钠溶液。所有大鼠自末次注射后进行观察2周。将成模后的大鼠随机分为3组:心衰组、芪苈强心组、美托洛尔组。芪苈强心组每天给予芪苈强心胶囊生药(1 g/kg,以0.9%氯化钠溶液溶为2 g/mL悬浊液)进行灌胃;美托洛尔组以10 mg/kg(将药片碾碎用0.9%氯化钠溶液溶为2 mg/mL悬浊液)进行灌胃;心衰组和正常对照组以同等体积0.9%氯化钠溶液进行灌胃,持续时间为6 周。
1.3 评价指标
1.3.1 血清脑钠肽(BNP)的测定[7]按大鼠BNP ELISA 试剂盒说明书操作,测定BNP含量。
1.3.2 TUNEL法检测心肌微血管内皮细胞的细胞凋亡率[8]收集大鼠心肌活细胞,按照TUNEL试剂盒说明书进行操作,细胞凋亡率=TUNEL阳性细胞/总细胞数×100%。
1.3.3 蛋白免疫印迹(Western blot)法检测LDH、HBDH、CK、CK-MB、SOD、MDA等蛋白的表达[9]心肌微血管内皮细胞经过处理后,采用Bcl-2抗体,37 ℃孵育24 h,弃去培养液,用PBS冲洗3次,然后用蛋白裂解液使细胞裂解,冰上放置5 min后,收集细胞裂解液并煮沸25 min,用SDS-PAGE进行电泳,并将其转膜到硝酸纤维素(NC)膜上。对抗体孵育处理,经化学发光法曝光后观察结果。
1.3.4 心脏超声评价心功能 检测指标主要包括LVESD、LVEDD、LVEF和FS[10]。
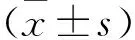
2 结果
2.1 芪苈强心的体外实验结果 见表1。
2.2 芪苈强心对DNR心脏毒性预防作用的结果 见表2。
2.3 芪苈强心对DNR心脏毒性治疗的结果 见表3。
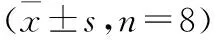
表1 4组心肌细胞凋亡率和LDH、HBDH、CK、CK-MB、SOD、MDA含量比较
注:与空白对照组比较,#P<0.05;与芪苈强心对照组比较,△P<0.05;与DNR组比较,▲P<0.05
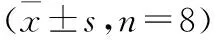
表2 4组心肌和血清中LDH、HBDH、CK、CK-MB、SOD、MDA含量比较
注:与空白对照组比较,# P<0.05;与柔红霉素组比较,△ P<0.05;与芪苈强心组比较,▲ P<0.05
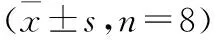
表3 3组LVESD、LVEDD、LVEF、FS和BNP比较
注:与心衰组比较,#P<0.05;与芪苈强心组比较,△P<0.05
3 小结
研究[11]表明,蒽环类药物对心肌细胞的毒性作用有直接和间接种形式,不仅可以抑制心肌细胞的氧化磷酸化,使机体心肌细胞发生变性、炎症渗出,严重者可引起心肌收缩力的减弱,从而发生心力衰竭等。芪苈强心胶囊可以通过协同或互补作用,起到强心、利尿及扩血管的作用[12]。广泛用于治疗冠心病、高血压所引起的心力衰竭。其作用机理可降低阿霉素诱导的心肌病的TNF2α水平,抑制炎性因子对心肌细胞的损伤作用,从而起到改善心功能的功效。本研究结果显示,芪苈强心可以有效预防和治疗柔红霉素心脏毒性,对儿童急性淋巴细胞白血病的辅助治疗起到重要作用。
[1]黄正,张小玲,章超慧,等.芪苈强心胶囊治疗慢性心力衰竭对心室重构的抑制作用[J].安徽医药,2014,18(10):1961-1963.
[2]SEICEAN S,SEICEAN A,ALAN N,et al.Gardioprotective effect of be ta-adrenoceptor blockade in patients with breast cancer undergo ing chemotherapy:follow-up study of heart failure[J].Girc Heart Fail,2013,6(3):420-426.
[3]KAYA M G,OZKAN M,GUNEBAKMAZ O,et al.Protective effects of nebivolol against anthracycline-induced cardiomyopathy:a randomized control study[J].International Journal of Cardiology,2013,167(5):2306-2310.
[4]肖芳芳,胡锴勋,郭梅,等.初诊急性白血病凝血指标异常及其临床意义探讨[J].中国实验血液学杂志,2013,21(2):300-304.
[5]AL-BILTAGI M,AHD R O,EL-SHANSHORY M R,et al.Strain echocardiography in early detection of Doxoruhicin induced left ventricular dysfunotion in children with acute lymphoblasticlcukcmia[J].ISRN Pcdiatr,2012(1):870549.
[6]侯翠,丁粤粤,王辉,等.二维斑点追踪成像技术评价急性淋巴细胞白血病患儿柔红霉素化疗后左心功能的价值[J].临床超声医学杂志,2016,18(1):25-28.
[7]吴志敏,阮林海,杨海萍,等.血清NT-pro-BNP水平评价柔红霉素心脏毒性的临床价值探讨[J].山东医药,2013,53(22):42-43.
[8]刘凯奇,魏辉,王慧君,等.高三尖杉酯碱与柔红霉素在急性白血病治疗中对心脏毒性的影响[J].实用临床医药杂志,2012,16(3):10-12,17.
[9]彭森,张克平,薛洁,等.芹菜素降低柔红霉素对小鼠心脏毒性的研究[J].华西药学杂志,2015,30(2):196-198.
[10]陈锐,邱少东,陈菲,等.超声心动图评价右丙亚胺对柔红霉素化疗所致心脏毒性的防治作用[J].实用医学杂志,2012,28(24):4156-4158.
[11]中国临床肿瘤学会,中华医学会血液学分会.蒽环类药物心脏毒性防治指南(2013年版)[J].临床肿瘤学杂志,2013,18(10):925-934.
[12]孔婧,陈婷,王爽,等.活血通络清脑饮对老年短暂性脑缺血发作患者脑血流动力及纤维蛋白原的影响[J].长春中医药大学学报,2016,32(2):335-336.
Preventive and therapeutic effect of Qiliqiangxin on daunorubicin cardiotoxicity
LI Xiaohui,WANG Yajun,ZHANG Guoli,ZHANG Jianbai
(Department of Paediatrics,The First Affiliated Hospital of Harbin Medical University,Harbin 150001,China)
Objective To study the preventive and therapeutic effect of Qiliqiangxin on daunorubicin cardiotoxicity.Methods Collected 32 cultured myocardial cells of neonatal rats,the morphological changes of myocardial cells were observed under microscope,TUNEL method to detect apoptosis rate,the protein immunoblot (Western blot) assay for the detection of LDH,HBDH,CK,CK-MB,SOD and MDA protein expression;by electrochemiluminescence immunoassay method for the determination of serum brain natriuretic peptide (BNP).Results Qili Qiangxin in vitro experiments in four groups of myocardial cell apoptosis rate had significant difference (P< 0.05);four groups of LDH,HBDH CK,CK-MB,SOD,MDA had obvious difference (P<0.05);Qili Qiangxin to DNR cardiac toxicity prevention role in 4 groups of research object of myocardium and serum LDH,HBDH,CK,CK-MB,SOD,MDA had significant difference (P<0.05);Qili Qiangxin to DNR cardiac toxicity in the treatment of 3 groups of LVESD and LVEDD,LVEF,FS had obvious difference (P<0.05);and group 3 research object of BNP had obvious difference (P<0.05).Conclusion Qiliqiangxin is effective for prevention and treatment of soft erythromycin cardiac toxicity,adjuvant therapy for children with acute lymphoblastic leukemia (all) will play a important role.
Qiliqiangxin;erythromycin;cardiac toxicity;apoptosis rate;serum brain natriuretic peptide
10.13463/j.cnki.cczyy.2016.06.006
黑龙江省中医药科研项目“芪苈强心对柔红霉素心脏毒性的预防和治疗作用研究”(ZHY12-Z147)。
李晓辉(1969-),女,硕士,主治医师,主要从事小儿血液系统疾病研究。
R285.5
A
2095-6258(2016)06-1116-03
2016-06-08)
