C2S前导物对C0.3S形成及活化能的影响
2016-12-22管宗甫
管宗甫
(郑州升达经贸管理学院,郑州 451191)
C2S前导物对C0.3S形成及活化能的影响
管宗甫
(郑州升达经贸管理学院,郑州 451191)
用工业原料在不同温度预合成C2S(2CaOSiO2)为主要矿物的前导物,并以该前导物为基础,补入适量的钙,在不同温度下二次烧成水泥熟料。结果显示:采用1250 ℃、1300 ℃和1350 ℃预合成的C2S前导物配料二次烧方法,有利于熟料在低温下烧成,在1350 ℃左右实验熟料样品中游离氧化钙即可小于1.0%。相应C3S在熟料体系中的表观形成活化能相比不同配料烧成的对比组明显降低,而不同温度制备的前导物配料,C3S在熟料体系中的形成活化能相差无几。
C2S前导物; 二次烧成; 水泥熟料; 硅酸三钙; 活化能
1 引 言
硅酸三钙(3CaOSiO2,简记为C3S )是主要的水泥熟料矿物,它的性质在很大程度上决定了熟料的性质。如何在熟料体系中快速形成高水化活性的C3S ,一直是水泥熟料研究的重点。有关C3S 形成动力学的研究主要集中在上个世纪六、七十年代,Taylor[1]将其形成过程归纳为3个基本过程。(1)C2S和熔体形成;(2)C2S继续形成,并出现一些表面覆盖着一薄层C3S 的孤立石灰晶粒群,分布在溶解有C2S的熔体中; (3)这些石灰晶粒群与周围的C2S反应形成阿里特,其机理是基于氧化钙通过液相的扩散。其关键是在C3S 薄层包裹的石灰晶粒群之间的Ca2+的扩散。也就是说,C3S 是通过C2S+CaO反应形成的,包括3个基本过程:(1)C2S形成;(2)在液相存在条件下,CaO和/或C2S溶解进入液相;(3) CaO和/或C2S扩散,相互反应形成C3S 并结晶[2]。
无论是反应物在液相中的溶解还是扩散,液相都是提高C3S 形成速率并可人工干预的因素。熟料中的微量元素和烧成矿化剂技术促进熟料烧成,除了形成过渡相的矿化机理外,增加液相量、改善液相性质也是很重要的机理[3]。龚方田[4]等则认为C3S 的结晶过程是形成过程的关键过程,提出了在水泥生料中掺加熟料提高窑产量的晶种理论和技术。
考察助熔剂、矿化剂和晶种理论技术可以看出,所有研究都是针对C3S 形成3个基本过程的后两个环节开展研究的,或者说都是针对反应C2S+CaO→C3S 方程式开展的,也就是说,反应基于C2S和CaO作为起始物。这实际上是建立在反应物C2S和CaO的浓度足以满足反应需要这么一个假设前提之下的,也就是C2S和CaO必须是足量的。哪么,这个前提在工业条件下总是存在吗?虽然从开始形成温度顺序来看,C3S 的形成在C2S之后,但没有证据显示C2S的形成速率可以保证为C3S 的形成提供足够的C2S浓度,以保持C3S 较高的形成速率。它们的形成在温度区间上有重合,C2S在很大的烧成温度范围伴随着C3S 共同形成。因此,C2S的形成对C3S 的形成有重要影响,并有可能是控制因素,关于这方面的研究尚未见诸报道,有必要深入研究。
2 实 验
2.1 原材料
研究思路是在最终配料成分相同的情况下,对比研究采用C2S前导物配料对C3S 在熟料体系中形成动力学的影响。样品制备采用工业原料石灰石、砂岩作为石灰质和粘土质物料,铁质和铝制校正料物料采用化学试剂Fe2O3和Al2O3。石灰石和砂岩的化学成分见表1。所有原材料在玛瑙研钵中粉磨至全部通过0.080 mm筛备用。

表1 石灰石和粘土的化学成分Tab.1 Chemical compositions of raw materials /wt%
2.2 C2S前导物的制备
按照样品中硅酸盐矿物全部是C2S的熟料来配制C2S前导物。其配料率值和计算矿物组成见表2。

表2 前导物的配料率值和计算矿物组成Tab. 2 Modulus and calculated mineral compositions of C2S precursor /wt%
按照配方配料、混匀、加水压片、烘干。分别在1250 ℃、1300 ℃、1350 ℃烧成60 min,出炉风冷,并粉磨通过80 μm筛备用。前导物经XRD检验和岩相分析,其矿相为C2S和中间相,以代号P1、P2、P3代表三个温度下烧成的前导物。分别用这三种前导物配料烧制的熟料样品相应用1、2、3在样品组字母后标注。前导物的XRD图谱见图1。
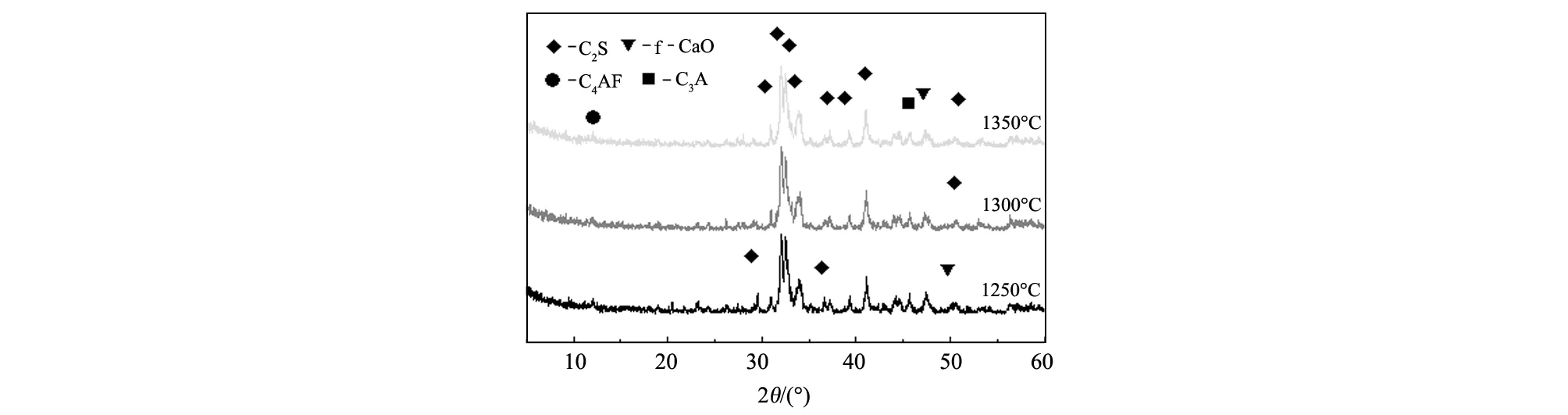
图1 不同温度下煅烧的C2S前导物的XRD图谱Fig. 1 XRD patterns of C2S precursors burned at different temperatures
2.3 熟料的合成
以前导物为基础,采用石灰石、砂岩、Fe2O3和Al2O3试剂进行生料配料。设计A、B、C三组不同KH,相同SM和IM的熟料配比。生料配料见表3。其中样品号没有数字下标的A、B、C为用原料直接配料的对比组,带有数字下标的各试样为采用不同温度烧成C2S前导物配料的实验样品。
准确称取原料按表3配料,加无水乙醇拌匀,压制成料片。烘干后,分别硅钼棒电炉中于1250 ℃、1300 ℃、1350 ℃、1400 ℃、1450 ℃和1500 ℃烧成30 min,风冷。
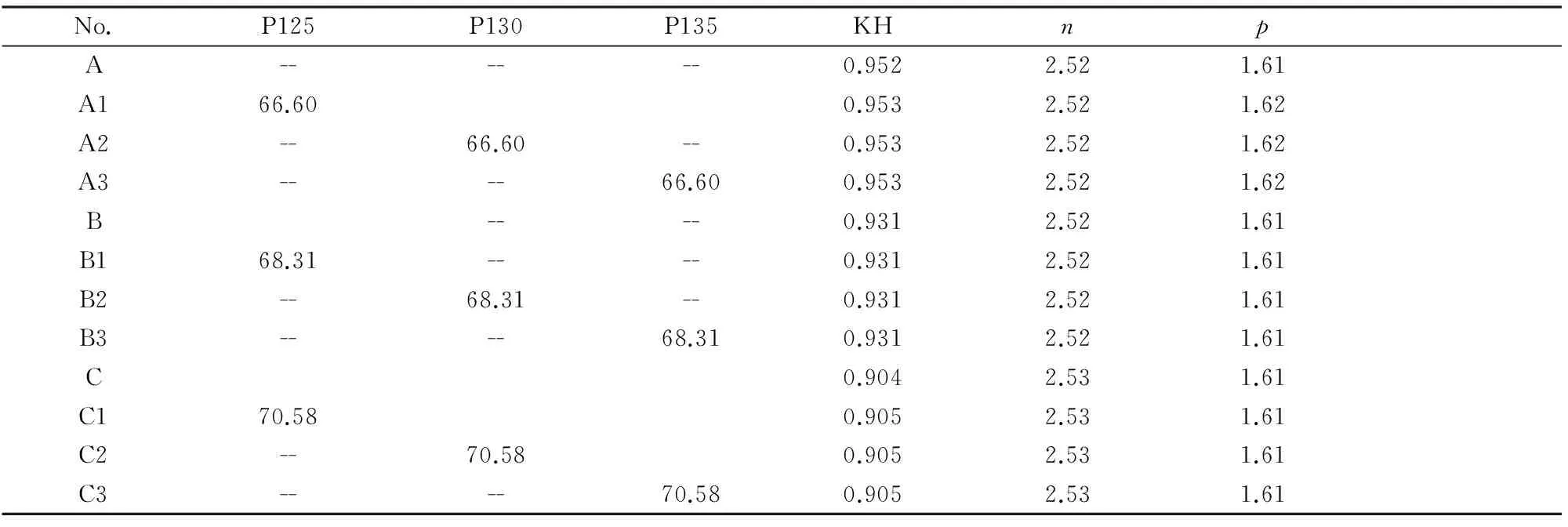
表3 生料中C2S前导物配比和熟料率值Tab. 3 Proportions of C2S precursors in raw meals and modulus of clinkers /wt%
用乙二醇酒精快速法分析样品中f-CaO,反光显微镜观察熟料岩相结构,XRD分析熟料矿物组成。
2.4 活化能计算方法
一般采用烧成后残余的f-CaO标志熟料烧成情况,用式(1)表示CaO化合生成熟料的转化率。
(1)
式(1)只是表达了CaO转化为熟料的转化率,对于不同的配料率值,由于中间相的不同含量,SiO2吸收CaO的反应负担是不同的。式(1)并不能准确评判不同配料条件下C3S 形成的动力学差异。而采用C3S 单矿物来研究其形成动力学,则无法反应其在熟料体系中的形成动力学过程。一般而言,在熟料烧成温度下,中间相总是可以反应完全形成的。为了单纯计算C3S 在熟料体系中的转化率,避免不同配料方案其他熟料矿物形成对C3S 形成转化率的影响,我们提出如式(2)参与C2S反应生成C3S 的那部分CaO的转化率公式:
(2)
由于采用C2S前导物配料组的C2S和C3A、C4AF在前导物中已经形成完毕。转化率计算公式为:
(3)
其中:CaOΣ是配料的总CaO, CaOⅡ是二次配入CaO在熟料中的百分含量; 其他是下标对应矿物形成吸收的CaO量,其中将C4AF按照C3A+CF计算;f-CaO是熟料中的游离氧化钙测试结果。式(2)、(3)分别应用于一次配料烧成及C2S前导物二次烧成的转化率计算。
根据f-CaO分析结果和式(2)、(3)计算的转化率,按照文献[5]介绍的方法联立金斯特林格方程和Arrhenius方程计算C3S 在熟料体系中的形成活化能。
3 结果与讨论
3.1 C2S前导物对熟料烧成的影响
熟料样品的烧成情况见图2。
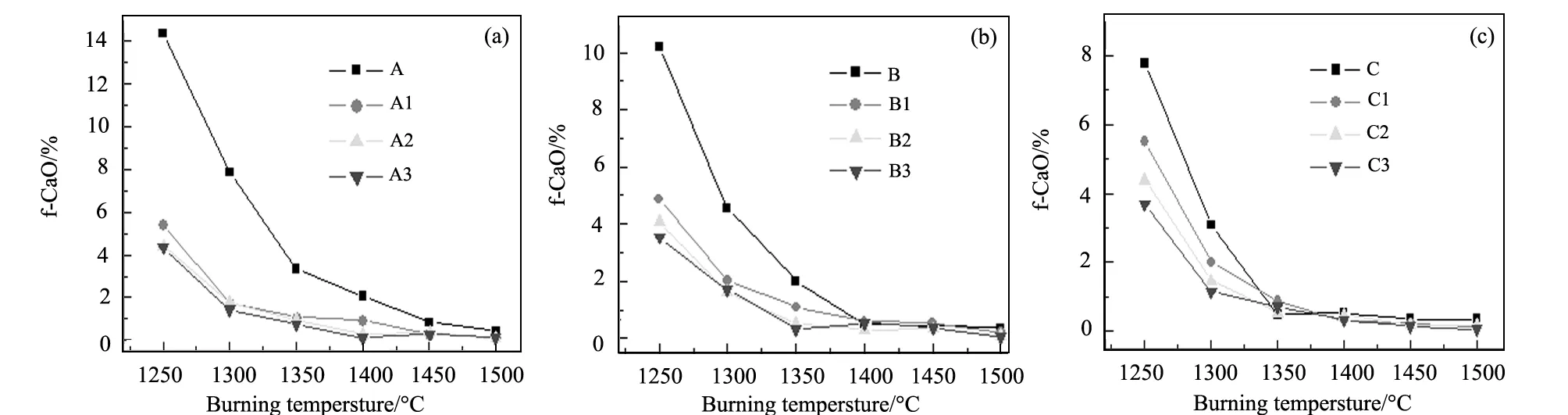
图2 样品的f-CaO含量(a)A group;(b)B group;(c)C groupFig.2 Free CaO in samples
从图2可以看出,所有掺加C2S前导物的试样f-CaO都低于对比试样。在1350 ℃以上温度,熟料中f-CaO已小于1%,熟料已经烧成。表明C2S前导物配料可以改善生料的易烧性,有利于熟料在低温下烧成。高温合成的C2S前导物更有利于C3S 在低温下形成,从图2可以看出,采用高温合成C2S前导物配料,在相同烧成温度下熟料中f-CaO更低,但1350 ℃以上各同温度合成C2S前导物配料烧成的熟料中f-CaO差别不大。
水泥熟料XRD图谱见图3,熟料岩相分析见图4。
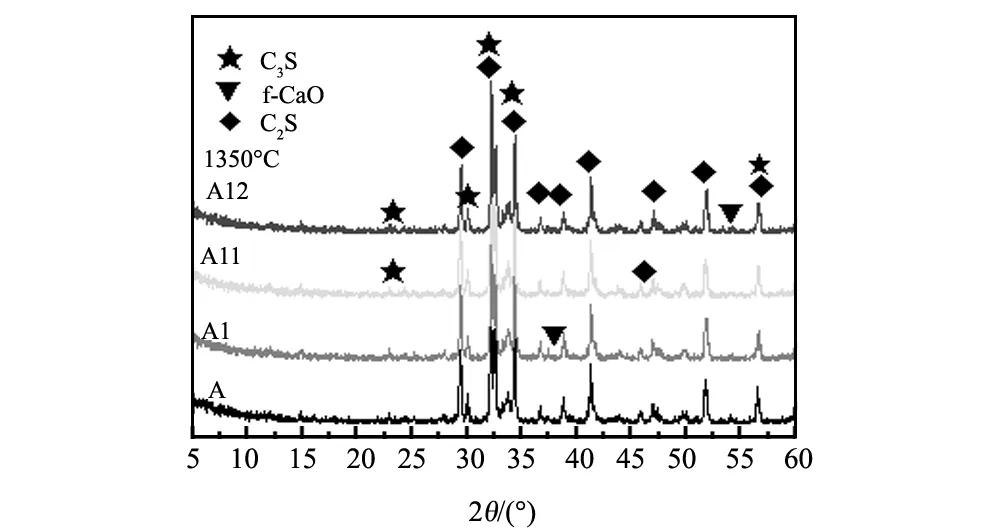
图3 1350 ℃下煅烧A组熟料的XRD图谱Fig.1 X-ray diffraction pattern of sample A group burned at 1350 ℃
从XRD分析可看出,在1350 ℃,各组熟料样品都呈现出C3S 和C2S重叠衍射峰,f-CaO衍射峰都很低,说明C3S 开始形成,只是量的多少和结晶程度不同。从岩相照片可看出,图4a所示普通配料的样品A1,视域中主要是beilite,很难看到典型的alite结晶。对于采用C2S前导物配料的A1、A11和A12组样品,如图4b~d所示,则都可以看到典型的alite晶体,并且随着C2S前导物合成温度的提高,相同温度煅烧的熟料样品中,alite结晶发育更为完整,边沿整齐,包裹物更少。说明C2S前导物有利于C3S 形成,充足数量的C2S和发育良好的C2S晶体,更有利于促进C3S 的生成反应。

图4 A组熟料的岩相结构(a)A 1350 ℃;(b)A1 1350 ℃;(c)A11 1350 ℃;(d)A12 1350 ℃Fig.4 Optical reflection image of sample A group burned at 1350 ℃
3.2 活化能
根据各组方案的试验结果按照上述步骤分别进行C3S 在熟料体系中生成活化能计算,结果见图5。
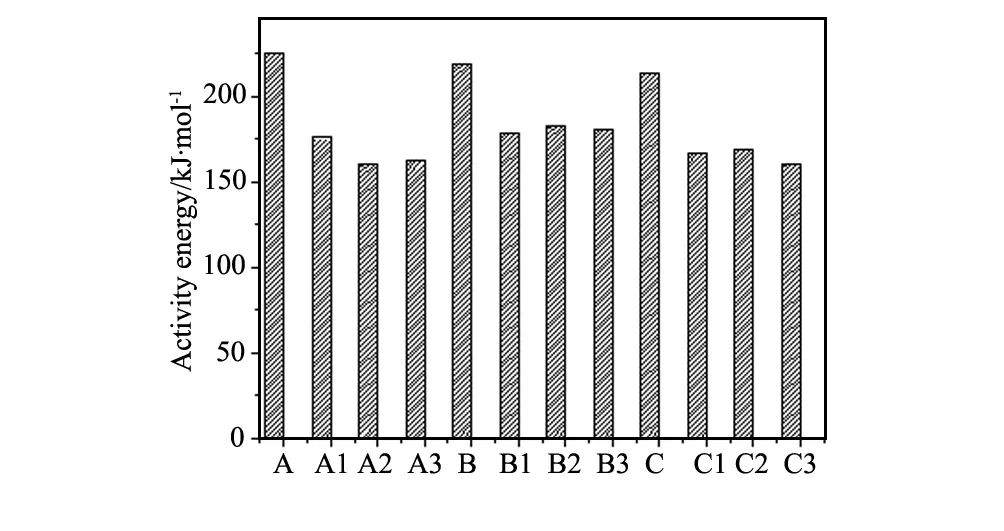
图5 C3S 在熟料体系中生成活化能计算结果Fig.5 Calculated formation activity energy of C3S in clinker
从图5可以看出,在相同的配料率值相,用前导物配料,C3S 在熟料中的形成活化能低于对比组。C3S 形成的化学过程可以分成两个阶段:首先是SiO2和CaO通过固相反应生成C2S,其后是在更高温度下,C2S在有液相存在的条件下吸收CaO形成C3S。通常的熟料烧成过程中,C2S和C3S 的形成温度区间有部分重合。在这个温度区间,C2S吸收CaO形成C3S 的消耗速率较高,新形成的C2S可能不能满足其消耗速率,则C3S 的形成由于C2S不足受到制约。也就是说,C2S的生成可能控制着是C3S 生成反应速率。采用C2S前导物配料,由于烧成体系中的SiO2已经全部提前形成C2S。也就是说,形成C3S 所需的反应物之一C2S是足够的,C2S的生成反应由于提前进行而不再是C3S 生成控制反应,而是C2S吸收CaO生成C3S 反应阶段的物理化学过程之一,在不同的实验条件下可以是CaO的溶解或CaO通过液相的扩散[1],而这个过程的活化能可能较低。
实验数据也表明,采用不同温度制备的前导物配料,C3S 在熟料体系中的形成活化能相差无几。说明在试验温度范围内制备的C2S前导物,其吸收CaO生成C3S 的反应活性差别不大。
4 结 论
(1)采用C2S前导物二次烧成方法,可以降低C3S 在熟料体系中的形成表观活化能。1250 ℃、1300 ℃、1350 ℃三个不同温度制备的C2S前导物配料,C3S 在熟料体系中的形成活化能相差无几;
(2)采用C2S前导物配料在实验室二次烧成,在1350 ℃左右熟料样品中游离氧化钙小于1.0%,生料的易烧性得到明显改善。
[1] Taylar H W.Cement Chemistry[M].London:2nd edition,Thomas Telford,1997:74-75.
[2] Ghosh S N.Advances in cement technology (In Chinese)[M].London:Pergamon Press Ltd,1983:67-70.
[3] 沈 威,黄文熙,闵盘荣.水泥工艺学[M].武汉:武汉工业大学出版社,1991:73-81.
[4] 龚方田,刘长发,莫 艳,等.添加晶种对硅酸盐水泥熟料形成过程的影响[J].硅酸盐学报,1996,24(4):365-372.
[5] Kingery W D,Bowen H K,Uhlmann D R.Introduction to Ceramics(2nd edition,in Chinese)[M].New York:John Wiley & Sons Inc,1976:217-258.
Effect of C2S-Precursor on Forming and Activity Energy of C3S
GUANZong-fu
(Shengda Economic Trade and Management College,Zhengzhou 451191,China)
The C2S-precursors, which primary mineral was C2S (2CaOSiO2), was prepared using industrial materials at different temperatures of 1250 ℃、1300 ℃和1350 ℃. Added amount of calcium oxide in the C2S-precursors, the clinkers were two-feeding burned experimentally at different temperatures. The results illustrate that: With to two-feeding burn cement clinkers, the burn-ability of the raw meals were improved, the burning temperatures of the clinkers were decreased, Free CaOs in the clinker samples were less than 1.0% at 1350 ℃. And the formation activity energy of C3S in clinkers was reduced. The C2S-precursors prepared at different temperatures were almost similar effect on the formation activity energy of C3S .
C2S Precursor;two-feeding burning;cement clinker;alite;activation energy
绿色建筑材料国家重点实验室开放基金项目(YA-475);升达经贸管理学院人才基金
管宗甫(1956-),男,博士,教授.主要从事水泥材料和固废利用的研究.
TQ172.11
A
1001-1625(2016)10-3167-05
