磨玻璃样密度肺腺癌脏层胸膜浸润的相关影像因素分析
2016-12-22丁红豆史景云陈林松王海峰
丁红豆,史景云,周 晓,谢 冬,陈林松,王海峰
1.同济大学附属上海市肺科医院胸外科,上海 200433;2.同济大学附属上海市肺科医院影像科,上海 200433
磨玻璃样密度肺腺癌脏层胸膜浸润的相关影像因素分析
丁红豆1,史景云2,周 晓1,谢 冬1,陈林松1,王海峰1
1.同济大学附属上海市肺科医院胸外科,上海 200433;2.同济大学附属上海市肺科医院影像科,上海 200433
目的 分析磨玻璃密度(ground glass opacity,GGO)肺腺癌CT特征与脏层胸膜浸润的关系。方法 选择2013年9月—2014年10月接受手术治疗且术后病理证实为腺癌的740例肺部GGO,其中脏层胸膜浸润组84例,无浸润组656例,分析其与CT特征之间的关系。结果 患者年龄、GGO类型、GGO最大直径、实性成分直径、实性成分比例、距胸膜最小距离、胸膜凹陷征、边缘和形状均与脏层胸膜浸润情况有关,多因素logistic回归分析显示GGO最大直径>12mm、实性成分直径>5mm、距胸膜最小距离<6mm、胸膜凹陷征和粗糙边缘是脏层胸膜浸润的危险因素(OR=3.23、4.41、3.58、2.21和2.65),联合以上5个因素判别浸润情况的曲线下面积(area under curve,AUC)达到0.861。结论 术前CT特征用于判别表现为GGO的肺腺癌的脏层胸膜浸润情况有重要价值。
磨玻璃密度;CT;脏层胸膜浸润
随着高分辨率CT的使用及早期筛查的普及,肺部磨玻璃样密度(ground glassopacity,GGO)病灶的发现大大增加[1]。肺部磨玻璃样密度定义为高分辨率 CT(high resolution computed tomography,HRCT)上较正常肺组织密度增高,但仍能辨识出其中的支气管和血管结构的病灶影[2],其病理类别多为早期腺癌,手术完全切除病灶后预后较好[3]。脏层胸膜浸润(visceral pleural invasion,VPI)是肺癌TNM分期和手术治疗预后的重要依据之一,肿瘤累及脏层胸膜时分期由T1期升级为T2期,经手术治疗的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者无胸膜浸润者其5年生存率达86%,而有胸膜浸润者仅为62%~70%[4]。通过术前CT特征判断病理胸膜浸润情况,有助于对病情的准确判断及手术方案的制定。本研究回顾性分析了740例GGO病灶的临床资料及HRCT特征与脏层胸膜浸润的关系,从而为术前判断胸膜浸润情况提供指导。
1 材料与方法
1.1一般资料
回顾同济大学附属肺科医院2013年9月—2014年10月接受手术治疗的3 783例病例,筛选出其中符合条件者:①术后病理诊断为“肺腺癌”;②表现为磨玻璃样密度,可为单纯性或亚实性结节;③最大直径小于3 cm;④排除未在术前1个月内于本院行HRCT检查者;⑤排除合并实性结节者。
1.2CT检查及评估
采用德国西门子CT机扫描,层厚1mm,电压15 120 kVp,电流300m A。由2~3名具有5年以上胸部疾病影像经验、预先未被告知病理诊断结果的医师评价CT扫描图像的以下参数:①GGO类型,即单纯型GGO或亚实性GGO;②病灶横断面最大直径;③若为亚实性病灶,测量实性成分横断面最大直径;④病灶累及主支气管、肺叶或肺段支气管,或临近肺门,为中央型,否则为周围型;⑤距胸膜最小距离;⑥胸膜凹陷征;⑦边缘光滑或粗糙;⑧形状圆形、类圆形,或者不规则形。对于亚实性病灶,实性成分比例为实性成分最大直径除以病灶最大直径所得到的值。
1.3脏层胸膜浸润病理诊断方法
病理切片镜下明显有胸膜浸润可直接诊断,临近胸膜未见明显浸润迹象的切片以弹性纤维特染确定。
1.4统计学分析
数据采用SPSS 19.0以及MedCalc 11.4.2.0软件分析,P<0.05为差异有统计学意义。相关性分析采用χ2检验、单样本独立t检验,其中P<0.05的因素进入单因素logistic回归分析。绘制受试者工作特征曲线(receiver operating characteristi,ROC),计算曲线下面积(area under curve,AUC)评价各因素诊断价值。危险因素分析中病灶最大直径、实性成分最大直径和实性成分比例临界值均通过诊断性临界值得出,距胸膜最小距离临界值取中位数(因多数病灶紧贴胸膜,得到的最优临界点过小不宜使用)。
2 结果
2.1患者一般特征及病灶CT特征与脏层胸膜浸润相关性分析
如表1所示,单纯型GGO 372例,亚实性GGO 368例,共740例。脏层胸膜浸润组84例,占比11.4%,无脏层胸膜浸润组656例,两组平均年龄分别为59.7和55.2岁(P<0.001)。无脏层胸膜浸润组亚实性GGO 300例(45.7%),浸润组为68例(81.0%);两组平均最大直径分别为12.7和18.8mm,平均实性直径分别为2.9和7.9mm,实性成分所占比例分别为19.4%和40.1%,脏层胸膜浸润组均大于无浸润组,且差异均有统计学意义。相比于无脏层胸膜浸润组,浸润组GGO与胸膜距离更小(3.9mm对9.5mm),其中有58.3%(49/84)的GGO紧贴胸膜;该组胸膜凹陷征病灶占比更高(76.2%对25.6%),更多表现为粗糙边缘及不规则形状。相关性分析显示,性别、GGO位置与脏层胸膜浸润的相关性不显著(P=0.166、0.623)。
2.2脏层胸膜浸润相关危险因素的单因素、多因素logistic回归分析
GGO病灶CT最大直径、实性直径和实性比例所得最优临界点分别为12mm、5mm和42%,以上3个参数以其值大于相应临界点为危险因素。距胸膜最小距离中位数为6mm,以距胸膜最小距离<6mm为脏层胸膜浸润危险因素。各危险因素单因素分析OR值如表2所示,多因素分析后保留在回归方程中的因素有5个,即最大直径>12mm、实性直径>5mm、距胸膜最小距离<6mm、胸膜凹陷征和粗糙边缘,其OR值分别为3.23、4.41、3.58、2.21和2.65。GGO类型、实性成分比例未纳入方程(P= 0.188、0.229,见表2)。
2.3多因素分析模型预测脏层胸膜浸润
最大直径、距胸膜最小距离、实性直径、胸膜凹陷征和病灶边缘为用于预测GGO脏层胸膜浸润的曲线下面积分别为0.786、0.769、0.706、0.753和0.697,其中GGO最大直径诊断价值最高,病灶边缘诊断价值最低。联合应用以上5项指标的多因素回归模型预测脏层胸膜浸润情况时,曲线下面积达到0.861,高于任一单一项预测价值(图1)。
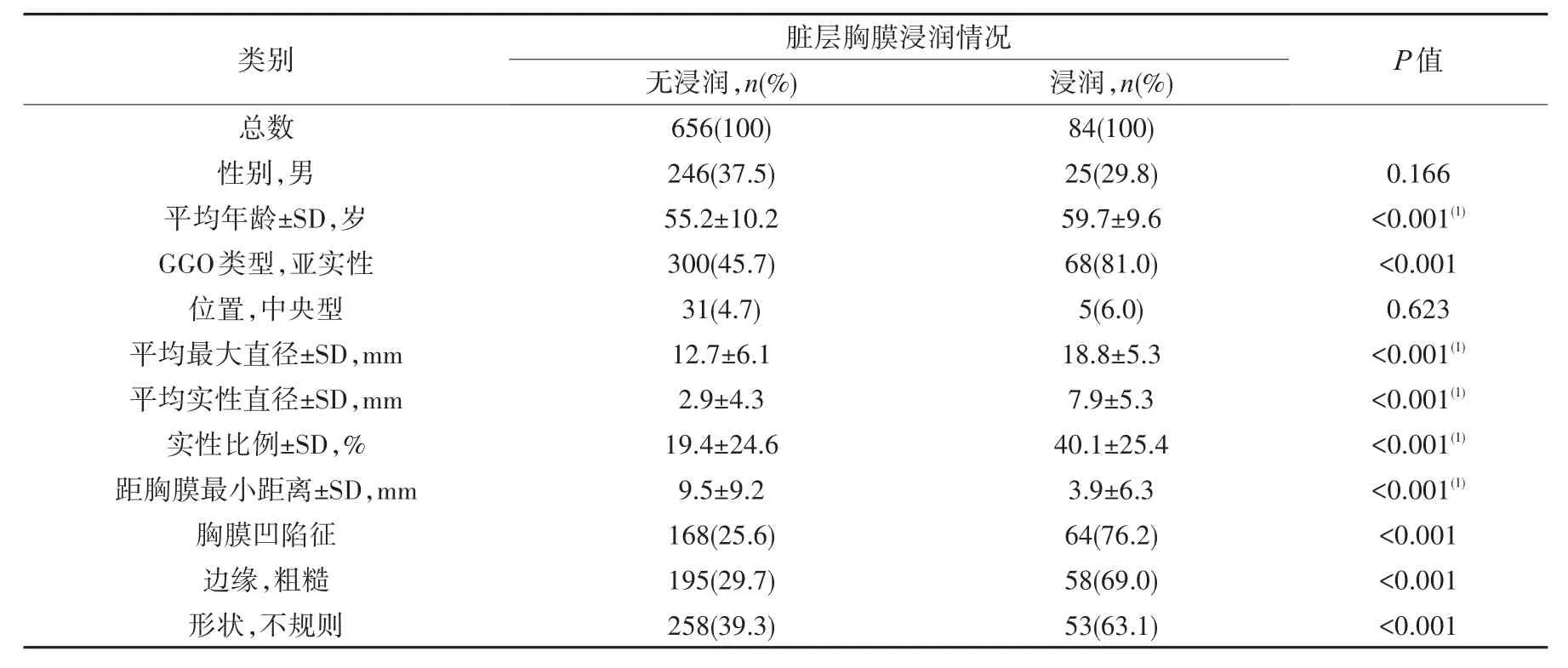
表1 740例GGO患者一般特征及病灶CT特征与脏层胸膜浸润相关性分析Tab.1 Correlation of demographicsand CT characteristicsand visceralp leural invasion of 740 casesof GGOs
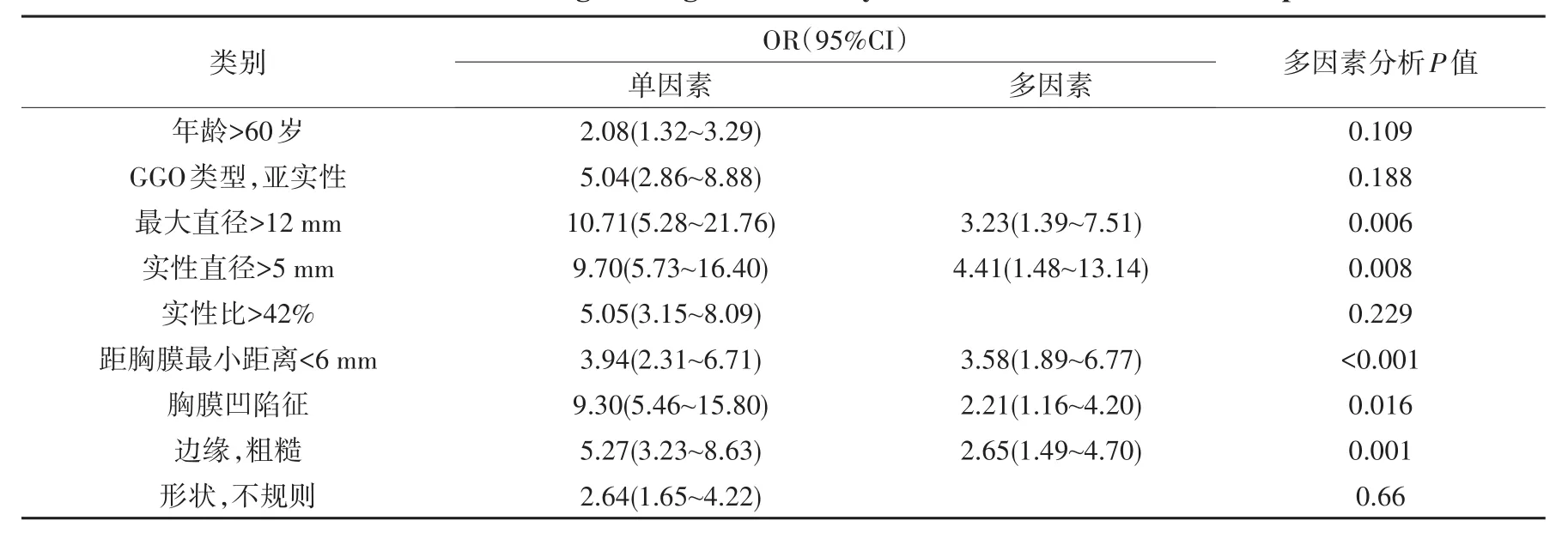
表2 脏层胸膜浸润相关危险因素的单因素、多因素logistic回归分析Tab.2 Univariate and m u ltivariate logistic regression analysisof risk factors for visceral p leural invasion

图1 分别以最大直径、距胸膜最小距离、实性直径、胸膜凹陷征、粗糙边缘和多因素回归模型为变量作ROC曲线诊断脏层胸膜浸润Fig.1 ROC curvesw ithm u ltivariate regressionm odel,the maxim um whole diameter,the diameter of consolidation,them inimum distance from lesions to p leura,p leural retraction and nonsm oothm argin as variates in diagnosisof visceralp leural invasion
3 讨论
2011年修订的第七版肺癌TNM分期中规定出现脏层胸膜浸润的T1期肺癌应升级为T2期,并依据脏层胸膜浸润程度将其分为3级:肿瘤位于胸膜下肺实质内,或仅侵犯胸膜表面结缔组织而未至弹力层,PL0;侵犯并超过脏层胸膜弹力层,PL1;侵犯脏层胸膜表面,PL2[5]。脏层胸膜浸润对非小细胞肺癌患者预后的影响存在争议[6-7],而2015年Huang等[8]纳入22个研究的Meta分析显示,脏层胸膜浸润与I期非小细胞肺癌术后死亡及复发有关,在肿瘤大小亚组分析中均与死亡有关,而在3 cm以下的肿瘤中与术后复发有关。国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)最新出版的第八版TNM分期建议肯定了脏层胸膜浸润对肺癌预后的负面影响,数据分析进一步认为预后随胸膜浸润程度增加而下降,PL0预后差于PL1、PL2,PL2差于PL1;脏层胸膜浸润对3 cm以下肿瘤的预后指示作用尤其重要[9]。近年来随着HRCT的应用及肺部肿瘤筛查的普及,肺部GGO诊断数量大量增加,通过术前CT特征探究GGO与脏层胸膜浸润之间的关联性有重要意义。
目前大多数研究认为GGO最大直径、实性成分直径与其侵袭性有关。李西等[10]认为纯GGO直径大于>10mm应考虑有侵袭性,而实性部分直径大于5mm的GGO往往倾向于浸润性腺癌的诊断[11-12]。M asahiro等[13]研究发现,GGO实性成分体积比例大于63%与脏层胸膜浸润高度相关,Tsutani 等[14]进一步表明GGO实性成分直径可预测胸膜浸润情况。本研究显示GGO最大直径、实性直径及实性比例均与胸膜浸润有关,与Tanaka等[15]的结果相一致,进行多因素分析后最大直径、实性直径仍与之相关联。
胸膜凹陷征是肺内小叶间隔增厚所导致的从肺部肿瘤表面延伸至胸膜表面的一条或多条线状影,其与肺部病灶良恶性的相关性尚有争议[16]。Zw irew ich等[17]及Harders等[18]的研究均发现肺部恶性肿瘤中胸膜凹陷征出现率为58%,后者更认为该征象与恶性疾病显著相关。Hung等[6]尝试用胸膜凹陷征预测远离胸膜的肺部肿瘤脏层胸膜的浸润情况,发现无胸膜凹陷征的病灶均无胸膜浸润,两者存在紧密联系。本研究中31.4%(232/740)的GGO出现胸膜凹陷征,低于以上数据,这可能与GGO浸润性更低有关;76.2%的胸膜浸润GGO存在胸膜凹陷征,远高于无浸润组(25.6%)。
肿瘤的浸润过程随时间延长而发展,病灶与胸膜距离越大,胸膜浸润的可能性越低。本研究中无浸润组GGO与胸膜的距离(9.5mm)明显大于浸润组(3.9mm),且浸润组中58.3%的GGO紧贴胸膜,有研究进一步认为贴近胸膜的肿瘤脏层胸膜浸润情况与其和胸膜接触长度、形成角度(锐角/钝角)等因素有关[15,19]。肺部结节边缘粗糙与其浸润性高度相关[20],分叶、毛刺等征象表示肿瘤周边各处生长速度不统一及向远处侵袭,因而更易浸润脏层胸膜,这一推断在我们的研究中得到证实。
本研究样本量较大,分析结果发现了术前CT特征与表现为GGO的肺腺癌脏层胸膜浸润之间的关系,建立的多因素分析模型判断GGO脏层胸膜浸润情况的价值高,ROC曲线的AUC达到0.861,可为术前判断是否存在脏层胸膜浸润提供重要的参考信息,对于临床工作有一定指导作用。
[1]Chang B,Hwang JH,Choi YH,et al.Natural history of pure ground-glass opacity lung nodules detected by low-dose CT scan[J].Chest,2013,143(1):172-178.
[2]LeeHY, LeeKS.Ground-glassopacitynodules:histopathology,imaging evaluation,and clinical implications [J].JThorac Imaging,2011,26(2):106-118.
[3]Van Schil PE,Asamura H,Rusch VW,et al.Surgical implications of the newIASLC/ATS/ERS adenocarcinoma classification[J].Eur Respir J,2012,39(2):478-486.
[4]Oyama M,M iyagi Maeshima A,Tochigi N,et al.Prognostic impact of pleural invasion in 1488 patients w ith surgically resected non-small cell lung carcinoma[J].Jpn JClin Oncol,2013,43(5):540-546.
[5]TravisWD,Brambilla E,Ram i-Porta R,et al.Visceral pleural invasion:pathologic criteria and use of elastic stains:proposal for the 7th edition of the TNM classification for lung cancer[J]. JThorac Oncol,2008,3(12):1384-1390.
[6]Hung JJ,Wang CY,Huang MH,et al.Prognostic factors in resected stage Inon-small cell lung cancerw ith a diameter of 3 cm or less:visceral pleural invasion did not influence overall and disease-free survival[J].JThorac Cardiovasc Surg,2007,134(3):638-643.
[7]Hattori A,Suzuki K,Matsunaga T,et al.Visceral pleural invasion is not a significant prognostic factor in patientsw ith a part-solid lung cancer[J].Ann Thorac Surg,2014,98(2):433-438.
[8]Huang H,Wang T,Hu B,et al.Visceral pleural invasion remains asize-independent prognosticfactor instageI non-small cell lung cancer[J].Ann Thorac Surg,2015,99(4):1130-1139.
[9]Ram i-Porta R,Bolejack V,Crow ley J,et al.The IASLC Lung Cancer Staging Project:Proposals for the Revisions of the T Descriptors in the Forthcom ing Eighth Edition of the TNM Classification for Lung Cancer[J].J Thorac Oncol,2015,10 (7):990-1003.
[10]李西,范丽,肖湘生.肺部纯磨玻璃结节的CT研究进展[J].国际医学放射学杂志,2016,39(1):31-34.
[11]Lee HY,Choi YL,Lee KS,et al.Pure ground-glass opacity neoplasticlungnodules:histopathology,imaging,and management[J].AJR Am J Roentgenol,2014,202(3):W 224-W 233.
[12]El-Sherief AH,Gilman MD,Healey TT,et al.Clear vision through the haze:a practical approach to ground-glass opacity [J].Curr Probl Diagn Radiol,2014,43(3):140-158.
[13]Yanagawa M,Tanaka Y,Leung AN,et al.Prognostic importance of volumetric measurements instage I lung adenocarcinoma[J].Radiology,2014,272(2):557-567.
[14]Tsutani Y,M iyata Y,NakayamaH,et al.Prognostic significance of usingsolidversus whole tumor size on high-resolution computed tomography for predicting pathologic malignant gradeoftumorsinclinical stageIAlung adenocarcinoma:a multicenter study[J].J Thorac Cardiovasc Surg,2012,143(3):607-612.
[15]Tanaka T,Shinya T,Sato S,et al.Predicting pleural invasion using HRCT and 18F-FDG PET/CT in lung adenocarcinoma w ith pleural contact[J].Ann NuclMed,2015,29(9):757-765.
[16]Gruden JF.W hat is the significance of pleural tags?[J].AJR Am JRoentgenol,1995,164(2):503-504.
[17]Zw irew ich CV,Vedal S,M iller RR,et al.Solitary pulmonary nodule:high-resolution CT and radiologic-pathologic correlation[J].Radiology,1991,179(2):469-476.
[18]Harders SW,Madsen HH,Rasmussen TR,et al.High resolution spiral CT for determ ining themalignant potential of solitary pulmonary nodules:refining and testing the test[J]. Acta Radiol,2011,52(4):401-409.
[19]Imai K,M inam iya Y,Ishiyama K,et al.Use of CT to evaluate pleural invasion in non-small cell lung cancer:measurement of the ratio of the interface between tumor and neighboring structures to maximum tumor diameter[J].Radiology,2013,267(2):619-626.
[20]JinX,ZhaoSH,GaoJ,et al.CTcharacteristics and pathological implications of earlystage(T1N0M 0) lung adenocarcinomaw ith pure ground-glass opacity[J].Eur Radiol,2015,25(9):2532-2540.
Correlation analysisof preoperative imaging characteristicsw ith visceralp leural invasion in lung adenocarcinom a presented w ith ground glassopacity
DING Hongdou1,SHIJingyun2,ZHOU Xiao1,XIEDong1,CHEN Linsong1,WANG Haifeng1
1.DepartmentofThoracic Surgery,ShanghaiPulmonary Hospital,TongjiUniversity Schoolof Medicine,Shanghai 200433,China;2.DepartmentofRadiology,ShanghaiPulmonary Hospital,TongjiUniversity Schoolof Medicine,Shanghai 200433,China
Ob jective To investigate the correlation of CT characteristics w ith visceral pleural invasion in lung adenocarcinoma presented w ith ground glass opacity(GGO).M ethods A totalof 740 cases of GGO undergoing surgery between September 2013 and October 2014 w ith conformation as adenocarcinoma by postoperative pathological exam inationswere selected.Among them,therewere 84 casesw ith visceral pleural invasion,and therewas no invasion in the other 656 cases.The correlation of CT characteristics w ith visceral pleural invasion was analyzed.Resu lts Age,GGO types,themaximum whole diameter,the diameter of consolidation,the proportion of consolidation,them inimum distance from lesions to pleura,pleural retraction,margins and shape were significantly related to visceral pleural invasion.M ultivariate logistic regression analysis showed the maximum whole diameter>12 mm,the diameter of consolidation>5 mm,them inimum distance from lesions to pleura<6 mm,pleural retraction and nonsmooth margin were risk factors for visceral pleural invasion(OR=3.23,4.41,3.58,2.21,2.65).The area under the receiver operating characteristic curve ofmultivariate analysismodel was 0.861.Conclusion Preoperative CT findings play an important role in evaluating visceralpleural invasion in lung adenocarcinoma presented w ith GGO.
Ground glassopacity;Computed tomography;Visceralpleural invasion
R655
A
2095-378X(2016)02-0111-03
10.3969/j.issn.2095-378X.2016.02.012
上海市科委科技基金(15411965400)
丁红豆(1990—),男,胸外科硕士研究生,研究早期肺癌诊断及治疗
王海峰,电子邮箱:nautilus2316@163.com
(2016-03-25)
