乙肝肝硬化APRI指数与HBV-DNA的相关性研究
2016-12-22徐芳
徐芳
(张家港市第一人民医院传染科,江苏 张家港 215600)
乙肝肝硬化APRI指数与HBV-DNA的相关性研究
徐芳
(张家港市第一人民医院传染科,江苏 张家港 215600)
目的 探讨乙肝肝硬化患者APRI指数与HBV-DNA水平的相关性。方法 收集乙肝肝硬化患者101例,抽取空腹血化验肝功能(ALT、AST)、血常规、HBV-DNA(Log数)、肿瘤指标(AFP、SF)等相关指标,计算APRI指数,对APRI指数、血清HBV-DNA水平进行统计并分析二者之间的关系。结果 随着Child-Pugh分级的升高,APRI指数亦随之升高(P<0.05),但APRI指数和HBV-DNA之间无显著相关性(r=0.093,P>0.05)。随着Child-Pugh分级的升高,SF亦随之升高,APRI指数和SF呈正相关(r=0.642,P<0.05)。结论 临床可以应用APRI指数可以较好评估乙肝肝硬化程度,乙肝肝硬化患者HBV-DNA与肝纤维化严重程度并无相关性,故临床抗病毒治疗和抗纤维化治疗应并重。
乙肝肝硬化; APRI指数; HBV-DNA; 相关性
乙肝肝硬化是慢性乙型肝炎反复发作的结果,慢性乙型肝炎患者体内HBV不断复制,通过机体的免疫机制[1]导致肝细胞损伤,发生变性坏死,从而造成肝细胞再生和纤维结缔组织增生,肝纤维化形成,最终进展为肝硬化[2]。肝纤维化程度与HBV-DNA之间有无明确关系,各项研究[3-4]结果不一,因基层医院肝活检条件不足,且目前APRI指数是反映肝纤维化最敏感的指标之一[5],临床可用作肝纤维化或肝硬化的无创性指标。研究[6]证明APRI在HBV相关显著肝纤维化的诊断上具有较好的准确性[6],APRI指数及HBV-DNA的相关性。本文旨在探讨APRI指数及HBV-DNA的相关性。
1 资料与方法
1.1 一般资料 选取2009年1月至2011年4月在我科住院的乙肝肝硬化患者101例,其中男性63例,女性38例。年龄(49.25±11.18)岁,其中Child-Pugh分级A级34例,B级31例,C级36例,HBeAg阴性57例,HBeAg阳性44例。诊断标准:符合2010年制定的《慢性乙型肝炎防治指南》[7]。上述患者近6个月内均未接受任何一种抗病毒药物治疗,近期未使用激素、免疫抑制剂,以及未使用活血化瘀类中药抗纤维化治疗。排除标准:除外上消化道出血、肝性脑病、感染等并发症,除外合并酒精性肝病、自身免疫性肝病、遗传代谢因素引起的肝病。
1.2 方法 住院次日抽取空腹血,化验其肝功能(ALT、AST)、血常规、HBV-DNA(为了统计方便,以Log数计量)、肿瘤指标(AFP、SF)等相关指标,计算APRI指数((AST/ULN)×100/PLT(109L-1)。
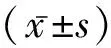
2 结 果
2.1 一般数据 不同Child-Pugh分级肝功能、肿瘤指标、HBV-DNA、APRI指数见表1。

表1 不同Child-Pugh分级肝功能、肿瘤指标、HBV-DNA、APRI指数
2.2 不同Child-Pugh分级之间HBV-DNA、APRI、SF相比较 Child-Pugh分级和HBV-DNA之间比较差异均无统计学意义(P均>0.05);Child-Pugh分级和APRI比较差异均有统计学意义(P均<0.05);Child-Pugh分级和SF之间,B级和C级之间差异无统计学意义(P>0.05),其余两两比较差异均有统计学意义(P均<0.05),见表2。

表2 不同Child-Pugh分级之间HBV-DNA、APRI、SF相比较
注:与A级相比,△P>0.05,*P>0.05,☆P<0.05,#P<0.05;与B级相比,▽P<0.05;与A级相比,○P<0.05;与B级相比,◇P>0.05。
3 讨 论
肝硬化是各种慢性肝病发展的后期阶段,以弥漫性肝纤维化、假小叶和再生结节形成为特征[1]。 在中国,乙肝病毒感染是慢性肝病的主要原因之一,长期感染乙肝病毒易造成肝细胞损伤,出现变性、坏死,进而肝细胞再生和纤维结缔组织形成,肝纤维化形成后最终发展为肝硬化,导致肝脏储备功能严重受损。肝活检一直被认为是判断慢性肝病肝脏纤维化的金标准[8]。但作为基层医院,受经济、技术条件等的限制,无法进行肝活检,为了提高诊断的准确性,国内外学者建立了多种无创性肝纤维化诊断模型如APRI、Forns、FIB-4、FibroTest等。其中APRI模型,仅需两项临床常用检验指标(AST和PLT),且计算方法简单,在肝纤维化诊断中表现出很好的诊断价值,故临床应用较广泛[9]。本文结果显示,HBV-DNA水平和Child-Pugh分级和APRI指数之间并无相关性,HBV-DNA在Child-pughA、B、C级并无明显差别,且高载量病毒复制状态的APRI指数与低水平复制状态下的APRI指数相比并无显著差异,表明肝纤维化程度与乙肝病毒复制程度并不一致,肝脏的纤维化程度越高其病毒复制程度越高不一定也越高。慢性乙肝患者血清HBV-DNA水平反映了病毒在肝脏内的复制程度,其复制过程中会激发机体免疫系统对乙肝病毒的清除,同时也引发了机体免疫病理反应,导致了肝细胞损伤、破坏,随之发生的是肝脏组织的修复与纤维化。在慢性乙肝免疫耐受期,尽管HBV-DNA载量高,但由于肝细胞破坏少,炎症程度较轻,所以肝纤维化程度也较轻,而在免疫清除期,尽管HBV-DNA载量可能较低,但由于肝细胞反复感染、破坏,肝纤维化进程较快,肝纤维化程度反而较重[10]。所以肝纤维化发生的机制是慢性肝脏炎症及损伤修复反应,肝纤维化发生发展的最终结局导致肝硬化[11]。概况而言,乙肝病毒的持续复制是肝脏炎症、损伤、纤维化的始动因子,但与肝脏纤维化间并无确切相关性[12]。而早期肝硬化是可逆的,所以在抗病毒治疗同时也应加强抗肝纤维化的治疗。
本研究还发现,随着Child-Pugh分级的升高,SF也随之升高,SF和APRI指数呈正相关。血清铁蛋白主要在肝脏内合成,是体内储存铁的标志,在正常人血清中含量很低,但在肝功能损害时,多明显升高[13]。肝细胞的受损情况、功能状态在某种程度上也可以由血清铁蛋白代谢来体现。肝脏炎症发生,能够明显增加铁蛋白合成;而肝细胞受损时,细胞内铁蛋白进入血液内,但血液对铁蛋白的清除力下降,同时体内内毒素升高引起对红细胞的毒性损伤或脾亢增加红细胞破坏,都可以促使铁释放至细胞外,随着肝损害的加重,肝脏将血液中的铁转化为组织铁的能力降低,这些因素可能是发生肝损害时血清铁蛋白增高的机制[14]。故临床上亦可以根据铁蛋白的水平来判断肝脏的功能状态。
[1] 董忠,沈洪,张福奎.慢性乙型肝炎患者血清HBV-DNA水平与肝纤维化标志物的关系[J].中华实验和临床病毒学杂志,2007,21(2):129-131.
[2] 陆再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008:446-448.
[3] 刘妲梅,刘久梅,戴万荣. 慢性乙型肝炎患者血清HBV-DNA水平与肝纤维化标志物的关系[J].实验 与 检 验 医 学,2011,29(6):677-678.
[4] 顾琳,张宇锋,项凤梅,等.慢性乙型肝炎患者血清HBV-DNA水平与肝组织病理及免疫组化水平的关系[J].广东医学,2006,27(8):1125-1126.
[5] 蒋忠胜,温小凤,柯柳,等.APRI和Forns指数对慢乙肝肝纤维化的诊断价值[J].临床肝胆病杂志,2008,24(6):423-425.
[6] 金文文,林中华 ,辛永宁,等.APRI指数诊断HBV相关显著肝纤维化准确性的Meta分析[J].实用医学杂志,2011,27(5):797-799。
[7] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版) [J].肝脏,2011,16(l):2-16.
[8] 王丹,郭丽颖,贾建伟. HBV肝硬化患者肝脏储备功能与肝纤维化的相关性研究[J].湖北中医杂志,2013,35(3):19-21.
[9] Lin ZH,Xin YN,Dong QJ.et al Performance of the as-partate aminotransferase-to-platelet ratio index for the staging of hepatitis C-related fibrosis:an updated meta-analysis[J]. Hepatology,2012,53(3):726736.
[10] 柯柳,温小凤,蒋忠胜.慢性肝炎患者乙型肝炎病毒复制与肝纤维化程度的关系[J].广东医学,2010,31(5):628-629.
[11] 赵红光 张坚 褚晓.乙型肝炎肝硬化患者血清HBV DNA水平与肝纤维化指标相关性研究[J].新疆医学,2012,42:86-88.
[12] 蔡文品,赵春,吴惠洁,等.慢性乙型肝炎患者血清HBV DNA水平与肝纤维化指标的相关性[J].实用医学杂志,2009,25(1):72-73 .
[13] Wendt As,Jdfferds ME,Perrine CG,et al. Obese women less likely to have low serum ferritin,Nicaragua[J].Public Health Nutr,2014,22:1-6.
[14] 王丰园,章林华,赖卫强.血清纤维化指标联合AFP和铁蛋白检测在肝硬化患者Child-Pugh分级中的价值[J].检验医学,2014,29(12):1222-1225.
R512.6+2;R575.2
B
1000-744X(2016)11-1142-03
2016-07-09)
