SPR传感器检测痕量炸药的研究进 展
2016-12-22谭俊鹏郝红霞杨瑞琴
谭俊鹏,郝红霞,杨瑞琴
(1. 中国人民公安大学,北京 100038;2. 2011计划司法文明协 同创新中心;
3
. 证据科学教育部重点实验室(中国政法大学),北京 100088)
SPR传感器检测痕量炸药的研究进 展
谭俊鹏1,2,郝红霞2,3,*,杨瑞琴1,*
(1. 中国人民公安大学,北京 100038;2. 2011计划司法文明协 同创新中心;
3
. 证据科学教育部重点实验室(中国政法大学),北京 100088)
痕量炸药成分的检测对于预防和打击涉爆犯罪具有重要意义,传统方法难以满足现场快速检测的需要,表面等离子体共振(SPR)传感器作为一种新兴的检测手段,具有灵敏度高、操作简单、设备可小型化、可实时监测等特点,现已广泛应用于各个研究领域。本文介绍了SPR传感器的工作原理;概括了当前基于SPR传感器对炸药成分检测的方法现状,描述了间接竞争法和置换法的检测过程;重点阐述了SPR传感器检测痕量炸药的芯片修饰方法的研究进展与特点,包括使用蛋白物理吸附修饰、聚乙二醇修饰、高分子聚合物修饰的传感器芯片;总结了近年来对SPR传感器检测痕量炸药的研究情况。最后对SPR传感器检测痕量炸药的发展方向进行了展望。
表面等离子体共振(SPR);传感器检测;痕量炸药
炸药常被用于有组织犯罪和恐怖袭击中,恐怖分子采取制造爆炸方式所引发的大范围恐慌,会给社会造成巨大的危害,严重威胁着人们的生命和财产安全。面对日益严峻的公共安全威胁,爆炸物检测技术的研究正愈益受到重视和加强,快速、高效、准确地对爆炸物检测和识别的手段也在不断出现,其中,对于痕量炸药的检验和实时监测尤为重要和突出[1-2]。由于传统的离子迁移质谱、气相色谱质谱联用等大型仪器,前处理复杂、仪器设备昂贵、专业要求较高,难以满足现场快速检测的迫切需求[3],故灵敏度高、成本低廉、携带方便、可现场实时分析的传感器快速检测方法越来越受到关注和欢迎。
传感技术相对于其他技术虽起步较晚,但因其具有很多优势而发展迅速。表面等离子共振(surface plasmon resonance,SPR)传感技术、荧光检测技术、生物传感技术、核酸适配体传感技术是目前传感技术的主流。以这些传感器技术构建的检测系统具有成本低、体积小、可靠性高、多功能集成、可批量生产等优点。其简单实用的结构使炸药检测设备能达到低功耗、小型化、高精度的性能。目前,应用于检测炸药的传感器包括微机电系统传感器[4]、表面声波传感器[5]、分子荧光传感器[6]、电化学传感器[7]、分子印迹传感器[8]等。SPR传感器已成为近年来用于检测炸药的研究热点之一。表面等离子体共振现象自1902年Wood[9]发现至今虽已有一百多年历史,但其应用却是随着20世纪80年代初第一个SPR传感器的产生[10-11]才开展起来,如今国内外学者对其研究已非常普遍和深入,商业化也相当成功,如瑞典Biacore AB公司生产的Biacore系列、美国Affi nity Sensors公司生产的IASys等。SPR传感器不但具有与其它传感器共同的优点,还具有无需标记样品、分析时间短、可在浑浊或不透明样品中检测、能实时监测反应动态过程等优势,在生命科学、医学、环境监测、食品安全等领域应用广泛。
1 SPR传感器基本原理
SPR是一种经光学耦合由金属薄膜所产生的物理光学现象,通过测量金属膜表面物质的折射率变化而进行测定的一种高灵敏的实时光谱分析技术。SPR传感器采用的基本原理为,当入射光以一定角度从光密介质入射到光疏介质而发生全反射现象时,会产生消逝波。同时,入射光会与SPR传感器上金属薄膜表面的自由电子相互作用产生表面等离子振荡,当消逝波与表面等离子振荡的频率与波数相同,即产生表面等离子体共振。由于共振使电子吸收了光能量,因此反射光在一定范围内就大大地减弱,呈现在反射光谱上便为光强度的一个最低值,对应此时的入射角称为共振角。SPR传感器对附着在金属膜的电介质的折射率非常敏感,由于折射率是任何材料的固有特性,故金属膜的电介质折射率不同,则共振角就会不同,据此可对待测物进行检测[12]。基于这种原理,SPR传感器在检测目标物时,通常是将反应物(配体)固定于传感芯片的金属膜表面,通过监测溶液中分析物(受体)和配体的结合过程,根据两者的结合或者解离使金属膜表面折射率所发生的变化,而由系统检测发现。在此过程中,当溶液中分析物的浓度发生改变时,金属膜表面的附着物量也会发生变化,从而使折射率和共振角发生转变,最终引起SPR响应信号改变,达到对分析物定量的目的。SPR传感器原理如图1所示。

图1 SPR传感器原理示意图[13]Fig.1 Schematic view for the principle of SPR sensor[13]
2 SPR传感器检测炸药的方法
SPR传感器常用的检测方法有直接检测法、夹心检测法、间接竞争检测法和表面置换检测法。由于炸药成份为小分子物质,在检测过程中往往需要绑定大分子,因此检测炸药主要采用基于酶联免疫吸附检测(ELISA)的间接竞争法和置换法[14]。间接竞争法和置换法均依据配体与受体、待测物间亲和力的不同而进行选择性的吸附,通过不同的检测过程对待测物进行定量分析。间接竞争法是指在检测前将小分子待测物或与待测物结构相近的物质作为受体固定在芯片表面,在检测时,将可与待测物结合的大分子配体(如抗体)加入到含有待测物的样品中,使其与待测物间的结合反应达到平衡后,引入检测系统中,诱使游离大分子配体结合到芯片表面,从而引起信号变化,在此过程中SPR响应信号与样品中的待测物含量成反比。Nagatomo等[15]使用该检测方法对痕量2,4-二硝基甲苯(2,4-DNT)进行了检测,检出限为20 pg/ mL,检测原理如图2所示。置换法是指将与待测小分子结构相近的物质作为受体固定到SPR芯片表面,且该物质与大分子配体(如抗体)有一定的亲和力,检测时先将大分子配体引入系统内,使其结合到芯片上,待稳定后再引入待测小分子物质,由于大分子配体与待测物有更强的特异性识别和结合能力,使得配体脱离芯片表面流出系统外,从而检测出小分子待测物的浓度。Larsson等[16]使用该方法,利用单克隆抗体作为配体,对2,4,6-三硝基甲苯(TNT)进行了定量检测,检出限为900 pg/mL,检测原理如图3所示。

图2 间接竞争法检测2,4-DNT的原理[15](a)未加入2,4-DNT (b)加入2,4-DNTFig.2 The principle of indirect competitive SPR measurement for detection of 2,4-DNT[15], illustrated by sensor response to a measurement sample without (a) and with 2,4-DNT (b)
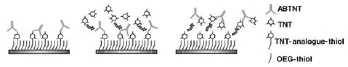
图3 置换法检测TNT的原理[16]Fig.3 The principle of displacement with SPR measurement for detection of TNT[16]
3 SPR传感器检测痕量炸药芯片修饰方法的研究进展
SPR传感器对目标物的检测效果主要依赖于芯片表面材料的数量和质量,芯片的修饰决定了传感器的特异性、灵敏度、重复性、稳定性以及对非特异性吸附的抑制等性能指标。针对当前SPR传感器检测痕量炸药的研究,可将芯片表面的修饰方法分为蛋白物理吸附修饰、聚乙二醇修饰、高分子聚合物修饰三种。
3.1 蛋白物理吸附修饰传感器芯片
金属表面的蛋白吸附可以通过范德华力、静电吸引、氢键等方式,其中范德华力通常是蛋白与金属表面相互作用的主要因素[17]。蛋白质通过物理吸附修饰SPR传感器芯片,具有吸附量大、吸附速度快、操作简单等特点,但溶液中pH值以及离子强度等会对其产生影响。
Shankaran等[18]将三硝基苯酚-牛血清白蛋白(TNP-BSA)结合物作为与2,4,6-三硝基苯酚(TNP)结构相近的物质,通过BSA与金(Au)元素表面的物理吸附作用将其修饰在SPR传感器芯片表面,采用间接竞争法对TNP进行检测。检测中分别使用了鼠源抗-TNP抗体(TNP-Ab(L))和羊源抗-TNP抗体(TNP-Ab(C))作为配体,结果显示使用TNP-Ab(L)的芯片相对标准偏差小于5 %,使用TNP-Ab(C)的芯片相对标准偏差小于6 %,且使用胃蛋白酶作为洗脱液可对芯片再生至少20次,表明此种方法修饰的芯片具有良好的稳定性和重现性,检出限为1 pg/ mL,检测范围在10 pg/mL~100 ng/mL之间。
由于抗-TNP抗体对TNT同样具有较强的亲和力,Shankaran等又进行了一系列使用TNP-蛋白结合物修饰SPR传感器检测TNT的研究[19-20]。在实验中,研究人员分别使用2,4,6-三硝基苯酚-牛血清白蛋白(TNP-BSA)结合物[19]和2,4,6-三硝基苯酚-卵白蛋白(TNP-OVA)结合物[20]通过物理吸附方法修饰传感器芯片。检测使用间接竞争法,抗体均为鼠源多克隆抗-TNP抗体,对TNT的检测范围分别为60 p g/mL~1000 ng/mL和90 pg/mL~1000 ng/mL。使用该种修饰方法检测TNT,对于硝基芳香类化合物2,4-二硝基甲苯、1,3-二硝基苯、2-氨基-4,6-二硝基甲苯、4-氨基-2,6-二硝基甲苯的交叉反应率均小于1.1 %,但与TNP不能区分,交叉反应率为125 %。之后,课题组在使用该芯片修饰方法的基础上对抗体的选择进行了优化[21-22],得到了更低的检出限和交叉反应性。
3.2 聚乙二醇修饰传感器芯片
聚乙二醇(Poly(ethylene glycol),PEG) 作为最佳的防止蛋白质非特异性吸附的表面修饰材料之一,具有水溶性好、毒性小、无免疫原性等优点,其重复单元为氧乙烯基,端基为两个羟基,呈线性或枝化链状结构[23]。在修饰SPR传感器芯片过程中,采用一端巯基另一端具有不同基团的PEG通过金硫(Au-S)键组装在芯片表面,而使传感器具有丰富的可反应性和选择性。
Nagatomo等[15]研究了SPR传感器检测DNT的方法。该方法通过使用包含寡聚乙二醇(oligo(ethylene glycol),OEG)的自组装单分子膜(self-assembled monolayer,SAM)对SPR芯片进行修饰。芯片的修饰过程如图4所示,首先将金芯片浸泡在HS-C11-EG6-COOH溶液中,由于金硫键的稳定结合,使该成分固定在芯片表面;使用1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)/N-羟基琥珀酰亚胺(NHS)溶液将羧基活化后,加入摩尔比为1∶9的H2N-EG12-COOH和2-氨基乙醇混合溶液进一步对芯片作修饰;然后通入氨基乙醇-盐酸溶液,对芯片上已活化但未反应的位点进行封闭;之后的反应在SPR检测系统中进行,先通入EDC/NHS溶液活化羧基,再通入乙二胺溶液,用于将氨基引入到H2NEG12-COOH的一端,最后通入已活化的2,4-二硝基苯甲酸(DNBA)溶液,完成对芯片的修饰。检测采用间接竞争法,将兔源抗-二硝基苯肼-钥孔血蓝蛋白(anti-DNPh-KLH)多克隆抗体[24]作为配体,由于其对硝基芳香类化合物有较好的亲和能力,可通过DNBA与待测DNT的竞争作用,对DNT进行定量检测,检出限为20 pg/m L,线性范围为1~100 ng/ mL。
在SPR传感器检测TNT方面,研究发现通过SAM技术将连有TNT相似物的寡聚乙二醇-硫醇(TNTanalogue-OEG-thiol)采用一定比例与羟基终止的寡聚乙二醇-硫醇(OEG-thiol)共同修饰在芯片表面,由于羟基终止的OEG-thiol具有抑制非特异性蛋白吸附的作用,可进一步增强芯片的防污性能[25]。Larsson等[16]运用此芯片,采用置换法检测,对TNT检出限为900 pg/mL,Kawaguchi等[26]使用了类似的芯片,采用间接竞争法对TNT进行了检测,得到更低的检出限,检测范围在8 pg/mL~30 ng/mL之间。在此基础上,研究人员为了提高小型便携式SPR系统的响应信号,使用纳米金颗粒修饰免疫芯片表面,从而放大了局域SPR信号[27]。这是由于芯片金表面与纳米金颗粒相互作用,使电子密度发生起伏而形成往复振荡,增强了表面等离子波[28]。芯片修饰纳米金后,SPR共振角的变化值提高了四倍,使小型便携式SPR系统与普通SPR系统具有同量级的检测范围,达到10 pg/mL~100 ng/mL。

图4 SPR传感器芯片修饰过程[15]Fig.4 Fabrication procedure of the SPR sensor chip[15]
还有研究表明[29],长链硫醇具有更强的吸附能力,但随着芯片的使用时间增长,长链硫醇比短链硫醇更容易发生表面位移。Mizuta等[30]研究运用自组装多分子膜(self-assembled monolayers,SAMs)方法,将芳香双硫酚与OEG结合物修饰在芯片表面,芯片修饰结构如图5所示。通过该修饰方法,芯片的耐久性和重复性得到了改善,循环使用次数可超过100次。Tanaka等[31]通过相似方法修饰芯片对黑索金(RDX)进行检测,使用鼠源抗-RDX单克隆抗体作为配体,检出限为40 pg/mL。
3.3 高分子聚合物修饰传感器芯片
近年来,高分子聚合物合成快速发展,将其应用于SPR传感器芯片修饰成为研究热点之一。多种类型的高聚物用于修饰SPR芯片,为芯片表面提供了不同的结构,从而提高了传感器的性能。Crooks和Ricco[32]研究发现,树状分子具有高密度表面官能团,可通过核心分子实现反复分支,重复分支的周期数称为一代[33],修饰在金属芯片表面能够结合更多数量的配体,且在重复再生的过程中有较好的稳定性。Singh等[34]通过使用高度分支化的聚酰胺(PAMAM)树状大分子,以1,2-二氨基十二烷为核心得到第四代(G4)分子对SPR传感器芯片进行修饰,提高了表面的负载能力和检测效率,使用间接竞争法对TNT进行检测,结果显示使用树状分子修饰的芯片对抗TNT抗体有更好的结合能力,结合量是未修饰树状分子芯片的1.6倍。Mizuta等[35]通过利用树状分子的立体结构和高密度的结合位点,与包含OEG的SAM有效结合用于修饰SPR传感器芯片,增强了对目标生物分子的亲和性[36]。在修饰过程中,通过使以胱胺为核心的第六代(G6)PAMAM树状大分子裂解为两个硫醇功能化的树状结构分子而结合到OEG修饰的芯片表面,芯片结构如图6所示。检测使用间接竞争法,在引入非常少量的抗TNT抗体(约为90 RU)后,仍保持很低的相对标准偏差(2.5 %),最终的检出限为15 pg/mL。

图5 SPR传感器SAMs芯片的修饰结构示意图[30]Fig.5 Schematic illustration for fabricating the SAMs-kind SPR sensor chip[30]
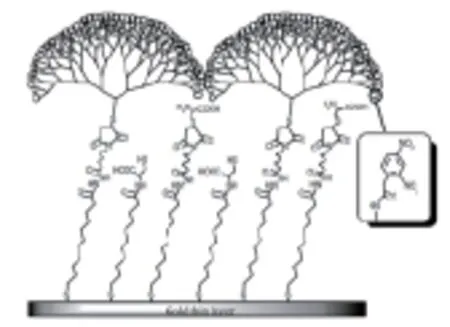
图6 PAMAM G6树状分子修饰的芯片表面结构示意图[35]Fig.6 Schematic illustration of the PAMAM G6-dendron-based fabrication in sensor surface[35]
Yatabe等[37]通过将聚乙烯胺-co-N-乙烯基甲酰胺(poly-(VAm-co-NVF))结合SAM修饰SPR传感器芯片对TNT进行检测。此方法的优点在于,一方面,通过构建三维立体结构增加了芯片的结合位点;另一方面,通过控制poly-NVF的水解率,有效地减弱了由于过多数量的氨基而引起的静电吸附作用,从而降低了聚合物对抗体的非特异性吸附,芯片修饰结构如图7所示。研究表明,将poly-NVF的水解率控制在23 %,可有效地为TNT相似物提供结合位点且聚合物对抗体的非特异性吸附最弱,其检出限为28 pg/ mL。同时,Yatabe课题组还研究运用表面引发原子转移自由基聚合(SI-ATRP)的方法将两种聚合物修饰到传感器芯片表面检测TNT[38],该方法的特点为聚合物可直接连接在芯片表面并且长度可控。两种聚合物分别为琥珀酸单[2-[(2-甲基-丙烯酰基)氧]乙基]酯(MES)和二乙基氨基甲基丙烯酸乙酯(DEAEM)。MES通过链端的羧基绑定TNT相似物,其三维结构增加了抗TNT抗体的结合位点。DEAEM的链端为带正电的叔氨基,可平衡MES的电负性,从而降低芯片的非特异性吸附,SI-ATRP法修饰芯片结构如图8所示。通过间接竞争法进行检测,检出限为5.7 pg/mL。
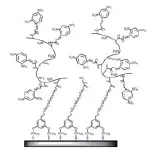
图7 poly-(VAm-co-NVF)修饰的芯片表面结构示意图[37]Fig.7 Schematic illustration of the poly-(VAm-co-NVF)-based fabrication in sensor surface[37]
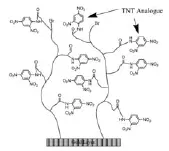
图8 SI-ATRP法修饰聚合物的芯片表面结构示意图[38]Fig.8 Schematic illustration of polymer-based sensor surface by SI-ATRP fabrication[38]
4 SPR传感器检测痕量炸药的研究总结
SPR传感器检测痕量炸药的相关研究主要集中在近十年,目标物多为硝基芳香类炸药,其中检测TNT的论文数量相对较多;检测方法以间接竞争法为主,均使用抗体作为配体;传感器检出限普遍较低,为每毫升皮克到纳克级,且使用间接竞争法检测相较于置换法具有更低的检出限。相关研究总结于表1。

表1 SPR传感器检测痕量炸药的研究总结Table 1 Summary of SPR Sensor in determining trace explosive

续表1
5 结论与展望
SPR传感器技术作为一种新兴的现代分析手段,运用在痕量炸药检测上具有许多独特的优势。本文介绍了SPR传感器的检测原理、对痕量炸药的检测方法以及相关芯片的修饰方法,并对SPR传感器检测炸药的研究现状进行了总结。根据现有检测炸药的分析方法以及SPR技术的发展趋势,该研究将会在以下方向有更多创新[40-41]:(1)通过运用多种类的SPR传感器,如光纤光栅SPR、光子晶体光纤SPR等,设计相应的方法对炸药进行检测;(2)扩大检测炸药的种类,目前SPR传感器对炸药检测主要集中在硝基芳香类炸药和RDX硝胺炸药,而硝酸酯类炸药和大部分硝铵类炸药研究较少;(3)现有的研究中均使用ELISA作为目标物识别方法,在今后的发展中应尝试新的炸药特异性识别物,如运用特异性更强、结构更稳定的适配体;(4)结合更加灵活多样的纳米修饰技术以增强SPR传感器的响应信号;(5)在保持芯片表面物质的稳定性和生物活性的基础上,建立高效快速的芯片活化方法。随着进一步的发展,SPR传感器技术将会在痕量炸药的检测中发挥越来越重要的作用。
[1] Caygill JS, Davis F, Higson SPJ. Current trends in explosive detection techniques [J]. Talanta, 2012, 88(15): 14-29.
[2] Senesac L, Thundat T G. Nanosensors for trace explosive detection [J]. Materials Today, 2008, 11(3): 28-36.
[3] Bharadwaj R, Mukherji S. Gold nanoparticle coated U-bend fi bre optic probe for localized surface plasmon resonance based detection of explosive vapours [J]. Sensors and Actuators B: Chemical, 2014, 192(3):804-811.
[4] Thundat T, Chen G Y, Warmack R J, et al. Vapor detection using resonating microcantilevers [J]. Analytical Chemistry, 1995, 67(3): 519-521.
[5] Kannan G K, Nimal A T, Mittal U, et al. Adsorption studies of carbowax coated surface acoustic wave (SAW) sensor for 2,4-dinitro toluene (DNT) vapour detection [J]. Sensors & Actuators B Chemical, 2004, 101(3): 328-334.
[6] Patra D, Mishra A K. Fluorescence quenching of benzo[k]fl uoranthene in poly(vinyl alcohol) fi lm: a possible optical sensor for nitro aromatic compounds [J]. Sensors & Actuators B Chemical, 2001, 80(3): 278-282.
[7] Yu Y, Cao Q, Zhou M, et al. A novel homogeneous label-free aptasensor for 2,4,6-trinitrotoluene detection based on an assembly strategy of electrochemiluminescent graphene oxide with gold nanoparticles and aptamer [J]. Biosens Bioelectron, 2013, 43(1):137-142.
[8] Chenggen X, Bianhua L, Zhenyang W, et al. Molecular imprinting at walls of silica nanotubes for TNT recognition [J]. Analytical Chemistry, 2008, 80(2): 437-443.
[9] Wood R W. On a remarkable case of uneven distribution of light in a diffraction grating spectrum [J]. Proceedings of the Physical Society of London, 1902, 18(1): 269-275.
[10] Nylander C, Bo L, Lind T. Gas detection by means of surface plasmon resonance [J]. Sensors & Actuators, 1982, 3(82): 79-88.
[11] Bo L, Nylander C, Lunstr M I. Surface plasmon resonance for gas detection and biosensing [J]. Sensors & Actuators, 1983, 4(83): 299-304.
[12] Englebienne P, Hoonacker A V, Verhas M. Surface plasmon resonance: principles, methods and applications in biomedical sciences[J]. Spectroscopy: An International Journal, 2003, 17(2-3): 255-273.
[13] Shankaran D, Gobi K, Miura N. Recent advancements in surface plasmon resonance immunosensors for detection of small molecules of biomedical, food and environmental interest [J]. Sensors and Actuators B: Chemical, 2007, 121(1): 158-177.
[14] Wang JL, Zhou HS. Aptamer-based Au nanoparticles-enhanced surface plasmon resonance detection of small molecules [J]. Anal Chem, 2008, 80(18):7174-7178.
[15] Nangtomo K, Kawaguchi T, Miura N, et al. Development of a sensitive surface plasmon resonance immunosensor for detection of 2,4-dinitrotoluene with a novel oligo (ethylene glycol)-basedsensor surface [J]. Talanta, 2009, 79(4): 1142-1148.
[16] Larsson A, Angbrant J, Ekeroth J, et al. A novel biochip technology for detection of explosives-TNT: Synthesis, characterisation and application [J]. Sensors and Actuators B: Chemical, 2006, 113(2): 730-748.
[17] Bra-nemapk P I, Zarb G A, Albrektsson T, et al. Tissue-integrated prostheses (Osseo-integration in clinical dentistry) [J]. Plastic & Reconstructive Surgery, 1986, 77(3): 496-497.
[18] Shankaran D R, Gobi K V, Matsumoto K, et al. Highly sensitive surface plasmon resonance immunosensor for parts-per-trillion level detection of 2,4,6-trinitrophenol [J]. Sensors and Actuators B: Chemical, 2004, 100(3): 450-454.
[19] Dhesingh Ravi Shankaran K V G, Takatoshi Sakai. A novel surfance plasmon resonance immunosensor for 2,4,6-trinitrotoluene(TNT) based on indirect competitive immunoreaction: A promising approach for on-site landmine detection [J]. IEEE Sensors Journal, 2005, 5(4): 616-621.
[20] Shankaran D R, Gobi K V, Sakai T, et al. Surface plasmon resonance immunosensor for highly sensitive detection of 2,4,6-trinitrotoluene [J]. Biosensors and Bioelectronics, 2005, 20(9): 1750-1756.
[21] Shankaran D R, Matsumoto K, Toko K, et al. Development and comparison of two immunoassays for the detection of 2,4,6-trinitrotoluene (TNT) based on surface plasmon resonance [J]. Sensors and Actuators B: Chemical, 2006, 114(1): 71-79.
[22] Shankaran D R, Kawaguchi T, Kim S J, et al. Evaluation of the molecular recognition of monoclonal and polyclonal antibodies for sensitive detection of 2,4,6-trinitrotoluene (TNT) by indirect competitive surface plasmon resonance immunoassay [J]. Anal Bioanal Chem, 2006, 386(5): 1313-1320.
[23] Bailon P, Berthold W. Polyethylene glycol-conjugated pharmaceutical proteins [J]. Pharmaceutical Science & Technology Today, 1998, 1(8): 352-356.
[24] Sakai T, Torimaru A, Shinahara K. Preparation of a polyclonal antibody and a bioassay for nitroaromatic compounds by an enzymelinked immunosorbent assay technique and a surface plasmon resonance biosensor [J]. Sensors and Materials, 2003, 15(8): 439-452.
[25] Kyo M, Usui-Aoki K, koga H. Label-free detection of proteins in crude cell lysate with antibody arrays by a surface plasmon resonance imaging technique [J]. Anal Chem, 2005, 77(22):7115-7121.
[26] Kawaguchi T, Shankaran D R, Kim S J, et al. Fabrication of a novel immunosensor using functionalized self-assembled monolayer for trace level detection of TNT by surface plasmon resonance [J]. Talanta, 2007, 72(2): 554-560.
[27] Kawaguchi T, Shankaran D R, Kim S J, et al. Surface plasmon resonance immunosensor using Au nanoparticle for detection of TNT [J]. Sensors and Actuators B: Chemical, 2008, 133(2): 467-472.
[28] Xu HX, Käll M. Modeling the optical response of nanoparticlebased surface plasmon resonance sensors [J]. Sensors and Actuators B: Chemical, 2002, 87(2): 244-249.
[29] Silin V V, Weetall H, Vanderah D J. SPR Studies of the nonspecifi c adsorption kinetics of human IgG and BSA on gold surfaces modifi ed by self-assembled monolayers (SAMs) [J]. J Colloid Interface Sci, 1997, 185(1): 94-103.
[30] Mizuta Y, Onodera T, Singh P, et al. Development of an oligo(ethylene glycol)-based SPR immunosensor for TNT detection [J]. Biosens Bioelectron, 2008, 24(2): 191-197.
[31] Tanaka Y, Yatabe R, Nagatomo K, et al. Preparation and characteristics of Rat anti-1,3,5-trinitroperhydro-1,3,5-triazine (RDX) monoclonal antibody and detection of RDX using surface plasmon resonance immunosensor [J]. IEEE Sensors Journal, 2013, 13(11): 4452-4458.
[32] Crooks R M. New organic materials suitable for use in chemical sensor arrays [J]. Acc Chem Res, 1998, 31(5):219-227.
[33] Tomalia D A, Huang B, Swanson D R, et al. Structure control within poly(amidoamine) dendrimers: size, shape and regio-chemical mimicry of globular proteins [J]. Cheminform, 2003, 59(22): 3799-3813.
[34] Singh P, Onodera T, Mizuta Y, et al. Dendrimer modifi ed biochip for detection of 2,4,6 trinitrotoluene on SPR immunosensor: Fabrication and advantages [J]. Sensors and Actuators B: Chemical, 2009, 137(2): 403-409.
[35] Mizuta Y, Onodera T, Singh P, et al. Highly sensitive detection of TNT using a poly(amidoamine) dendron-based SPR immunosensor [J]. Sensors & Materials, 2010, 22(4): 193-200.
[36] Mark S S, Neelakantapillai S, Changcheng Z, et al. Dendrimerfunctionalized self-assembled monolayers as a surface plasmon resonance sensor surface [J]. Langmuir the Acs Journal of Surfaces & Colloids, 2004, 20(16): 6808-6817.
[37] Yatabe R, Onodera T, Toko K. Highly sensitive detection of 2,4,6-trinitrotoluene(TNT) using poly(vinylamine-co-N-vinylformamide)-based surface plasmon resonance (SPR) immunosensor [J]. Sensors & Materials, 2013, 25(1): 45-56.
[38] Yatabe R, Onodera T, Toko K. Fabrication of an SPR sensor surface with antifouling properties for highly sensitive detection of 2,4,6-trinitrotoluene using surface-initiated atom transfer polymerization [J]. Sensors (Basel), 2013, 13(7): 9294-9304.
[39] Yasuura M, Toko K, Onodera T. Modelling of displacement method in surface plasmon resonance sensing [J]. Sensors and Materials, 2011, 23(1): 21-37.
[40] Hao HX, Zhou H, Chang J. Molecularly imprinted polymers for highly sensitive detection of morphine using surface plasmon resonance spectroscopy [J]. Chinese Chemical Letters, 2011, 22(4): 477-480.
[41] Zeng L, Pawlowska N, Liu ZC, et al. A novel method for the detection of forensic drugs based on nucleic acid aptamers [J]. Basic & Clinical Pharmacology & Toxicology, 2015,117: 22-23.
Advances in the Application of SPR Sensor for Determining Trace Explosive
TAN Junpeng1,2, HAO Hongxia2,3,*, YANG Ruiqin1,*
(1. People’s Public Security University of China, Beijing 100038, China; 2. 2011 Collaborative Innovation Center of Judicial Civilization, China; 3. MOE (Ministry of Education) Key Laboratory of Evidence Science, Affi liated under China University of Political Science and Law, Beijing 100088, China)
Trace explosive detection is vital for the prevention and combatting against the explosion-related crimes. Traditional methods are insuffi cient to the in situ detection because the relevant equipment is expensive and bulky, usually suited to be used in lab, easily affected by environment, and needs professional operation and other requirements. As an emerging analysis technology, surface plasmon resonance (SPR) sensor has been extensively investigated in various fi elds for its advantages of high sensitivity, easy operation, portable devices, non-necessity of labeling and real-time monitoring. In this review, we summarize the recent studies about the detection of trace explosive, such as the ones from TNT and DNT, based on SPR sensor, and outlook the development tendency in this area. To begin with, a preliminary overview was given of the SPR theory and SPR sensor's working principle. The methods to detect explosive based on SPR sensor were summed up, with the description of the indirect competitive and displacement approaches. Most importantly, the methods of modifying SPR sensor chips were discussed, mainly focusing on the modifi cations through physical immobilization of protein, polyethylene glycol and polymer, together with the analysis of the characteristics of such various modification measurements. Herein,several on-going and applicable implementations were predicted of SPR sensor to detect trace explosive. Firstly, SPR sensor will be integrating with other technologies such as fi ber Bragg grating, photonic crystal fi ber; secondly, the scope of detecting explosives will be expanded into those of containing nitro aro matic groups, RDX nitramine, nitrate type and most of the ammonium nitrate kind; thirdly, surface modification would be further enhancing the response of SPR sensor when more fl exible nanometer choices are combined. Promisingly, the SPR sensor will be highly developed along with coupling such a sensitive transducer that can make the prior labeling of analytes unnecessary. Moreover, SPR detector will be made into portable instruments for the on-site determination so that the routine explosive analysis could be signifi cantly improved at its effi ciency and availabilit y.
surface plasmon resonance (SPR); sensor detection; trace explosive
DF794.3
A
1008-3650(2016)05-0345-07
2016-04-20
格式:谭俊鹏, 郝红霞, 杨瑞琴. SPR传感器检测痕量炸药的研究进展[J]. 刑事技术,2016,41(5):345-351.
10.16467/j.1008-3650.2016.05.00 1
国家自然科学基金(No. 81001348);中国政法大学省部级合作项目(2011-23214203、23215243);中央高校基本科研业务费专项资金项目(2016JKF01210)
谭俊鹏(1989—),男,河北张家口人,硕士,研究方向为刑事科学技术。 E-mail: tjp2014@163.com
* 通讯作者:郝红霞(1976—),女,内蒙古包头人,博士,副教授,研究方向为药物毒物分析。 E-mail: haohx@126.com
杨瑞琴(1971—),女,内蒙古包头人,博士,教授,研究方向为刑事科学技术。 E-mail: 2604419477@qq.com
