氯吡格雷联合阿司匹林治疗急性大动脉粥样硬化型卒中患者预防早期神经功能恶化及改善结局效果评价
2016-12-22易兴阳
冯 芹, 李 洁, 易兴阳, 何 妮, 张 萍
氯吡格雷联合阿司匹林治疗急性大动脉粥样硬化型卒中患者预防早期神经功能恶化及改善结局效果评价
冯 芹, 李 洁, 易兴阳, 何 妮, 张 萍
目的 评估阿司匹林联合氯吡格雷治疗对于急性大动脉粥样硬化型卒中患者早期神经功能恶化和6 m结局的影响。方法 574例大动脉粥样硬化型卒中患者被随机分配到联合治疗组或阿司匹林单药治疗组。主要结局指标是早期神经功能恶化。次要结局指标是复发缺血性卒中和6 m结局。结果 联合治疗组30 d时的神经功能恶化率和卒中复发率低于单药治疗组。联合治疗能够改善老年患者,症状性后循环和基底动脉狭窄患者6 m随访结局。结论 阿司匹林和氯吡格雷联合治疗在减少30 d时神经功能恶化率和缺血性卒中复发率方面优于阿司匹林单药治疗,同时联合治疗也能改善特定亚组的6 m结局。
急性缺血性卒中; 早期神经功能恶化; 双联抗血小板治疗; 单药抗血小板治疗
在世界范围内卒中已成为影响人类健康的重大问题,并且卒中患病率随人口年龄增长呈上升趋势。短暂性脑缺血发作或缺血性卒中发生后的早期阶段,尤其在卒中发生后数小时至数天时间内,就存在很高的卒中复发风险[1,2];同时,早期神经功能缺损恢复良好的患者也存在较高的神经功能恶化风险[3,4]。因此,抗血小板治疗被一系列的临床指南推荐用于非心源型卒中患者[5]。
阿司匹林是世界范围内最为广泛使用的抗血小板药物。2个Meta分析证实,与安慰剂相比,阿司匹林使血管事件的相对风险降低了13%[6,7],同时欧洲卒中预防研究(ESPS-2)也发现阿司匹林使卒中相对风险降低了18%[8]。一项大型临床试验发现氯吡格雷在降低缺血性卒中、心肌梗死和血管性死亡事件联合风险上比阿司匹林更有效[9]。然而,近来一些研究表明,在服用阿司匹林或氯吡格雷的患者当中部分患者因药物抵抗导致治疗失败[10,11]。因此,需要进一步的研究探寻更有效的干预措施。
阿司匹林和氯吡格雷作用机制不同,阿司匹林通过不可逆地抑制环氧化酶,导致血栓素A2(TX-A2,一种血小板聚集激活物)减少,而氯吡格雷通过阻断二磷酸腺苷(ADP)与血小板膜表面的ADP受体结合而干扰血凝块的形成,它们在抑制血小板聚集上有协同作用[12~14]。阿司匹林联合氯吡格雷治疗已被证实能够降低急性冠脉综合征患者缺血性卒中事件复发风险[15,16]。尽管大规模的临床试验并未证明阿司匹林联合氯吡格雷治疗在卒中后缺血事件的二级预防上有效[17~18],然而这些试验并未着力于研究卒中后早期高风险期。3个小型的预试验结果显示联合治疗在缺血性卒中二级预防上有效的趋势[19~21]。基于不同的卒中亚型有着不同的病理生理基础,我们需要更多的研究证据以得出进一步的结论[22,23]。
血小板激活,也就是所谓的血小板聚集和血小板-白细胞聚集体形成,通过一系列的机制在缺血性卒中的病理生理过程中发挥关键性作用[24,25]。越来越多的证据表明血小板与炎症反应相关,而炎症反应通过炎症介导的动脉粥样硬化病变的不稳定和破坏在动脉粥样硬化进展过程中发挥重要作用[26~29]。然而,血小板激活是否与卒中后早期神经功能恶化和卒中复发相关尚未有确切结论。因此,我们假设血小板激活可能导致神经功能恶化和(或)卒中复发。因此,氯吡格雷联合阿司匹林治疗与阿司匹林单药治疗相比,因能更有效抑制血小板活化,在减少卒中后早期神经功能恶化和卒中复发方面更有效。基于此科学假设,我们设计实施了如下随机对照实验,评估阿司匹林联合氯吡格雷治疗与阿司匹林单药治疗相比,对于急性大动脉粥样硬化型卒中患者血小板激活、早期神经功能恶化和6 m结局的影响。
1 资料和方法
1.1 研究对象 连续纳入2009年8月~2011年12月间在发病48 h内入住我院神经内科的首次发病脑梗死患者。纳入研究的每例患者或其家属均签署研究知情同意书。所有纳入研究对象年龄均≥18岁并经头部CT或MRI检查确诊为缺血性卒中。根据TOAST病因分型30,所有缺血性卒中患者被分为5型(大动脉粥样硬化型,小动脉病变型,心源性栓塞型,其他病因型或病因不明确型)。仅大动脉粥样硬化型(LAA)卒中患者574例纳入进一步分析。所有纳入研究对象在随机分组前及14 d均进行了头部CT扫描。通过颈动脉超声、CT血管成像或磁共振血管成像等血管影像学检查方式明确颈内动脉、椎基底动脉、大脑中动脉、大脑前动脉、大脑后动脉中度(50%~70%)或重度(>70%)的狭窄。所有纳入研究对象均无颈动脉内膜剥脱术或支架植入术的病史,并且无计划在随访期内进行颈动脉内膜剥脱术或支架植入术。排除标准:昏迷或基线NIHSS评分20≥15分;入院时伴有房颤或其他临床相关的心律失常;严重合并症如肾衰、恶性肿瘤;入院时有发热、缺氧、意识状态改变或血流动力学不稳定;本次卒中前或发病时正在使用噻氯匹定、双嘧达莫或其他非甾体类抗炎药以及含有水杨酸成分的制剂;纳入研究前24 h内使用了肝素或低分子肝素;纳入研究前1 w内行较大外科手术;有家族或个人出血疾病史;血小板计数>450×109/L或<100×109/L;任何骨髓增生异常病史或肝素诱导的血小板减少史;其他情况如阿司匹林过敏,哮喘,严重心血管、肝脏、肾脏疾病。
1.2 研究方法 所有纳入研究对象被随机分配到以下两组之一接受治疗:氯吡格雷+阿司匹林组(联合治疗组;n=286)或阿司匹林组(单药治疗组;n=288)。研究对象的随机分组由我院随机化机构通过密闭信封或互联网分配的方式进行中心随机。阿司匹林组从入院当日前起口服阿司匹林200 mg/d共30 d,其后阿司匹林100 mg/d。联合治疗组从入院当日起每日口服阿司匹林200 mg及氯吡格雷75 mg共30 d,其后氯吡格雷75 mg/d。
血小板聚集功能检测通过OPA法(光学比浊法,opticalplateletaggregometry)进行[30]。服药前及用药后30 d通过肘前静脉采集血样。将全血标本先以200 r/min离心10 min,提取富含血小板血浆(platelet-richplasma,PRP),剩余血液再以4000r/min离心10 min,制备乏血小板血浆(platelet-prroplasma,PPP)。经典OPA法提取富含血小板血浆通过美国Bio/Data公司提供的PAP-4D血小板聚集仪进行。血小板聚集功能通过透光度的改变进行记录。以PRP管初始透光度为0%,PPP管初始透光度为100%,OPA法的结果以加入0.5 mmol/L花生四烯酸(arachidonicacid,AA)或10 μmol/L二磷酸腺苷(adenosinediphosphate,ADP)作为诱导剂后透光度的改变进行记录。
血小板-白细胞聚集体(PLA)检测首次服用阿司匹林或氯吡格雷前和服用30 d后采集肘前静脉血,注入有3.8%枸橼酸钠的抗凝管中静置10 min备用,血小板-白细胞聚集体(PLA)的检测通过FC500 MPC流式细胞仪(BeckmanCoulter公司,迈阿密,佛罗里达州,美国)进行32,采用直接荧光标记法。
1.3 结局指标 通过记录患者入院时以及3、7、10、14 d和出院时的NIHSS评分评价患者的神经功能状态。本研究的主要有效性指标是早期神经功能恶化(END)。早期神经功能缺损定义为入院后10 d内NIHSS评分增加≥4分并且排除梗死后出血转化(HT)或其它血管分布区的新发梗死[31~35]。次要有效性指标包括复发缺血性卒中(RIS),外周血管事件(深静脉血栓形成[DVT],肺栓塞[PE],以及心肌梗死[MI])和治疗后30 d内的死亡。复发缺血性卒中定义为入院后突然发生的,持续时间>24 h的神经功能缺损,符合临床诊断标准并且影像学发现已发卒中区域以外独立血管供血区新发缺血性卒中。死亡定义为全因死亡。安全性指标包括治疗后30 d内的出血事件。出血事件包括梗死后出血转化(HT),与脑梗死无关的颅内出血(ICH)以及颅外出血(例如胃肠道出血、血尿)。严重出血事件定义为症状性颅内出血或者任何需要输血的出血事件。30 d或者在出院当时评价患者的NIHSS评分以及改良Rankin量表评分(mRS)。6 m时的mRS评分由对治疗分组不知情的临床医生进行评价。良好结局定义为mRS评分0~2分,残疾定义为存活者的mRS评分≥3分。31 d~6 m的复发缺血性卒中、心肌梗死、出血、深静脉血栓形成、肺栓塞和所有死亡均被记录。
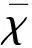
2 结 果
共574例患者纳入研究,其中286例分配到联合治疗组,288例分配到单药治疗组。4例患者(联合治疗组2例,单药治疗组2例)因不符合纳入标准(症状发生到开始治疗时间>48 h)在基线评估时被研究者剔除出研究。因此,570例患者(联合治疗组284例,单药治疗组286例)纳入分析。共4例(0.70%)患者(联合治疗组2例,单药治疗组2例)失访。单药治疗组中的9例(3.15%)患者及联合治疗中的10例(3.52%)患者在研究结束前终止使用研究所用药物。
表1概括了所有纳入研究对象的临床特征。纳入研究对象的中位发病年龄为70岁,45.09%为女性。两组患者的基线特征可比,两组在临床特征的分布上差异无统计学意义。联合治疗组和单药治疗组从卒中发生到随机分组的平均时间分别为(36.2±13.3)h和(34.4±14.2)h。
表2显示了30 d内的有效性及安全性结局指标。38例(6.7%)患者在治疗后10 d内发生早期神经功能恶化。与单药治疗组相比,联合治疗组早期神经功能恶化(END)的发生率更低(3.5% vs 9.8%,OR0.34,95%CI0.12~0.86,P<0.001)。570例患者中,23例(4%)的患者在入院后30 d内复发缺血性卒中。同样,与单药治疗组相比,联合治疗组缺血性卒中复发率更低(1.7% vs 6.3%,OR0.26,95%CI0.08~0.82,P<0.001;见表2)。这些结果显示在大动脉粥样硬化型卒中患者中,阿司匹林和氯吡格雷联合治疗与阿司匹林单药治疗相比,能够降低早期神经功能恶化的发生和缺血性卒中复发。
我们随后检验了是否阿司匹林和氯吡格雷联合治疗影响血小板聚集率和血小板-白细胞聚集体的形成。如表3所示,在抗血小板治疗前,两组间血小板聚集率和血小板-白细胞聚集体水平无显著差异。治疗后30 d,无论联合治疗组或单药治疗组血小板聚集率和血小板-白细胞聚集体水平和1 d时相比均显著降低,而氯吡格雷和阿司匹林联合治疗组血小板聚集率和血小板-白细胞聚集体水平更低(见表3)。研究结果表明氯吡格雷和阿司匹林联合治疗能够有效抑制血小板聚集功能和血小板-白细胞聚集体形成。
我们分析了是否血小板激活促成了神经功能恶化和卒中复发(见表4)。将所有标本按照是否发生早期神经功能恶化和卒中复发分为两组,与随后没有发生早期神经功能恶化和30 d内缺血性卒中复发的患者相比,发生END或RIS的患者1 d时AA或ADP诱导的血小板聚集率和血小板-白细胞聚集体水平更高。研究结果表明血小板激活在神经功能恶化和缺血性卒中复发过程中起着重要作用。
如表2所示,联合治疗组和单药治疗组在治疗后30 d心肌梗死、深静脉血栓形成、全因死亡的发生率以及梗死后出血转化、颅内出血和颅外出血发生率等安全性指标上无显著差异。我们随后关注了治疗后6 m结局。如表5所示,阿司匹林和氯吡格雷联合治疗组与阿司匹林单药治疗组在有效性结局指标(RIS、DVT、PE、MI和31 d到6 m时的全因死亡)和安全性结局指标(HT、ICH和颅外出血)上无显著差异。两组均未发生严重出血事件。
最后我们评价了疗效与患者的年龄、性别、基线NIHSS评分以及症状性动脉狭窄的关系(见表6)。6 m有效性结局指标分析显示,对于中位发病年龄>70岁的患者,联合治疗组与单药治疗组在良好结局的发生率上有显著差异[64.29%(81 of 126) vs 51.16%(66 of 129),P=0.038]。对于症状性后循环动脉狭窄的患者,联合治疗显著优于单药治疗,良好结局发生率分别为75.0%(51 of 68) vs 45.45%(30 of 66),P<0.001。同样在症状性基底动脉狭窄患者中,联合治疗也显著优于单药治疗,良好结局发生率分别为77.78%(28 of 36) vs 46.88%(15 of 32),P<0.001。我们的研究结果显示,阿司匹林和氯吡格雷联合治疗能够使70岁以上老年患者、后循环或基底动脉狭窄患者获益。
3 讨 论
血栓形成和动脉粥样硬化是缺血性卒中的主要发病机制。血小板在激发动脉血栓形成35和动脉粥样硬化进展36过程中起着关键作用。血小板激活和血小板-白细胞聚集体参与了缺血性卒中事件的发生[36,37]。然而,血小板激活和血小板-白细胞聚集体是否参与了急性缺血性卒中早期神经功能恶化及卒中复发尚未可知。在本研究中,经历了早期神经功能恶化或缺血性卒中复发的患者在卒中后入院当日测得的花生四烯酸(AA)诱导的或二磷酸腺苷(ADP)诱导的血小板聚集率和血小板-白细胞聚集体水平比没有发生早期神经功能恶化或卒中复发的患者更高。这表明高血小板聚集率和血小板-白细胞聚集体水平在急性大动脉粥样硬化型缺血性卒中后早期神经功能恶化或卒中复发的进程中起关键作用。因此,强化抗血小板治疗如双联抗血小板可能减少早期神经功能恶化或缺血性卒中复发。
缺血性卒中复发可导致缺血性卒中患者的不良预后,因此抗血小板治疗被推荐用于非心源性卒中或短暂性脑缺血发作患者的二级预防,以减少非致死性心肌梗死、非致死性卒中或血管性死亡的发生[38,39]。我们的研究表明双联抗血小板治疗比阿司匹林单药治疗更能有效预防早期神经功能恶化和缺血性卒中的复发。与阿司匹林单药治疗相比,联合抗血小板治疗并不增加出血的发生率。我们的研究结果与既往研究氯吡格雷和阿司匹林联合治疗用于缺血性卒中的其它临床试验结果不同[17,40,41]。可能的解释是,不同于以往的临床研究,本研究的研究对象是首次卒中且NIHSS评分小于15分的患者(出血的风险可能相对较低)。在以往的研究中,纳入患者卒中严重程度更重,并且没有在卒中发生后的前几个小时内纳入患者(而卒中发生后最初几个小时发生早期神经功能恶化和缺血性卒中复发的风险尤其较高[42,43]。其次,本研究双联抗血小板治疗的疗程是30 d,而既往研究中联合治疗的疗程是18~28 m。再次,既往研究纳入了所有类型的卒中患者,而本研究主要针对急性大动脉粥样硬化型卒中,抗血小板药物的作用在不同类型卒中患者中可能有差异[39]。现有的数项研究证实,对症状性颅内动脉狭窄为主要发病机制的患者,氯吡格雷和阿司匹林联合治疗与阿司匹林单药治疗相比,能够更有效地减少微栓子信号和缺血性卒中复发[19,20]。然而,对于新发腔隙性卒中患者,氯吡格雷和阿司匹林联合治疗不仅没有显著减少缺血性卒中复发,还显著增加了出血和死亡的风险[44]。
本研究发现,两组患者在治疗1 d,血小板聚集功能和血小板-白细胞聚集体水平并没有显著差异。然而,在治疗30 d,予以联合治疗的患者比单药治疗的患者这些指标显著降低,这表明联合治疗能更有效地抑制血小板活性。阿司匹林和氯吡格雷通过不同的生化途径抑制血小板粘附性。阿司匹林抗栓作用的主要机制是抑制血小板环氧化酶,减少血栓素A2的生成,而血栓素A2是血小板聚集的潜在刺激因素。阿司匹林的作用更集中于花生四烯酸(AA)诱导的血小板聚集过程中。氯吡格雷的作用机制在于通过阻断二磷酸腺苷(ADP)与血小板表面ADP受体的结合而抑制血小板聚集[13,14]。因此,二磷酸腺苷激动剂能更显著地抑制血小板聚集。这也可能是阿司匹林单药治疗对二磷酸腺苷诱导的血小板聚集无效(89.0onday1vs70onday30),而对花生四烯酸诱导的血小板聚集有显著效果的原因(89.5onday1vs20.6onday30)。因此,氯吡格雷和阿司匹林联合治疗可能对抗血小板聚集有协同作用。这或许就能解释双联抗血小板治疗比阿司匹林单药治疗更能有效地预防早期神经功能恶化和缺血性卒中复发。
本研究发现,两组卒中后31 d到6 m的缺血性卒中复发率没有显著差异。然而,对于中位发病年龄70岁以上的患者,与阿司匹林单药治疗相比,联合治疗与6 m良好结局显著相关。年龄是卒中的独立危险因素,随着年龄增长,血栓形成和动脉粥样硬化的发生率随之增加[45]。因此,这可能就是大于70岁的患者中,氯吡格雷和阿司匹林联合治疗比阿司匹林单药治疗更有效的原因。年龄不仅增大了颅内动脉粥样硬化的严重程度,同时还影响了闭塞血管的分布范围46。我们的研究还发现,联合治疗可能对后循环狭窄和基底动脉狭窄的患者更有效。其原因目前尚不明确。卒中的病因和发病机制在前循环卒中和后循环卒中中有所不同。后循环卒中更常见于动脉粥样硬化和局部分支血管闭塞,前循环卒中常与动脉到动脉栓塞相关,而与局部分支血管闭塞的关系相对较少[46,47]。因此,在不同的血管供血区双联抗血小板治疗效果可能不同。
两组患者在治疗期间梗死后出血转化、颅内出血或颅外出血的发生率没有显著性差异。所有患者均没有出现严重的出血事件。本研究的局限性在当前药物治疗策略应用于临床实践之前,需要更大规模的临床研究证实大动脉型急性缺血性卒中双联抗血小板治疗的优势。本研究结果出自两个中心的研究,其样本量均有限,因此,在付诸临床实践之前,需要更大的样本量的多中心研究进一步证实。此外,双联抗血小板治疗对于不同卒中亚型的有效性值得进一步探讨。
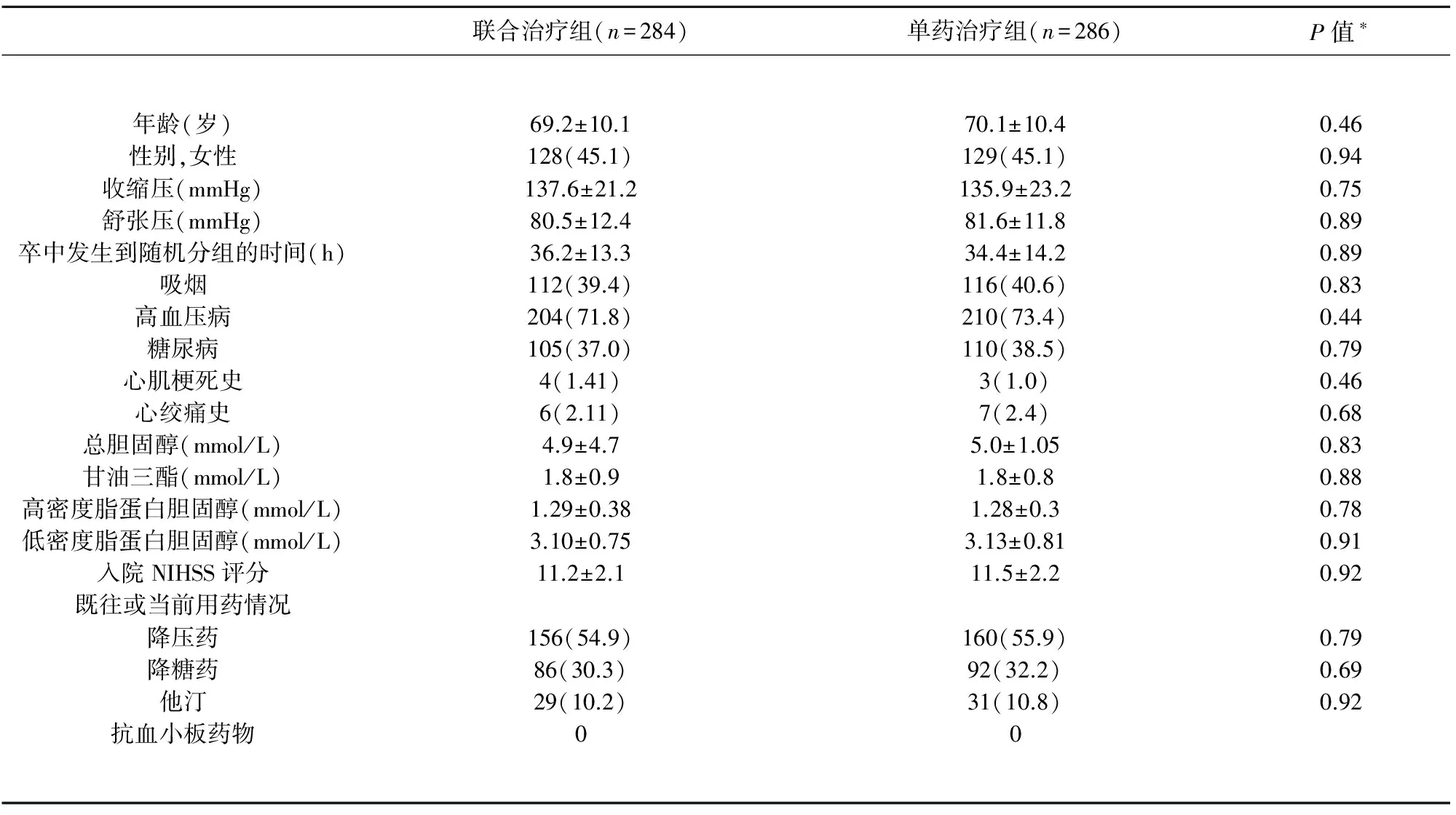
表1 联合治疗组和单药治疗组的人口统计学及基线特征(n,%)
*:统计学显著性基于Student’st检验和卡方检验;NIHSS:美国国立卫生院卒中量表评分

表2 联合治疗组和单药治疗组30 d时的结局(n,%)
OR:比值比;CI:可信区间. ;*:代表卒中后10 d内的数据.
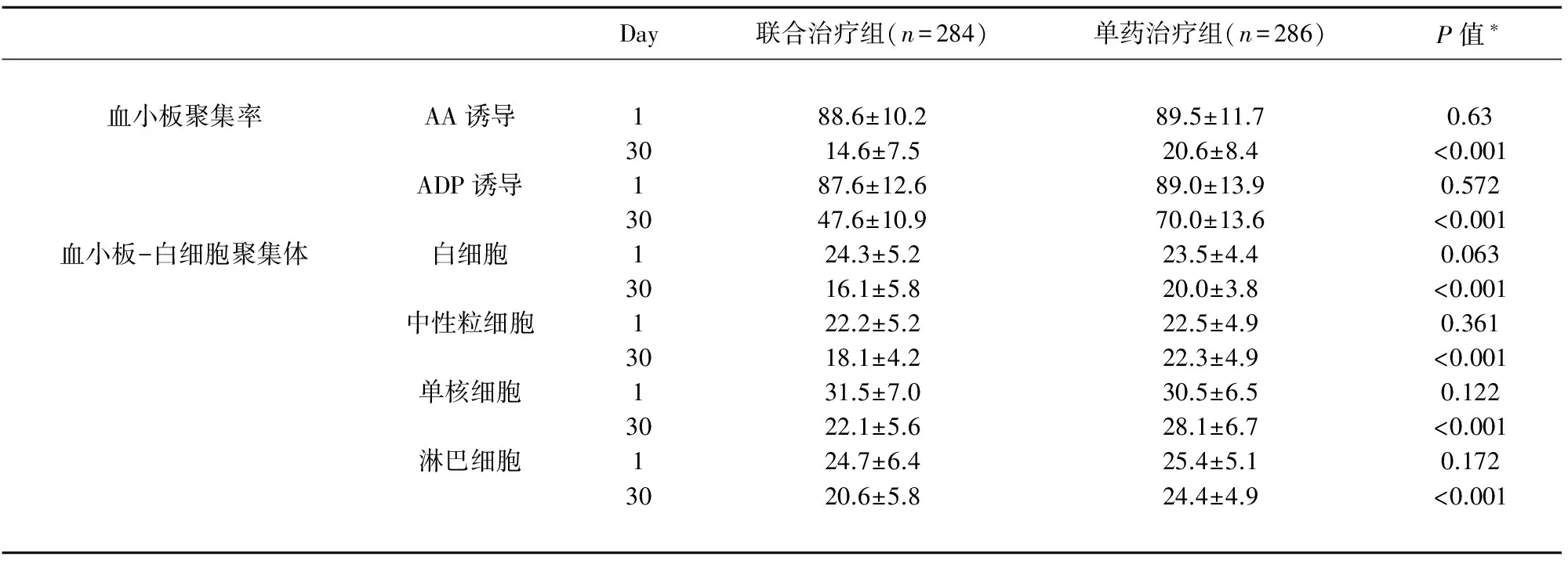
表3 联合治疗组和单药治疗组的血小板聚集率和血小板-白细胞聚集体水平(%)
*:统计学显著性基于Student’st检验;AA:花生四烯酸;ADP:二磷酸腺苷.

表4 发生END或30 d内RIS患者与未发生的患者在卒中后1 d时的血小板聚集率和血小板-白细胞聚集体水平(%)
*:统计学显著性基于Student’st检验;AA:花生四烯酸;ADP:二磷酸腺苷;END:早期神经功能恶化;RIS:缺血性卒中复发
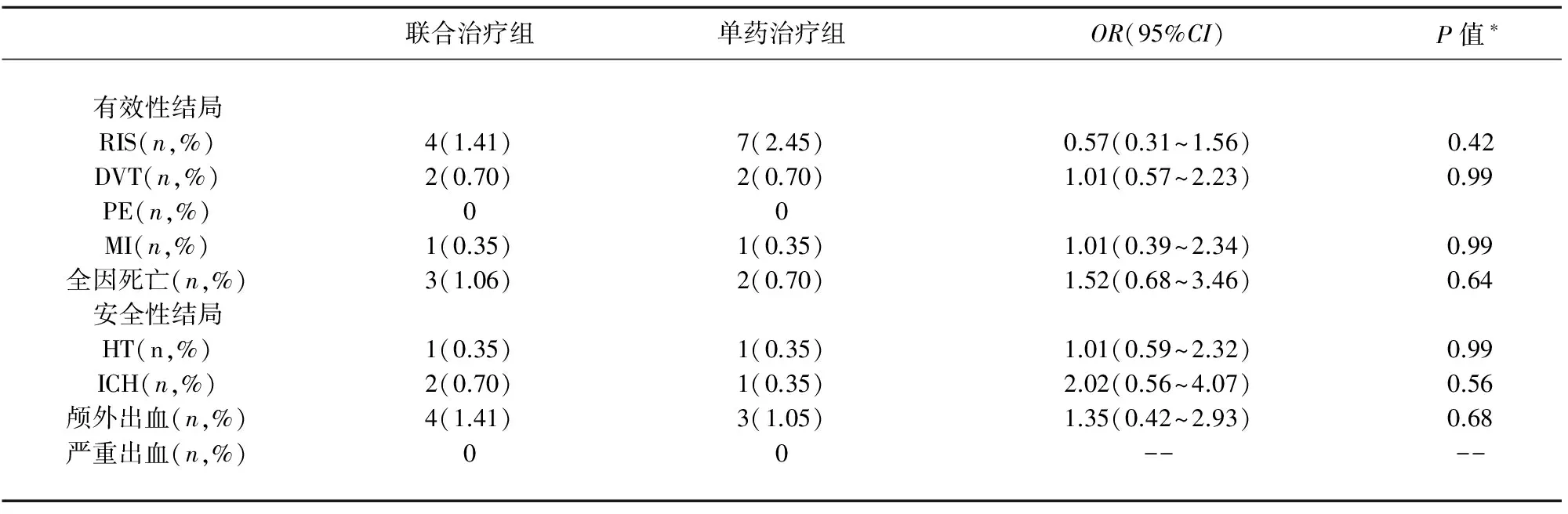
表5 两组31 d到6 m时结局比较
*:统计学显著性基于卡方检验;RIS:缺血性卒中复发;DVT:深静脉血栓形成;PE:肺栓塞;MI:心肌梗死;HT:梗死后出血转化;ICH:颅内出血;OR:比值比;CI:可信区间.
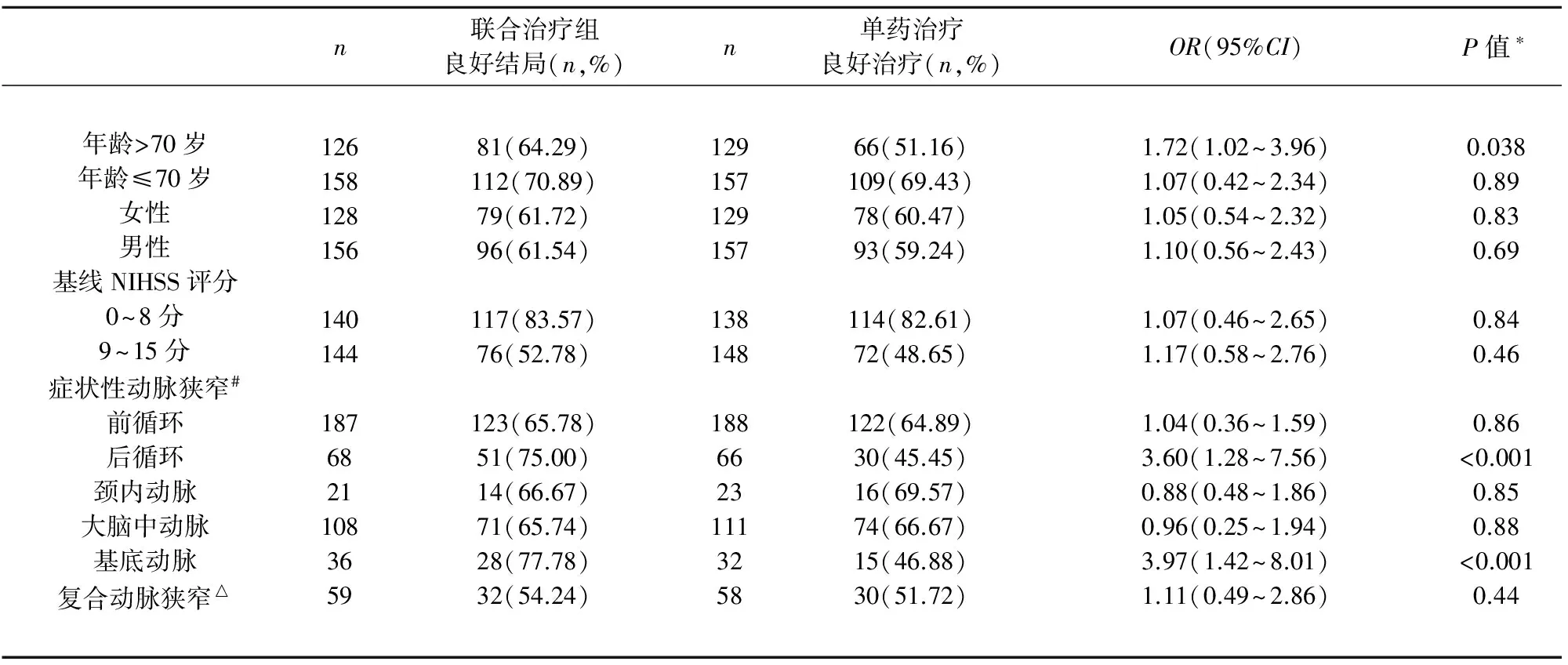
表6 联合治疗组和单药治疗组特定亚组6 m时mRS评分比较
NIHSS:美国国立卫生院卒中量表评分;OR:比值比;CI:可信区间;*:卡方检验用于联合治疗组和单药治疗组良好结局的比较;#:症状性动脉狭窄的确定通过颈动脉超声、CT血管成像或磁共振血管成像等血管影像学检查方式;△:复合动脉狭窄包括颈内动脉和大脑中动脉,大脑中动脉和大脑前动脉,大脑后动脉和基底动脉,大脑后动脉和椎动脉,基底动脉和椎动脉,入组时双侧椎动脉狭窄均被认为系症状性动脉狭窄
[1]Hill MD,Yiannakoulias N,Jeerakathil T,et al. The high risk of stroke immediately aftertransient ischemic attack:a population-based study[J]. Neurology,2004,62(11):2015-2020.
[2]Coull AJ,Lovett JK,Rothwell PM. Population based study ofearly risk of stroke after transient ischaemic attack or minor stroke:implications for public education and organisation of services BMJ[J]. 2004,328(7435):326.
[3]Johnston SC,Leira EC,Hansen MD,et al. Early recovery after cerebral ischemia risk of subsequent neurological deterioration[J]. Ann Neurol,2003,54(4):439-444.
[4]Johnston SC,Easton JD. Are patients with acutely recovered cerebralischemia more unstable[J]? Stroke,2003,34(10):2446-2450.
[5]FurieKL,Kasner SE,Adams RJ,et al. Update to theAHA/ASArecommendationsfor the prevention of stroke in patients with strokeand transient ischemic attack[J]. Stroke,2008,39(5):1647-1652.
[6]Barnett HJM,Eliasziw M,Meldrum HE. Drugs and surgery in theprevention of ischemic stroke[J]. N Engl J Med,1995,332(4):238-248.
[7]Algra A,van Gijn J. Aspirin at any dose above 30 mg offers onlymodest protection after cerebral ischemia[J]. J Neurol Neurosurg Psychiatry,1996,60(2):197-199.
[8]Diener HC,Cunha L,Forbes C,et al. European stroke prevention study 2:dipyridamole and acetylsalicylicacid in the secondary prevention of stroke[J]. J Neurol Sci,1996,143(1-2):1-13.
[9]CAPRIE Steering Committee. A randomised,blinded,trial of clopidogrel versus aspirin in patients at risk of ischemic events Lancet[J]. 1996,348(9038):1329-1339.
[10]Schwammenthal Y,Tsabari R,Shenkman B,et al. Aspirin responsiveness in acute brain ischaemia:association with stroke severity and clinical outcome[J]. Cerebrovasc Dis,2008,25(4):355-361.
[11]Yi X,Zhou Q,Lin J,et al. Aspirin resistance in Chinese stroke patients increased the rate of recurrent stroke and other vascular events[J]. Int J Stroke,2013,8(7):535-539.
[12]Sacco RL,Diener HC,Yusuf S,et al. Aspirin and extendedrelease dipyridamole versus clopidogrel for recurrent stroke[J]. N Engl J Med,2008,359(12):1238-1251.
[13]Herbert JM,Dol F,Bernat A,et al. The antiaggregating and antithrombotic activity of clopidogrel is potentiated by aspirin in several experimental models in the rabbit[J]. Thromb Haemost,1998,80(3):512-518.
[14]Makkar RR,Eigler NL,Kaul S,et al. Effects of clopidogrel,aspirin and combined therapy in a porcine ex vivo model ofhigh-shear induced stent thrombosis[J]. Eur Heart J,1998,19(10):1538-1546.
[15]Yusuf S,Zhao F,Mehta SR,et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation[J]. N Engl J Med,2001,345(7):494-502.
[16]Steinhubl SR,Berger PB,Mann JT,et al. Clopidogrel for the Reduction of Events During Observation. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention:a randomized controlled trial[J]. JAMA,2002,288(19):2411-2420.
[17]Bhatt DL,Fox KA,Hacke W,et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events[J]. N Engl J Med,2006,354(16):1706-1717.
[18]The SPS3 Investigators. Effects of clopidogrel added to aspirin in patients with recent lacunar stroke[J]. N Engl J Med,2012,367(9):817-825.
[19]Wong KS,Chen C,Fu J,et al. Clopidogrel plus aspirin versus aspirin alone for reducing embolisation in patients with acute symptomatic cerebral or carotid artery stenosis (CLAIR study):a randomised,open-label,blinded-endpoint trial[J]. Lancet Neurol,2010,9(5):489-497.
[20]Markus HS,Droste DW,Kaps M,et al. Dual antiplatelet therapy with clopidogrel and aspirin in symptomatic carotid stenosis evaluated using doppler embolic signal detection:the clopidogrel and aspirin for reduction of emboli in symptomatic carotid stenosis (CARESS) trial[J]. Circulation,2005,111(17):
[21]Kennedy J,Hill MD,Ryckborst KJ,et al. Fast assessment of stroke and transient ischaemic attack to prevent early recurrence (FASTER):a randomized controlled pilot trial[J]. Lancet Neurol,2007,6(11):961-969.
[22]Tuttolomondo A,Pecoraro R,Di Raimondo D,et al. Stroke subtypes and their possible implication in stroke prevention drug strategies[J]. Curr Vasc Pharmacol,2013,11(6):824-837.
[23]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al. Inflammation in ischemic stroke subtypes[J]. Curr Pharm Des,2012,18(28):4289-4310.
[24]Lavalle PC,Labreuche J,Faille D,et al. Circulating markers of endothelial dysfunction and platelet activation in patients with severe symptomatic cerebral small vessel disease[J]. Cerebrovasc Dis,2013,36(2):131-138.
[25]Toghi H,Suzuki H,Tamura K,et al. Platelet volume,aggregation,and adenosine triphosphate release in cerebral thrombosis[J]. Stroke,1991,22(1):17-22.
[26]de Stoppelaar SF,van’t Veer C,van der Poll T. The role of platelets in sepsis[J]. Thromb Haemost,2014;112(2).
[27]Licata G,Tuttolomondo A,Corrao S,et al. Immunoinflammatory activation during the acute phase of lacunar and non-lacunar ischemic stroke:association with time of onset and diabetic state[J]. Int J Immunopathol Pharmacol,2006,19(3):639-646.
[28]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al. Atherosclerosis as an inflammatory disease[J]. CurrPharm Des,2012,18(28):4266-4288.
[29]Han SW,Kim SH,Lee JY,et al. A new subtype classification of ischemic stroke based on treatment and etiologic mechanism[J]. EurNeurol,2007,57(2):96-102.
[30]Yi X,Zhou Q,Lin J,et al. Platelet response to aspirin in Chinese stroke patients is independent of genetic polymorphisms of COX-1 C50 T and COX-2 G765C[J]. J Atheroscler Thromb,2013,20(1):65-72.
[31]Zeller JA,Frahm K,Baron R,et al. Plateletleukocyte interaction and platelet activation in migraine:a link to ischemic stroke[J]? J Neurol Neurosurg Psychiatry,2004,75(7):984-987.
[32]Wang Q,Chen C,Chen XY,et al. Low-molecular-weight heparin and early neurologic deterioration in acute stroke caused by large artery occlusive disease[J]. Arch Neurol,2012,69(11):1454-1460.
[33]Weimar C,Mieck T,Buchthal J,et al. Neurologic worsening during the acute phase of ischemic stroke[J]. Arch Neurol,2005,62(3):393.
[34]Ruggeri ZM. Platelets in atherothrombosis[J]. Nat Med,2002,8(11):1227-1234.
[35]Fateh-Moghadam S,Li Z,Ersel S,et al. Platelet degranulation is associated with progression of intima-media thickness of the common carotid artery in patients with diabetes mellitus type 2[J]. Arterioscler Thromb Vasc Biol,2005,25(6):1299-1303.
[36]Marquardt L,Ruf A,Mansmann U,et al. Course of platelet activation markers after ischemic stroke[J]. Stroke,2002,33(11):2570-2574.
[37]McCabe DJ,Harrison P,Mackie IJ,et al. Platelet degranulation and monocyte-platelet complex formation are increased in the acute and convalescent phases after ischaemic stroke or transient ischaemic attack[J]. Br J Haematol,2004,125(6):777-787.
[38]Pinto A,Di Raimondo D,Tuttolomondo A,et al. Antiplatelets in stroke prevention[J]. Curr Vasc Pharmacol,2013,11(6):803-811.
[39]Pinto A,Di Raimondo D,Tuttolomondo A,et al. Antiplatelet treatment in ischemic stroke treatment[J]. Curr Top Med Chem,2009,9(14):1298-1231.
[40]Johnston SC,Gress DR,Browner WS,et al. Sidney S. Short-term prognosis after emergency department diagnosis of TIA[J]. JAMA,2000,284(22):2901-2906.
[41]Lovett JK,Coull AJ,Rothwell PM. Early risk of recurrence by subtype of ischemic stroke in population-based incidence studies[J]. Neurology,2004,62(4):569-753.
[42]Alawneh JA,Moustafa RR,Baron JC. Hemodynamic factors and perfusion abnormalities in early neurological deterioration[J]. Stroke,2009,40(6):e443-e450.
[43]Nolte CH,Albach FN,Heuschmann PU,et al. Silent new DWI lesions within the first week after stroke[J]. Cerebrovasc Dis,2012,33(3):248-254.
[44]SPS3 Investigators,Benavente OR,Hart RG,et al. Effects of clopidogrel added to aspirin in patients with recent lacunar stroke[J]. N Engl J Med,2012,367(9) 817-825.
[45]Turan TN,Makki AA,Tsappidi S,et al. Risk factors associated with severity and location of intracranial arterial stenosis[J]. Stroke,2010,41(8):1636-1640.
[46]Bogousslavsky J,Regli F,Maeder P,et al. The etiology of posterior circulation infarcts:a prospective study using magnetic resonance imaging and magnetic resonance angiography[J]. Neurology,1993,43(8):1528-1533.
[47]Kim JS,Nah HW,Park SM,et al. Risk factors and stroke mechanisms in atherosclerotic stroke:intracranial compared with extracranial and anterior compared with posterior circulation disease[J]. Stroke,2012,43(8):3313-3318.
Clopidogrel Plus Aspirin Prevents Early Neurologic Deterioration and Improves 6-Month Outcome in Patients with Acute Large Artery Atherosclerosis Stroke
FENG Qin,LI Jie,YI Xingyang,et al.
(Department of Neurology,People’s Hospital of Deyang City,Deyang 618000,China)
Objective To evaluate the effects of treatments with clopidogrel plus aspirin (dual therapy) on early neurological deterioration (END) and outcomes at 6 months in patients with acute large artery atherosclerosis (LAA) stroke. Methods A total of 574 patients with LAA stroke were randomly assigned to receive either dual therapy or aspirin alone (monotherapy). The primary outcome was END. Secondary outcomes included recurrent ischemic stroke (RIS) and outcomes at 6 months. Results The prevalence of END and RIS was lower in patients on dual therapy than in those on monotherapy during the 30 days. At 6 months,dual therapy improved outcomes among older patients and those with symptomatic stenosis in the posterior circulation and basilar artery. Conclusion Clopidogrel plus aspirin is superior to aspirin alone for reducing END and RIS within 30 days and improves outcomes in certain subgroups at 6 months.
Acute ischemic stroke; Early neurological deterioration; Dual antiplatelet therapy; Monoantiplatelet therapy
1003-2754(2016)11-0980-07
2016-03-15;
2016-09-06
(四川省德阳市人民医院神经内科,德阳 四川 618000)
易兴阳,E-mail:YiXingYang64@126.com
R743
A
