脑微出血患者血清25(OH)D水平的临床意义探讨
2016-12-21徐宾金岗生冯炯陈衍
徐宾 金岗生 冯炯 陈衍
脑微出血患者血清25(OH)D水平的临床意义探讨
徐宾 金岗生 冯炯 陈衍
目的 探讨血清25(OH)D水平和脑微出血分布情况的相关性。方法 对2013年1月至2014年12月神经内科住院诊治的146例急性脑梗死或短暂性脑缺血发作患者,采用磁敏感加权成像(SWI)检测脑微出血及其部位,依据SWI结果提示将患者分为有脑微出血58例(脑微出血组)及无脑微出血88例(对照组)。采用酶联免疫吸附法检测两组患者血清25(OH)D水平并作比较,同时对血清25(OH)D水平与脑微出血灶数量、分布部位的关系进行分析。结果 脑微出血组血清25(OH)D水平为(25.8± 10.8)nmol/L,低于对照组的(37.1±12.9)nmol/L,差异有统计学意义(t=12.182,P<0.05)。血清25(OH)D水平降低是深部脑微出血及混合脑微出血的危险因素(P<0.05或0.01)。25(OH)D水平与脑微出血的数量呈负相关(r=-0.475,P<0.01)。结论 血清25(OH)D水平降低是急性脑梗死或短暂性脑缺血发作患者深部脑微出血的危险因素。
25(OH)D 脑微出血 SWI脑梗死
脑微出血是脑小血管病变引起的一种亚临床脑实质损害,以脑小血管微小出血为主要特征。由于出血量少,患者临床上常无典型症状和体征[1]。脑微出血常出现在高血压性脑病、脑淀粉样血管病和阿尔茨海默病等人群中,与缺血性卒中患者溶栓后出血、卒中复发、脑出血及认知功能下降等均密切相关,因此受到高度关注[2-6]。近来己有临床研究证据表明血清25(OH)D水平降低是高血压病、2型糖尿病、心血管疾病和认知功能受损的危险因素[6-9]。同时高血压病、2型糖尿病均可影响到脑微小血管,导致脑微出血的发生[10]。本研究分析脑微出血患者血清25(OH)D水平的临床意义,现将结果报道如下。
1 对象和方法
1.1 对象选择 2013年1月至2014年12月金华市中医院神经内科住院,起病7d内的急性脑梗死或短暂性脑缺血发作患者146例,均符合1995年全国第四届脑血管病学术会议制定的诊断标准[11]。男103例,女43例,年龄42~82(64.1±9.8)岁;其中高血压病100例(68.5%),糖尿病32例(21.9%),高脂血症48例(32.9%),冠心病11例(7.5%),吸烟50例(34.2%),饮酒54例(37.0%)。依据磁敏感加权成像(SWI)结果提示将患者分为有脑微出血58例(脑微出血组)及无脑微出血88例(对照组)。排除标准:(1)患有幽闭恐惧症、体内植入心脏起搏器等导致MRI检查禁忌或不能配合完成MRI检查的患者;(2)有严重的心、肺、肝、肾功能不全及全身其他严重疾病的患者;(3)颅内出血、脑外伤、脑部肿瘤、中枢神经系统感染或其他感染性疾病等。本研究得到金华市中医院伦理委员会批准,并获得患者及家属知情同意(签署知情同意书)。
1.2 方法
1.2.1 两组患者临床资料比较 比较两组患者性别、年龄、高血压病史、糖尿病史、高脂血症史、吸烟史、饮酒史、冠心病史、收缩压、舒张压及美国国立卫生研究院神经功能缺损评分(NIHSS)。所有入组患者于入院后次日清晨空腹抽取肘正中静脉血5ml,检测并比较两组患者总胆固醇水平、空腹血糖及C反应蛋白等各项指标。运用酶联免疫吸附法(ELISA)测定两组患者血清25(OH)D水平并比较。检测试剂盒用购买于英国IDS公司,所有检测步骤按照说明书进行操作。
1.2.2 脑微出血部位及数量的评定 应用西门子公司Trio 3.0 T超导磁共振仪,头颅12通道正交线圈,对所有患者进行T1加权、T2加权、SWI、DWI及液体衰减反转恢复序列扫描。SWI扫描参数:重复时间28ms;回波时间20ms;翻转角15°;视野184mm×230mm;矩阵218× 320;激励次数1次;层厚1.5mm;层数96层;iPAT因子2;扫描时间5min24s。脑微出血定义为在SWI上表现为直径2~10mm且质地均一的圆形、类圆形或椭圆形的低信号缺失,边界清楚,周围无水肿,排除基底核区钙化、血管流空效应、眼眶和乳突骨伪影、海绵状血管瘤、血管畸形及血管周围间隙扩大造成的影响。由2位经验丰富的影像科医师参考微出血解剖评定量表对脑微出血的部位及数量进行评定,根据出血部位分为脑叶微出血、深部微出血及脑叶合并深部的混合微出血,并分别予以计数[2,12]。分析血清25(OH)D水平与脑微出血灶数量及分布部位的相关性。
1.3 统计学处理 应用SPSS17.0统计软件,计量资料以表示,组间比较采用t检验,非正态分布的资料采用独立样本Mann-Whitney U检验。计数资料以百分率表示,组间比较采用χ2检验或Fisher精确概率法。变量相关关系分析采用Pearson相关系数。采用多因素logistic回归分析血清25(OH)D水平降低与脑微出血灶数量、分布部位的关系。
2 结果
2.1 两组患者临床资料的比较 见表1。
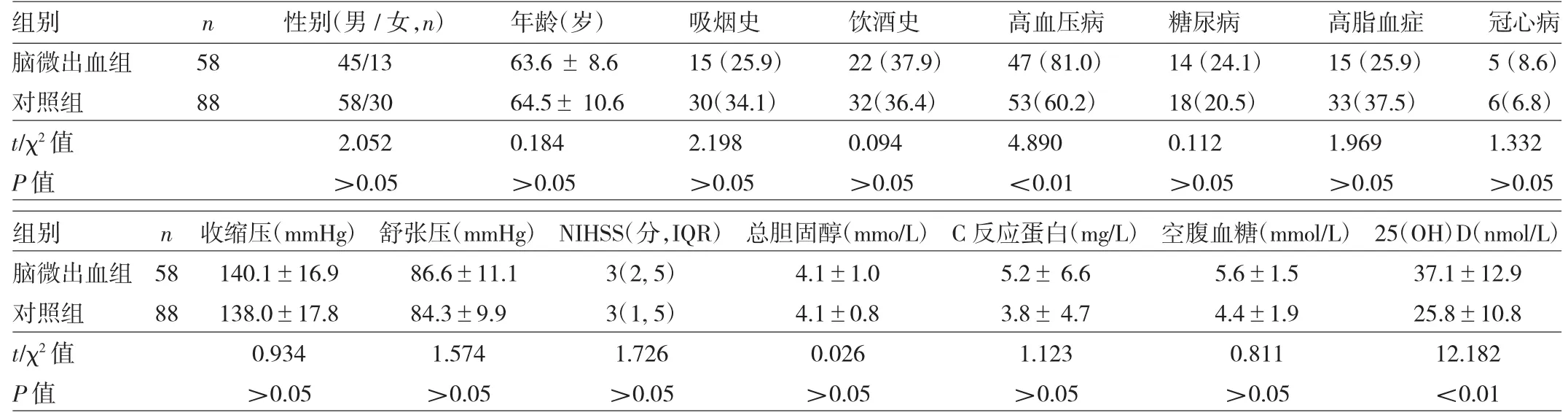
表1 两组临床资料的比较[例(%)]
由表1可见,脑微出血组血清25(OH)D水平低于对照组,而高血压病患病率高于对照组,差异均有统计学意义(均P<0.01)。两组患者其他项目指标比较,差异均无统计学意义(均P>0.05)。
2.2 血清25(OH)D水平与脑微出血灶数量的相关性脑微出血组患者中,脑叶微出血15例(25.9%),深部微出血16例(27.6%),混合微出血27例(46.5%);微出血灶1~42个,其中1个16例(27.6%),2~10个30例(51.7%),>10个12例(20.7%)。以脑微出血数量为因变量,血清25(OH)D水平为自变量进行Pearson相关分析显示:血清25(OH)D水平与脑微出血数量呈负相关(r=-0.475,P<0.01)。
2.3 血清25(OH)D水平与脑微出血部位的相关性以是否存在脑微出血、脑叶微出血、深部微出血及混合微出血为因变量,将血清25(OH)D水平为自变量纳入多因素logistic回归模型进行分析,结果见表2。

表2 血清25(OH)D水平与不同部位脑微出血的相关性
由表2可见,25(OH)D水平降低是脑微出血、深部微出血及混合微出血患者的危险因素(P<0.05或0.01)。
3 讨论
脑微出血是由于脑微小血管病、小动脉硬化、脑淀粉样变性等导致微量血液通过病变的血管壁外漏所致,血脑屏障损伤和内皮细胞完整性破坏可能是其形成的主要因素,渗出的红细胞破裂分解后产生的含铁血黄素被巨噬细胞吞噬,于血管周围间隙形成含铁血黄素沉积,在特殊的影像学检查手段(GRE-T2WI或SWI)表现为2~10mm的圆形或类圆形信号丢失区域,周围无水肿[1,4]。既往研究表明,脑微出血在无症状或健康的老年人群中的患病率为5%~6%,在缺血性脑血管患者中的患病率高达12%~71%[2,13-14],本研究采用SWI检测脑微出血,结果表明58例(39.7%)急性缺血性脑血管病患者伴有不同程度的脑微出血,同既往文献报道类似。
本研究结果显示,深部微出血、混合微出血和脑叶微出血的高血压病患病率差异有统计学意义,类似于既往文献报道称高血压病为脑微出血的危险因素,尤其收缩压水平与脑微出血密切相关[5]。既往研究表明,低血清25(OH)D水平人群更有可能发生高血压[8]。本研究也显示高血压病患者血清25(OH)D水平较低,但由于样本量较小,差异并无统计学意义。25(OH)D水平降低参与高血压的发病机制可能有:(1)25(OH)D是活性维生素D的前体,维生素D经过肝脏25α羟化酶和肾脏1α羟化酶转变为有活性的1,25二羟基维生素D。1,25二羟基维生素D可抑制小鼠体内肾素的表达,负性调节肾素-血管紧张素系统[15];(2)1,25二羟基维生素D亦抑制体外培养的血管平滑肌细胞的生长,使得血管硬化[16-17];(3)胰岛素抵抗和25(OH)D降低有关[7],维生素D能够提高胰岛素分泌和胰岛素的敏感度,使血管收缩减弱,最后起到预防及逆转动脉粥样硬化的作用。因此,25(OH)D可能是通过肾素-血管紧张素-醛固酮系统,胰岛素抵抗和血管内皮功能等途径参与人体血压水平的调节。
本研究采用logistic回归进一步分析显示,血清25(OH)D水平与深部微出血和混合微出血相关,但与单纯脑叶微出血无关。这可能是因为深部微出血和脑叶微出血的病理学基础不同。既往研究表明深部微出血的病理学基础通常是小分支血管管壁在高血压和糖尿病等危险因素的影响下,平滑肌被纤维组织或坏死组织取代,动脉中层组织出现退行性改变,发生透明样变性的分支小血管破裂,血液外渗形成微出血。而脑叶微出血主要是由于淀粉样蛋白沉积引发皮质和软脑膜小血管壁结构的改变[18-21]。脑微出血的发病机制目前仍不明确,但上述两种方式最后均可能导致血脑屏障功能紊乱、血管神经单元损伤以及内皮完整性受损,从而继发脑微出血[4,19]。由于25(OH)D水平和高血压有明显的相关性,因此血清25(OH)D水平降低可能参与介导脑深部微出血的发生。
本研究尚存在一些不足:本研究是我院的单中心、横断面研究,样本数量有限;入组首次发病的急性脑血管病患者,不能排除梗死病灶大小对血清25(OH)D水平的影响;所有患者血清25(OH)D水平的检测都是入院后第2天清晨,时间点单一,缺乏动态检测;本研究显示血清25(OH)D水平的下降和脑小血管病的发生相关。因此,25羟基维生素的替代治疗能否防止或降低脑小血管病的负担仍有待于前瞻性、多中心及大样本量基于人群为基础的研究来证实。本研究的价值在于通过观察血清25(OH)D水平的降低与不同部位脑微出血的相关性,证实了血清25(OH)D的水平降低是深部微出血发生的危险因素,但其确切的发病机制有待于进一步的研究。
[1]Cordonnier C.Brain microbleeds[J].PractNeurol,2010,10(2): 94-100.
[2]Poels M M,Vernooij M W,Ikram M A,et al.Incidence of cerebral microbleeds in the general population:the Rotterdam Scan Study [J].Stroke,2011,42(3):656-661.
[3]VVernooij M W,Haag M D,van der Lugt A,et al.Use of antithrombotic drugs and the presence of cerebral microbleeds:the Rotterdam Scan Study[J].Arch Neuro,2009,66(6):714-720.
[4]Loitfelder M,Seiler S,Schwingenschuh P,et al.Cerebral microbleeds:a review[J].Panminerva Med,2012,54(3):149-160.
[5]Charidimou A,Kakar P,Fox Z,et al.Cerebral microbleeds and recurrent stroke risk:systematic review and meta-analysis ofprospective ischemic stroke and transient ischemic attack cohorts[J].Stroke,2013,44(4):995-1001.
[6]Rihan W,Chao F,Yanxin Z,et al.A meta-analysis of association between cerebral microbleeds and cognitive impairment[J].Med SciMonit,2014,20:2189-2198.
[7]Song B,Kim H,Choi D O,et al.Association between serum 25-hydroxyvitamin D level and insulin resistance in a rural population[J].YonseiMed J,2014,55(4):1036-1041.
[8]Forman J,Giovannucci E,Holmes M,et al.Plasma 25-hydroxyvitamin D levels and risk of incident hypertension[J].Hypertension,2007,49(5):1063-1069.
[9]Kunadian V,Ford G,Bawamia B,et al.Vitamin D deficiency and coronary artery disease:a review of the evidence[J].Am Heart J, 2014,167(3):283-291.
[10]Vernooij M,van der Lugt A,Ikram M,et al.Prevalence and risk factors of cerebral microbleeds:The Rotterdam Scan Study SYMBOL[J].Neurology,2008,70(14):1208-1214.
[11]中华神经外科学会中华神经科学会,各类脑血管疾病诊断要点[J].中华神经科杂志1996,29(1):379-380.
[12]Gregoire S,ChaudharyU,Brown M,etal.The microbleedanatomicalratingscale(MARS):reliability of a tool to map brain microbleeds[J].Neurology,2009,73(21):1759-1766.
[13]Koennecke H.Cerebral microbleeds on MRI:prevalence,associations,and potential clinical implications[J].Neurology,2006, 66(2):165-171.
[14]Cordonnier C,Al-ShahiSalman R,Wardlaw J.Spontaneous brain microbleeds:systematic review,subgroup analyses and standards for study design and reporting[J].Brain,2007,130(Pt8): 1988-2003.
[15]Wang L,Manson J,Song Y,et al.Systematic review:Vitamin D and calcium supplementation in prevention of cardiovascular events[J].Ann Intern Med,2010,152(5):315-323.
[16]Tukaj S,Trzonkowski P,Tukaj C.Regulatory effects of 1,25-dihydroxyvitamin D3 on vascular smooth muscle cells[J].Acta-Biochim Pol,2012,59(3):395-400.
[17]Cardús A,Parisi E,Gallego C,et al.1,25-Dihydroxyvitamin D3 stimulates vascular smooth muscle cell proliferation through a VEGF-mediated pathway[J].KidneyInt,2006,69(8):1377-1384.
[18]Hawkes C,Sullivan P,Hands S,et al.Disruption of arterial perivascular drainage of amyloid-β from the brains of mice expressing the human APOE ε4 allele[J].PLoS One,2012,7 (7):e41636.
[19]Charidimou A,Werring D.Cerebral microbleeds:detection, mechanisms and clinicalchallenges[J].Future Neurol,2011,6(5): 587-609.
[20]Vemooij M.Cerebral microbleeds:do they really predict macrobleeding?[J].Int J Stroke,2012,7(7):565-566.
[21]Dierksen G,Skehan M,Khan M,et al.Spatial relation between microbleeds and amyloid deposits in amyloid angiopathy[J]. Ann Neurol,2010,68(4):645-648.
Association between serum 25-Hydroxyvitamin D level and distribution patterns of cerebral microbleeds in patients with acute ischemic
cerebrovascular disease
XU Bin,JIN Gangsheng,FENG Jiong,et al.Department of Neurology,Jinhua Municipal TCM Hospital, Jinhua 321017,China
Objective To investigate the association between serum 25-Hydroxyvitamin D[25(OH)D]level and distribution patterns of cerebral microbleeds(CMB)in patients with acute ishcemic cerebrovascular disease. Methods One hundred and forty-six patients with acute ischemic cerebrovascular disease were enrolled from Jan 2013 to Dec 2014.All patients underwent susceptibility weighted imaging scan and the clinical data were corrected.The association of serum 25(OH)D level with different location of CMB were analyzed by logistic regression analysis. Results Among 146 patients,CMB occurred in 58 cases(40.1%), including 15 cases of purely lobar CMB,16 of pure deep CMB and 27 of lobar with deep CMB.There were significant differences in serum 25(OH)D levels among patients with CMB negative,purely lobar CMB,purely deep CMB and combined CMB groups (P<0.05).Multivariate logistic regression analysis indicated that low levels of serum 25(OH)D were significantly associated with the presence of CMB(OR=0.917,95%CI:0.884~0.951,P<0.001),deep CMB(OR=0.874,95%CI:0.813~0.939,P=0.004)and combined CMB(OR=0.877,95%CI:0.826~0.930,P<0.001).In addition,Pearson analysis showed that serum 25(OH)D level was negatively correlated with the number of CMBs. Conclusion Low serum 25(OH)D level is an independent predictors for the presence of deep CMB in patients with acute ischemic cerebrovascular disease.
25-Hydroxyvitamin Cerebral microbleeds Susceptibility weighted imaging ischemic cerebrovascular disease
2015-08-23)
(本文编辑:杨丽)
321017 金华市中医院神经内科
徐宾,E-mail:xubing_neuro@126.com
