蛛网膜下腔注射SRT1720对慢性坐骨神经结扎大鼠脊髓SIRT1表达和NF-κB去乙酰化调节的影响
2016-12-21吕晨郭小文郑晖叶玲马千张娟
吕晨 郭小文 郑晖 叶玲 马千 张娟
●论 著
蛛网膜下腔注射SRT1720对慢性坐骨神经结扎大鼠脊髓SIRT1表达和NF-κB去乙酰化调节的影响
吕晨 郭小文 郑晖 叶玲 马千 张娟
目的 探讨蛛网膜下腔注射SRT1720对慢性坐骨神经结扎(CCI)大鼠脊髓沉默信息调节因子2相关酶1(SIRT1)表达和活性的影响,以及对NF-κB p65去乙酰化的调节作用。方法 将120只雄性SD大鼠采用随机数表法分成5组,每组24只,即假手术组(S)组、坐骨神经结扎组(CCI组)、二甲亚砜(DMSO)组、坐骨神经结扎+低剂量SRT1720治疗组(CCI+LD组)和坐骨神经结扎+高剂量SRT1720治疗组(CCI+HD组)。其中CCI、DMSO、CCI+LD和CCI+HD组大鼠提前8d蛛网膜下腔预置给药导管后建立CCI模型。DMSO组从手术日起,每天通过蛛网膜下腔预置细管给予10μl DMSO,而CCI+LD组和CCI+HD组每天分别给予SRT1720 10μg和20μg(溶于10μl DMSO)。在CCI前1d、CCI后1、3和7d各组分别处死大鼠6只,取L4~5段手术侧脊髓组织,采用荧光法测定沉默信息调节因子2相关酶1(SIRT1)活性,Western blot法测定SIRT1、NF-κB、乙酰化-NF-κB p65(Lys310)水平,并计算各组NF-κB的乙酰化水平(乙酰化-NF-κB p65/NF-κB)。结果 与S组比较,CCI和DMSO组在CCI后各时点SIRT1水平和酶活性均显著下降(均P<0.01),相反,NF-κB、乙酰化-NF-κB p65水平和NF-κB乙酰化水平均显著升高(均P<0.01);而与CCI组比较,CCI+LD和CCI+HD组在CCI后3d、7d SIRT1水平和酶活性均较高(均P<0.01),NF-κB、乙酰化-NF-κB p65(Lys310)水平则较低。其中SRT1720高剂量组在CCI后7d,SIRT1水平和酶活性显著高于低剂量组(P<0.01),而NF-κB的乙酰化水平则更低(P<0.01)。结论 SRT1720蛛网膜下腔给药可改善CCI导致的脊髓SIRT1水平和酶活性的降低,抑制NF-κB p65的过高表达和乙酰化。
SRT1720 慢性坐骨神经结扎 沉默信息调节因子2相关酶1 NF-κB去乙酰化
【 Abstract】 Objective To investigate the effect of intrathecal SRT1720 injection on expression and activity of SIRT1,and deacetylation of NF-κBp65 in rats with chronic constriction injury(CCI). Methods One hundred and twenty male SD rats were randomly divided into five groups with 24 animals in each group:Sham group(S group),CCI group,dimethylsulfoxide(DMSO) group,CCI+LD group and CCI+HD group.Lumbosacral intrathecal(IT)catheter was placed 8d before CCI operation in DMSO, CCI+LD and CCI+HD groups.CCI was induced in all animals except those in S group.10μl DMSO was intrathecally injected q.d via the catheter in DMSO group;10μg and 20μg SRT1720 dissolved in 10μl DMSO was given to rats in CCI+LD and CCI+HD groups.Six rats were sacrificed randomly before and at 1,3,7 d after CCI or sham surgery in each group.The L4~5spinal cord segments were removed for detection of deacetylase activity of SIRT1 by fluorometric kit.The proteins levels of(SIRT1)and NF-κB/Ac-NF-κB p65 were determined by Western blot analysis. Results The deacetylase activity and protein levels of SIRT1 were significantly decreased after operation in CCI and DMSO group at postoperative d1,3 and 7,and the proteins level of NF-κB/Ac-NF-κB p65 were significantly increased(P<0.01),compared with S group(P<0.01).Compared with CCI group,the deacetylase activity and protein level of SIRT1 increased,and NF-κB/Ac-NF-κB p65 protein level decreased both in CCI+LDgroup and CCI+HD group at postoperative d3 and d7(P<0.01).Furthermore,the activity and protein levels of SIRT1 were higher in CCI+HD group and the proteins levels of Ac-NF-κB p65 were lower(P<0.01)than those in CCI+LD group at postoperative d7(P<0.01). Conclusion SRT1720 intrathecal injection can improve the down-regulation of spinal SIRT1 deacetylase activity and protein levels in CCI rats,furthermore,it also can inhibit over-expression and acetylation of NF-κB p65.
【 Key words】 SRT1720 Chronic constriction injury Silentmating type information regulation 2 homolog 1 NF-κB Deacetylation
神经病理性疼痛(neuropathic pain,NP)是由于外周或中枢神经系统直接损伤和功能紊乱所引起,并由伤害性感受通路活动异常导致的一种慢性疼痛,其发生与维持机制在于神经元和胶质细胞对伤害性刺激应答后出现了异常记忆并长期存在,这种病理性表观遗传改变也正是其难以治愈的主要原因之一。沉默信息调节因子2相关酶1(silentmating type information regulation 2 homolog 1,SIRT1)是一种依赖于尼克酰胺腺嘌呤二核苷酸(NAD+)Ⅲ型去乙酰化酶,其对组蛋白/非组蛋白进行去乙酰化表观修饰,进而影响蛋白的生物学功能。近期多项研究认为SIRT1在NP的病理过程中起着重要作用[1-3]。SRT1720是目前新研制的SIRT1激动剂,前期研究已证实蛛网膜下腔给予SRT1720可有效改善慢性坐骨神经结扎(chronic constriction injury,CCI)大鼠的痛觉敏化[4],但其具体作用机制尚待进一步明确。笔者建立CCI大鼠模型,通过蛛网膜下腔给予两种不同剂量的SRT1720,检测SRT1720对脊髓SIRT1表达和去乙酰化酶活性,以及NF-κBp65(Lys310)的乙酰化水平影响,阐述SRT1720改善神经病理性疼痛可能的作用机制,为进一步的临床应用提供实验依据,现报道如下。
1 材料和方法
1.1 材料 清洁级雄性SD大鼠120只,由浙江中医药大学实验动物中心提供,动物许可证号:SCXK(沪)2008-0016。体重240~260g,喂饲普通饲料,自由饮水进食,自然节律采光。SRT1720由美国Selleck公司生产;SIRT1/sir2去乙酰化荧光测定试剂盒ver.2由日本CycLex公司生产;多功能酶标仪SpectraMax M2由美国美谷分子仪器公司生产;Western blot实验中兔抗大鼠SRIT1、NF-κB、乙酰化-NF-κB p65(Lys310)单克隆抗体由英国Abcam公司生产,山羊抗兔(二抗)抗体由美国Santa Cruz公司生产。
1.2 方法
1.2.1 实验分组 按随机数字表法分为5组:假手术组(S)组、坐骨神经结扎组(CCI组)、二甲亚砜(DMSO)组、坐骨神经结扎联合低剂量SRT1720组(CCI+LD组)和坐骨神经结扎联合高剂量SRT1720组(CCI+HD组),每组24只。
1.2.2 蛛网膜下腔预置管操作 腹腔注射10%水合氯醛300mg/kg麻醉,俯卧位四肢固定于手术板上,常规消毒铺孔巾后取L5~6间隙,纵向切开lcm切口,钝性分离皮下组织和肌肉,暴露出脊间膜,用5号针尖破膜后用细钢丝引导PE 10号导管置入,出现鼠尾侧向甩动视为穿刺成功,拔出导丝可见清澈脑脊液流出。将PE 10导管向头端插入2cm,至脊髓腰膨大段,然后固定导管并缝合伤口,术后常规肌肉注射青霉素3万U预防感染。大鼠清醒24h后剔除运动功能障碍的大鼠,其余进行后续实验。
1.2.3 CCI模型建立 预置管1周后,腹腔注射2%戊巴比妥钠40mg/kg进行麻醉,消毒大鼠左下肢,于左侧大腿中部切开,暴露坐骨神经,在接近其分叉之前游离出约7mm的神经,用4根320的铬制羊肠线间隔1mm进行松结扎,要求不阻断神经血供,然后逐层缝合切口。而S组仅暴露坐骨神经并游离连接组织,但不做坐骨神经结扎。
1.2.4 SRT1720药液的配置 分别配置两种不同剂量的SRT1720溶液,低剂量:将10μg SRT1720溶于10μl二甲基亚砜(DMSO)中;高剂量:将20μg SRT1720溶于10μl DMSO中。
1.2.5 连续给药 DMSO组于CCI后12h通过微量注射器经预置导管注射10μl DMSO,注射时间为2min,1次/d;CCI+LD组和CCI+HD分别给予低剂量SRT1720药液10μl和高剂量SRT1720药液10μl,给药方法和频率同DMSO组。
1.3 脊髓标本采集和保存 分别于CCI模型建立前1d、CCI模型建立后1、3、7d随机抽取6只大鼠,在给药中点(当日给药后12h)过量乌拉坦注射处死,迅速分离大鼠L4~5段左侧(CCI制备同侧)脊髓组织,置于液氮中保存。
1.4 脊髓SIRT1去乙酰化酶活性测定 通过SIRT1/ sir2去乙酰化荧光测定试剂盒ver.2检测SIRT1活性。按试剂盒说明书要求,分别将各组、各时点脊髓和RVP蛋白裂解液 10μl加入微孔板中与反应混合溶液(40μl)混合,在37℃孵育60min后置于荧光酶标仪中测量荧光强度(EX:485mm,EM:535nm),最终测量值为荧光强度/蛋白浓度(F485/F535×10-3/μg)。
1.5 脊髓SIRT1、NF-κB、乙酰化-NF-κB p65(Lys310)蛋白的检测 采用Western blot法检测,脊髓组织于细胞裂解缓冲液中匀浆,14 000r/min离心5min分离提取总蛋白溶液,采用Bradford法测定总蛋白浓度。经SDS-PAGE胶电泳分离后转印到PVDF膜上。用5%脱脂牛奶封闭 2h,在4℃条件下与一抗孵育过夜(1∶1 000),经TBST洗膜后于室温下加入辣根过氧化物酶标记的二抗溶液(1∶10 000)中孵育1h,再用超敏ECL化学发光试剂盒显像。Quantity one软件分析SIRT1、NF-κB、乙酰化-NF-κB p65(Lys310)条带的平均灰度值。
1.6 统计学处理 应用SPSS 15.0统计软件,计量资料以表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验。
2 结果
2.1 各组大鼠脊髓SIRT1去乙酰化酶活性水平的比较 坐骨神经结扎前各组大鼠脊髓中SIRT1去乙酰化酶活性水平均无统计学差异(均P>0.05);与S组比较,坐骨神经结扎后1、3、7d,各组大鼠脊髓中SIRT1去乙酰化酶活性水平均下降(均P<0.01),但CCI+HD组在CCI后7d时,其酶活性水平与S组比较无统计学差异(P>0.05);与单纯CCI组比较,SRT1720给药各组(CCI+LD和CCI+HD)在CCI后3d和7d脊髓SIRT1去乙酰化酶活性水平均明显升高(均P<0.01),但在CCI后1d无统计学差异(P>0.05);与CCI+LD组比较,CCI+HD组在CCI后3d和7d去乙酰化酶活性水平更高(P<0.01),详见表1。
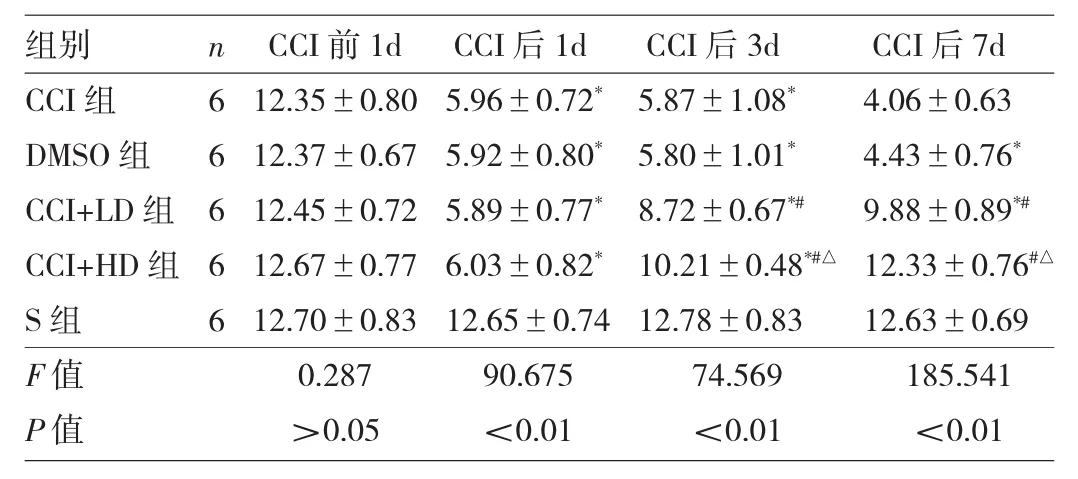
表1 各组大鼠脊髓SIRT1去乙酰化酶活性水平的比较(F485/F535×10-3/μg)
2.2 各组大鼠脊髓SIRT1水平的比较 坐骨神经结扎前各组大鼠脊髓中SIRT1水平均无统计学差异(均P>0.05);与S组比较,坐骨神经结扎后1、3、7d,各组大鼠脊髓中SIRT1水平均明显下调(P<0.01);与单纯CCI组比较,SRT1720给药各组(CCI+LD和CCI+HD)在CCI后3d和7d脊髓SIRT1水平均升高(均P<0.01),但在CCI后1d无统计学差异(P>0.05);与CCI+LD组比较,CCI+HD组在CCI后7d SIRT1水平更高(P<0.01),详见表2、图1。

表2 各组大鼠脊髓SIRT1水平的比较(SIRT1/GAPDH灰度值)
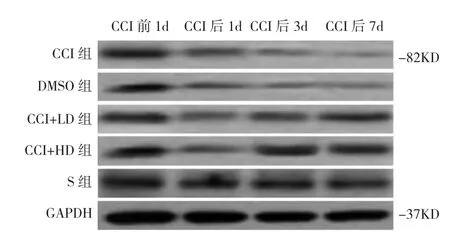
图1 各组大鼠脊髓Western blot测定SIRT1水平比较(GAPDH为检测的内部参照)
2.3 各组大鼠脊髓NF-κB、乙酰化-NF-κB p65(Ac-NF-κB,Lys310)水平的比较坐骨神经结扎前各组大鼠脊髓中NF-κB、乙酰化-NF-κB p65水平均无统计学差异(P>0.05);与S组比较,CCI组和DMSO组在CCI后1、3、7d,NF-κB和乙酰化-NF-κB p65水平均升高(P<0.01),尽管CCI+LD组和CCI+HD组NF-κB水平在各时点同样升高(P<0.01),但乙酰化-NF-κB p65水平在CCI后3、7d无统计学差异(P>0.05);与CCI组比较,CCI+LD组和CCI+HD组在CCI后3、7d,NF-κB和乙酰化-NF-κB p65水平均较低(P<0.01),详见表3。
2.4 各组大鼠脊髓NF-κB乙酰化水平的比较 坐骨神经结扎前各组大鼠脊髓中NF-κB乙酰化水平均无统计学差异(P>0.05);与S组比较,CCI组和DMSO组在CCI后1、3、7d,NF-κB乙酰化水平均升高(均P<0.01),尽管CCI+LD组和CCI+HD组在CCI后1d的NF-κB乙酰化水平同样升高(P<0.01),但NF-κB乙酰化水平在CCI后3d则无统计学差异(P>0.05),而在CCI后7d时,CCI+HD组的NF-κB乙酰化水平已较S组和CCI+LD组更低(P<0.01),详见表4。

表3 各组大鼠脊髓NF-κB、乙酰化-NF-κB p65(Ac-NF-κB,Lys310)水平的比较(与GAPDH灰度比值)

表4 各组大鼠脊髓NF-κB乙酰化水平的比较(乙酰化-NF-κB p65/NF-κB灰度比值)
3 讨论
NP是躯体感觉系统的疾病或病变直接引起的疼痛,可由外伤和疾病致末梢神经、脊髓及以上中枢神经某些部位如脑干、大脑皮层等损伤而引发。最新研究提示疼痛相关基因和组蛋白的表观遗传修饰显著影响神经元细胞和神经胶质细胞在分化、修复、突触重塑等方面的功能,而组蛋白/转录因子的乙酰化修饰被证实在NP的发生、发展过程中起着重要作用[5-6]。
SIRT1是依赖于NAD+的去乙酰化酶,对组蛋白/非组蛋白进行去乙酰化调控,在抑制细胞凋亡、有机体的能量代谢、线粒体功能保护、抑制炎症反应、抵抗氧化应激和延长细胞寿命方面起着关键作用。在神经系统疾病的研究中发现SIRT1的低表达或酶活性的降低与阿尔兹海默病、帕金森病的发病具有相关性[7-8]。本研究结果显示在大鼠CCI模型建立后1d起至第7天,脊髓组织中的SIRT1水平和SIRT1去乙酰化酶活性均显著下调,在我们前期研究结果显示,通过活化SIRT1去乙酰化酶功能,可改善CCI大鼠的机械痛敏和热痛敏[4,9],而Yin[2]和Shao[3]在蛛网膜下腔给予SIRT1的天然激动剂——白藜芦醇后,同样观察到CCI大鼠痛觉敏化的行为学改善,这些研究结果均提示SIRT1在神经病理性疼痛起着重要作用。
SRT1720是新近研发的一种小分子新药,和天然植物药白藜芦醇一样,均属于SIRT1激动剂,但在结构上和白藜芦醇并不相似。SRT1720在体内的代谢时间比白藜芦醇更长,作用更为特异,其通过活化SRIT1途径改善线粒体呼吸链功能,抑制炎症细胞浸润及炎症因子释放从而对2型糖尿病、哮喘、阿尔兹海默病等均具有干预效果[10-11]。本研究发现,蛛网膜下腔注射SRT1720可以显著改善由于CCI诱导的SIRT1蛋白水平和酶活性的降低,而且成剂量相关性。这与蛛网膜下腔注射白藜芦醇结果相似,但这种效应在给药初期(CCI后1d)并不明显,而在连续给药3d后才表现出这一激动效应。
既往在阐述SIRT1以及其激动剂是如何参与神经病理性疼痛调控的实验中,最为关注的是组蛋白H3的去乙酰化调节[2-3],通过这一途径,可负性调节多种疼痛相关基因的表达。除外组蛋白,SIRT1去乙酰化酶的底物还包括多个转录因子,如NF-κB、AP-1等。Sirtl基因敲除小鼠巨噬细胞中的NF-κB表现为高乙酰化,增加致炎因子基因的表达[12]。在阿尔茨海默病研究中,通过激活小胶质细胞SIRT1对NF-κB去乙酰化,可产生显著的神经保护作用。同样,NF-κB是疼痛病理过程中至关重要的转录因子,被致炎刺激活化后,NF-κB从胞浆转入核内,和DNA上的κB序列结合,参与调控众多疼痛相关基因的转录。NF-κB p65亚单位可在多个赖氨酸位点发生乙酰化修饰,其中Lys310的乙酰化可增强NF-κB的转录活性[13]。本研究显示,蛛网膜下腔注射SRT1720后3d,CCI大鼠脊髓中NF-κB的过高表达得到控制,而乙酰化NF-κB p65(Lys310)与NF-κB的比值下降更为显著,到CCI后7d,高剂量组中脊髓NF-κB p65(Lys310)乙酰化水平甚至低于S组,据此,推测SRT1720蛛网膜下腔注射,可能降低脊髓中NF-κB的转录活性,进而抑制下游众多疼痛相关基因的表达。
结合我们的前期研究,笔者推测蛛网膜下腔给予SRT1720,通过激动SIRT1去乙酰化酶活性并提高其表达水平,进而抑制CCI所致的疼痛相关转录因子NF-κBp65(Lys310)乙酰化水平,最终减少下游疼痛基因的表达,从而改善CCI大鼠的痛觉敏化。但是,SRT1720的药理作用尚未完全清楚,SIRT1在神经病理性疼痛中的作用可能存在更为广泛的分子靶点,长期使用SRT1720是否存在神经系统的严重并发症,这些仍需进一步的研究探讨。
[1]Gui Y,Li A,Chen F,et al.Involvement of AMPK/SIRT1 pathway in anti-allodynic effect of troxerutin in CCI-induced neuropathic pain[J].Eur J Pharmacol,2015,769(12):234-241.
[2]Yin Q,Lu F F,Zhao Y,et al.Resveratrolfacilitates pain attenuation in a rat model of neuropathic pain through the activation of spinal Sirt1[J].Reg Anesth Pain Med,2013,38(2):93-99.
[3]Shao H,Xue Q,Zhang F,et al.Spinal SIRT1 activation attenuates neuropathic pain in mice[J].PLoS One,2014,9(6):e100938.
[4]Lv C,Hu H Y,Zhao L,et al.Intrathecal SRT1720,a SIRT1 agonist,exerts anti-hyperalgesic and anti-inflammatory effects on chronic constriction injury-induced neuropathic pain in rats[J].Int J Clin Exp Med,2015,8(5):7152-7159.
[5]Imbe H,Kimura A.Repeated forced swim stress prior to complete Freund's adjuvant injection enhances mechanical hyperalgesia and attenuates the expression of pCREB and ΔFosB and the acetylation of histone H3 in the insular cortex of rat[J].Neuroscience,2015,301(1):12-25.
[6]LiD,Huang Z Z,Ling YZ,et al.Up-regulation of CX3CL1 via nuclear factor-κB-dependent histone acetylation is involved in paclitaxel-induced peripheral neuropathy[J].Anesthesiology, 2015,122(5):1142-1151.
[7]Julien C,Tremblay C,Emond V,et al.Sirtuin 1 reduction parallels the accumulation of tau in Alzheimer disease[J].J Neuropathol Exp Neurol,2009,68(1):48-58.
[8]Okawara M,Katsuki H,Kurimoto E,et al.Resveratrol protects dopaminergic neurons in midbrain slice culture from multiple insults[J].Biochem Pharmacol,2007,73(4):550-560.
[9]Zhang J,Lv C,Wang H N,et al.Synergistic interaction between total glucosides and total flavonoids on chronic constriction injury induced neuropathic pain in rats[J].Pharm Biol,2013,51(4):455-462.
[10]Milne J C,Lambert P D,Schenk S,et al.Smallmolecule activators of SIRT1 as therapeutics for the treatment of type 2 diabetes[J]. Nature,2007,450(7170):712-716.
[11]Feige J N,Lagouge M,Canto C,et al.Specific SIRT1 activation mimics low energy levels and protects against diet-induced metabolic disorders by enhancing fat oxidation[J].Cell Metab, 2008,8(5):347-358.
[12]Smith J J,Kenney R D,Gagne D J,et al.Small molecule activators of SIRT1 replicate signaling pathways triggered by calorie restriction in vivo[J].BMC Syst Biol,2009,3:31.
[13]Yeung F,Hoberg J F,Ramsey C S,et al.Modulation of NF-κB-dependenttranscription and cellsurvivalby the SIRT1 deacetylase[J].EMBO J,2004,23(12):2369-2380.
(本文编辑:严玮雯)
《浙江医学》“病例讨论”栏目征稿
根据广大读者的建议,本刊开辟了“病例讨论”栏目,论文结构分为“病例摘要”和“讨论”两部分,以期通过对疑难、复杂或罕见病例的介绍和讨论,交流临床工作经验,帮助广大临床医师掌握科学的临床思维方式,提高各专科和多学科的综合分析判断能力,进而提高医疗水平。现特向广大临床医师征集相关病例,具体要求如下。
1病例选择(1)疑难病例,特别是涉及多学科、多领域的疑难病例;(2)诊断明确,但病情危重和(或)治疗棘手的病例;(3)临床较罕见的病例。以上病例均需最终获得明确诊断或成功治疗,且临床资料齐全,并能提供实验室、影像学和(或)病理确诊依据。
2写作格式和要求(1)病历摘要:分段叙述患者的简要病史(包括主诉、现病史、既往史等)、入院后体检情况、辅助检查结果、入院后治疗方案及病情变化等内容;(2)讨论:分段记录各级或各科或各院医师对该病例的特点、诊断、鉴别诊断、进一步辅助检查和治疗方案等方面的分析,若为罕见病,则需介绍目前国内外关于该病诊治方面的最新进展;(3)列出相关的国内外主要参考文献;(4)全文字数在3 000字左右。
3投稿注意事项 投稿时请务必在稿件末页留下第一作者手机号码和电子邮箱地址,同时附上单位证明(证明该病例所有资料属实,无一稿两投,无涉及保密等情况)。
本刊编辑部
Effects of intrathecal SRT1720 injection on expressions of SIRT1 and deacetylation of NF-κB in spinal cord in rats with chronic constriction injury
LYU Chen,GUO Xiaowen,ZHENG Hui,et al.Department of Anesthesiology,Zhejiang Provincial Hospital of TCM,Hangzhou 310006,China
2016-01-09)
国家自然科学基金青年科学基金项目(81202823);浙江省医药卫生科技计划项目(2014KYA156)
310006 杭州,浙江省中医院麻醉科
张娟,E-mail:zhangjuan8989@hotmail.com
