HGFK1基因真核表达载体的构建及鉴定研究
2016-12-21朱昱顾玲玲朱敏张法标方哲平
朱昱 顾玲玲 朱敏 张法标 方哲平
HGFK1基因真核表达载体的构建及鉴定研究
朱昱 顾玲玲 朱敏 张法标 方哲平
目的 构建携带人HGFK1基因的真核表达载体pcDNA3.1(-)-HGFK1。方法 通过PCR方法从已经构建好的病毒穿梭载体中扩增出HGFK1基因,构建pcDNA3.1(-)-HGFK1真核表达载体,经PCR、酶切、测序、蛋白表达等方法进行鉴定。结果 PCR、酶切、测序以及蛋白表达证实pcDNA3.1(-)-HGFK1载体序列正确。结论 本研究成功构建了pcDNA3.1(-)-HGFK1真核表达载体,可为后续进行肝癌细胞的生物学研究提供帮助。
基因 HGFK1 载体构建
HGFK1是肝细胞生长因子(HGF)第一个环状结构域(K1)的基因表达产物,由Xin等[1]在2000年首次被克隆于HGF的α链,是一个由79个氨基酸构成的球形结构。有研究表明,HGFK1可能通过表皮生长因子/表皮生长因子受体(EGF/EGFR)途径,抑制肿瘤血管生成、阻止肿瘤远处转移及拮抗HGF功能,并有效延长实验动物的生存期[2]。本研究通过克隆人HGFK1基因,构建其重组真核表达载体,转染至人肝癌HepG2细胞,观察HGFK1蛋白在HepG2细胞的表达,以期为研究HGFK1的生物学效应和肝癌的基因治疗打下基础。
1 材料和方法
1.1 材料 克隆载体pGEM-T Easy(美国Promega公司),pcDNA3.1(-)真核细胞表达载体(美国Invitrogen公司),DNA Marker DL100(上海捷瑞生物工程有限公司),RNA提取试剂 Trizol(美国 Invitrogen公司),Lipofectamine 2000阳离子脂质体(美国Invitrogen公司)。T4DNA连接酶Taq DNA聚合酶(美国Thermofisher scientific公司),限制性内切酶XbaⅠ、HindⅢ(美国Thermofisher scientific公司),限制性内切酶XbaⅠ、HindⅢ引物(上海基康生物公司合成),兔抗人HGF抗体(武汉博士德生物工程有限公司),羊抗兔二抗(武汉博士德生物工程有限公司),大肠杆菌菌株DH5a、pDC316-HGFK1病毒穿梭载体(浙江省台州医院中心实验室保存),人肝癌H ep G2细胞株(复旦大学附属中山医院肝癌研究所)。
1.2 方法
1.2.1 HGFK1基因的克隆 根据HGFK1基因序列设计含有XbaⅠ、HindⅢ限制性酶切位点的引物(上游:5′-TCTAGAAGGATTCTTTCACCCAGGC-3′;下游:5′-CCCAAGCTTCTTGTCGGGATATCTTTCAG-3′),扩增片段长度约为827bp;以本课题组之前合成的pDC316-HGFK1腺病毒表达载体[3]为模板,PCR扩增HGFK1基因,反应条件:95℃预变性2min,94℃变性45s,58℃退火45s,72℃延伸1min,35个循环,72℃总延伸10min,4℃降温10min;扩增产物包含了HGFK1基因cDNA的编码区及部分非编码区;1%琼脂糖凝胶电泳检测PCR产物;自凝胶中回收HGFK1基因,与pGEM-T Easy载体按摩尔比8∶1的比例混合,16℃条件下用T4 DNA连接酶进行连接;连接产物转化感受态大肠杆菌DH5a,挑取单菌落,行菌落PCR验证;挑选阳性菌落,提取质粒DNA,用限制性内切酶XbaⅠ和HindⅢ进行双酶切鉴定,重组质粒行DNA序列分析。
1.2.2 真核表达载体pcDNA3.1(-)-HGFK1的构建以限制性内切酶XbaⅠ和HindⅢ切割重组克隆载体和质粒pcDNA3.1(-),琼脂糖凝胶电泳;回收2种目的片段,用T4 DNA连接酶连接,连接产物转化感受态大肠杆菌DH5a;挑选单菌落行菌落PCR验证,挑选阳性菌落,提取质粒DNA,用限制性内切酶XbaⅠ和HindⅢ进行双酶切鉴定。
1.2.3 细胞转染 在HepG2细胞贴壁生长融合至85%~90%时进行细胞转染,分两组同时进行(实验组为转染重组表达载体pcDNA3.1(-)-HGFK1,阴性对照组为转染空载体pcDNA3.1(-),以未转染的HepG2细胞作为空白对照组):37℃、5%二氧化碳常规静置培养HepG2细胞;将5×104个/ml细胞种植于6孔板,培养16h,待细胞融合率达70%时,将4.0μg pcDNA3.1(-)-HGFK1质粒和10μl Lipofectamine 2000分别加至250μl无血清DMEM培养液中,轻轻摇匀,室温孵育5min后将两者混匀,室温放置20min,再将其加入PBS漂洗后的HepG2细胞,边加边轻轻混合。将转染后的细胞置37℃、5%二氧化碳的孵箱中孵育6h后弃去转染液,加入含10%胎牛血清的1640培养液中继续培养,至24h,收集部分细胞,用于总RNA抽提。另取部分细胞按1∶10稀释,将其转种于另一培养板,再经过24h后,向培养液中加入终浓度为500μg/ml的G418进行抗性筛选,对阳性克隆进行有限稀释,扩大培养后获得稳定表达的细胞株。
1.2.4 HGFK1蛋白检测 采用Western blot法。取稳定转染pcDNA3.1(-)-HGFK1的HepG2细胞系对数生长期细胞,抽提总蛋白;抽提蛋白10μg,加适量2×上样缓冲液,经煮沸变性后,行10%SDS-PAGE电泳(120V,180min),切取含目的蛋白凝胶,半干转膜15V,30min;用5%脱脂奶粉室温摇床振荡封闭3h,加入兔抗人HGF多克隆抗体(1∶200),4℃标记过夜,TBST洗涤3次后,标记二抗(1∶1 000),室温振荡孵育1h,洗膜显色,曝光,显影并定影,成像分析。
2 结果
2.1 HGFK1基因PCR扩增产物鉴定 琼脂糖凝胶电泳检测PCR产物,可见约827 bp处有一优势扩增条带,与预期结果一致,见图1。

图1 HG FK1基因PCR扩增产物鉴定电泳图(1:D L100Ma r k er;2:HG FK1基因)
2.2 HGFK1基因的克隆和鉴定 重组克隆载体转化感受态大肠杆菌DH5a,挑选单菌落行PCR验证,经琼脂糖凝胶电泳可见约827 bp处有一亮条带,见图2。选取阳性菌落,抽提质粒,经SmaⅠ和HindⅢ双酶切,回收酶切产物经琼脂糖凝胶电泳可见约827 bp处有一亮条带,证明此载体中有大小约为827 bp的外源DNA片段插入,见图3。重组质粒进行基因测序,序列测定结果与Genebank报道的2.5 kb HGFmRNA的cDNA(M29145)[长度为2576bp,cds=(102,2 288)]报道区域(43,860)的序列完全相同,表明重组于载体的HGFK1基因片段序列正确。

图2 p G E M-T-HG FK1菌落PCR验证电泳图(1:D L100Ma r k er;2、3、4:阳性菌落HG FK1基因)

图3 p G E M-T E as y-HG FK1双酶切后PCR验证电泳图(1:D L100Ma r k er;2:p G E M-TE as y载体;3:酶切后的HG FK1基因)
2.3 真核表达载体pcDNA3.1(-)-HGFK1鉴定 将重组好的pcDNA3.1(-)-HGFK1真核表达载体转化感受态大肠杆菌DH5a,挑选单菌落行PCR验证,经琼脂糖凝胶电泳可见约827 bp处有一亮条带,见图4。选取阳性菌落,抽提质粒,经XbaⅠ和HindⅢ双酶切,回收酶切产物经琼脂糖凝胶电泳可见约827 bp处有一亮条带,证明此载体中有大小约为827 bp的外源DNA片段插入,见图5。

图4 p cDNA3.1(-)-HG FK1菌落PCR验证电泳图(1:D L100 Ma r k er;2、3、4:阳性菌落HG FK1基因)

图5 p cDNA3.1(-)-HG FK1重组质粒双酶切验证电泳(1、2:酶切后的p DC316-HG FK1质粒DNA片段;3:D L 200Ma r k er)
2.4 HepG2细胞转染HGFK1基因鉴定 取实验组、阴性对照组和空白对照组HepG2细胞提取总 RNA,行PCR。扩增产物经电泳发现实验组存在特异性条带(827 bp),而空白对照组、阴性对照组均无,提示实验组HepG2细胞已成功转染重组表达载体pcDNA3.1(-)-HGFK1,且阴性对照组和空白对照组HepG2细胞均无HGFK1mRNA表达,见图6。
2.5 G418抗性筛选后实验组细胞 实验组细胞再培养24h后,向培养液中加入G418进行抗性筛选,得到单克隆细胞,对细胞进行有限稀释,扩大培养后获得稳定表达的细胞株,见图7-8。
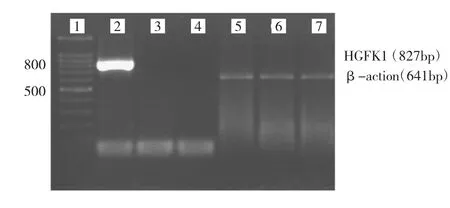
图6 p CDNA3.1(-)-HG FK1转染H ep G2细胞PCR验证电泳图(1:D L100Ma r k er;2:实验组;3:阴性对照组;4:空白对照组;5、6、7:β-action)

图7 脂质体转染,G418筛选后获得的单克隆细胞显微镜下所见(×100)

图8 传代培养后获得稳定表达的细胞株显微镜下所见(× 50)

图9 HG FK1基因转染后H ep G2细胞HG FK1蛋白表达检测电泳图(1:蛋白分子量标准;2:实验组;3:阴性对照组)
2.6 HGFK1基因转染后HepG2细胞HGFK1蛋白表达检测 Western blot结果表明,实验组细胞培养液有大小约为28 kD的蛋白条带存在,而阴性对照组无蛋白条带存在,提示HGFK1基因转染HepG2细胞后可表达HGFK1蛋白,见图9。
3 讨论
原发性肝癌是指肝和肝内胆管的原发性恶性肿瘤,目前以肝切除术为代表的外科治疗是其首选治疗方法[4]。但实际工作中,大部分原发性肝癌患者在临床确诊时已错过最佳手术治疗时机,且术后复发率高,术后5年复发率>60%。对于原发性肝癌,除手术治疗外,临床主要还有放射介入治疗、全身化疗、区域性化疗、免疫治疗、中医中药、基因治疗等[5]。近年来,随着分子生物学技术的发展,肿瘤的基因治疗逐渐成为研究重点。目前,已有多种抗肿瘤治疗的相关基因被研究,如抑癌基因、自杀基因、抗血管生成基因、炎性细胞因子基因、微小RNA基因等[6],但总体效果尚不理想。因而,寻找更多更具杀伤肿瘤细胞能力的基因将大大推动基因治疗的研究和临床应用。
随着对肿瘤发生、发展、转移机制的研究不断深入,学者们逐渐认识到肿瘤新生血管的生成在肿瘤演进过程中具有极其重要的作用[7]。定点清除肿瘤新生血管作为一种崭新的抗肿瘤战略具有极为重要的理论与临床价值。有研究表明,HGFK1在体内可以拮抗HGF诱导的细胞增殖、迁移,且能抑制由血管内皮生长因子或成纤维细胞生长因子所诱导的微血管内皮细胞的增殖和迁移[8]。Shen等[2]研究显示,重组HGFK1蛋白可在体内、外抑制肿瘤血管生成,作用效果强于血管抑素和内皮抑素重组蛋白。HGFK1蛋白在对大鼠肝癌、结肠癌、非小细胞肺癌等肿瘤的实验研究中也都取得了令人满意的效果[9-12]。Lu等[13]研究发现,HGFK1可有效抑制人脐血管内皮细胞生长、迁移,并在小鼠体内抑制脉络膜及视网膜新生血管形成。Zhou等[14]研究发现,表达HGFK1的非小细胞肺癌患者总生存期及无进展生存期显著长于不表达HGFK1的非小细胞肺癌患者。
在本研究中,笔者没有直接构建pcDNA3.1(-)-HGFK1载体,而是先构建重组克隆载体pGEM-TEasy-HGFK1,通过PCR、酶切等方法验证HGFK1基因cDNA已成功插入载体pGEM-TEasy,双向测序证实序列正确后扩大培养已转化的感受态细胞,提取质粒行XbaⅠ和HindⅢ双酶切,获得足量的HGFK1基因cDNA,再与pcDNA3.1(-)真核表达载体连接。这样可使整个实验设计更为合理、稳定。载体pGEM-TEasy是一种高效的克隆PCR物的专用载体。因大部分耐热DNA聚合酶进行PCR反应时都有在PCR物即cDNA的3’端添加一个“A”的特性,而载体pGEM-TEasy插入处序列的两侧3’端含“T”,因此通过“A-T”碱基配对可使此载体的连接、克隆效率获明显提高。pCDNA3.1(-)载体是被广泛应用的基因真核表达载体之一,其携带有较多的酶切位点,因而可根据不同的酶切位点插入大片段外源基因,高效地转导不同类型的人组织细胞,是目前使用最多的基因治疗运载系统之一。构建的pCDNA3.1(-)-HGFK1真核表达载体可以介导HGFK1在真核细胞里持续长期表达,用于研究对多种细胞的生物学功能的影响。
本课题组前期研究发现,HGFK1可通过TAK1/p38 MAPK信号通路抑制乳腺癌的骨转移[15],还发现HGFK1基因表达与肝癌的发生、发展及转移相关,其表达率的高低也显著影响着肝癌患者的预后[16]。肝细胞癌为典型的具有丰富血管生成的肿瘤,肿瘤血管生长在肝癌增殖、浸润和转移中都起重要作用,所以在其生长、浸润和转移过程中HGFK1的作用值得期待。通过载体导入HGFK1基因,抑制血管生成从而抑制肝癌细胞生长及转移,可谓是肝癌治疗研究的一种新思路。本研究成功构建了pcDNA3.1(-)-HGFK1真核表达载体,并转染入人肝癌细胞,建立了稳定表达HGFK1蛋白的HepG2细胞系,这为下一步开展HGFK1基因表达对人肝癌细胞的生物学影响的相关研究提供帮助。
[1]Xin L,Xu R,Zhang Q,et al.Kring le1 o f hum anhepatocyte g row th factor inhibits bovine aortic endothelialce llp ro liferation stimulated by basic fibrob last grow th fac tor and causes cell apop tosis Biochem[J].Biophys Res Commun,2000,277(1):186-190.
[2]Shen Z,Yang Z F,Gao Y,etal.The kring le 1 domain of hepatocyte g row th factor has antiangiogenic and anti-tum or cell effects on hepatocellular carcinom a[J].Cancer Res,2008,68(2):404-414.
[3]朱昱,朱敏,张法标,等.pDC316-HGFK1病毒穿梭载体的构建及鉴定[J].肿瘤学杂志,2012,18(7):516-519.
[4]Braillon A.Hepatocellular carcinom a and evidence based surgery [J].World JGastroentero l,2009,15(42):5371.
[5]吴孟超.原发性肝癌外科综合治疗的现状和展望[J].中华外科杂志, 2004,1(41):13-15.
[6]Touchefeu Y,Harring ton K J,Galm iche J P,et al.Review artic le:gene therapy,recent developm ents and future p rospects in gastrointestinal oncology[J].Alim ent Pharm acol Ther,2010,32(8):953-968.
[7]Guo SW,Che HM,LiW Z.Construction o f lentivirus vectors carrying alphastatin gene and its secretion exp ression in hum an umbilical vein endothelia cells[J].Academ ic Journal of Xi'an Jiaotong University,2010,22(3):168-174.
[8]Tatyana Merkulova-Rainon,Patrick Eng land,Shunli Ding,et al. The N-term inalDomain of Hepatocyte Grow th Factor Inhibits the Angiogenic Behavior of Endothelial Ce lls dependently from Bind ing to the c-m et Recep tor[J].Biol Chem,2003,278(39):37400-37408.
[9]顾春荣,郭跃武,赵晖,等.腺相关病毒介导的HGFK1对大鼠肝细胞癌的治疗作用研究[J].中国癌症杂志,2009,19(6):416-422.
[10]Nie B,Shen Z,Wen J B,et al.AAV-HGFK1 and Ad-p53 cocktail therapy p rolongs survival of m ice with colon cancer[J].Mol Cancer Ther,2008,7(9):2855-2865.
[11]周晓辉,杨异,高宗礼,等.119例非小细胞肺癌患者HGFK1蛋白表达的检测及其临床意义[J].中国癌症杂志,2010,20(5):353-357.
[12]邓飞鸿,聂飚,左俊华,等.AAV-HGFK1抑制EGFR磷酸化拮抗大肠癌细胞生长[J].重庆医学,2014,43(33):4447-4453.
[13]Lu Q,Zhang L,Shen X,et al.A novel and effective human hepatocyte g row th factor kring le 1 domain inhibits ocu larneovascularization[J].Exp Eye Res,2012,105(9):15-20.
[14]Zhou X H,Tang L N,Yue L,et al.HGFK1 is associciated w ith a better p rognostis and recerses inhibition by gefitinib in NSCLC cases[J].Asian Pac JCancerPrev,2012,13(4):1457-1461.
[15]Yao Y,Fang ZP,Chen H,etal.HGFK1 inhibits bonemetastasis in b reast cancer through the TAK1/p38 MAPK signaling pathway [J].CancerGene Therapy,2012(19):601-608.
[16]杨健,王伟林,方哲平,等.HGFK1在原发性肝细胞癌中的表达及其临床意义[J].浙江医学,2011,33(3):307-308.
Construction and identification of pcDNA3.1(-)-HGFK1 plasmid
ZHU Yu,GU Lingling,ZHU Min,et al.Department of Hepatobiliary Surgery,Taizhou Hospital of Zhejiang Province,Taizhou 317000,China
【 Abstract】 Objective To construct human pcDNA3.1(-)-HGFK1 gene eukaryotic exp ression vector.Methods HGFK1 gene was am p lified by PCR method from the constructed virus shuttle vector,and the pcDNA3.1(-)-HGFK1 eukaryotic exp ression vector was constructed and identified by PCR,enzyme d igestion,sequencing and p rotein exp ression. Results Enzyme d igestion,PCR,sequencing and p rotein exp ression showed the successful construc tion of pcDNA3.1(-)-HGFK1 eukaryotic exp ression vector. Conclusion We construct pcDNA3.1(-)-HGFK1 eukaryotic exp ression vector successfully,which may be used for further study of hepatocellular carcinoma gene therapy.
Gene HGFK1 Vector Construction
2016-04-13)
(本文编辑:李媚)
浙江省医药卫生科技计划项目(2014KYB308);浙江省科技计划项目(2009C33096)
317000 浙江省台州医院肝胆外科
方哲平,E-mail:z l yzy@y eah.ne t
