RNA干扰HO-1表达对肺腺癌A549细胞生物学行为的影响研究
2016-12-21夏利龙具晟袁丰祝鑫海舒跃陈国平
夏利龙 具晟 袁丰 祝鑫海 舒跃 陈国平
●论 著
RNA干扰HO-1表达对肺腺癌A549细胞生物学行为的影响研究
夏利龙 具晟 袁丰 祝鑫海 舒跃 陈国平
目的 应用RNA干扰技术特异性抑制血红蛋白加氧酶-1(HO-1)的表达,观察HO-1对肺腺癌A549细胞增殖、凋亡及侵袭能力的影响。方法 将体外构建的HO-1小分子RNA(siRNA)转染入肺腺癌A549细胞,分为空白对照组(b lank组)、脂质体组(mock组)、阴性对照组(NC组)、HO-1 siRNA组;应用实时荧光定量PCR、蛋白质印迹法检测HO-1 mRNA和蛋白表达水平;分别以CCK-8法、流式细胞术检测细胞增殖能力和凋亡率,用Transwell试验检测细胞迁移能力。结果 细胞培养48、72h后,与b lank组、mock组、NC组比较,HO-1 siRNA组细胞存活率均降低(均P<0.05),细胞凋亡率均增高(均P<0.05),G0期/G1期细胞比例均增高(均P<0.05),Transwell试验中穿膜细胞数均减少(均P<0.05)。结论 RNA干扰HO-1基因表达后能有效调控肺腺癌A549细胞的恶性生物学行为,抑制肺腺癌A549细胞的增殖,促进凋亡,降低细胞的侵袭能力。
肺肿瘤 HO-1 RNA干扰
血红蛋白加氧酶-1(HO-1)是体内血红蛋白降解的重要限速酶,HO-1基因也是体内重要的细胞保护基因,各种氧化应激和炎症因子均能诱导HO-1基因的表达[1]。研究表明,人类多种恶性肿瘤中该基因表达水平增高,在肺癌、乳腺癌、前列腺癌等实体肿瘤中HO-1与肿瘤的发生、浸润和转移密切相关[2]。对非小细胞肺癌(NSCLC)的免疫组织化学研究提示,HO-1在NSCLC中有较高的表达水平,且与淋巴结转移有一定的相关性[3]。本研究应用RNA干扰技术特异性抑制HO-1的表达,观察HO-1对肺腺癌A549细胞增殖、凋亡及侵袭能力的影响,以期进一步在细胞和分子水平为HO-1可能作为肺癌基因治疗的靶点提供理论依据,现报道如下。
1 材料和方法
1.1 材料 荧光定量PCR试剂盒购自上海生物工程有限公司,HO-1兔抗购自美国Abcam公司,DNA引物由上海吉玛制药技术有限公司合成,细胞凋亡试剂盒购自美国GIBCO公司,细胞周期试剂盒购自杭州联科生物公司。肺腺癌A549细胞由中国科学院上海细胞库提供,在浙江医院公共实验平台保存。
1.2 细胞培养及小分子RNA(siRNA)构建 肺腺癌A549细胞生长于37℃、5%二氧化碳、饱和湿度的培养箱内,在含10%胎牛血清的RPMI-l640培养基中培养,使用PBS清洗,0.25%胰蛋白酶消化细胞进行传代,当细胞融合50%~70%时更换无血清培养基Opti-MEM进行转染实验。3对靶向干扰HO-1的siRNA(分别命名为HO-1 siRNA组、HO-1 siRNA1组、HO-siRNA2组)及1对荧光标记的siRNA由美国Ambion公司化学合成。
1.3 实时荧光定量PCR检测HO-1mRNA的表达水平按照Trizol说明书步骤提取总RNA,按M-MLV反转录酶(Thermo Scientific Fermentas公司)操作说明书合成cDNA:HO-1(forward:5′-CCAGCAACAAAGTGCAAGATTC-3′;reverse:5′-GGTAAGGAAGCCAGCCAAGAG-3′;产物长度287bp)、β-actin(forward:5′-AAGATGACCCAGATCATGTTTGA-3′;reverse:5′-TTAATGTCACGCACGATTTCC-3′;产物长度240bp)。扩增反应条件:95℃预变性2min,94℃ 45s,64.5℃ 90s,72℃ 60s,30个循环,72℃10min;计算HO-1/β-actin比值,试验重复3次,取平均值进行统计分析。
1.4 蛋白质印迹法检测HO-1蛋白的表达水平 提取30μg总蛋白进行聚丙烯酸胺凝胶电泳,电泳后将蛋白转移至硝酸纤维素膜上;5%脱脂奶粉室温封闭2h,一抗4℃封闭过夜(1∶2 000稀释的HO-1),二抗室温封闭2h,ECL化学发光试剂检测、X线曝光;用QuantityOne软件行灰度值分析,计算HO-1/GAPDH比值,试验重复3次,取平均值进行统计分析。
1.5 CCK-8法检测细胞增殖能力 取对数期生长细胞,0.25%胰蛋白酶消化,离心计数后,以2×103/well铺96孔板,37℃、5%二氧化碳培养箱孵育培养,24h后进行转染,实验分为空白对照组(blank组)、脂质体组(mock组)、阴性对照组(NC组)、HO-1 siRNA组,分别培养48、72h;按操作说明书进行各组细胞A值检测,细胞存活率=(试验组A值/对照组A值)×100%;试验重复3次,取平均值进行统计分析。
1.6 流式细胞术检测细胞凋亡 取对数期生长细胞,以2×105/well铺4块6孔板,24h后加无血清无抗生素RPMI-1640培养液同步化24h;培养48h和72h两个时间点,消化细胞,微量离心机转速1 500r/min,离心时间5min,弃培养基用冷PBS洗涤细胞2次(1 500r/min,离心时间5min),用100μl 1X Binding Buffer悬浮细胞;在细胞悬浮液中加入5μl Annexin V-FITC和1μl PI,轻轻混匀后4℃避光条件下孵育 15min,使用流式细胞仪检测细胞凋亡率;试验重复3次,取平均值进行统计分析。
1.7 流式细胞术检测细胞周期 取对数期生长细胞,以2×105/well均匀铺于6孔板,24h后加无血清无抗生素RPMI-1640培养液同步化24h;分组转染细胞并分别培养48h和72h;消化细胞,微量离心机转速1 500r/ min,离心时间5min,加冰75%乙醇在4℃固定24h以上;微量离心机转速1 500r/min,离心时间5min后弃乙醇,风干,加PBS洗2遍(1 500r/min,离心时间5min),加入1ml Reagent A振荡混匀5~10 s,孵育30min;用流式细胞仪检测各周期细胞比例;试验重复3次,取平均值进行统计分析。
1.8 Transwell试验检测细胞侵袭能力 将在4℃融好的Matrigel用冷的PBS稀释,取100μl稀释胶(约25μg)加到24孔Transwell上室;放置37℃孵育过夜包被基底膜,取出Transwell板,用无血清RPMI-1640培养基轻洗凝胶;消化、收集转染后细胞,制备5×104/ml、1%FBS RPMI-1640细胞悬液,取200μl加入上室,下室加入600μl培养基;37℃,5%二氧化碳培养箱孵育24h;用棉签擦去上室非侵袭细胞,移去Transwells,倒置,风干;在24孔板中加入500μl含0.1%结晶紫,把小室放入其中,37℃孵育30min;取出小室,PBS清洗;直径上取3个视野、照相、计数取平均值。
1.9 统计学处理 应用SPSS17.0统计软件;计量资料以表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料以构成比表示,组间比较采用χ2检验。
2 结果
2.1 HO-1 siRNA组、HO-1 siRNA1组、HO-siRNA2组、mock组及NC组细胞HO-1 mRNA和蛋白表达水平比较 见表1。

表1 HO-1 siRNA组、HO-1 siRNA1组、HO-siRNA2组、mock组及NC组细胞HO-1mRNA和蛋白表达水平比较
由表1可见,各组细胞HO-1mRNA和蛋白表达水平比较均有统计学差异(均P<0.05);与mock组、NC组细胞比较,HO-1 siRNA组、HO-1 siRNA1组、HO-siRNA2组mRNA和蛋白表达水平均降低(均P<0.05),且HO-1 siRNA组mRNA和蛋白表达水平均最低(均P<0.05)。这表明HO-1 siRNA序列是有效的靶基因干扰序列。
2.2 HO-1 siRNA组、blank组、mock组及NC组培养48、72h后细胞存活率比较 见表2。

表2 HO-1 siRNA组、blank组、mock组及NC组培养48、72h后细胞存活率比较(%)
由表2可见,与blank组、mock组、NC组比较,HO-1 siRNA组培养48、72h后细胞存活率均降低(均P<0.05);而blank组、mock组、NC组培养48、72h后细胞存活率比较均无统计学差异(均P>0.05)。
2.3 HO-1 siRNA组、blank组、mock组及NC组培养48、72h后细胞凋亡率比较 见表3。由表3可见,与blank组、mock组、NC组比较,HO-1 siRNA组培养48、72h后细胞凋亡率均增高(均P<0.05);而blank组、mock组、NC组培养48、72h后细胞凋亡率比较均无统计学差异(均P>0.05)。

表3 HO-1 siRNA组、blank组、mock组及NC组培养48、72h后细胞凋亡率比较(%)
2.4 HO-1 siRNA组、blank组、mock组及NC组培养
48、72h后各周期细胞比例比较 见表4。
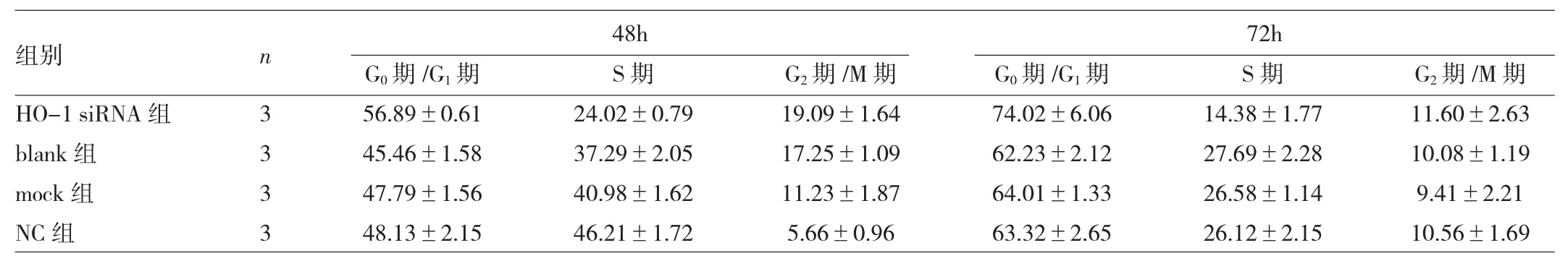
表4 HO-1 siRNA组、blank组、mock组及NC组培养48、72h后各周期细胞比例比较(%)
由表4可见,与blank组、mock组、NC组比较,HO-1 siRNA组培养48、72h后G0期/G1期细胞比例均增高(均P<0.05),S期细胞比例均降低(均P<0.05),G2期/ M期细胞比例比较均无统计学差异(均P>0.05);而blank组、mock组、NC组培养48、72h后各周期细胞比例比较均无统计学差异(均P>0.05)。
2.5 HO-1 siRNA组、blank组、mock组及NC组培养48、72h后细胞侵袭能力比较见图1、表5。

表5 HO-1 siRNA组、blank组、mock组及NC组培养48、72h后细胞侵袭能力比较
由图1、表5可见,与blank组、mock组、NC组比较,HO-1 siRNA组培养48、72h后穿膜细胞数均减少(均P<0.05);而blank组、mock组、NC组培养48、72h后穿膜细胞数比较均无统计学差异(均P>0.05)。
3 讨论
肺癌是严重危害人类生命和健康的常见肿瘤,由于肺癌细胞存在较强的侵袭、转移等恶性生物学特征,因此肺癌患者预后较差。目前在世界范围内,肺癌已成为癌症病亡的主要原因[4]。从基因水平找到有效的靶点来控制肿瘤细胞的增殖和转移是目前研究的热点和难点。
HO-1是体内血红蛋白分解代谢重要的限速酶,其分解的产物分别为一氧化碳(CO)、胆绿素和Fe2+。CO通过激活P3细胞分裂素活化蛋白激酶(p38-MAPK)及sGC/cGMP信号通路对细胞增殖起抑制作用;而胆绿素可以通过抑制某些细胞周期调节蛋白阻断细胞增殖;Fe2+的细胞保护作用也已被证实,但具体机制尚未明确[5-6]。目前发现,HO-1在肺癌、乳腺癌、前列腺癌等多种恶性肿瘤中表达水平增高,并与肿瘤的发生、浸润和转移关系密切[2]。一项对NSCLC的免疫组织化学研究发现,HO-1在NSCLC中的表达水平明显高于癌旁组织,且与淋巴结转移密切相关[3]。以往多数研究利用药物(如SnPPIX、ZnPPIX、ZnMPIX等)抑制HO-1的表达,但这些药物可能通过调控细胞周期素D1(cyclin D1)、caspase-3、caspase-8对肿瘤细胞起抑制作用,而不依赖HO-1的表达[8-9]。因此,本研究通过RNA干扰技术靶向抑制肺腺癌A549细胞HO-1的表达,观察对其细胞生物学行为的影响,在细胞和分子水平上,为HO-1可能作为肺癌基因治疗的靶点提供更多的理论依据。

图1 HO-1 siRNA组、blank组、mock组及NC组培养48、72h后穿膜细胞镜下所见(结晶紫染色,×100)
本研究针对HO-1的不同靶点化学合成3对HO-1 siRNA,为筛选干扰效果最好的HO-1 siRNA,本研究利用脂质体转染法将siRNA转染细胞,通过实时荧光定量PCR、蛋白质印迹法检测HO-1mRNA和蛋白表达水平,结果显示3条构建的siRNA在mRNA和蛋白水平对HO-1都有抑制作用,然后选取干扰效果最好的HO-1 siRNA进行下一步细胞实验;应用CCK-8法、流式细胞术检测发现,转染HO-1 siRNA的细胞增殖能力显著下降、细胞凋亡率明显增高,细胞周期停滞在G0期/G1期;Transwell检测结果显示细胞侵袭能力降低,这可能与HO-1对VEGF[10]、MMP-9[11]等相关侵袭因子的调节有关。
综上所述,靶向干扰HO-1基因表达后能有效抑制肺腺癌A549细胞的恶性生物学行为,但如何安全、有效地针对靶点进行治疗仍然需要进一步的动物实验和临床研究。
[1]Was H,Dulak J,Jozkowicz A.Heme oxygenase-1 in tum or biology and therapy[J].Current d rug targets,2010,11(12):1551-1570.
[2]Jozkowicz A,Was H,Dulak J,etal.Heme oxygenase-1 in tumors:is ita false friend?[J].Antioxid Redox Signal,2007,9(12):2099-2117.
[3]Tsai J R,Wang H M,Liu P L,et a l.High exp ression of hem e oxygenase-1 is associated w ith tumor invasiveness and poor c linical outcome in non-sm all cell lung cancer patients[J].Cell Onco l,2012,6(35):461-471.
[4]Parkin DM,Bray F,Ferlay J,etal.Globalcancer statistics,2002[J]. CACancer JClin,2005,55(2):74-108.
[5]Zhu X,Fan W G,Li D P,et al.Heme oxygenase-1 system and gastrointestinaltumors[J].World journalofgastroenterology,2010, 21(16):2633-2637.
[6]Lanceta L,Matting ly J M,Li C,et al.How Hem e Oxygenase-1 Prevents Hem e-Induced CellDeath[J].PLoSONE,2015,10(8):e0134144.
[7]Degese M S,Merd izabal J E,Gard inl N A,et al.Exp ression of hem e oxygenase-1 in non-sm allce ll lung cancer(NSCLC)and its correlationwith c linicaldata[J].Lung Cancer,2012,1(77):168-175. [8]Blum enthal S B,Kiem er A K,Tiegs G,et a l.Metalloporphyrins inactivate caspase-3 and-8[J].FASEB J,2005,19(10):1272-1279.
[9]Was H,Cichon T,Smolarczyk R,et a l.Overexp ression of heme oxygenase-1 in murine melanoma:inc reased p ro liferation and viability of tumorce lls,decreased survivalo fm ice[J].The Am erican journa lofpathology,2006,169(6):2181-2198.
[10]夏利龙,朱成楚,陈保富,等.血红素加氧酶-1对食管癌Eca109细胞VEGF表达的影响[J].实用医学杂志,2013,29(20):9-12.
[11]Tsai J R,Wang H M,Liu P L,et al.High exp ression of hem e oxygenase-1 is associated with tum or invasiveness and poor c linicaloutcome in non-small cell lung cancer patients[J].Cell Oncol,2012,35(6):461-471.
Effect of silencing HO-1 gene expression on biological behavior of lung adenocarcinoma A549 cells
XIA Lilong,JU Sheng,YUAN Feng,et al.Department of Thoracic Surgery,Zhejiang Hospital,Hangzhou 310013,China
【 Abstract】 Objective To investigate the effects of silencing heme oxygenase-1(HO-1)gene exp ression by RNA interference(RNAi)on p roliferation and invasiveness of human lung adenocarcinoma A549 cells in vitro. Methods The small interfering RNA(siRNA)targeting HO-1 gene was constructed and transfec ted into A549 cells.Reverse transcrip tionpolymerase chain reaction(RT-PCR)and Western b lotwas used to detect the silencing effectof HO-1 exp ression.The assays of cellcounting kit-8(CCK-8),flow cytometry and Transwellwere performed to assess the malignant phenotypes of transfected A549 cells. Results The p roliferation of interference g roup was marked ly decreased (P<0.05).The apop tosis rate was significanthigher in the interference g roup(P<0.05),and the number of cells in Go/G1 phase was marked ly increased(P<0.05). The number ofm igrated cells in interference group was significant higher than those in non-transfected control g roups(P<0.05). Conclusion Silencing HO-1 gene exp ression by RNA interference can significantly induce cellapop tosis,and inhibit the p roliferation and m igratory capacity of lung adenocarcinoma A549 cells in vitro.
Lung neop lasms HO-1 RNA interference
2015-11-07)
(本文编辑:李媚)
310013 杭州,浙江医院胸外科
夏利龙,E-mail:532089305@qq.com
