高效液相色谱法测定壳寡糖的含量
2016-12-21蒋慧李恒张澜李妍李悦明徐建春辛跃强
蒋慧,李恒,张澜,李妍,李悦明,徐建春,辛跃强
(1.山东省食品药品检验研究院,山东济南250000;2.日照市食品药品检验检测中心,山东日照276800;3.青岛市黄岛区食品药品监督管理局,山东青岛266400;4.青岛科海生物有限公司,山东青岛266400)
高效液相色谱法测定壳寡糖的含量
蒋慧1,李恒1,张澜2,李妍3,李悦明4,徐建春4,辛跃强4
(1.山东省食品药品检验研究院,山东济南250000;2.日照市食品药品检验检测中心,山东日照276800;3.青岛市黄岛区食品药品监督管理局,山东青岛266400;4.青岛科海生物有限公司,山东青岛266400)
探讨高效液相色谱(HPLC)法在壳寡糖含量测定中的应用。选用Shodex Asahipak NH2P-50 4E色谱柱(4.6 mm×250 mm,5 μm)测定壳寡糖样品中2~6个聚合度壳寡糖的含量。检测器为示差折光检测器,流动相V(乙腈)∶V(水)=75∶25,流速1.2 mL/min,柱温30℃。液相检测壳寡糖的回收率为96.9%~98.2%,相对标准偏差为0.1%~1.0%。结果表明:该定量分析方法可快速、高效地测定壳寡糖样品中2~6个聚合度壳寡糖的含量。
壳寡糖;高效液相色谱法;含量;测定
随着生活水平的提高,肥胖、高血压、胆固醇等疾病的发病率也随之升高,食品安全和健康问题日益成为人们关注的焦点。壳寡糖(Chitosan oligosaccharide,简称COS)是以壳聚糖为原料经酶解反应得到的,它是以2~10个乙酰氨基葡萄糖经β-1,4糖苷键连接而成的水溶性好、易被人体吸收且生物活性高的低分子量寡聚糖[1-6]。壳寡糖是目前发现的自然界中唯一带正电荷、呈碱性的水溶性多糖,具有优越的生物活性[7-9]。壳寡糖不仅保留了壳聚糖大分子所具有的功能性质,如降血压、降低胆固醇、防治糖尿病、治疗烧烫伤、排除体内有毒有害物质、强化肝脏机能等[10-13],同时不同分子量的壳寡糖还具有壳聚糖所不具备的独特的生理功能[14],特别是6个聚合度的壳寡糖[15],如调节肠道菌群,在人体肠道内增殖双歧杆菌,抑制大肠杆菌的生长[16];抑制肿瘤细胞的生长,促进脾脏抗体生成[17-19];强化肝脏功能,防止胃溃疡[20];在微酸性环境中具有较强的抗菌作用和显著的保温吸湿能力[21-22];作为营养强化剂的载体等作用[23]。因此,壳寡糖在保健品、生物医药等方面具有极为广泛的应用范围和发展前途。
目前,壳寡糖含量的检测方法一般采用化学试剂法[24-26],化学试剂法的原理是将高分子聚糖在强酸的条件下分解成单糖N-乙酰氨基葡萄糖,然后通过3,5-二硝基水杨酸(DNS)测定还原糖的方法测定单糖含量,从而计算出高分子聚糖的含量[27-28]。该方法检测成本低、易操作,但检测结果无法确定聚合度在2~10个之间的壳寡糖的含量。笔者探讨了高效液相色谱法在壳寡糖含量测定中的应用,期望通过运用高相液相色谱法寻找快速、精密度高和重现性好的壳寡糖含量检测方法。
1 材料与方法
1.1 试验材料
1.1.1 仪器与设备
LC-1200高效液相色谱仪,含RID-20A示差折光检测器、LC-20AT二元泵、控制器、CTO-20A柱温箱,日本岛津公司;AS 20600B超声清洗仪,天津奥特赛恩斯仪器有限公司。
1.1.2 试剂与药品
壳寡糖标准物质壳二糖(≥97%)、壳三糖(≥98%)、壳四糖(≥98%)、壳五糖(≥97%)、壳六糖(≥96%),购自青岛博智汇力生物科技有限公司;壳寡糖样品,青岛科海生物科技有限公司提供;HPLC级乙腈,美国天地试剂(TEDIA,USA);超纯水,娃哈哈集团瓶装用水。
1.1.3 标准溶液的配制
将标准物质壳二糖、壳三糖、壳四糖、壳五糖、壳六糖分别配成质量分数为1.5%,2.5%,5.0%,7.5%,10%的标准溶液,经0.22 μm滤膜过滤后,4℃冷藏备用。
1.1.4 壳寡糖样品溶液的配制
将壳寡糖样品配制成适宜浓度,经0.22 μm滤膜过滤,4℃冷藏备用。
1.2 试验方法
1.2.1 色谱条件:
色谱柱:Shodex Asahipak NH2P-50 4E(4.6 mm×250 mm,5 μm);流动相:V(乙腈)∶V(水)=75∶25;流动相流速:0.6~1.2 mL/min;柱温:26~34℃;进样体积:20 μL。
1.2.2 试验过程
配制流动相乙腈-水的混合溶液,分别设置0.6,0.8,1.0,1.2,1.4 mL/min五个流动相流速以及分别选取26,28,30,32,34℃五个柱温进行壳寡糖高效液相色谱分析。
将1.1.3和1.1.4步骤中配制好的标准溶液和壳寡糖样品溶液分别注入高效液相色谱仪中进行色谱分离,记录不同条件下壳寡糖标准物质和样品的出峰保留时间和峰面积。
2 结果与讨论
2.1 分析条件的确定
由于乙腈的洗脱能力强,基线噪音低和分离度高,在多种糖的分离中应用广泛,选择乙腈-水作为流动相并使用氨基柱进行壳寡糖的分离[29-32]。经过比较不同柱温分析壳寡糖样品的结果,最终确定柱温为30℃,此温度下各聚合度壳寡糖的出峰时间相隔适宜,有效将2~6个聚合度壳寡糖分离开的同时,所用时间最短。经过比较不同流动相流速分析壳寡糖样品的结果,最终确定流速为1.2 mL/min,此流速下色谱图显示各峰无拖尾现象,各峰分离效果最好,同时缩短了检测时间。因此,确定的分析条件为:V(乙腈)∶V(水)=75∶25;柱温30℃;流动相流速1.2 mL/min。
2.2 精密度试验
对壳寡糖样品溶液进行定性定量分析。取壳寡糖样品溶液重复测定7次,结果见表1。由表1看出:相对标准偏差(RSD)为0.1%~1.0%,都小于2%,精密度高,说明这种分析方法是可靠的。
2.3 方法回收率
取同一壳寡糖样品溶液四份,其中一份作本底,另三份添加一定量的不同聚合度、不同浓度的壳寡糖标准溶液后测定各聚合度壳寡糖的峰面积,每份样品进行平行测定3次,考察方法的回收率,结果见表2。从表2看出:壳寡糖的回收率在96.9%~98.2%之间,说明该方法准确度较高、重现性好。

表1 精密度试验结果(n=7)
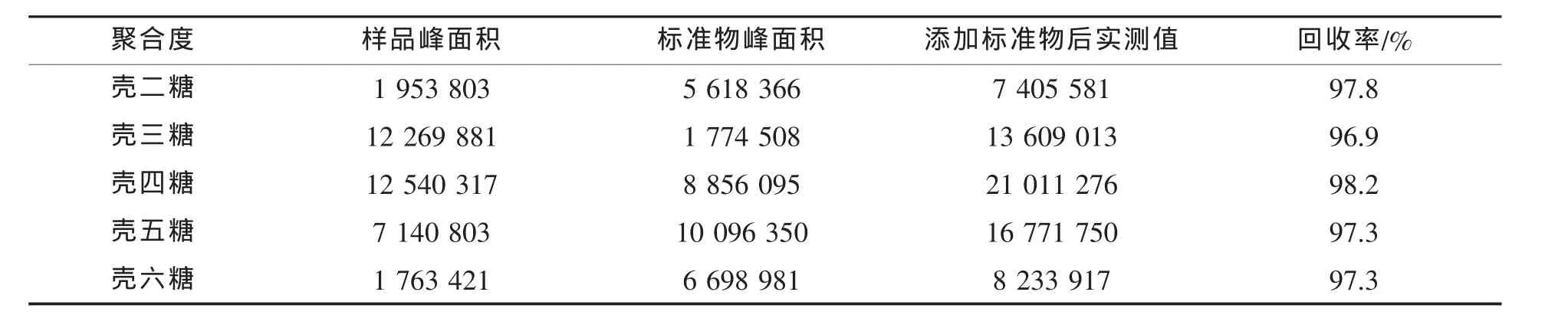
表2 壳寡糖的回收率试验结果
2.4 样品中壳寡糖的检测
图1~5为壳二糖至壳六糖标准物质的液相色谱图,其中壳二糖标准物质的出峰保留时间在8.78 min,峰面积为5 618 366;壳三糖标准物质的出峰保留时间在12.77 min,峰面积为1 774 508;壳四糖标准物质的出峰保留时间在18.72 min,峰面积为8 856 095;壳五糖标准物质的出峰保留时间在27.52 min,峰面积为10 096 350;壳六糖标准物质的出峰保留时间在39.39 min,峰面积为6 698 981。
壳寡糖样品液相色谱图如图6所示,对应各聚合度壳寡糖标准物质的出峰保留时间,对样品出峰进行归属,并记录各聚合度壳寡糖的峰面积,结果如表3所示。
根据壳寡糖标准物质的浓度和峰面积的比值与样品中相应聚合度壳寡糖的浓度和峰面积的比值相等的关系,便可求得样品中各聚合度壳寡糖的浓度,各聚合度壳寡糖浓度之和与样品的配制浓度的比值,即为2~6个聚合度壳寡糖的含量。如表3所示的壳寡糖样品中壳二糖的质量分数为1%,壳三糖的质量分数为11%,壳四糖的质量分数为7%,壳五糖的质量分数为5.6%,壳六糖的质量分数为3.5%,因此样品中2~6个聚合度壳寡糖的总质量分数为28.1%,壳寡糖样品配制的质量分数为31%,由此算得2~6个聚合度壳寡糖的质量分数为90.6%,符合国家2014年颁布的《关于批准壳寡糖等6种新食品原料的公告》中壳寡糖含量≥80%的要求。

表3 壳寡糖样品中各聚合度壳寡糖的峰面积
3 结论
采用高相液相色谱中示差折光检测器,使用Shodex Asahipak NH2P-50 4E色谱柱(4.6 mm× 250 mm,5 μm),V(乙腈)∶V(水)=75∶25作为流动相,流速为1.2 mL/min,柱温30℃,可较好地完成对壳寡糖含量的检测。经过多次试验证明,该方法具有处理简单、灵敏度高、分析速度快和结果准确等优点,对测定壳寡糖样品中2~6个聚合度壳寡糖的含量具有重要意义。
[1]谭佩毅,黄秀锦.纤维素酶法制备壳寡糖工艺的研究[J].中国调味品,2012,12(37):79-83.
[2]王鲁霞,吴延立,马文平.壳寡糖的制备方法及其在视频中的应用现状[J].安徽农业科学,2014,42(32):11485-11487.
[3]MUANPRASAT C,WONGKRASANT P,SATITSRI S,et al. Activation of AMPK by chitosan oligosaccharide in intestinal epithelial cells:Mechanism of action and potential applications in intestinal disorders[J].Biochemical pharmacology,2015,96 (3):225-236.
[4]严钦,沈月新.壳寡糖制备研究进展[J].上海水产大学学报, 2004,11(4):383-387.
[5]HUANG L,CHEN J,CAO P,et al.Anti-obese effect of glucosamine and chitosan oligosaccharide in high-fat diet-induced obese rats[J].Marine drugs,2015,13(5):2732-2756.
[6]PARK J K,KIM T H,NAM J P,et al.Bile acid conjugated chitosan oligosaccharide nanoparticles for paclitaxel carrier[J]. Macromolecular research,2014,22(3):310-317.
[7]TERMSARASAB U,CHO H J,DONG H K,et al.Chitosan oligosaccharide-arachidic acid-based nanoparticles for anticancer drug delivery[J].International journal of pharmaceutics, 2012,441(1/2):373-380.
[8]KIM S K,PARK P J,YANG H P,et al.Subacute toxicity of chitosan oligosaccharide in Sprague-Dawley rats[J].Arzneimittel-Forschung,2001,51(9):769-774.
[9]胡健,姜涌明.壳寡糖抑制植物病原菌生长的研究[J].扬州大学学报(自然科学版),2000,3(2):42-44.
[10]REIGHARD K P,HILL D B,DIXON G A,et al.Disruption and eradication of biofilms using nitric oxide-releasing chitosan oligosaccharides[J].Biofouling,2015,31(9/10):775-787.
[11]曹维强,王静,佘永新,等.壳寡糖对肠道致病菌抑制作用的研究[J].食品科学,2008,29(4):114-116.
[12]KHUTORYANSKIY V V.Advances in mucoadhesion and mucoadhesive polymers[J].Macromolecular bioscience,2011, 11(6):748-764.
[13]祝君梅,关景芳,聂卫,等.壳寡糖降血糖作用的实验研究[J].天津医药,2007,35(7):520-522.
[14]刘晶莹,刘洋,谭子强.壳寡糖对S180肉瘤小鼠抗肿瘤作用的研究[J].国外医药:抗生素分册,2015,36(1):23-24.
[15]杜昱光,张铭俊,张虎,等.海洋寡糖工程药物——壳寡糖制备分离新工艺及其抗癌活性研究[J].中国微生态学杂志, 2001,13(1):5-7.
[16]夏文水,吴焱楠.甲壳低聚糖的功能性质[J].无锡轻工业大学学报,1996,15(4):297-302.
[17]许翔,李吕木,张民扬.壳寡糖的生物学功能及其在畜禽营养中的应用[J].饲料博览,2015(6):31-36.
[18]沈献周,沈月新.不同平均分子量的壳聚糖的抑菌作用[J].上海水产大学学报,2000,9(2):138-141.
[19]周天,刘晶.壳聚糖对作物的生理效应及其增产作用[J].吉林师范大学学报(自然科学版),2003(5):18-20.
[20]杜昱光,白雪芳,金宗潦.壳寡糖抑制肿瘤作用的研究[J].中国海洋药物,2002,21(2):18-21.
[21]高先池,陈国华,应骏.两种不同凝胶柱测定壳聚糖分子量结果的比较[J].青岛海洋大学学报,2002,32(3):463-468.
[22]LIUJ,XIAW.Purificationandcharacterizationofa bifunctional enzyme with chitosanase and cellulase activity from commercial cellulase[J].Biochemical engineering journal, 2006,30(1):82-87.
[23]KIM Y H,ROH Y B.Ultrastructural study of the liver by chitosanoligosaccharide administrated in rat[J].Journal of histochemistry&cytochemistry,2001,31(4):591-600.
[24]CHOIY,KIME,PIAOZ,etal.Purificationand characterization of chitosanase from Bacillus sp.strain KCTC 0377BP and its application for the production of chitosan oligosaccharides[J].Applied and environmental microbiology, 2004,70(8):4522-4531
[25]CENTI S,TATINI F,RATTO F,et al.In vitro assessment of antibody-conjugated gold nanorods for systemic injections[J]. Journal of nanobiotechnology,2014,12(1):1-10.
[26]SU E P,KIM O H,KWAK J H,et al.Antihyperglycemic effect of short-term arginyl-fructose supplementation in subjects with prediabetes and newly diagnosed type 2 diabetes:randomized, double-blinded,placebo-controlled trial[J].Trials,2014,16 (1):1-8.
[27]LEE H W,KARIM M R,PARK J H,et al.Poly(vinyl alcohol)/chitosan oligosaccharide blend submicrometer fibers preparedfromaqueoussolutionsbytheelectrospinning method[J].Journal of applied polymer science,2009,111(1): 132-140.
[28]PARK J H,LEE H W,DONG K C,et al.Electrospinning and characterization of poly(vinyl alcohol)/chitosan oligosaccharide/ clay nanocomposite nanofibers in aqueous solutions[J].Colloid &polymer science,2009,287(8):943-950.
[29]梁荣荣,李丕武,辛跃强.从异麦芽酮糖母液中分离异麦芽酮糖和海藻酮糖方法的研究[J].食品工业,2016,37(4): 74-78.
[30]辛跃强.低聚半乳糖对肠道益生菌作用机理的研究[D]:济南:齐鲁工业大学,2015.
[31]曾荣香,张清华,管咏梅,等.柱前衍生化高效液相色谱法测定地稔多糖中单糖组成[J].中国实验方剂学杂志,2015(10): 73-76.
[32]胡志鹏.壳寡糖的研究进展[J].中国生化药物杂志,2003, 24(4):210-212.
(责任编辑:朱小惠)
Determination of chitosan oligosaccharide by high performance liquid chromatography
JIANG Hui1,LI Heng1,ZHANG Lan2,LI Yan3,LI Yueming4,XU Jianchun4,XIN Yueqiang4
(1.Shandong Provincial Food and Drug Inspection and Research Institute,Jinan 250000,China;2.Rizhao Center for Food and Drug Control,Rizhao 276800,China;3.Huangdao Drug Supervision and Administration Bureau, Qingdao 266400,China;4.Qingdao Kehai Biochemistry Co.,Ltd.,Qingdao 266400,China)
Chitosan oligosaccharides containing 2-6 degree of polymerization were analyzed by high performance liquid chromatography with a refraction index detector.Samples(20 μL)were separated in a Shodex Asahipak NH2P-50 4E column(4.6 mm×250 mm,5 μm).Eluent V (acetonitrile)∶V(water)=75∶25 was used as mobile phase and the flow rate was set at 1.2 mL/min at 30℃.The recovery of chitosan oligosaccharides were 96.9%-98.2%and the relative standard deviation were 0.1%-1.0%.The results indicated that it was a rapid and effective method to determine the content of chitosan oligosaccharides.
chitosan oligosaccharide;high performance liquid chromatography;content;detection
O657
A
1674-2214(2016)04-0232-05
2016-07-02
蒋慧(1964—),女,山东滨州人,副主任药师,主要从事食品、药品检验和产品质量控制工作,E-mail:xubz19@163.com.
