电刺激对富脂性胰岛素抵抗骨骼肌细胞糖代谢的影响
2016-12-20潘红英徐晓阳贾章志
潘红英 徐晓阳 贾章志

摘 要:棕榈酸孵育C2C12细胞建立富脂性胰岛素抵抗骨骼肌细胞模型,观察一定强度的电刺激引发收缩对其糖代谢的影响。选用不同梯度浓度的棕榈酸孵育分化5 d的C2C12细胞16 h,检测各组细胞培养液中葡萄糖剩余量和细胞活性,选取合适的棕榈酸浓度建立其诱导的胰岛素抵抗细胞模型。随后实验分为4组:对照组(C组)、电刺激组(EPS组)、棕榈酸组(PA组)、电刺激+棕榈酸组(EPS+PA组),以15 V、30 ms、2 Hz的强度电刺激60 min,收样测定细胞培养液葡萄糖剩余量、AMPK-α2 mRNA和GLUT4蛋白表达量。结果显示,(1)0.5 mmol/L棕榈酸溶液孵育16 h,与C组相比,LDH、MTT无显著变化(P>0.05),葡萄糖剩余量明显增加(P<0.05),加入胰岛素刺激后,葡萄糖剩余量与刺激前相比无显著性差异(P>0.05);(2)与C组相比,PA组葡萄糖剩余量显著增加(P<0.05)、AMPK-α2基因表达显著下降(P<0.05)、总GLUT4蛋白和膜GLUT4蛋白表达量显著下降(P<0.05);(3)与PA组相比,EPS+PA组葡萄糖剩余量显著减少(P<0.05)、AMPK-α2基因表达显著升高(P<0.05)、肌管膜GLUT4蛋白表达量非常显著增加(P<0.01)、总GLUT4蛋白量虽有所增加,但无显著性变化(P>0.05)。结果说明:棕榈酸(0.5 mmol/L)孵育分化5 d的C2C12细胞16 h,可以导致其富脂性胰岛素抵抗的发生。15 V、30 ms、2 Hz的强度电刺激60 min,可以提高胰岛素抵抗骨骼肌细胞对葡萄糖的吸收,增加AMPK-α2mRNA和GLUT4蛋白的表达,有助于改善富脂性胰岛素抵抗骨骼肌细胞的糖代谢。
关 键 词:运动生物化学;骨骼肌细胞;棕榈酸;胰岛素抵抗;电刺激;糖代谢;小鼠
中图分类号:G804.7 文献标志码:A 文章编号:1006-7116(2016)06-0129-06
Effects of electric stimulation on lipid rich insulin resisting the
sugar metabolism of skeletal muscle cells
PAN Hong-ying1,XU Xiao-yang1,JIA Zhang-zhi2
(1.School of Physical Education,South China Normal University,Guangzhou 510006,China;
2. Sports Science Research Institute of Guangdong Province,Guangzhou 510100,China)
Abstract: By using palmitic acid to incubate C2C12 cells, the authors established a model of lipid rich insulin resisting skeletal muscle cells, so as to observe the effects of contraction triggered by a certain intensity of electric stimulation on the cells sugar metabolism. The authors used different gradient concentrations of palmitic acid to incubate 5d differentiated C2C12 cells for 16h, measured glucose remaining amount and cell activity in the cell culture fluid of various groups, selected an appropriate palmitic acid concentration to establish a model of insulin resisting the cells, which was induced by such a concentration, then divided the experiment into 4 groups: a control group (C), an electric stimulation group (EPS), a palmitic acid group (PA), and an electric stimulation + palmitic acid group (EPS+PA ), applied an intensity of (15 V, 30 ms, 2 Hz) of electric stimulation for 60min, collected the samples and measured glucose remaining amount, AMPK-α2 mRNA and GLUT4 protein expression levels in the cell culture fluid, and revealed the following findings: 1) Comparing the group incubated with 0.5 mmol/L palmitic acid for 16 h with group C, LDH and MTT had no significant change (P>0.05), glucose remaining amount increased significantly (P<0.05), after adding insulin stimulation, glucose remaining amount had no significant difference as compared with that before stimulation (P>0.05); 2) Comparing group PA with group C, glucose remaining amount increased significantly (P<0.05), AMPK-α2 gene expression decreased significantly (P<0.05), total GLUT4 protein and membrane GLUT4 protein expression levels decreased significantly (P<0.05); 3) Comparing group EPS+PA with group PA, glucose remaining amount decreased significantly (P<0.05), AMPK-α2 gene expression increased significantly (P<0.05), myotube membrane GLUT4 protein expression level increased very significantly (P<0.01), total GLUT4 protein content had no significant change (P>0.05), although increased somewhat. The said findings indicate the followings: using palmitic acid (0.5 mmol/L) to incubate 5 d differentiated C2C12 cells for 16 h can cause the occurrence of resistance of their lipid rich insulin; an intensity of (15 V, 30 ms, 2 Hz) of electric stimulation for 60min can promote insulin resisting the glucose absorption by skeletal muscle cells, increase AMPK-α2 mRNA and GLUT4 protein expression, thus help improving lipid rich insulin resisting the sugar metabolism of skeletal muscle cells.
Key words: sports biochemistry;skeletal muscle cell;palmitic acid;insulin resistance;electric stimulation;glucose metabolism;mouse
胰岛素抵抗(IR)是指胰岛素的外周靶组织对胰岛素的敏感性和反应性降低,导致生理剂量的胰岛素产生低于正常值的一种病理状态[1]。IR与葡萄糖代谢异常密切相关,因此改善胰岛素抵抗及葡萄糖代谢紊乱,是防治2型糖尿病及相关代谢性疾病的重要途径。骨骼肌作为机体最大的胰岛素靶器官和葡萄糖利用的主要外周组织,是IR发生的主要场所。研究发现,长期高脂饮食或短期脂肪酸大量输入,以及机体因增龄引起的退化,均可引起骨骼肌脂肪含量增加,导致出现富脂性胰岛素抵抗[2-3]。
电刺激是运动生理中常用的刺激方法,目前己广泛应用到与骨骼肌收缩有关的疾病预防和治疗中。电刺激对已发生胰岛素抵抗的骨骼肌细胞的作用如何,国内外相关的研究很少。因此,本研究以C2C12小鼠骨骼肌细胞为研究对象,利用饱和脂肪酸棕榈酸(PA)孵育诱导建立富脂性胰岛素抵抗细胞模型,电刺激引起骨骼肌细胞收缩,观察收缩对富脂性胰岛素抵抗的C2C12肌管的糖转运能力的影响,为下一步深入开展骨骼肌细胞胰岛素抵抗电刺激方面的研究提供参考。
1 材料与方法
1.1 C2C12细胞培养、分化
小鼠骨骼肌肌母细胞系C2C12细胞购自南方医科大学,DMEM高糖培养基(含10%胎牛血清),37 ℃、体积分数5% CO2培养箱中培养,细胞生长密度达70%~80%时将所有细胞用0.25%胰蛋白酶消化后,以2×105/mL密度种到6孔培养板中,待细胞单层覆盖培养板底面密度达95%左右,换成分化培养基(高糖DMEM,2%马血清,质量分数1%青霉素/链霉素)开始进行分化培养,每天换液,并从加入分化培养基开始计算分化天数。
1.2 PA孵育建立IR骨骼肌细胞模型
细胞分化5 d后,换成1%BSA的低糖无血清培养液孵育12 h(饥饿处理)。培养板每孔分别加入0、0.25、0.5、0.75、1.0 mmol/L浓度的棕榈酸(PA),孵育16 h,收取细胞和培养上清液。选取适当参数,建立IR细胞模型。
油红O染色:PA孵育后,加入质量分数10%中性甲醛固定30 min,PBS冲洗3次,每孔加入新鲜配制的油红O染液1 mL,室温孵育2 h,观察脂滴形成情况。弃去染色液,每孔加入1 mL质量分数4%的NP-40的异丙醇,反复吹打后每孔取出150 μL,按照南京建成生物工程研究所提供的脂质形成检测试剂盒说明测定脂质含量。试剂盒由普利莱基因技术有限公司提供。
1.3 实验分组和电刺激方案
饥饿处理后的肌管随机分为4组,对照组(C组)、电刺激组(EPS组)、棕榈酸组(PA组)、电刺激+棕榈酸组(EPS+PA组)。C组和EPS组用分化培养基培养16 h,PA组和EPS+PA组用PA孵育16 h成IR肌管。 随后分别对EPS组和EPS+PA组进行电刺激,强度设为15 V、30 ms、2 Hz,时间60 min,刺激结束立即收样;C组和PA组直接收样。测定相关指标。
1.4 细胞活性测定
细胞活力检测试剂盒(MTT法)测定细胞活性,用酶联免疫检测仪(美国,BIO-RAD公司)570 nm处测定其光密度值,计算细胞存活率。乳酸脱氢酶(LDH)活性定量检测试剂盒测定细胞膜完整性,440 nm波长处测光密度值,通过公式计算各组LDH浓度。试剂盒由南京建成生物工程研究所提供。
1.5 细胞培养液葡萄糖(G)剩余量测定
葡萄糖氧化酶-过氧化物酶法检测上清液中剩余葡萄糖浓度,酶标仪测定550 nm处光密度值,通过公式计算葡萄糖含量。在棕榈酸孵育结束前30 min加入100 nm的胰岛素(Ins)溶液或加入同溶剂的胰岛素对照品(除了不含胰岛素,其他溶液成分一样)刺激。
1.6 腺苷酸活化蛋白激酶α2(AMPK-α2)mRNA的测定
采用实时定量PCR方法测定C2C12肌管中AMPK-a2 mRNA水平,引物由上海生工生物有限公司设计,抗体由北京博奥森生物技术有限公司提供。Trizol法提取肌管总RNA,mRNA反转录合成cDNA,然后进行逆转录聚合酶链反应(RT-PCR)。AMPK-α2上游引物5-TCCAAAGTCAGCTATCTTAGCGTT-3,下游引物5-CGTGGATTACTGTCACAGGCATAT -3。内参上游引物5-TGATGTCACGCACGATTTCC-3,下游引物5-ACACTGTGCCCATCTACGAGG-3。在管中加20 μL反应体系,Hema3200基因扩增仪上反应。以GAPDH为内参,计算目的基因的相对表达量。
1.7 Western Blotting 测定葡萄糖转运蛋白4(GLUT4)蛋白表达
收集细胞,加入裂解液,离心提取胞浆和胞膜蛋白。按照GLUT4蛋白检测试剂盒说明书和检测目的条带大小来配制一定浓度的分离胶和5%浓缩胶。兔抗GLUT4,AMPK,一抗、二抗孵育后,TBST洗涤膜。使用ECL试剂盒发光,显影,X线胶片压片曝光,扫描定量各条带的相对灰度值,β-actin为内参蛋白,“目的蛋白相对含量=目的蛋白灰度值/β-actin内参蛋白灰度值”。试剂盒由北京博奥森生物技术有限公司提供。
1.8 数据统计处理
SPSS17.0统计学软件进行处理。所有数据以“ ±s”表示,单因素方差分析检验各组数据间差异的显著性,P<0.05为显著性差异,P<0.01为非常显著性差异。
2 结果及分析
2.1 不同浓度PA孵育后细胞活性和LDH活性变化
MTT法是检测活细胞的数量和代谢活力的经典方法,MTT值下降,提示活细胞数量减少,细胞生长受抑制。表1所示:低浓度(0、0.25、0.5 mmol/L)PA孵育16 h,细胞活性均增加,与0 mmol/L PA孵育相比,0.25、0.5 mmol/L孵育后MTT值虽有降低,却无显著性差异(P>0.05),0.75、1.0 mmol/L孵育后,MTT值降低显著(P<0.05)。提示0.5 mmol/L以上浓度明显抑制了细胞增殖。LDH是质膜完整性的标志,也是检测细胞毒性的指标,酶活力越大,表示细胞受损程度越严重。表1结果显示,与浓度0 mmol/L PA孵育相比,1.0 mmol/L孵育后LDH活性增加(P<0.05 ),而0.75 mmol/L以下的3个浓度孵育后,LDH活性均无显著性差异(P>0.05),提示浓度1.0 mmol/L孵育后,肌管膜出现明显损伤。
2.2 不同浓度PA孵育后C2C12肌管糖剩余量和脂质含量的比较
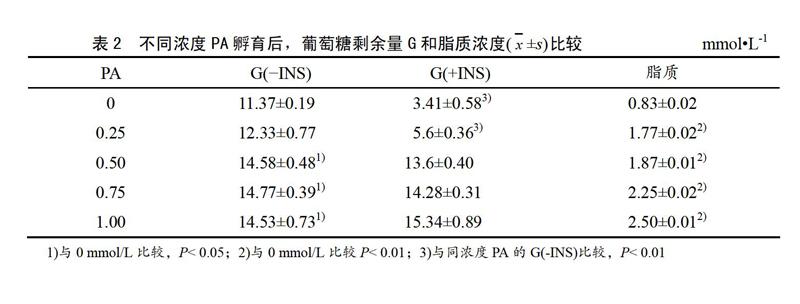
表2所示:16 h的PA孵育,浓度0.50、0.75和1.0 mmol/L上清中葡萄糖剩余量G与0 mmol/L相比显著增加(P<0.05),脂质含量非常显著增加(P<0.01)。在PA孵育结束前30 min加入100 nmol/L胰岛素溶液(+INS)刺激的各浓度中,浓度0、0.25 mmol/L与不加胰岛素(-INS)刺激的同浓度PA孵育相比,葡萄糖剩余量显著降低(P<0.01)。0.5 mmol/L PA孵育后,与0 mmol/L组相比,脂肪粒增多(见图1)。
2.3 电刺激IR肌管后葡萄糖剩余量、LDH活性、AMPK-a2 mRNA的变化
表3结果显示:EPS组肌管培养液中葡萄糖剩余量明显低于对照组(P<0.05),PA组则高于对照组(P<0.05),EPS+PA组葡萄糖剩余量明显低于PA组(P<0.05)。各组培养液中LDH活性与对照组相比都无显著差异(P>0.05),但EPS组明显低于PA组(P<0.01)。AMPK-a2mRNA 表达,与对照组相比,PA组降低(P<0.05),而EPS组明显增加(P<0.01),EPS+PA组与PA组相比也显著增加(P<0.05)。
2.4 电刺激IR肌管,引起GLUT4蛋白表达的变化
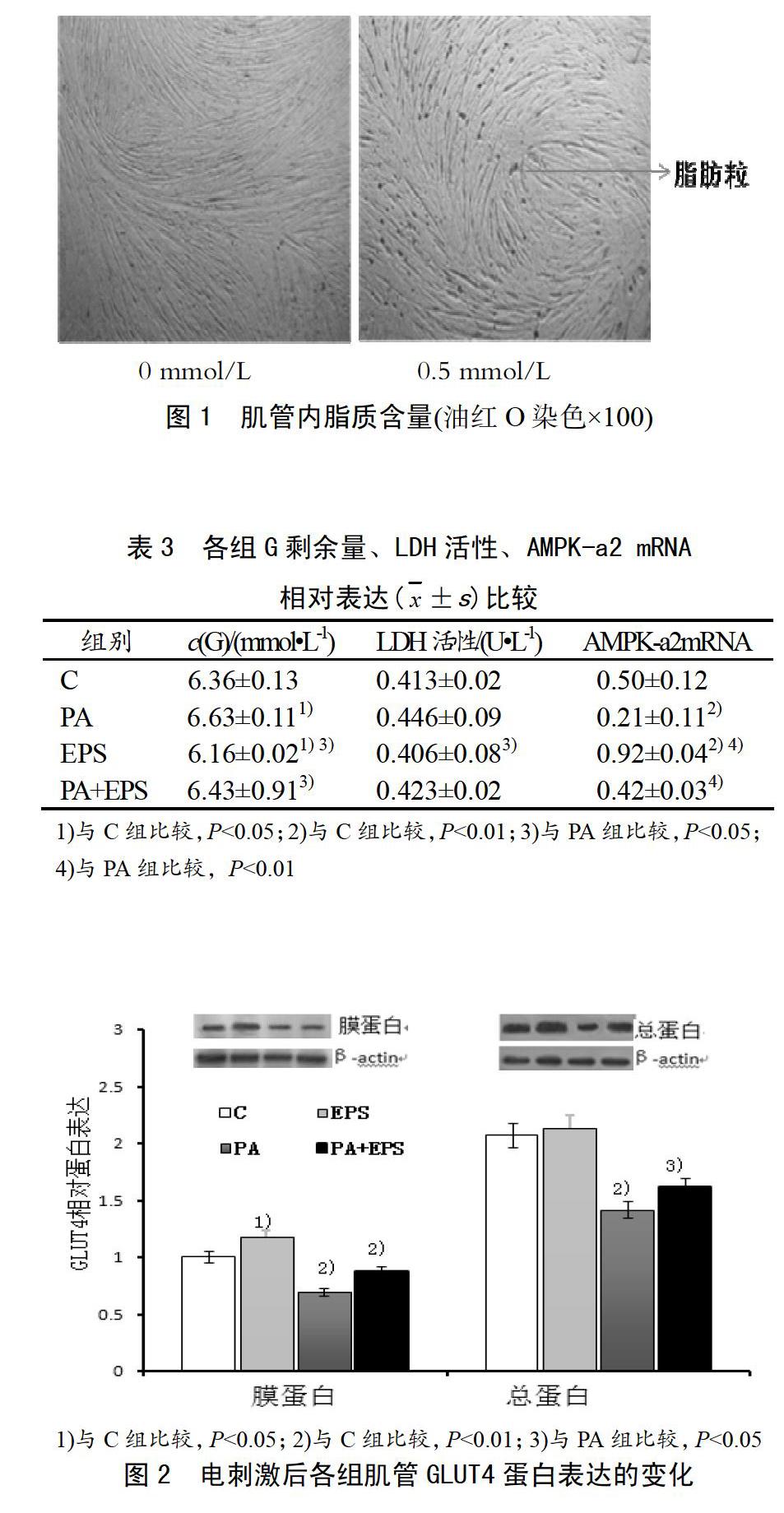
图2结果显示:与C组相比,PA组膜GLUT4蛋白和总蛋白表达显著性降低(P<0.01),EPS组膜GLUT4蛋白表达增加(P<0.05),总蛋白虽有增加确无显著差异(P>0.05)。与PA组相比,PA+EPS组膜GLUT4蛋白表达显著增加(P<0.01),总蛋白有所上升,但无显著差异(P>0.05)。
3 讨论
3.1 富脂性胰岛素抵抗细胞模型的建立
研究骨骼肌富脂性胰岛素抵抗发生机制,建立相关的胰岛素抵抗模型尤为重要。分化后具有收缩功能的C2C12细胞,常被用做离体骨骼肌功能的研究。动物和人体实验表明[2],无论是通过脂质灌注还是慢性的高脂饮食,引起血中游离脂肪酸升高,均可导致骨骼肌出现富脂性胰岛素抵抗。老年人易发生的胰岛素抵抗也与骨骼肌线粒体功能异常,产生肥胖和脂质堆积有关[3]。在引起胰岛素抵抗的脂肪酸中,又以长链饱和脂肪酸棕榈酸最为典型[4],且不同浓度的棕榈酸对细胞的影响不同。在C2C12和L6细胞诱导分化前加入棕榈酸孵育,可影响肌细胞分化,但分化后再加入棕榈酸则不影响分化程度[5]。浓度为0.2~0.8 mmol/L的棕榈酸孵育L6骨骼肌细胞8 h,细胞活性不变,但对棕榈酸的吸收随浓度增加[6]。而0.8、1.0 mmol/L浓度的棕榈酸分别孵育到24和36 h,细胞活性出现降低[7]。也有研究发现0.75 mmol/L 棕榈酸处理分化4 d的C2C12肌管16 h,GLUT4 mRNA水平和糖摄入均降低[8]。
本研究选取1 mmol/L以下的4个浓度梯度,孵育分化5 d的C2C12肌管16 h,发现,高浓度(0.75、1 mmol/L)的棕榈酸孵育后,细胞活性明显降低,低浓度(0.25、0.5 mmol/L)的棕榈酸孵育不会引起细胞活性下降和膜损伤。各组上清中葡萄糖剩余量与对照组相比均显著性增加。在PA孵育结束前30 min加入100 nmol/L胰岛素溶液刺激后,低浓度(0.25 mmol/L) PA孵育的肌管葡萄糖剩余量与同浓度不加胰岛素刺激的PA组相比显著减少(P<0.01);0.5 mmol/L 组则无显著性变化。因胰岛素刺激下对葡萄糖的代谢能力是判断骨骼肌胰岛素敏感性的主要指标。故可推断0.5 mmol/L PA孵育后,肌管对胰岛素敏感性已降低,出现胰岛素抵抗。油红O染色也发现,肌管内红色脂质颗粒明显增加,表明此时已引起肌管脂质积累。即由此可以认为,0.5 mmol/L的浓度PA孵育细胞16 h,可引起分化的肌管产生胰岛素抵抗,是建模的适宜浓度。
3.2 电刺激对富脂性IR骨骼肌细胞葡萄糖代谢的改善作用
骨骼肌的收缩水平是底物代谢及转录事件的重要调节因子。不同的电刺激条件及强度会对骨骼肌细胞产生不同的影响[9]。Nedachi[10]认为40 V、60 mmol/L、2 ms、1 Hz的强度较适合研究C2C12肌管收缩反应时的代谢改变。Marotta[11]等以50 V、100 mmol/L、30 ms、3 Hz的强度电刺激C2C12 肌管90 min,发现肌管中糖原分解增加,糖原代谢相关酶活性改变。本研究前期研究发现,15 V、60 mmol/L、30 ms,3 Hz的强度刺激分化5 d的C2C12肌管120 min,细胞膜没有明显损伤,且能通过AMPK途径增加肌管糖摄入和糖转运[12]。因此,本研究仍采取同样的强度,观察电刺激对富脂性IR肌管的影响。
结果显示:电刺激60 min后,各组间细胞活性和细胞膜完整性无显著性差异(P>0.05),即此强度不会对细胞造成损伤,适合对富脂性IR细胞的研究。但电刺激IR组肌管培养液中的葡萄糖剩余量明显低于对照组(P<0.05)。胰岛素抵抗的主要症状就是机体组织摄取和清除葡萄糖的能力低下。培养液中葡萄糖剩余量减少,表明电刺激引起的收缩可以有效地促进IR肌管对培养液中葡萄糖的吸收和利用,调节胰岛素抵抗肌管的糖代谢。
3.3 电刺激对富脂性IR骨骼肌细胞糖代谢相关因子的调控
GLUT4是骨骼肌葡萄糖转运的主要转运因子,其在细胞膜上载体的数量与细胞葡萄糖最大转运能力呈正相关关系[13]。胰岛素和收缩作用均可以促进GLUT4 从细胞囊泡内向细胞膜的转运。然而,两者调节葡萄糖转运则是通过不同的信号途径完成的[14-15]。在本研究中,胰岛素抵抗组GLUT4膜蛋白和总蛋白表达量都明显下降,电刺激组总GLUT4蛋白表达量变化不大,但肌膜GLUT4蛋白表达量却显著性增加,提示胰岛素抵抗时,骨骼肌肌管GLUT4 膜蛋白转位减少,导致细胞内总 GLUT4蛋白贮存量降低。电刺激诱导的收缩可以促使骨骼肌细胞 GLUT4转位,使骨骼肌细胞膜上转运蛋白含量增加,从而增加机体转运葡萄糖能力。在体研究也发现,当机体处于胰岛素抵抗或2型糖尿病状态时,骨骼肌中GLUT4蛋白表达明显低于正常大鼠,而GLUT4的过表达则可以明显改善胰岛素抵抗的症状[16-17]。这与本研究的结果相吻合,其机制可能与运动激活细胞内的能量开关分子——腺苷酸活化蛋白激酶(AMPK),后者进而促进GLUT4转位有关。
为探讨收缩运动对胰岛素介导的葡萄糖摄取的变化,本研究检测了骨骼肌收缩中对能量变化最敏感也最易被激活的AMPK-α2亚基。发现胰岛素抵抗组AMPK-α2基因表达下降,而电刺激可引起其表达上升,提示适当的电刺激改善了胰岛素抵抗造成的AMPK-α2表达下降。近来有关 AMPK在骨骼肌葡萄糖转运中的机制仍未明了。有研究认为,无论低强度或是高强度运动,AMPK-α2基因的缺失并不影响GLUT4 的转位[18]。也有研究认为,AMPK-α2是胰岛素刺激下肌糖原合成的重要因子[19],运动训练激活AMPK-α2表达,可明显改善高脂饮食导致的胰岛素抵抗[20]。结合本研究实验结果,可以表明,不论是动物实验还是细胞研究,收缩运动均可激活胰岛素抵抗骨骼肌AMPK-α2表达,调节糖代谢。但是阻断AMPK-α2的表达,电刺激胰岛素抵抗的骨骼肌细胞,是否影响GLUT4的糖转运,尚需进一步实验验证。
棕榈酸(0.5 mmol/L)孵育分化5 d的C2C12细胞16 h,可诱导其胰岛素抵抗的发生。15 V、30 ms、2 Hz的强度电刺激60 min,可以提高富脂性IR骨骼肌对葡萄糖的吸收,增加AMPK-α2mRNA和GLUT4蛋白的表达,有助于改善富脂性IR骨骼肌细胞的糖代谢。
参考文献:
[1] GOBATO A O,VASQUES A C,ZAMBON M P,et al. Metabolic syndrome and insulin resistance in obese adolescents[J]. Rev Paul Pediatr,2014,32(1):55-62.
[2] 任路平,宋光耀,刘娜,等. 高脂和高果糖饲料喂养大鼠肌细胞内长链酯酷辅-A和含量及其与胰岛素抵抗旳关系[J]. 基础医学与临床,2011,31(9):1047-1048.
[3] 温煦,王梅,张一民,等. 中国城镇居民骨骼肌含量和骨骼肌力量在增龄过程中的变化[J]. 体育科学,2010,30(3):36-41.
[4] OAKES N D,KJELLSTEDT A,TURNER N,et al. Roles of Fatty Acid over supply and impaired oxidation in Lipids accumulation in tissues of obese rats[J/OL]. J Lipids,2013,420754.doi:10.1155 .
[5] YANG M,WEI D,MO C,et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes[J]. Lipids Health Dis,2013,12:104.
[6] PIMENTA A S,GAIDHU M P,HABIB S,et al. Prolonged exposure to palmitate impairs fatty acid oxidation despite activation of AMP-activated protein kinase in skeletal muscle cells[J]. J Cell Physiol 2008,217(2):478-485.
[7] 杨宁宁,王佑民,陈冬,等. 棕榈酸致大鼠L6肌细胞胰岛素抵抗与JNK1活化的关系[J]. 安徽医科大学学报,2012:241-244.
[8] JOV? M,PLANAVILA A,S?NCHEZ R M,et al. Palmitate induces tumor necrosis factor-alpha expression in C2C12 skeletal muscle cells by a mechanism involving protein kinase C and nuclear factor kappaB activation[J]. Endocrinology,2006,147(1):552-561.
[9] 刘永,潘其乐,罗冬梅,等. 电刺激对体外培养C2C12细胞抗氧化能力的影响[J]. 北京体育大学学报,2014,37(5):67-71.
[10] NEDACHI T,FUJITA H,KANZAKI M. Contractile C2C12 myotube model for studying exercise in ducible responses in skeletal muscle[J]. Am J Physiol Endocrinol Metab,2008,295(5):1191-1204.
[11] MAROTTA M,BRAG?S R,G?MEZ-FOIX A M. Design and performance of an electrical stimulator for long term contraction of cultured muscle cells[J]. Biotechniques,2004,36(1):68-73.
[12] 潘红英,徐晓阳,郝选明,等. 电刺激对C2C12骨骼肌细胞糖代谢及其机制研究[J]. 体育科学,2012,32(8):34-39.
[13] LAURITZEN H P,SCHERTZER J D. Measuring GLUT4 translocation in mature muscle fibers[J]. Am J Physiol Endocrinol Metab,2010,299:169-179.
[14] TAKENAKA N,YASUDA N,NIHATA Y,et al. Role of the guanine nucleotide exchange factor in Akt2-mediated plasma membrane translocation of GLUT4 in insulin stimulated skeletal muscle[J]. Cell Signal,2014,26(11):2460-2469.
[15] UEDA M,HAYASHIBARA K,ASHIDA H. Propolis extract promotes translocation of glucose transporter 4 and glucose uptake through both PI3K-and AMPK-dependent pathways in skeletal muscle[J]. Biofxctors,2013,39(4):457-466.
[16] DOS SANTOS J M,MORELI M L,TEWARI S,et al. The effect of exercise on skeletal muscle glucose uptake in type 2 diabetes: An epigenetic perspective[J]. Metabolism,2015,64(12):1619-6928.
[17] CUNHA V N,LIMA M P,MOTTA-SANTOS D,et al. Role of exercise intensity on GLUT4 content,aerobic fitness and fasting plasma glucose in type 2 diabetic mice[J]. Cell Biochem Funct,2015,33(7):435-442.
[18] 龚豪杰,陈大鹏,张楠,等. 不同强度运动对AMPKα2基因敲除小鼠骨骼肌葡萄糖运载体4表达的影响[J]. 中国运动医学杂志,2010,29(4):467-471.
[19] LEE-YOUNG R S,BONNER J S,MAYES W H,et al. AMP-activated protein kinase (AMPK)α2 plays a role in determining the cellular fate of glucose in insulin-resistant mouse skeletal muscle[J]. Diabetologia,2013,56(3):608-617.
[20] ABBOTT M J,TURCOTTE L P. AMPK-α2 is involved in exercise training induced adaptations in insulin-stimulated metabolism in skeletal muscle following high-fat diet[J]. J Appl Physiol,2014,117(8):869-879.
