金针菇固体液化菌种研究
2016-12-20刘靖宇张凯孟俊龙常明昌元玲刚柴岍吕秀明
刘靖宇,张凯,孟俊龙,常明昌*,元玲刚,柴岍,吕秀明
(1.山西农业大学 食品科学与工程学院,山西 太谷 030801; 2.山西农业大学 园艺学院,山西 太谷 030801)
金针菇固体液化菌种研究
刘靖宇1,张凯1,孟俊龙1,常明昌1*,元玲刚2,柴岍1,吕秀明1
(1.山西农业大学 食品科学与工程学院,山西 太谷 030801; 2.山西农业大学 园艺学院,山西 太谷 030801)
[目的]为探究新型菌种,推进食用菌工厂化生产的进程。[方法]首先对金针菇固体液化菌种的最佳培养基进行了筛选,之后,对金针菇固体液化菌种和常规液体菌种的菌丝形态、菌丝球浓度、还原糖含量、基质降解酶活力等指标的变化情况进行了比较与分析。[结果]金针菇固体液化菌种最佳原料为木屑粉。金针菇固体液化菌种菌球浓度在第6天达到最大值68个·mL-1,且菌球浓度远高于常规液体菌种。金针菇固体液化菌种还原糖含量在第4天达到最大值18.626 g·L-1,比常规液体菌种提前1天;蛋白酶、纤维素酶和漆酶的活力均在第5天达到最大值后趋于平衡,且培养期间均高于常规液体菌种。[结论]固体液化菌种在菌球数量、基质降解活力和稳定性等方面明显优于对照常规液体菌种。
金针菇; 固体液化菌种; 基质降解活力
随着我国食用菌产业的快速发展,工厂化生产必将成为我国食用菌产业发展的必然方向[1]。高效优质菌种制备是工厂化生产的基础和丰产优质的先决条件,也是工厂化生产最为重要的组成部分[2]。目前,我国工厂化生产主要采用固体和液体2种菌种。固体菌种具有活力稳定的优点,但生产周期较长、转接后易导致菌包菌龄不一致;近年来,液体菌种的应用大大缩短了生产周期,但菌种生产过程中常常会出现菌丝活力不稳定的现象[3~6]。为此,开展结合固体菌种的稳定性和液体菌种的周期短等优点的新型固体液化菌种的研究就显得尤为必要。
金针菇是我国最先进行工厂化栽培的食用菌种类之一。因其菌盖滑嫩、柄脆、营养丰富、味美适口而著称于世。金针菇味道鲜美营养丰富,干品中含蛋白质8.87%,碳水化合物60.2%,金针菇是我国最先进行工厂化栽培的食用菌种类之一。因其菌盖滑嫩、柄脆、营养丰富、味美适口而著称于世。金针菇味道鲜美营养丰富,干品中含蛋白质8.87%,碳水化合物60.2%,粗纤维达7.4%,经常食用可防治溃疡病。随着人们对健康饮食和儿童智力开发的关注,金针菇因其良好增智和保健疗效,近几年深受广大消费者喜爱。
目前,国内还鲜有关于固体液化菌种的相关研究报道。本研究首先将金针菇PDA菌种转接于粉碎的固体培养基中,之后,将培养好的固体菌种进行液化培养制备固体液化菌种,并对其生长过程中的主要生理生化指标进行了测定,以期为新型固体液化菌种的研发提供必要的理论依据。
1 材料与方法
1.1 供试材料
1.1.1 菌种
金针菇菌株“8903”由山西农业大学食用菌中心提供。
1.1.2 培养基
PDA斜面培养基:土豆250 g,葡萄糖25 g,磷酸二氢钾2.75 g,硫酸镁1.8 g,琼脂粉20 g。
常规液体培养基:土豆250 g,葡萄糖25 g,磷酸二氢钾2.75 g,硫酸镁1.8 g。
固体液化菌种原种培养基:主料83%,麸皮15%,糖1%,石膏1%,含水量65%(主料:棉籽壳粉、玉米芯粉、木屑粉等过80目筛细粉)
1.2 仪器与设备
BS210S电子天平(北京赛多利斯天平有限公司),TGL-16G台式离心机(上海安亭科学仪器厂),722E可见分光光度仪(上海光谱仪器有限公司),zqpw-250 全温振荡培养箱(天津市莱波特瑞仪器设备有限公司)。
1.3 试验方法
1.3.1 固体液化菌种培养基筛选
将活化的金针菇(菌种于PDA培养基上,24 ℃暗培养7天)菌块(5 mm)接种于固体液化菌种原种培养基中,测定菌丝生长速度。试验重复3次,优选出最佳固体液化菌种培养基。
1.3.2 固体液化菌种与常规液体菌种液体培养
应用优选出的原料制成固体液化菌种原种,分别将等量的固体液化菌种原种(用接种针敲碎)与PDA斜面试管种接种于装有100 mL三角瓶中,24 ℃,170 r·min-1暗培养,每日取样进行后续试验测定,试验重复3次。
1.3.3 指标测定
菌球计数:取1 mL菌液置于培养皿中稀释十倍,皿下衬黑白相间方格纸计数。
还原糖含量测定:参照Song Fengyan的研究结果[7],采用3,5-二硝基水杨酸法测定。
蛋白酶活性测定:采用Worthington法[8],培养液中蛋白酶活性单位定义为1 U即1min消化1 mg酪氨酸所需酶量,时间15 min。
羧甲基纤维素酶(CMC酶)活性测定:参照Li Fen的研究结果[9],采用3,5-二硝基水杨酸法测定。培养液中羧甲基纤维素酶活性单位定义为1 U即1 min消化1 mg葡萄糖所需酶量,时间30 min。
漆酶活性检测:参照王宜磊的研究结果[10],用纱布过滤菌液,吸取300 uL滤液到1.5 mL离心管中,加入等体积的0.012 mol·L-1的愈创木酚溶液,摇匀观察颜色变化。
2 结果与分析
2.1 固体液化菌种培养基筛选
由图1可见,5种培养料制成的金针菇固体菌种生长速度存在差异,木屑粉培养基生长速度最快,长速可达0.32 mm·d-1。由于木屑易粉碎,且粉碎后形成表面光滑的颗粒,制成的固体液化菌种在进行液体培养时形成的菌球大小均一、菌丝密度高、菌球形态较好。因此,选择木屑粉作为固体液化菌种的最佳培养基。
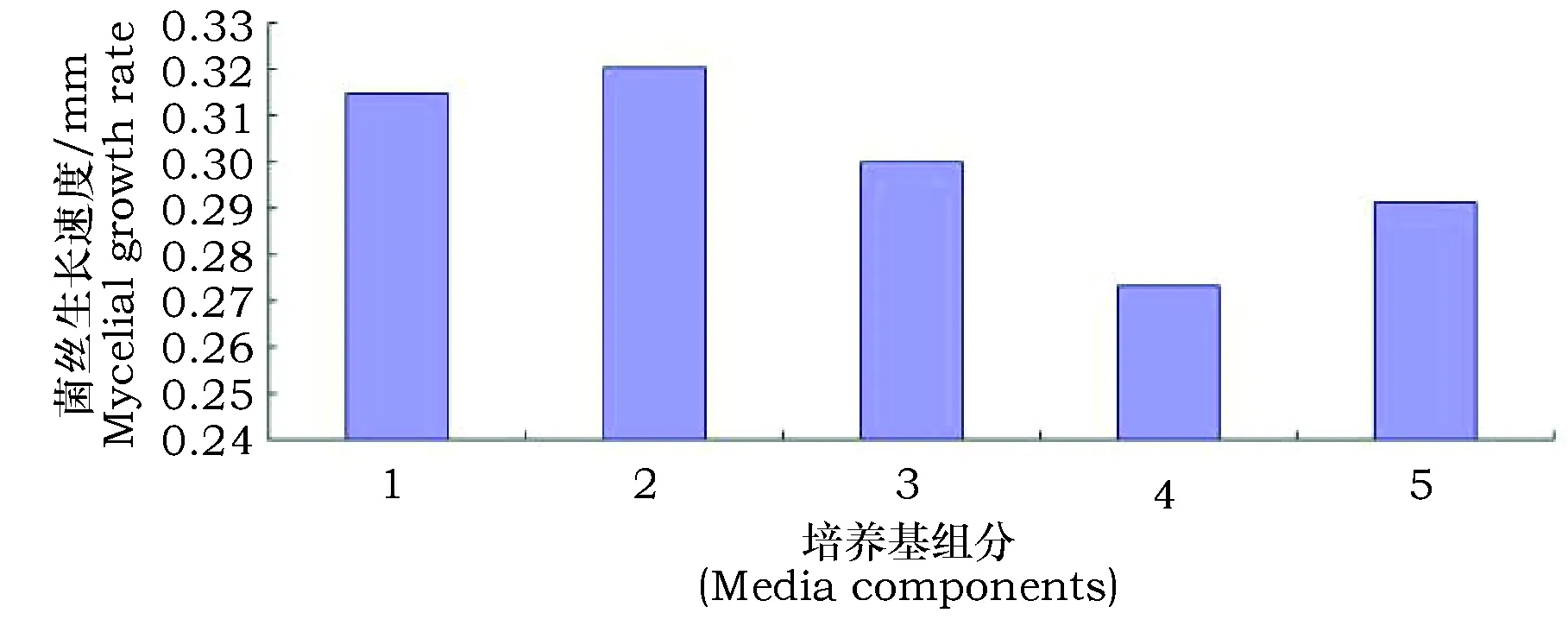
图1 不同培养基对菌丝生长速度的影响Fig.1 The Effect of different Composts on the mycelial growth race 注:1.棉籽壳培养基;2.木屑培养基;3.棉籽壳和木屑等比例混合培养基;4.玉米芯培养基;5.棉籽壳和玉米芯等比例混合培养基Note: 1.cottonseed hulls medium; 2.sawdust medium; 3.cottonseed hulls and wood composite media; 4.corn cob media; 5.cottonseed hulls and corn cob media
如图2所示,随着培养的进行,2种菌种的菌球数逐渐增加,之后略有下降。培养的第3天固体液化菌种出现较多的菌丝球(图2C),而常规液体菌种仅出现少量的菌球(图2中3)。培养的第6天固体液化菌种菌球浓度达到最大值为68个·mL-1,常规液体菌种在第7天达到最大值55个·mL-1。培养期间,固体液化菌种菌球数都远高于常规液体菌种。常规液体菌种在生长后期出现了培养液颜色变黄、变浑浊,菌丝球周围出现刺状菌丝等菌丝退化现象,而固体液化菌种无此现象。

图2 两种菌种菌丝形态变化Fig.2 The change of bacteria mycelium morphology on two different spawn 注:1~8为常规液体菌种8天培养图;A~H为固体液化菌种8天培养图Note: 1 to 8 for 8 days of conventional liquid spawn culture figure; A to H for 8 days of solid
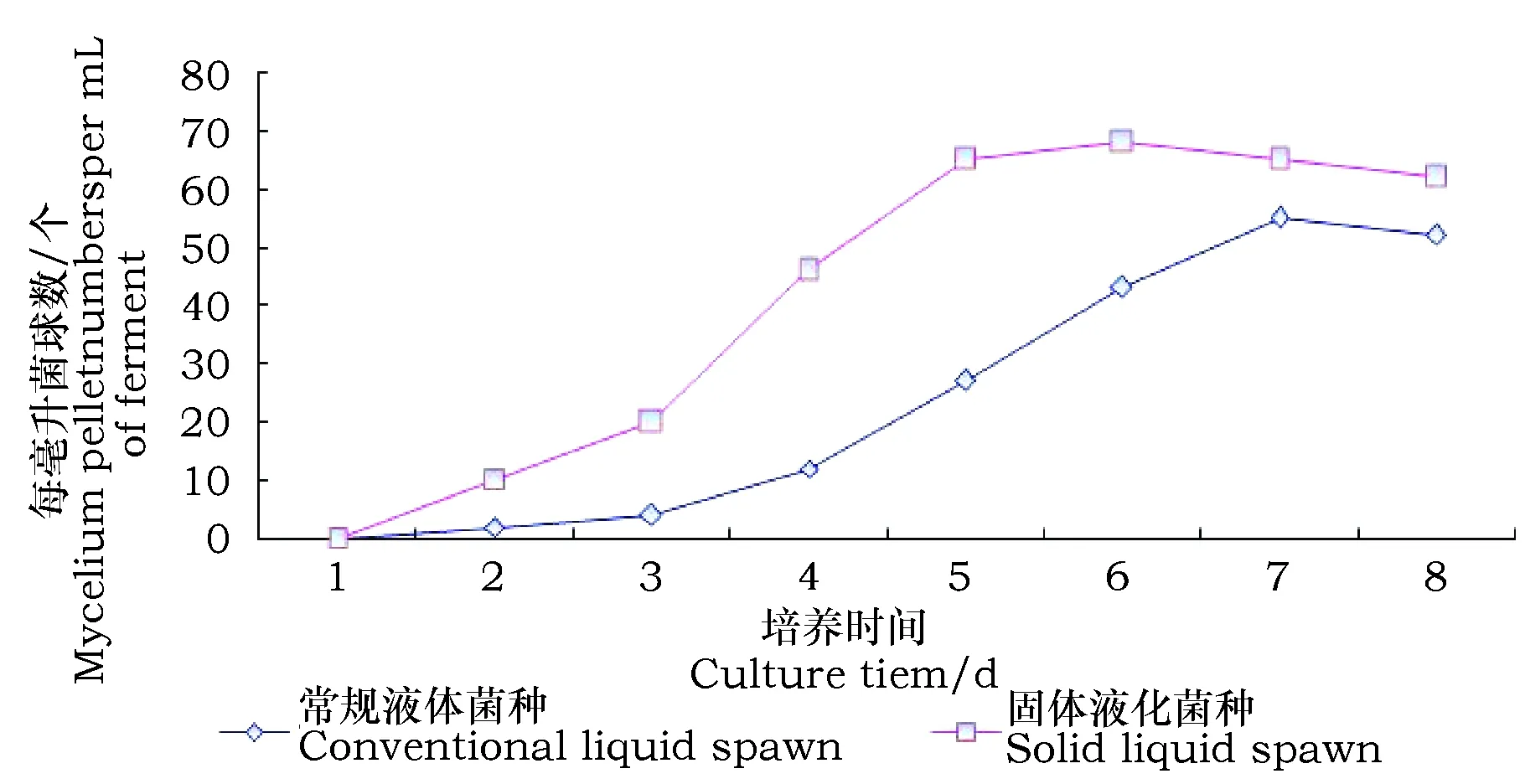
图3 两种菌种菌球数量变化Fig.3 The change of mycelial pellet numbers in two different spawnliquefaction spawn culture figure
2.2.2 液体培养基中还原糖含量的变化
由图4 可知,两种菌种培养液中还原糖含量均呈先增加后下降的趋势,固体液化菌种还原糖含量在第4天达到最大值18.626 mg·mL-1,常规液体菌种在第5天达到最大值18.623 mg·mL-1。培养前期,菌丝活力较弱,主要利用培养液中现有的还原糖;随后产生酶分解大分子物质产生还原糖,还原糖的产出率高于吸收率,因此还原糖含量呈上升趋势;培养后期菌丝活力增强,菌液中还原糖代谢加快,营养物质被消耗殆尽,还原糖含量呈下降趋势。固体液化菌种为菌丝包裹的木屑颗粒,培养过程中菌丝生物量较大,培养前期对还原糖的利用率较高;培养后期对还原糖的消耗量大,因此前期还原糖含量增长较快,后期下降趋势较为明显。固体液化菌种培养第4天达到最大值后略有下降,第5天较第4天只低了1.203 g·L-1,5天后下降较快,据图3可知第5天菌球浓度达到最大值,综合考虑,建议实际固体液化生产中选用菌龄为5天的菌种较适合,与常规液体菌种相比培养周期缩短1天以上。
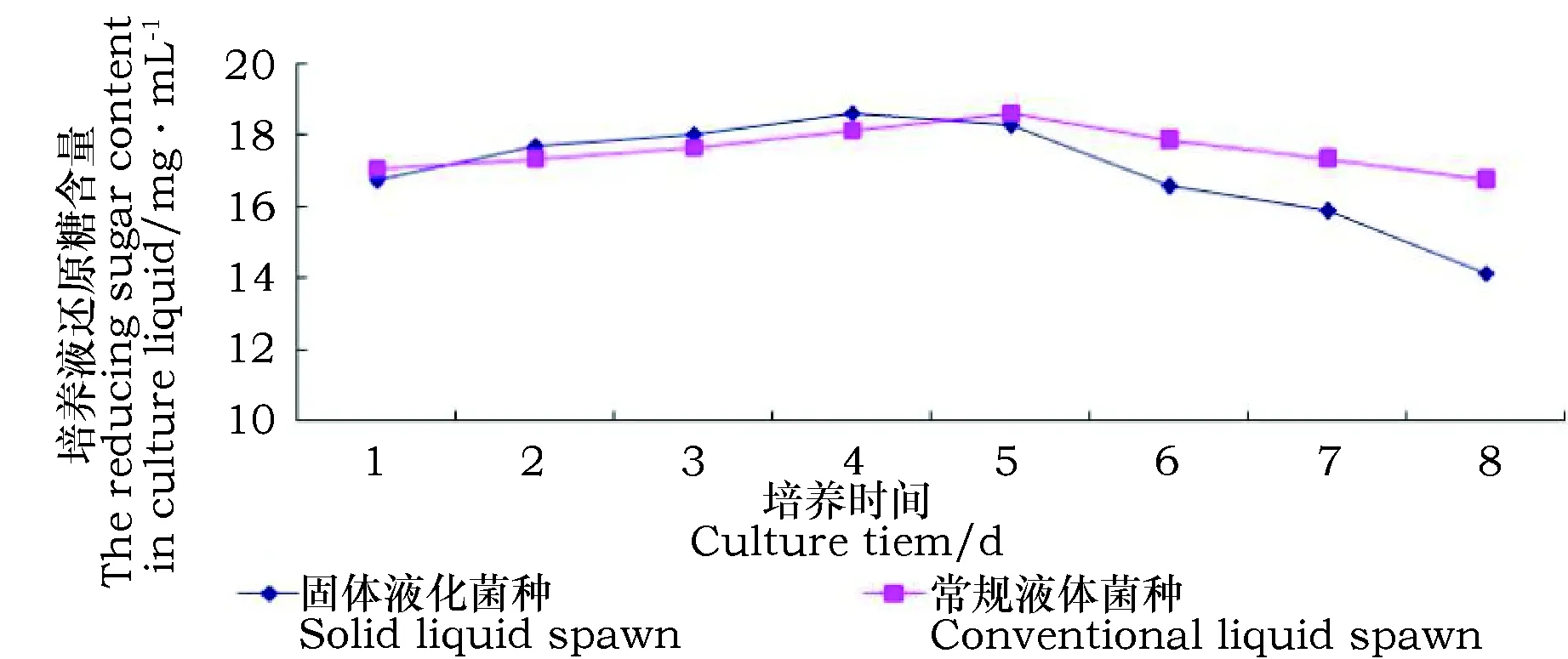
图4 两种菌种培养液中还原糖含量的变化Fig.4 The change of reducing sugar contents in liquid oftwodifferent spawn
2.3 固体液化菌种液体和常规液体菌种酶活性测定结果
2.3.1 蛋白酶活性
由图5可知,随着培养天数的增加,蛋白酶活性先增加后稳定的趋势,培养前期,培养液中氮素充足,菌丝分泌蛋白酶量较少。随着培养的进行,培养液中氮素缺乏,菌丝大量分泌蛋白酶,蛋白酶含量迅速增加。培养后期,蛋白酶含量趋于平衡。固体液化菌种蛋白酶含量从第2天的0.03 U开始迅速增加,第5天达到最大值2.09 U,比常规液体菌种第6天的最大值1.83 U高0.26 U,5天后蛋白酶含量趋于平衡维持在0.18 U左右。
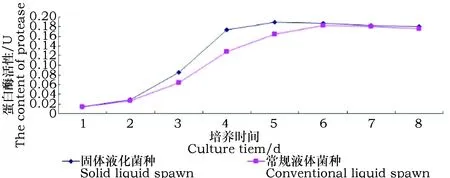
图5 两种菌种培养液中蛋白酶活性变化Fig.5 The change of activities of proteasein two different spwn
由图6可知,随着菌丝的生长,两种菌种的羧甲基纤维素酶含量变化趋势同蛋白酶。固体液化菌种生长第3天,羧甲基纤维素酶含量为0.3 U,之后含量均高于常规液体菌种;生长第5天,增加到峰值1.03 U,而常规液体菌种在第6天才达到峰值0.9 U。固体液化菌种因本身含有纤维素酶,培养中期纤维素酶含量增加较快。培养后期,培养液中营养耗尽,固体液化菌种部分酶释放,使得下降趋势较平缓。

图6 两种菌种培养液中纤维素酶含量的变化Fig.6 The change of activities of cellulase in two different spawn
2.3.3 漆酶活性
由图7可知,固体液化菌种产生漆酶较早,漆酶活性高于常规液体菌种。随着培养基中碳源物质的消耗,金针菇菌丝产生漆酶,分解培养基中的大分子物质维持生长和发育,最终培养液中营养物质被消耗殆尽,漆酶活性降低。固体液化菌种生长从第3天漆酶活性开始增强,在第5天,出现较强的颜色变化,之后颜色变淡,而常规液体菌中前6天颜色变化不明显,直到第7天才出现较强的颜色变化。

图7 两种菌种培养液中漆酶活性Fig.7 The change of activities of laccase in two different spawn 注:上图为固体液化菌种;下图为常规液体菌种Note: The above is the solid liquefaction spawn; the below is conventional liquid spawn
3 小结与讨论
本研究采用木屑粉为主料的固体液化菌种,对液体培养过程中的菌丝形态、菌球浓度、还原糖含量变化等生理生化指标进行了测定分析。结果表明,以木屑粉为主料的固体液化菌种菌丝洁白致密;较常规液体菌种生长速度快,菌球浓度高。固体液化菌种还原糖含量在培养第4天最高,之后略有下降但趋势不明显。菌丝培养第3~6天菌丝生长处于旺盛期,第5天浓度达到最大值,综合考虑菌球浓度和还原糖变化,在菌种制作中应选用菌龄为5天的菌种,较常规液体菌种提前1天以上,且菌球浓度远高于常规液体菌种。
为了从酶活方面说明结果的可靠性,对培养液中基质降解酶活力进行了测定。金针菇生长过程中主要利用培养料中的碳氮源提供生长发育所需的营养和能量,碳源主要由木质素、纤维素等大分子物质组成,氮源主要由有机氮源和无机氮源组成。蛋白酶是一种调节酶,是金针菇生长过程中分解氮素的主要酶类,其主要功能是在基质中缺乏氮素的情况下,为了吸收蛋白质中的氮素而产生的,其含量对菌丝生长后期的稳定性和产量有着重要的影响;纤维素酶和漆酶是降解纤维素、木质素等大分子物质的主要酚氧化酶,能加速木质素芳香族高分子化合物的分解,为菌株提供丰富营养。本研究结果表明:蛋白酶、羟甲基纤维素酶活性均呈现先上升后趋于平衡的变化趋势,固体液化菌种培养的过程中,上述三种酶含量从第3天开始迅速增加,在第5天达到最大值,之后趋于平稳,且培养前期,固体液化菌种中三种酶产生较早,培养中后期三种酶含量均普遍高于常规液体菌种。
金针菇固体液化菌种与常规液体菌种相比,具有萌发时间早、培养周期短、酶活高等优点,这一结果对我国新型固体液化菌种的研发具有重要的参考价值,也为我国食用菌产业新型菌种的制备提供了一种新的思路。
[1]Yesica Mayett, Daniel Daniel Martinez-Carrera,Miguel Sinchez,et al. Consumption Trends of Edible Mushrooms in Developing Countries[J].Journal of International Food & Agribusiness Marketing,2006,18 (1-2):151-176.
[2]秦俊哲,魏颖杰,陈合,等.金针菇液体菌种培养过程检测指标的研究[J].食用菌学报,2003,10(1): 12-16.
[3]Guo J L, Liu X. Comparison between liquid culture and solid culture technologies for edible mushroom spawn production and analysis on their economic benefits[J]. Sci Agr Sin, 2011, 44: 835-841.
[4]Szuecs J.Method of growing mushroom mycelium and resulting products:United States.2850841[P].1958.
[5]张引芳.食用菌工厂化生产中液体菌种的应用研究进展[J].菌物学报,2007,26(1):393-397.
[6]戴建清,曾志恒.食用菌液体菌种研究现状及发展趋势[J].中国食用菌,2012,31(5):1-3.
[7]Song Fengyan. Analysis on the Content of Reducing Sugar andTotal Sugar in the Fruits of Capparis spinosa L[J].Medicinal Plant 2012,3(6): 19-20,24
[8]B.施特尔马赫(钱嘉渊译).酶的测定方法[M].北京:中国轻工业出版社,1992:106-272.
[9]Li Fen,Zhu Xuwei,Li Nanyi,et al.Screening of Lignocellulose-Degrading Superior Mushroom Strains and Determination of Their CMCase and Laccase Activity[J].The Scientific World Journal,2014:1-6.
[10]王宜磊,岳辉.大型真菌漆酶的研究[J].食用菌,1999,21(2):3-4.
(编辑:马荣博)
Study on the solid liquefaction spawn ofFlammulinavelutipes
Liu Jingyu1, Meng Junlong1, Chang Mingchang1*, Yuan Linggang2, Zhang Kai1, Chai Qian1, Lv Xiumei1
(1.CollegleofFoodScicenceandEngineering,ShanxiAgriclucturalUniversity,Taigu0380801China, 2.CollegeofHorticulture,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]The aim of this study was to develop new species, and to promote edible fungus factory production process[Methods]The best solidmaterials of liquefaction spawn ofFlammulinavelutipeswere investigated. The changes of mycelial morphology, the concentrationcontent of hypha ball, concents of reducing sugar and substrate degradation enzyme activities of solid liquefaction and conventio nal liquid spawns ofF.velutipeswere compared and analyzed. [Result]The results showed that the best solidmaterials of solid liquefaction spawn ofF.velutipeswas wood flour. The concentration of hypha balls of liquefaction spawns ofF.velutipesreached a maximum of 68 ball/mL on the sixth day, and were still far above than the conventional liquid spawn. Contents of reducing sugars of solid liquefaction spawn ofF.velutipesinc reased the maximum of 18.62 mg/ml on the fourth day about one days earlier than the conventional liquid spawn.The activities of protease, cellulase and laccase of solid liquefaction spawn ofF.velutipeswere higher than the conventional liquid spawn before reaching the maximums and then droping down on the fifth day. [Conclusion]The concentrations of hypha ball, substrate degradation activities and stabilities of solid liquefaction spawns ofF.velutipeswere were better than the control conventional liquid spawns.
Flammulinavelutipes, Solid liquefaction spawn, Substrate degradation activities
2016-04-20
2016-07-08
刘靖宇(1980-),男(汉),山西大同人,副教授,博士,研究方向:食用菌栽培与育种
*通讯作者:常明昌,教授,博士生导师,Tel:03546888088,E-mail:sxmushroom@163.com
山西农业大学科研启动基金(xb2012019),国家自然科学基金(31301826),山西省煤基重点科技攻关项目(FT20140301)
S646.1
A
1671-8151(2016)11-0805-04
