细菌脂多糖处理对斑马鱼免疫球蛋白亚型表达水平的影响
2016-12-20王志平胡庆玲
王志平,胡庆玲,郝 转
( 1. 渭南师范学院 陕西省河流湿地生态与环境重点实验室,陕西 渭南 714099; 2. 陕西师范大学 生命科学学院, 陕西 西安710062 )
细菌脂多糖处理对斑马鱼免疫球蛋白亚型表达水平的影响
王志平1,2,胡庆玲1,郝 转1
( 1. 渭南师范学院 陕西省河流湿地生态与环境重点实验室,陕西 渭南 714099; 2. 陕西师范大学 生命科学学院, 陕西 西安710062 )
以20 μg/mL的细菌脂多糖溶液对斑马鱼进行浸泡处理24 h,用实时荧光定量PCR技术分析斑马鱼IgM、IgD和IgZ基因表达水平的变化。对照组斑马鱼中IgD和IgZ的表达水平相当,且均低于IgM,说明IgM可能具有更重要的生物学作用。细菌脂多糖处理后,斑马鱼3种Ig亚型的表达水平均表现出先升后降趋势,而且均在12 h达到最高值。然而,IgM和IgZ的升高幅度显著高于IgD,而且IgM和IgZ在处理24 h后表达水平仍然显著高于对照组,说明IgM和IgZ在鱼类病原防御中具有更重要的免疫作用。另外,IgM对细菌脂多糖处理的应答速度比IgZ更快,说明体液免疫系统能够更快地对细菌脂多糖处理作出有效应答,而黏膜免疫系统则反应较慢。
斑马鱼;补体;细菌脂多糖处理;表达水平; 荧光定量PCR
免疫球蛋白(Ig)是适应性免疫系统的重要组成部分,在疾病与机体免疫中具有主要作用。目前,围绕传统模式动物人和鼠的免疫球蛋白已开展了大量研究,现已发现哺乳动物的免疫球蛋白主要有5种亚型(IgA、IgD、IgE、IgG和IgM)。相比之下,仅在斑马鱼(Daniorerio)[1-3]、虹鳟(Oncorhynchusmykiss)[4-5]、鲤鱼 (Cyprinuscarpio)[6-8]和少量其他鱼类[9-11]中发现了3种Ig亚型,即IgD、IgM、IgZ,其中 IgZ被认为是硬骨鱼特有的Ig亚型[2]。
斑马鱼个体小,易于养殖、观察和操作,而且具有较完善的基因组信息和遗传学操作技术,成为研究鱼类免疫系统的新型模式生物[2,12]。Li等[13]曾研究了IgLC(Ig轻链恒定区)、mIg(膜结合IgM的μ链)、sIg(分泌型IgM的μ链)以及IgZ(ζ链恒定区)等基因在斑马鱼个体发育过程中的表达水平及其对细菌脂多糖(LPS)处理的应答,从而对斑马鱼适应性免疫系统的个体发育过程进行了分析。Zimmerman等[2]则设计了一系列适于定量PCR分析的Ig亚型重链基因引物并研究了3种Ig亚型重链基因在个体发育过程的表达模式,他们发现在斑马鱼个体发育过程中IgM 的表达水平高于IgD和IgZ,说明IgM在个体发育过程中可能具有更重要的生物学作用。有报道称,哺乳动物不同Ig亚型的相对表达水平变化是机体免疫反应的重要标志之一[2]。本文采用实时定量PCR技术分析细菌脂多糖浸泡处理对斑马鱼不同Ig亚型基因表达水平的影响,旨在探讨不同Ig亚型在鱼类机体免疫中的功能差异。
1 材料与方法
1.1 斑马鱼的饲养与处理
试验用斑马鱼购自本地花鸟虫鱼市场,在大玻璃缸内驯化2周后用于试验。缸内温度为25~27 ℃,自然光周期并连续充气,日投喂2次。取15尾健康斑马鱼放入质量浓度为20 μg/mL 的细菌脂多糖溶液中[13],3、6、12、24 h后各取3尾,用于提取RNA以检测基因表达水平。取3尾未进行处理的斑马鱼做对照。
1.2 RNA提取及cDNA制备
用DEPC水将斑马鱼洗3次,除去多余水分。加入液氮后迅速研磨,将组织粉末转入离心管中并加入TRIZOL试剂(每0.1 g组织加1 mL),充分振荡摇匀后提取总RNA,并用琼脂糖凝胶电泳进行检测。将总RNA用DNase Ⅰ(Promega)消化,以消除基因组污染。之后,用反转录试剂盒进行反转录,获得cDNA。
为检测反转录质量,以跨内含子的β-actin基因引物(上下游引物分别为5′-CTCCGGTATGTGCAAGGC-3′和5′-GCTGGGCTGTTGAAGGTC-3′)进行PCR扩增,并对扩增产物进行电泳检测(长度应为354 bp)。若仅有特异性目的片段,说明无基因组污染,该模板cDNA可用于定量PCR分析;否则需对RNA进一步消化并重新反转录。
1.3 Real-time PCR分析
本试验以β-actin基因作内参基因[14-16]。所有引物序列引自Zimmerman等[2],引物序列及扩增子长度见表1。引物由上海生物工程有限公司合成,以无菌水溶解,稀释至15 μmol/L。

表1 定量PCR分析中所用引物
按照SYBR GREEN Real-time PCR Master Mix(TAKARA)说明书在MiniOpticon PCR仪(伯乐)进行定量PCR扩增。每个反应3个重复,反应条件如下:

95℃3min1个循环95℃5s60℃15s72℃30s40个循环*熔解曲线分析
注:在每个循环的延伸阶段收集荧光信号.
1.4 数据分析
定量PCR结束后,根据目的基因和β-actin的Ct值,采用相对Ct法(2-ΔΔCt)法计算不同Ig亚型的相对表达量[17],其中ΔCt=(Ct目的基因-Ctβ-actin),ΔΔCt=(ΔCt目的基因-ΔCtIgM对照组)。结果以对照组IgM的表达量作参照。之后,对上述数据进行单因素方差分析,P<0.05认为差异显著。
2 结 果
电泳检测发现斑马鱼总RNA比较完整(图1),以跨内含子的β-actin引物对cDNA模板进行PCR扩增后所得产物单一且大小合适(约354 bp)(图2),说明cDNA质量很好。另外,定量PCR的熔解曲线仅有一个峰,再次证明扩增的特异性。
图1 斑马鱼总RNA的电泳检测

图2 斑马鱼反转录cDNA的β-actin扩增产物检测
2.1 细菌脂多糖处理对斑马鱼IgM基因表达水平的影响
IgM通常是动物血液中含量最丰富的Ig亚型,主要功能是抑制、凝集、溶解入侵血液的细菌。以细菌脂多糖处理斑马鱼后,IgM的表达水平自6 h开始显著升高(1.58)(P<0.05),12 h达到峰值(2.51),随后开始降低,但24 h时其表达水平(2.05)仍然显著高于对照组(1.00)(P<0.05)(图3)。

图3 细菌脂多糖处理对斑马鱼IgM基因表达水平的影响*表示与对照组差异显著(P<0.05),其他图同.
2.2 细菌脂多糖处理对斑马鱼IgD基因表达水平的影响
IgD可在个体发育的任何时候产生,与B细胞分化和发生密切相关。对照组斑马鱼中IgD的表达水平仅为0.63,显著低于IgM。IgD对细菌脂多糖处理的应答比较慢,直到12 h其表达水平才显著升高(1.14)(P<0.05),随后其表达水平开始降低,24 h时降到与对照组相当的水平(0.57)(图4)。
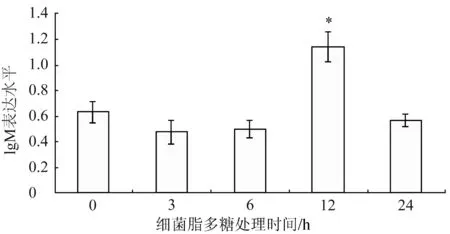
图4 细菌脂多糖处理对斑马鱼IgD基因表达水平的影响
2.3 细菌脂多糖处理对斑马鱼IgZ基因表达水平的影响
IgZ可能与哺乳动物IgA存在一定的进化关系,主要参与黏膜免疫反应,而黏膜免疫系统是病原微生物入侵鱼体的最初屏障。对照组斑马鱼中IgZ的表达水平(0.70)与IgD相当(图5)。斑马鱼经细菌脂多糖处理后,IgZ的早期应答模式与IgD十分相似,均自12 h开始升高(1.80),随后逐渐降低,区别在于24 h时IgZ的表达水平(1.28)仍显著高于对照组(P<0.05)。
3 讨 论
与哺乳动物类似,鱼类的Ig亚型在形态学、结构、基因型以及生理生化特征等方面存在诸多差异。目前,关于鱼类3种Ig亚型功能差异的研究还很有限。
细菌脂多糖是构成革兰氏阴性菌细胞壁的一种脂多糖,能够引起一系列的生物学效应,包括免疫刺激活性等。本文通过检测Ig亚型对细菌脂多糖处理的应答方式来比较3种鱼类Ig亚型的功能差异。研究表明,对照组斑马鱼中IgM的表达水平显著高于IgD和IgZ,且后2种Ig亚型的表达水平相当,这与Zimmerman等[2]的研究基本相似。
Hu等[3,8]发现,细菌脂多糖刺激可引起斑马鱼IgZ和鲤鱼IgT (IgZ同源物)的表达水平显著升高。本文则进一步发现,以细菌脂多糖浸泡处理斑马鱼后,3种Ig亚型的表达水平均显著升高,其中IgM 和IgZ 的上升幅度显著高于IgD(3种亚型的基因表达最高值分别是对照组的2.51、2.57和1.81倍),而且24 h时IgM 和IgZ的表达水平仍显著高于对照组,进一步证明了IgM 和 IgZ 在抵抗病原入侵中具有更重要的免疫功能。
另外,从不同Ig亚型对细菌脂多糖处理的应答时间看,IgM的应答速度最快,其基因表达水平在6 h即显著升高,而IgD和IgZ则从12 h开始升高。说明IgM参与的体液免疫系统能够更快地对细菌脂多糖处理作出有效应答,相比之下,IgZ参与的黏膜免疫系统则反应较慢。
综上,本文首次报道了低等脊椎动物斑马鱼受到细菌脂多糖处理后3种Ig亚型基因表达水平的变化。关于鱼类3种Ig亚型的生物学功能和作用机制等尚需要深入研究,以进一步比较鱼类和哺乳动物的免疫球蛋白差异并阐明免疫球蛋白从鱼类向高等脊椎动物的进化过程。
[1] Danilova N, Bussmann J, Jekosch K,et al. The immunoglobulin heavy-chain locus in zebrafish: identification and expression of a previousy unknown isotype, immunoglobulin Z[J]. Nat Immunol, 2005, 6(3): 295-302.
[2] Zimmerman A M, Moustafa F M, Romanowski K E, et al. Zebrafish immunoglobulin IgD: unusual exon usage and quantitative expression profiles with IgM and IgZ/T heavy chain isotypes[J]. Mol Immunol, 2011, 48(15/16):2220-2223.
[3] Hu Y L, Xiang L X, Shao J Z. Identification and characterization of a novel immunoglobulin Z isotype in zebrafish: implications for a distinct B cell receptor in lower vertebrates[J]. Mol Immunol, 2010, 47(4): 738-746.
[4] Andersson E, Matsunaga T. Complete cDNA sequence of a rainbow trout IgM gene and evolution of vertebrate IgM constant domains[J]. Immunogenetics, 1993, 38(4):243-250.
[5] Hansen J D, Landis E D, Phillips R B. Discovery of a unique Ig heavy-chain isotype (IgT) in rainbow trout: implications for a distinctive B cell developmental pathway in teleost fish[J]. Proc Natl Acad Sci USA, 2005, 102(19):6919-6924.
[6] Ryo S, Wijdeven R H, Tyagi A, et al. Common carp have two subclasses of bonyfish specific antibody IgZ showing differential expression in response to infection[J]. Dev Comp Immunol, 2010, 34(11): 1183-1190.
[7] Nakao M, Moritomo T, Tomana M, et al. Isolation of cDNA encoding the constant region of the immunoglobulin heavy-chain from common carp (CyprinuscarpioL.) [J]. Fish and Shellfish Immunol, 1998, 8(6): 425-434.
[8] Savan R, Aman A, Nakao M, et al. Discovery of a novel immunoglobulin heavy chain gene chimera from common carp (Cyprinuscarpio) [J]. Immunogenetics, 2005, 57(6):458-463.
[9] Stenvik J, Jorgensen T O. Immunoglobulin D (IgD) of Atlantic cod has a unique structure[J]. Immunogenetics, 2000, 51(6):452-461.
[10] Hordvik I, Thevarajan J, Samdal I, et al. Molecular cloning and phylogenetic analysis of the Atlantic salmon immunoglobulin D gene[J]. Scand J Immunol, 1999, 50(2):202-210.
[11] Gambon-Deza R, Sanchez-Espinel C, Magadan-Mompo S. Presence of an unique IgT on the IgH locus in three-spined stickleback fish (Gasterosteusaculeatus) and the very recent generation of a repertoire of VH genes[J]. Dev Comp Immunol, 2010, 34(34): 114-122.
[12] Trede N S, Langenau D M, Trave D, et al. The use of zebrafish to understand immunity[J]. Immunity, 2004, 20(4):367-379.
[13] Li F L, Zhang S C, Wang Z P, et al. Genes of the adatpive immune system are expressed early in zebrafish larval development following lipopolysaccharide stimulaton[J]. Chin J Oceanol Limnol, 2011, 29(2): 326-333.
[14] Tang R, Dodd A W, Lai D, et al. Validation of zebrafish (Daniorerio) reference genes for quantitative real-time RT-PCR normalization [J]. Acta Biochim Biophys Sin (Shanghai), 2007, 39(5):384-390.
[15] Chen J Y, Chen J C, Wu J I. Molecular cloning and functional analysis of zebrafish high density lipoprotein binding protein [J]. Comp Biochem Phys B, 2003, 136(1):117-130.
[16] Keegan B R, Feldman J L, Lee D H, et al. The elongation factors Pandora/Spt6 and Foggy/Spt5 promote transcription in the zebrafish embryo [J]. Development, 2002; 129(7):1623-1632.
[17] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-ΔΔCt)method[J]. Methods, 2001, 25(4): 402-408.
EffectofLipopolysaccharideTreatmentonExpressionofIgIsotypesInZebrafish
WANG Zhiping1,2, HU Qingling1, HAO Zhuan1
( 1. Key Laboratory for Ecology and Environment of River Wetlands in Shaanxi Province, Weinan Normal University, Weinan 714099, China; 2. Department of Life Science, Shaanxi Normal University, Weinan 710062, China )
The healthy zebrafish were immersed in 20 μg/mL LPS solution for 24 h, and the expressions of IgM, IgD and IgZ were analyzed by real-time fluorescent quantitative PCR. In the control group, the expression levels of IgZ and IgD were similar, lower than that of IgM, indicating a possible heighted role for the IgM isotype. After LPS challenge, the expression of all Ig isotypes was significantly increased with a peak in 12 h. However, the increase range of IgM and IgZ significantly exceeded that of IgD, and their expression remained higher level than that in the control until 24h, indicating that IgM and IgZ played more important immunological role in response to antigen invasion. Moreover, IgM up-regulated its expression a bit more rapidly than IgZ did, hinting at the clue that the humoral immune system might respond to LPS challenge a bit faster than the mucosal immune system.
zebrafish; Ig isotype; LPS treatment; expression; real-time fluorescent quantitative PCR
10.16378/j.cnki.1003-1111.2016.06.0023
S917.4
A
1003-1111(2016)06-0731-04
2015-12-02;
2016-03-08.
国家自然科学基金(31000410);渭南市科技局科研计划项目(2015KYJ-2-5);渭南师范学院学科建设项目(14TSXK05).
王志平(1978—),女,副教授,博士;研究方向:鱼类免疫学. Email:wzhp1978@126.com.
