水相合成CdTe量子点荧光光度法测定硫酸庆大霉素
2016-12-20庄布军吴伯岳高卫真
庄布军,黄 琛,张 莉,吴伯岳,高卫真,
(1.天津医科大学基础医学院药理学系,天津300070;2.天津医科大学医学检验学院,天津300203)
论著
水相合成CdTe量子点荧光光度法测定硫酸庆大霉素
庄布军1,黄 琛2,张 莉2,吴伯岳2,高卫真1,2
(1.天津医科大学基础医学院药理学系,天津300070;2.天津医科大学医学检验学院,天津300203)
目的:基于CdTe量子点的荧光淬灭现象,建立一种简便、经济和高灵敏度的检测硫酸庆大霉素的新方法。方法:以巯基乙酸(TGA)为稳定剂,在水相中合成CdTe量子点,并用荧光分光光度计、红外光谱仪、透射电镜对其进行表征。实验过程中,优化了CdTe量子点TGA、镉、碲三者之间的比例,考察了不同pH与回流时间对量子点荧光性质的影响。通过测定CdTe量子点荧光强度的下降,实现了对硫酸庆大霉素注射液浓度的测定。结果:合成了荧光发射峰在607 nm、粒径在4.0 nm左右的CdTe量子点。硫酸庆大霉素对CdTe量子点的荧光有淬灭作用,在pH=7.4的磷酸盐缓冲体系中,硫酸庆大霉素的浓度在0.10~2.00 mg/L范围时,量子点荧光强度比值与硫酸庆大霉素浓度符合Stern-Volmer方程且相关系数R2=0.998 9。结论:该方法灵敏度较高,快速简便,可用于硫酸庆大霉素浓度的测定。
量子点;水相合成;硫酸庆大霉素;荧光检测
庆大霉素是开发最早的氨基糖苷类抗生素之一。由于其较低的成本[1]、较广的抗菌谱[2]等良好的药效学特性[3],成为治疗革兰阴性杆菌感染常用的抗生素之一[4]。但是使用硫酸庆大霉素的剂量过大会出现潜在的肾毒性[5]和耳毒性[6],《中华人民共和国药典》中规定庆大霉素的有效血药浓度范围为4~10 mg/L,避免高峰血药浓度持续在12 mg/L以上和谷浓度超过2 mg/L[7]。因此,需要监测硫酸庆大霉素的血药浓度,以便给予患者合适的剂量,以达到良好的治疗作用及较少的不良反应[8-9]。目前对硫酸庆大霉素浓度检测常用的方法有高效液相色谱法[10]、液相色谱-质谱联用法[11]等,但这些方法存在仪器昂贵、操作复杂等缺点[12]。因此建立快速、简便、灵敏的硫酸庆大霉素检测方法,对保障用药安全具有重要意义。荧光分光光度法具有灵敏度高、选择性强以及方法简便等优点,现已广泛应用于食品检验、化学、医学、药物分析、冶金、生命科学和环境科学等多个领域[13]。半导体纳米晶体,又称为量子点,具有独特的光学与电子特性、较大的比表面积以及量子尺寸效应而成为备受关注的纳米材料[14-16]。与传统的有机荧光材料相比,量子点具有优异的耐光漂白性,窄而对称的发射光谱以及宽的吸收光谱[17]。近年来,量子
1 材料与方法
1.1 材料
1.1.1 实验试剂 所用化学试剂至少为分析纯,水为娃哈哈纯净水。所用试剂及其来源:无水乙醇、Te粉、KBH4、CdCl2·2.5H2O、NaOH(天津市光复科技发展有限公司,天津),TGA(上海萨恩化学技术有限公司,上海),硫酸庆大霉素(上海晶纯生化科技股份有限公司,上海),硫酸庆大霉素注射液(江苏康宝制药有限公司,江苏),磷酸盐缓冲液(PBS,0.02 mol/L,pH=7.4,配制:用500 mL水溶解8.500 g NaCl,5.543 g Na2HPO4·12H2O,0.260 g NaH2PO4·2H2O调pH至7.4,密闭保存于室温待用)。
1.1.2 实验仪器 F-380荧光分光光度计(天津市港东科技股份发展有限公司,天津),HT7700型透射电子显微镜(日立高新技术公司,日本),TENSOR27傅立叶变换红外光谱仪(Bruker公司,德国)。
1.2 方法
1.2.1 CdTe量子点的制备 在安瓿瓶中依次加入38 mgTe粉、100 mg KBH4、3.0 mL水,密闭环境下室温搅拌反应,直至黑色Te粉消失,得到无色透明的KHTe溶液。在100 mL三颈烧瓶中依次加入2.0 mL 0.1 mol/L的CdCl2·2.5H2O水溶液、不同体积的TGA、37.0 mL水,在磁力搅拌下滴加1.0 mol/L NaOH溶液调节pH。用氩气将该溶液在密闭体系中脱氧,然后在适当的搅拌速度下,向上述溶液中加入新制备的无色KHTe溶液,加热至沸并冷凝回流一定时间,即可得到CdTe量子点。
1.2.2 CdTe量子点的表征 取回流3 h的CdTe量子点母液,用倍比稀释法将量子点母液(C=86.4 mg/L)稀释一千倍,滴加制样。采用TEM对量子点的形貌进行表征。取2 mg干燥好的CdTe量子点,加入138 mg KBr,在研钵中沿同一方向研磨均匀至无大颗粒状固体出现,之后进行压片,置于傅立叶变换红外光谱仪进行光谱扫描。
1.2.3 硫酸庆大霉素标准溶液和注射液的配置 于电子天平上称量100 mg硫酸庆大霉素溶于10.0 mL水中,配置成硫酸庆大霉素初浓度C0=1.0×104mg/L。待溶液分散均匀后,再取1.0 mL硫酸庆大霉素溶液加入9.0 mL水于比色管中定容至10.0 mL,配置成硫酸庆大霉素浓度C1=1 000 mg/L,采用倍比稀释法依次稀释成硫酸庆大霉素浓度C2=100 mg/L,C3=10 mg/L备用。取硫酸庆大霉素浓度C3=10 mg/L依次配置不同的硫酸庆大霉素浓度(C=0.10,0.20,0.50,1.50,2.00 mg/L)。取1支2 mL 8万单位(80 mg)的硫酸庆大霉素注射液,采用倍比稀释法依次稀释,至终浓度C4=10 mg/L备用。
1.2.4 硫酸庆大霉素的检测 将得到的量子点用无水乙醇进行纯化、离心、干燥,用水复溶,制得量子点水溶液。向比色管中依次加入2.0 mL PBS、0.7 mL CdTe量子点(C=86.4 mg/L)、不同浓度的硫酸庆大霉素,然后用水定容至5.0 mL,于室温下放置40 min,以480 nm为激发波长测定530~700 nm范围内的荧光光谱。
2 结果
2.1 CdTe量子点的制备及条件优化
2.1.1 TGA与Cd的比例对量子点生长的影响 为获得高性能的CdTe量子点,本工作考察了TGA与Cd比例对量子点荧光性能的影响。我们固定 [Cd]=2.0×10-4mol/L,依次调节[TGA]/[Cd]=1.0,1.2,1.8,2.4。从图1可知,当[TGA]/[Cd]=1.0,1.2时,量子点具有较高的荧光强度。从图2可知当[TGA]/[Cd]=1.0时,硫酸庆大霉素的浓度在0.10~0.50 mg/L之间时与量子点荧光强度比值不符合Stern-Volmer方程。
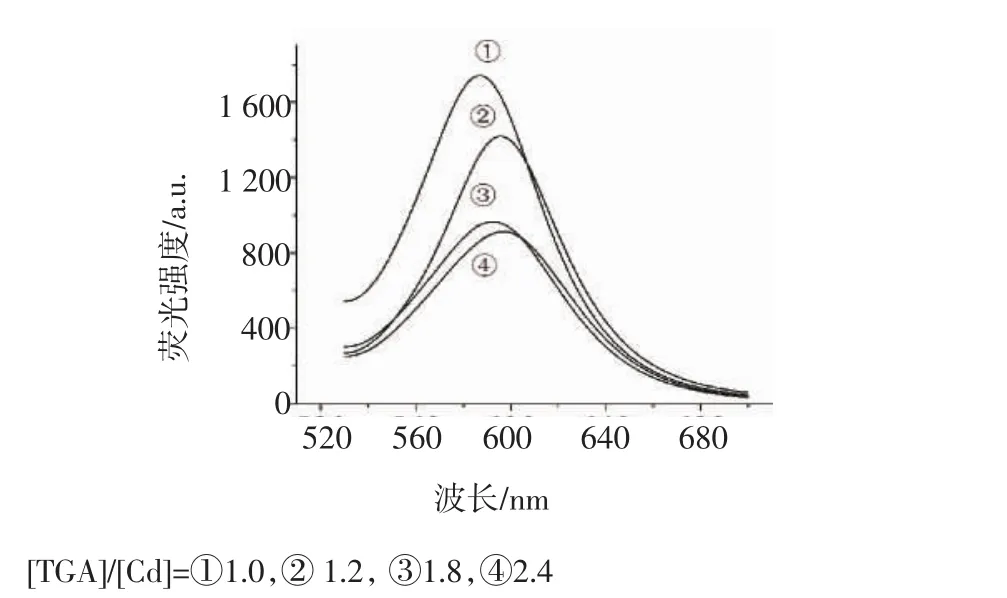
图1 [TGA]/[Cd]比对量子点荧光光谱的影响Fig 1 Effect of the[TGA]/[Cd]ratio on fluorescence spectra of the CdTe quantum dots
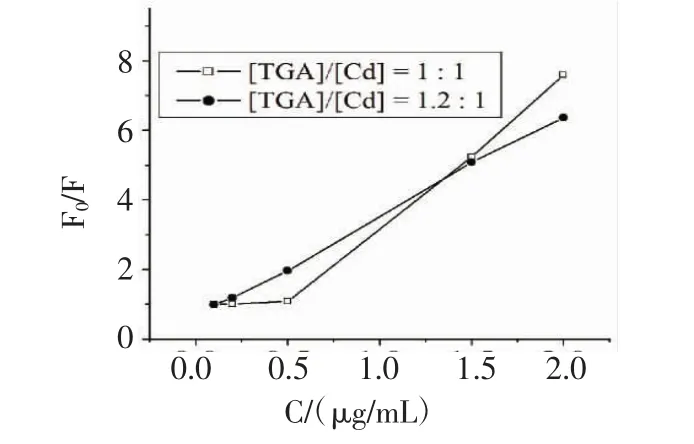
图2 硫酸庆大霉素对不同[TGA]/[Cd]比的量子点荧光强度比值的影响Fig 2 Influence of the concentration of added gentamicin sulfate on the fluorescence intensity ratio of CdTe quantum dots with different[TGA]/[Cd]ratio
2.1.2 Cd、Te比例对量子点生长的影响 为考察Cd与Te比例对量子点生长的影响,我们固定[TGA] /[Cd]=1.2,[Cd]=2.0×10-4mol/L,改变KHTe的加入量,使[Cd]/[Te]=2,4,6,8。由图3可知,随着[Cd]/[Te]比例的增加,荧光强度增强。Cd与Te的物质的量比为8∶1的量子点在合成过程中产生暗红色沉淀,有可能是量子点生长速度过快突破纳米尺度,形成CdTe体材料的原因。一个星期内Cd与Te的物质的量比为6∶1,回流不同时间的量子点也出现不同程度的沉淀,而Cd与Te的物质的量比为4∶1、2∶1时的量子点相对稳定,没有沉淀产生。
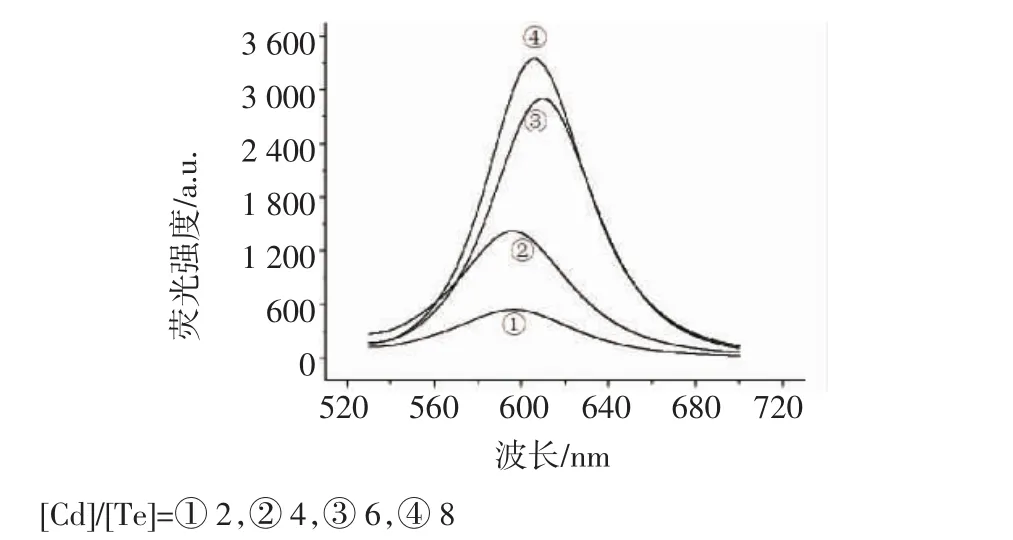
图3 [Cd]/[Te]比对量子点荧光光谱的影响Fig 3 Effect of the [Cd]/[Te]ratio on fluorescence spectra of the CdTe quantum dots
2.1.3 pH对量子点生长的影响 为研究pH对量子点生长的影响,我们固定 [TGA]/[Cd]=1.2,[Cd]=2.0×10-4mol/L,[Cd]/[Te]=4,通过向反应体系中加入不同体积的NaOH溶液,调节反应pH= 8.0,10.0,12.0。由图4可知,随pH的增加,量子点最大发射波长发生明显红移,在pH=12.0时量子点峰值较高。
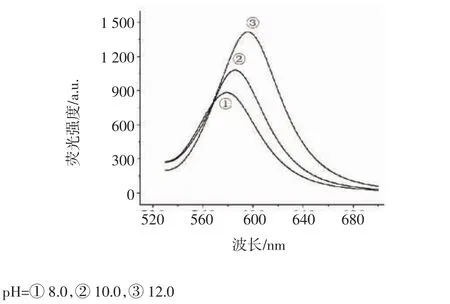
图4 pH对量子点荧光光谱的影响Fig 4 Effect of the pH on fluorescence spectra of the CdTe quantum dots
2.1.4 回流时间对量子点生长的影响 我们固定[TGA]/[Cd]=1.2,[Cd]=2.0×10-4mol/L,使[Cd]/[Te]=4.0, pH=12.0,考察回流时间对量子点生长的影响。由图5A可知,随时间的增加CdTe量子点的最大吸收波长发生明显红移。同时,随着回流时间的增加,量子点荧光强度逐渐增强,在3 h时荧光峰值达到最大,3 h后其荧光强度又随回流时间的增加开始减弱(图5B)。
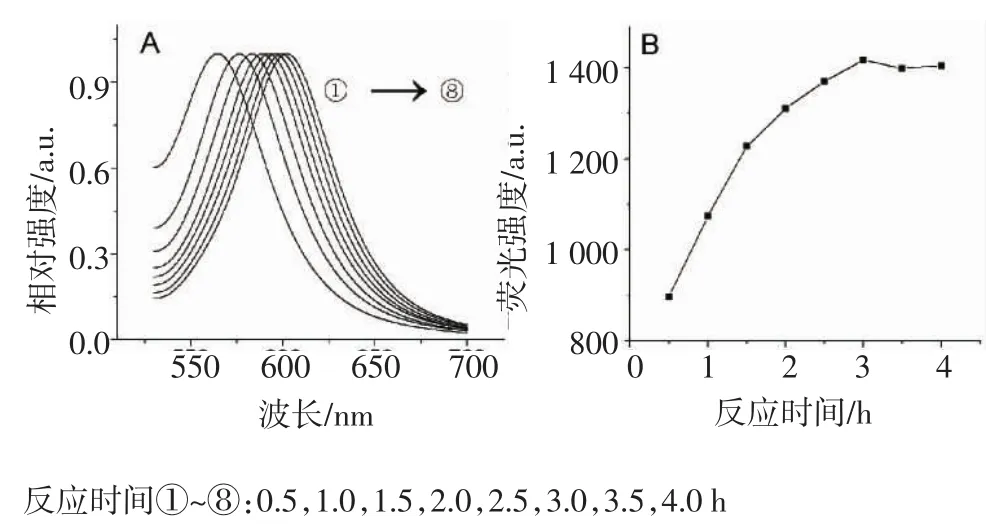
图5 回流时间对荧光光谱(A)和荧光强度(B)的影响Fig 5 Effect of the reaction time on fluorescence spectra(A)and fluorescence intensity(B)
2.2 量子点的形貌及光学性质 从图6可以看出,CdTe量子点呈球形,纳米粒子大小均匀,平均粒径为4.0 nm左右。从图7中可以看到羧基在3 401 cm-1处的强吸收峰以及羰基在1 563 cm-1与1 383 cm-1位置处的双振动吸收峰,这说明TGA已成功的包覆在CdTe量子点表面。

图6 量子点的透射电镜图(标尺:10 nm)Fig 6 The TEM images of CdTe quantum dots(Scale bar:10 nm)
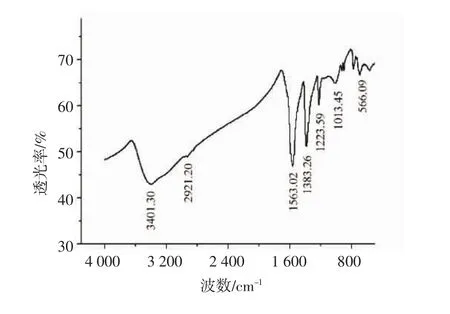
图7 量子点的傅立叶变换红外光谱图Fig 7 FT-IR spectra of CdTe quantum dots
2.3 量子点对硫酸庆大霉素的荧光响应 在pH=7.4的磷酸盐缓冲体系中检测,于室温下放置40 min。不同浓度硫酸庆大霉素的加入对CdTe量子点荧光发射光谱的影响见图8。由图8A可知,随着硫酸庆大霉素浓度的增加,量子点的荧光峰值显著降低并发生明显红移。由图8B可知,校正曲线(y=0.595 2x+2.972 6)的线性范围为0.10~2.00 mg/L,R2=0.998 9。
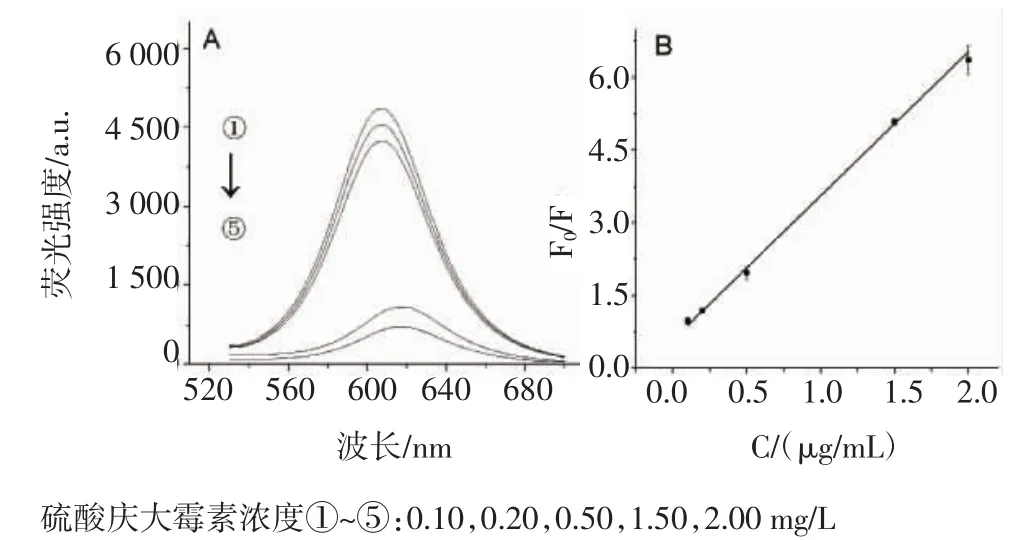
图8 不同浓度硫酸庆大霉素对CdTe量子点荧光光谱(A)和荧光强度比值(B)的影响Fig 8 Influence of the concentration of added gentamicin sulfate on the fluorescence spectra (A)and on the fluorescence intensity ratio(B)of CdTe quantum dots
2.4 硫酸庆大霉素的检测 在荧光分光光度计上选择激发波长480 nm、发射波长530~700 nm进行荧光扫描,并测定最大发射波长下的荧光强度,再将最大荧光强度代入校正曲线中计算硫酸庆大霉素标准品以及硫酸庆大霉素注射液浓度,结果列于表1。
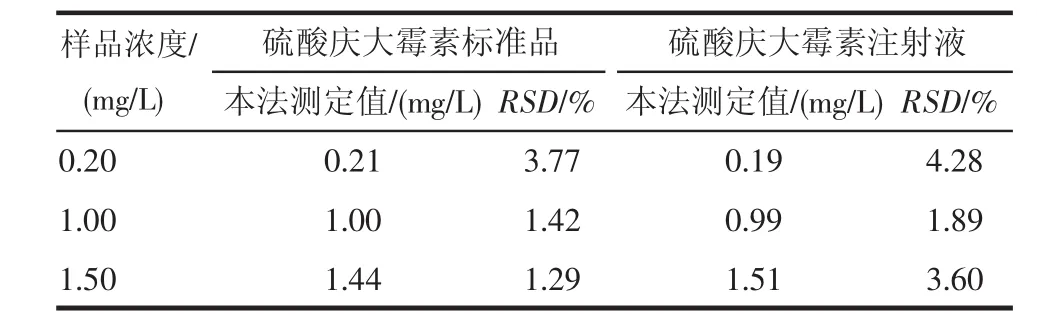
表1 硫酸庆大霉素检测结果Tab 1 Results for determination of gentamicin sulfate
3 讨论
笔者首先对CdTe量子点的水相合成过程进行改进,优化CdTe量子点稳定剂(巯基乙酸,TGA)、Cd及Te三者之间的比例、pH及回流时间等条件,制备了荧光性能优良、化学性质稳定的CdTe量子点。由图1、2可知,稳定剂TGA过量会降低量子点的荧光强度,过低又会影响量子点荧光强度比值与硫酸庆大霉素浓度的线性关系,因此本实验最终选取的比例为[TGA]/[Cd]=1.2。由图3可知,随着[Cd]/ [Te]比例的增加,荧光强度增强而量子点稳定性变差,产生上述现象的原因可能是随着反应物[Te]的摩尔比例减少,部分[Cd]吸附在量子点表面,减少了量子点的表面缺陷,提高了量子点的发光效率,从而导致荧光强度增强,而且当[Te]的摩尔比例减少到一定浓度时过量的[Cd]又会使量子点表面悬空键增加而导致量子点变得不稳定。本实验选择荧光强度较高而又稳定的量子点用于检测,因此我们将Cd与Te的物质的量比定为4∶1。由图4可知,在pH=12.0时量子点峰值较高且放置一个星期未出现沉淀,稳定性良好,因此本实验选取pH=12.0作为最终的的合成条件。由图5A可知,随时间的增加CdTe量子点的最大吸收波长发生明显红移,这是由于随着反应时间延长,CdTe量子点粒径逐渐增大、表面缺陷减少,使得导带与价带间的能级差减小,从而使受激发电子跃迁回到基态所释放的能量减少而产生的;由图5B可知,回流时间在3 h时荧光峰值达到最大,因此我们最终选择3 h作为合成CdTe量子点的回流时间。之后用红外光谱仪、透射电镜对其进行表征,由图6、7可知成功包裹TGA的量子点呈球形且粒径大小均匀。由图8A可知,硫酸庆大霉素能有效淬灭CdTe量子点荧光,荧光强度淬灭和硫酸庆大霉素的浓度之间的关系符合Stern-Volmer方程。在此基础上,建立了一种灵敏、快速、简便检测硫酸庆大霉素的新方法;由图8B可知在最优检测条件下,CdTe量子点检测硫酸庆大霉素浓度的线性范围为0.10~2.00 mg/L,R2=0.998 9。采用高效液相色谱-蒸发检测器测定实验表明,硫酸庆大霉素对照品在10~400 mg/L范围内线性关系良好[23],与常用的高效液相色谱法相比,该法检测硫酸庆大霉素浓度具有快速、简便、灵敏的优势,为硫酸庆大霉素的浓度检测提供了一种新方法。
[1] Mishra P K,Ashoub A,Salhiyyah K,et al.Role of topical application of gentamicin containing collagen implants in cardiac surgery[J].J Cardiothorac Surg,2014,9(1):122
[2] Draz E I,Abdin A A,Sarhan N I,et al.Neurotrophic and antioxidant effects of silymarin comparable to 4-methylcatechol in protection against gentamicin-induced ototoxicity in guinea pigs[J].Pharmacol Rep,2015,67(2):317
[3] Vakulenko S B,Mobashery S.Versatility of aminoglycosides and prospects for their future[J].Clin Microbiol Rev,2003,16(3):430
[4] Ahn J,You S J,Lee Y M,et al.Hypoxia-inducible factor activation protects the kidney from gentamicin-induced acute injury[J].Plos One,2012,7:48952
[5] Jia P,Teng J,Zou J,et al.Intermittent exposure to xenon protects against gentamicin-induced nephrotoxicity[J].Plos One,2013,8: 64329
[6] Aran J M,Darrouzet J,Erre J P.Observation of click-evoked compoundVIIInerveresponsesbefore,during,andoversevenmonths after kanamycin treatment in the guinea pig[J].Acta Otolaryngol, 1975,79(1/2):24
[7]国家药典委员会.中华人民共和国药典临床用药须知化学药和生物制品卷[M].北京:人民卫生出版社,2005:518
[8] Perletti G,Vral A,Patrosso M C,et al.Prevention and modulation of aminoglycoside ototoxicity(Review)[J].Mol Med Rep,2008,1(1):3
[9] Dehne N,Rauen U,De Groot H,et al.Involvement of the mitochondrial permeability transition in gentamicin ototoxicity[J].Hear Res,2002,169(1):47
[10]Brito SMO,Coutinho HDM,Talvani A,et al.Analysis of bioactivities and chemical composition of Ziziphus joazeiro Mart.using HPLCDAD[J].Food Chem,2015,186:185
[11]Rodriquez M,Cretoso D S,Euterpio M A,et al.Fast determination of underivatized gentamicin C components and impurities by LC-MS using a porous graphitic carbon stationary phase[J].Anal Bioanal Chem,2015,407(25):7691
[12]毛永强,李卓然,王继仁,等.基于CdTe量子点内滤效应同步荧光猝灭法测定四环素[J].分析测试学报,2015,34(1):96
[13]赵建,刘璇,文镜.荧光分光光度计测定保健食品总抗氧化能力[J].食品科学,2010(22):301
[14]Alivisatos A P,Johnsson K P,Peng X,et al.Organizatio n of'nanocrystalmolecules'usingDNA[J].Nature,1996,382(6592):609
[15]Jacobs K,Zaziski D,Scher E C,et al.Activation volumes for solidsolid transformations in nanocrystals[J].Science,2001,293(5536): 1803
[16]Peng X,Manna L,Yang W,et al.Shape control of CdSe nanocrystals [J].Nature,2000,404(6773):59
[17]Hu S,Zeng S,Zhang B,et al.Preparation of biofunctionalized quantum dots using microfluidic chips for bioimaging[J].Analyst, 2014,139(18):4681
[18]Yang Y,Mathieu J M,Chattopadhyay S,et al.Defense mechanisms of Pseudomonas aeruginosa PAO1 against quantum dots and their released heavy metals[J].ACS Nano,2012,6(7):6091
[19]Zhang K,Mei Q,Guan G,et al.Ligand replacement-induced fluorescence switch of quantum dots for ultrasensitive detection of organophosphorothioate pesticides[J].Anal Chem,2010,82(22): 9579
[20]Liu B,Tong C,Feng L,et al.Water-soluble polymer functionalized CdTe/ZnS quantum dots:A facile ratiometric fluorescent probe for sensitive and selective detection of nitroaromatic explosives[J].Chem-Eur J,2014,20(8):2132
[21]Chantada-Vázquez M P,Sánchez-González J,Pea-Vázquez E,et al.Sy nthesis and characterization of novel molecularly imprinted polymer-coated Mn-doped ZnS quantum dots for specific fluorescent recognition of cocaine[J].Biosens Bioelectron,2016,75: 213
[22]Esteve-Turrillas F A,Abad-Fuentes A.Applications of quantum dots as probes in immunosensing of small-sized analytes[J].Biosens Bioelectron,2013,41:12
[23]国立娟.HPLC-ELSD法测定硫酸庆大霉素含量的方法改进[J].黑龙江科技信息,2015(20):63
(2015-12-04收稿)
Aqueous synthesis of CdTe quantum dots with fluorescence spectrophotometry for gentamicin sulfate detection
ZHUANG Bu-jun1,HUANG Chen2,ZHANG Li2,WU Bo-yue2,GAO Wei-zhen1,2
(1.Department of Pharmacology,School of Basic Medical Sciences,Tianjin Medical University,Tianjin 300070,China;2.School of Medical Laboratory,Tianjin Medical University,Tianjin 300203,China)
Objective:To prepare a facile and cost efficient method for the determination of gentamicin sulfate.Methods:The thiogycolic acid capped CdTe quantum dots were synthesized in aqueous phase.Transmission electron microscopy,infrared spectroscopy and fluorescence spectroscopy were used to characterize the particle size and shape,the surface chemical group and the fluorescence property of the quantum dots.During the experiment,proportion of TGA,Cd,Te among CdTe quantum synthesis process were optimized,and the optical stability and the effect of pH on the fluorescence intensity of CdTe quantum dots were also evaluated.Results:The fluorescence emission peak at 607 nm and the TEM images displayed CdTe at about 4.0 nm were synthesized.The fluorescence quenching effect of gentamicin sulfate on CdTe quantum dots was researched,and a new method for the detection of gentamicin sulfate using CdTe quantum dots as fluorescent probes was established.In the optimal conditions,CdTe quantum dots were successfully applied to the detection of gentamicin sulfate in water,and a linear relationship was obtained to cover the concentration range of 0.10~2.00 mg/L,with a correlation coefficient of 0.998 9,which was best described by a Stern-Volmer equation.Conclusion:The proposed method can be used for the determination of gentamicin sulfate with satisfactory results.
quantum dots;aqueous synthesis;gentamicin sulfate;fluorescence detection
论著
1006-8147(2016)04-0347-05
R9
A
国家自然科学基金青年基金资助项目(21205087);天津医科大学科学基金资助项目(2011KY11)
庄布军(1991-),男,硕士在读,研究方向:纳米材料在药物检测方面的应用;通信作者:高卫真,E-mail:weizhengao33@163.com。
