毛细管电泳差异性检测尿液蛋白方法初探
2016-12-20姚远景换利高卫平
姚远,景换利,高卫平
(天津医科大学生物医学工程学院,天津 300070)
论著
毛细管电泳差异性检测尿液蛋白方法初探
姚远,景换利,高卫平
(天津医科大学生物医学工程学院,天津 300070)
目的:使用毛细管电泳(CE)与二极管阵列检测(DAD)联用技术(CE-DAD)的差异检测方法,优化膀胱癌患者尿液特异性蛋白的检测条件。方法:对5例膀胱癌患者及5例健康志愿者尿液蛋白中的低丰度蛋白进行含量的差异检测,并使用电解质添加剂对原缓冲体系进行优化,对电渗流进行有效控制,提高低丰度蛋白的分离效率。结果:确立了使用毛细管电泳与二极管阵列检测联用技术对正常人组与非肌层浸润性膀胱癌患者组尿液蛋白的差异检测最佳条件,并经ELISA法平行试验,显示两组低丰度蛋白存在差异相关性。结论:对CE-DAD的差异检测条件进行了初步的探索,为未来标准化检测方法的建立奠定了基础。
毛细管电泳;尿液蛋白;差异检测;电渗流
膀胱癌是泌尿系统最常见的恶性肿瘤,患病男女比例为4∶1,其中70%~80%的患者为非肌层浸润性膀胱癌,20%~30%为肌层浸润性膀胱癌[1]。对于膀胱癌的临床筛查,检测效率尤为重要。毛细管电泳(CE)这一分离手段,因其成本低、操作简便、耗时短等独特的优点而广泛的应用到相关检测研究中[2-3]。本文拟探讨优化一种毛细管电泳与二极管阵列检测器联用技术(CE-DAD)的差异检测方法的条件,使用超滤离心管对低丰度蛋白质进行有效提取,并使用电解质添加剂提高分离过程中缓冲溶液的离子强度;观察分离过程中电流的波动情况,并通过对电流稳定性的干预提高检测结果的重复性,从而对正常人与膀胱癌患者的尿液低丰度蛋白质进行差异检测。
1 材料与方法
1.1 仪器与材料 Agilent 7100高效毛细管电泳仪
(美国Agilent Technology),带有柱上二极管阵列检测器(波长范围:190~400 nm);弹性石英毛细管(河北省永年县润丰有限责任公司),内径75 μm;高速冷冻离心机(德国Sigma),用于尿液样本的离心;
1.5 mL/100 KDa超滤离心管和 PVDF膜(德国Millipore);BLCA-4 ELISA试剂盒(上海研生生化);使用安捷伦化学工作站和SPSS 17.0计算机软件进行数据处理。
1.2 试剂的选取与制备 在整个试剂制备过程中,所有的化学品均属分析纯及以上,试剂制备中均使用Milli-Q超滤后的超纯水。原溶液的准备:乙腈、甲酸、甲醇、25%氢氧化铵溶液、1 mmol/L苯甲基磺酰氟(PMSF)溶液、4 mol/L氯化钠溶液及2%十二烷基硫酸钠 (SDS)溶液,以上所有的溶液必须通过0.45 μm薄膜过滤器进行过滤之后使用,以防止存在大颗粒物阻塞毛细管。此外,为了防止溶液在电泳过程中产生气泡,在所有样本上机测试前,需使用超声清洗器进行气泡去除工作5 min。
1.3 方法
1.3.1 原理 Amaya等[4-5]使用酸性无盐缓冲液环样(50 mbar,180 s),每次注入样品之前,毛细管都必须依次通过0.10 mol/L氢氧化钠,水,运行缓冲液分别冲洗3 min。毛细管电泳分离在电压25 kV、温度25℃的条件下进行,分离时间60 min。
1.3.5 ELISA蛋白鉴定方法 在酶标包被板上设标准品孔10孔并对标准品进行稀释;分别设空白孔、待测样品孔,在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL,混匀;置37℃温育30 min;弃液,每孔加满洗涤液洗涤,重复5次;除空白孔,每孔加入酶标试剂50 μL;再次温育并洗涤;每孔先加入50 μL显色剂A,再加入50 μL显色剂B,混匀,37℃避光显色15 min;加入终止液50 μL;以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。
2 结果
2.1 检测波长的选取 根据DAD检测器的检测原理,检测蛋白通常会选取200 nm、214 nm、254 nm和280 nm作为检测波长。如图1,由于本试验缓冲液中含有尿素,尿素在短波紫外区有强吸收,其缓冲液电泳图在短紫外区(如200 nm和214 nm)受其影响较大(如红色点画框所示),因此不宜作为此试验的检测波长;此外,由于紫外吸收检测法在背景缓冲液具有紫外吸收特性时会有少量补偿,因此在空白检测试验时,缓冲液分别在200 nm、214 nm、280 nm波长下出现了很明显的基线下移(右侧黑体数字表示相对负吸收值),这一基线上的变化会提高物质的检出限,因而,为获得更低的检出限,减少这一补偿所带来的影响,本文选用254 nm作为检测波长。
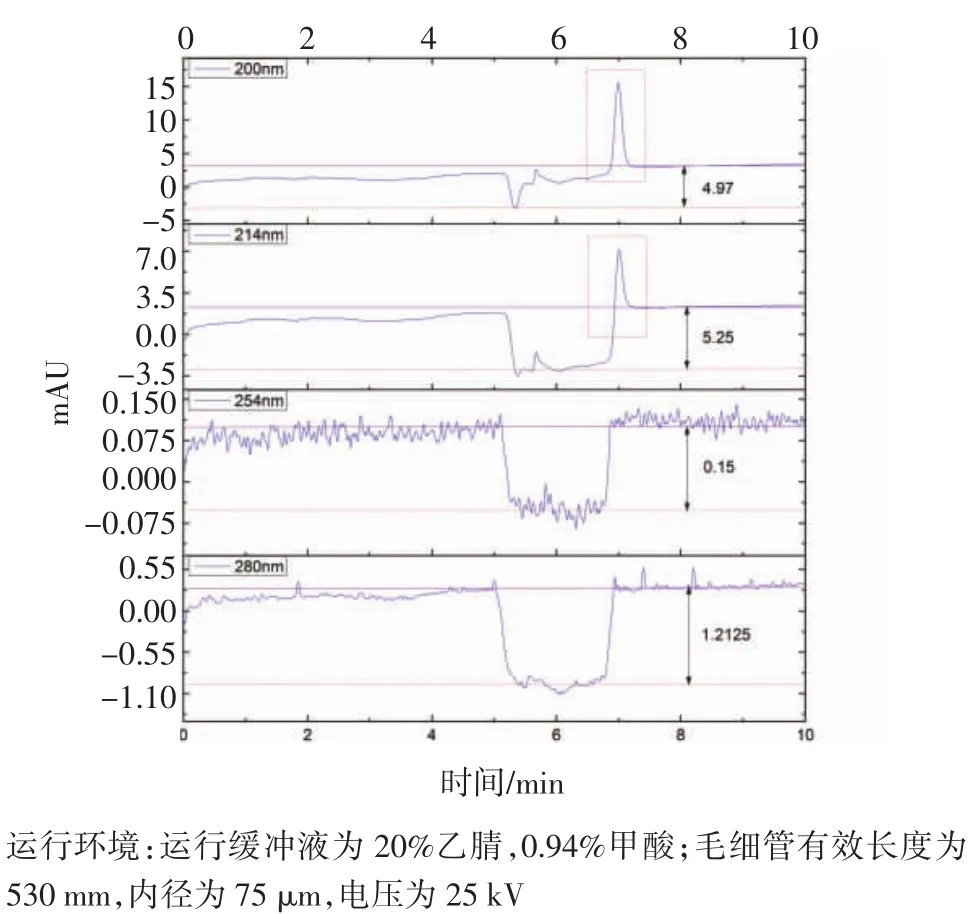
图1 检测波长的选取Fig 1 Selecting detection wavelength
2.2 对电渗流的抑制
2.2.1 缓冲液中pH值的选取 为有效控制电渗流,本文对缓冲液的pH值进行考察。图2表明不同的pH值(2.8~4.2)对尿蛋白分离的影响。本文选用主峰即高分子量蛋白的峰高测量分辨率。随着缓冲液pH值的增加,其分辨率也相应增加。pH为3.6时,分辨率达到最大值,之后随着pH值的增大而逐渐下降,因此本试验选定缓冲液的pH为3.6。
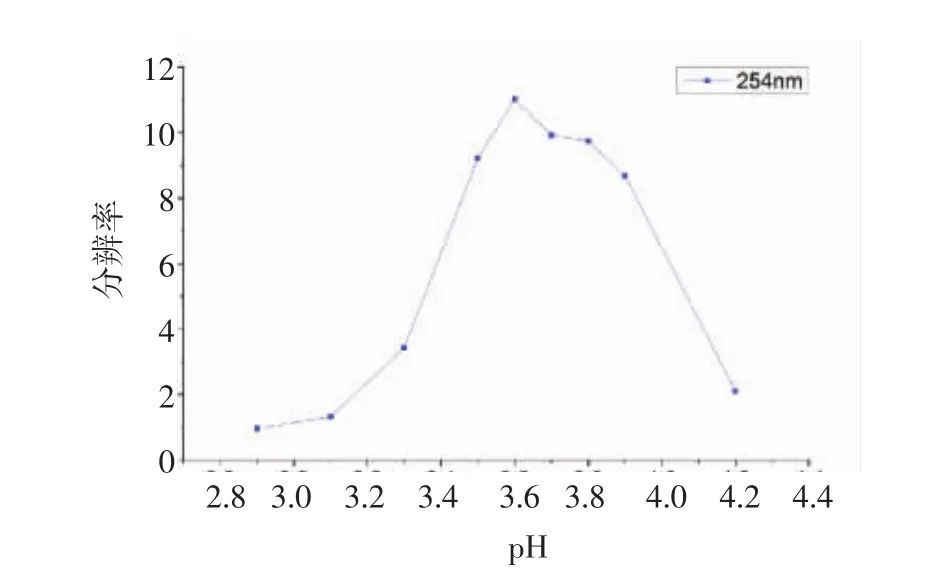
图2 运行缓冲液pH值的选取Fig 2 Selecting pH values of running buffer
2.2.2 分离过程中的电流控制 使用原酸性无盐缓冲体系分离样品时,因其电解质含量少,加入样本后会破坏分离过程中的背景缓冲液电解质平衡,使得分离过程中电流波动较大,且变化无规律,相应得到的电泳结果的重现性差。为获得更好的分离效果以及重复率,使用缓冲液添加剂技术增加背景缓冲液的电解质浓度,达到提高整体电流,稳定电流波动的目的。
2.2.3 缓冲液中电解质添加含量 本文对电解质(NaCl)的添加含量进行了考察。如图3,在0 mol和0.002 mol时,尿液蛋白分离并不完全,在0.004 mol 和0.006 mol时,尿液蛋白有了明显的分离,然而,在0.006 mol时的蛋白电泳图谱基线有所上扬,易破坏重复性,因此选用0.004 mol的NaCl作为电解质添加剂。
2.2.4 毛细管有效长度选择 由于毛细管电泳中因高电压所带来的焦耳热严重影响着试验的重复性,在不更改缓冲液配方的前提下,加长了毛细管的长度,选用了有效长度为816 mm的毛细管,使得平均电流值降低了近一倍,且分离过程中的电流依然保留了平缓的特性。
2.2.5 试验方法的重复性 对同一样本重复10次,记录迁移时间、峰高以及峰面积,并计算10次测量的相对标准差,来比较优化试验条件前与优化试验条件后的重复率。由表1可知,检测条件优化后该试验的重复率有显著提高。
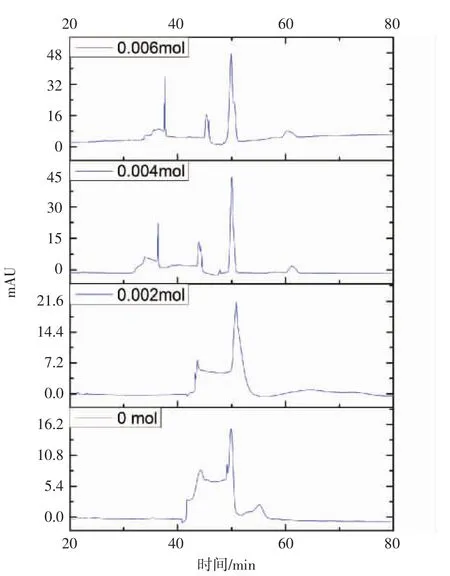
图3 电解质添加量的对比Fig 3 Comparison of electrophoretograms among different contents of electrolyte
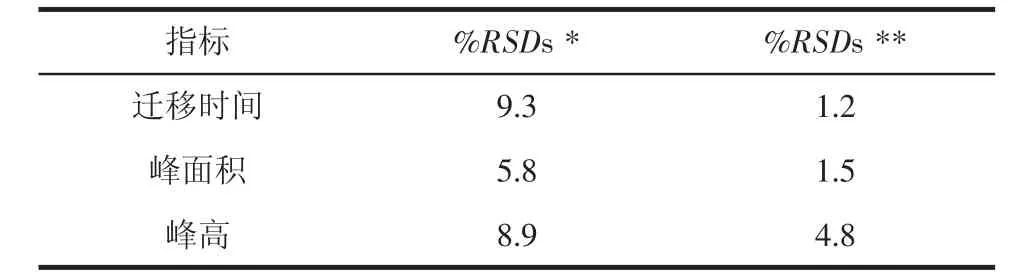
表1 不同试验条件下迁移时间、峰面积以及峰高的相对标准差(n=10)Tab 1 The%RSDs results in the different conditions(n=10)
2.3 方法验证 为验证该检验方法的可靠性,本文收集了5名患者的自发性第二次晨尿作为试验样本中的试验组,另收取5名健康志愿者的自发性第二次晨尿作为试验样品中的对照组,两组在年龄、性别、种族均不构成统计学差异。
通过两组电泳图谱对比的差异来评价该检测方法的有效性。除主峰外,有6个蛋白峰被检测出,依次为peak‘1’、peak‘2’、peak‘3’、peak‘4’、peak ‘5’、peak‘6’,见图4(正常人尿蛋白图谱)和图5(膀胱癌患者尿蛋白图谱)。
分别对两组中这6个峰的各个峰面积进行积分计算,并将结果分别通过t检验证明其差异性,数据处理结果见表2。
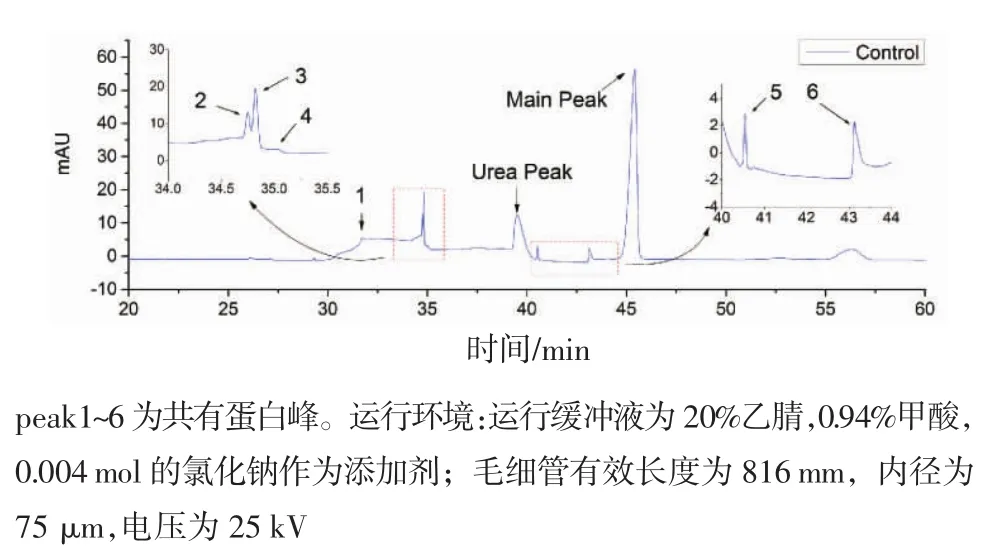
图4 正常人的尿液低丰度蛋白图谱Fig 4 Separation of urinary proteomes of healthy subjects
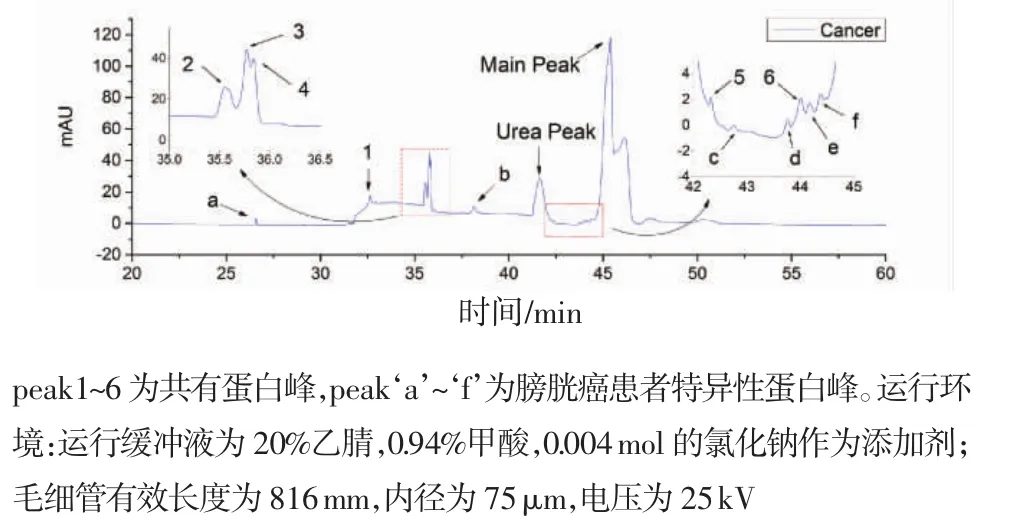
图5 膀胱癌患者的尿液低丰度蛋白图谱Fig 5 Separation of urinary proteomes in patient with BCs
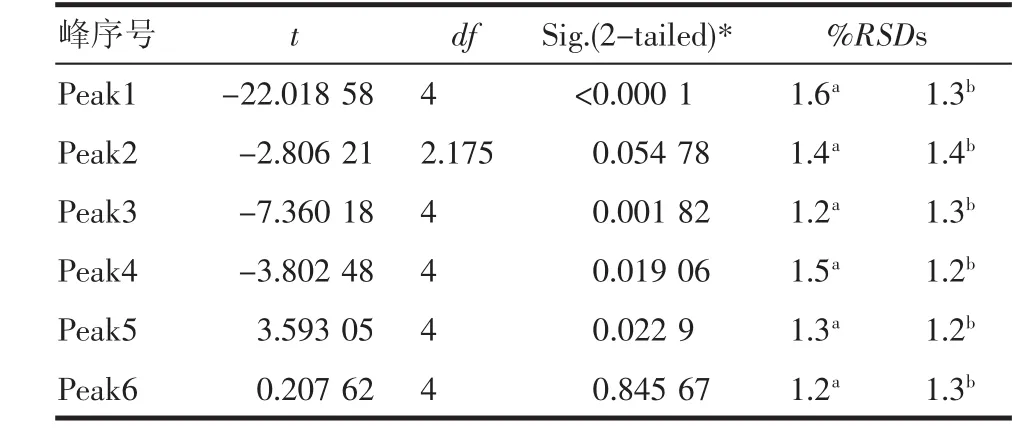
表2 两组间蛋白峰的差异比较结果(t检验)和组内蛋白峰的重复性考察(相对标准差)Tab 2 The difference between groups(t-test)and the repeatability in the group(%RSDs)of each peaks’areas
从表中可以看出,peak1、peak3、peak4和peak5在两组间存在明显的统计学差异,其余两个差异不显著。此外,还有6个峰只存在于膀胱癌患者的尿液蛋白电泳图谱中,如图5所示的peak‘a’、peak ‘b’、peak‘c’、peak‘d’、peak‘e’、peak‘f’,推测为膀胱癌患者尿液蛋白谱图的特异性蛋白峰。
为验证本实验中的结果,使用ELISA方法对上述毛细管电泳实验结果中膀胱癌患者以及正常人尿液蛋白差异进行验证性鉴定。该平行实验使用与上述毛细管电泳方法分离过后的膀胱癌患者与正常人尿液蛋白样品的同源样本作为检测样本,对比二者中的BLCA-4核基质蛋白表达量。
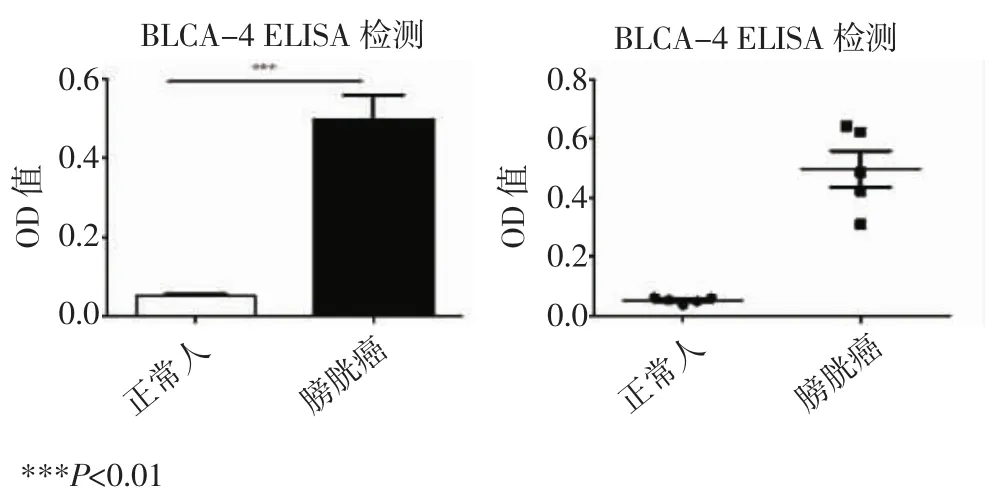
图6 膀胱癌患者与正常人尿液中BLCA-4的蛋白含量对比Fig 6 Up-regulation of the BLCA-4 in bladder cancer patients’urine sample
由图6可知,BLCA-4在正常人尿液样品中几乎没有表达,而在患者尿液样品中有高表达,从而证明本实验中毛细管电泳在膀胱癌尿液蛋白图谱所对比得出的差异蛋白峰中应有一个为鉴定中的BLCA-4。
3 讨论
随着尿液蛋白质组学研究的不断深入,目前以检测氨基酸序列为目的的尿液蛋白质组学的分析技术得到了迅猛的发展[15-16]。一些基于质谱联用的技术,如SELDI-MS[17]、2DE-MS[18]及LC-MS[19]开始广泛用于尿液蛋白的分析。然而,因其成本高昂,耗时长,且操作复杂等原因难以在临床中应用[20-21]。宋珑[22]等曾使用CE-LED-IF对尿液蛋白进行差异检测,但蛋白提取过程过于简单,高丰度的蛋白没有得到有效的去除,低丰度蛋白也没有有效的浓缩,因此实验结果并不能强有力地证明差异的有效性。
本文探讨优化了一种使用CE-DAD技术对尿液蛋白进行差异检测方法的条件,以用于非肌层浸润性膀胱癌的低丰度蛋白的检测。为获得更好的检测效果,本文分别对检测波长,分离环境的pH值进行了选择和优化,并对分离过程中的电渗流进行了有效的控制。同时,实验过程中还发现分离过程中的电流波动与分离的重复性和结果的稳定性存在关系,为提高检测的重复性,适当提高了缓冲液中电解质的浓度,稳定了分离过程中毛细管两端的电流,并对5名已确诊的非肌层浸润性膀胱癌患者与5名正常人的尿液样品进行差异检测。结果显示,共有6个蛋白峰在两组电泳图谱中共同存在,经过t检验,其中4个蛋白峰显示两组间差异具有统计学意义,余下2个差异不明显;另外,还有6个蛋白峰为膀胱癌患者特异蛋白峰,只存在于实验组的电泳图谱中;经过ELISA方法的分析鉴定,初步证明了该方法能够检测出正常人尿液中和膀胱癌患者尿液中低丰度蛋白质的差异化表现。本实验仅对膀胱癌患者的毛细管电泳尿液蛋白谱图中的特异蛋白峰进行了初步鉴定,要进一步的逐一鉴定本实验中对比得出的差异蛋白峰,还需在后续实验中通过毛细管与质谱的联用来实现。
综上所述,本文优化了毛细管电泳与二极管阵列检测联用技术的差异检测条件,并对该方法的应用进行了初步的探索,为未来标准化检测方法的建立奠定了基础。
[1] Van Rhijn B W,Burger M,Lotan Y,et al.Recurrence and progression of disease in non-muscle-invasive bladder cancer:from epidemiology to treatment strategy[J].Eur Urol,2009,56(3):430
[2] Good D M,Zuerbig P,Argiles A,et al.Naturally occurring human urinary peptides for use in diagnosis of chronic kidney disease[J].Mol Cell Proteomics,2010,9(11):2424
[3] Rossing P,Zuerbig P,Panagiotopoulos S,et al.Urinary proteomics for early diagnosis in diabetic nephropathy[J].Diabetologia,2010, 53(1):3304
[4] Albalat A,Franke J,Gonzalez J,et al.Urinary proteomics based on capillary electrophoresis coupled to mass spectrometry in kidney disease[J].Methods Mol Biol,2013,919:203
[5] Weissinger E M,Mullen W,AlbalatA.Urinary proteomics employing capillary electrophoresis coupled to mass spectrometry in the monitoring of patients after stem cell transplantation[J].Methods Mol Biol,2014,1109:293
[6]包日煌,范清杰,宋珑,等.毛细管电泳-发光二极管诱导荧光检测法分析肝硬化及正常人血清蛋白质的差异[J].色谱,2015,33 (2):201
[7]宋珑,范清杰,包日煌.毛细管电泳-发光二极管诱导荧光分析尿液蛋白[J].天津医科大学学报,2014,20(5):404
[8] Tilki D,Burger M,Dalbagni G,et al.Urine markers for detection and surveillance of non-muscle-invasive bladder cancer[J].Eur Urol,2011,60(3):484
[9] Getzenberg R H,Konety B R,Oeler T A,et al.Bladder cancerassociated nuclear matrix proteins[J].Cancer Res,1996,56(7):1690
[10]Myers-Irvin J M,Landsittel D,Getzenberg R H.Use of the novel marker BLCA-1 for the detection of bladder cancer[J].J Urol,2005,174(1):64
[11]Konety B R,Nguyen T S,Dhir R,et al.Detection of bladder cancer using a novel nuclear matrix protein,BLCA-4[J].Clin Cancer Res, 2000,6(7):2618
[12]Konety B R,Nguyen T S,Brenes G,et al.Clinical usefulness of the novel marker BLCA-4 for the detection of bladder cancer[J].J Urol, 2000,164(3,1):634
[13]Van Le T S,Miller R,Barder T,et al.Highly specific urine-based marker of bladder cancer[J].Urology,2005,66(6):1256
[14]李飞杨,张志凌,吴松,等.BLCA-1、BLCA-4与膀胱癌关系的研究现状[J].中华临床医师杂志:电子版,2013(18):8393
[15]Schaub S,Wilkins J,Weiler T,et al.Urine protein profiling with surface-enhanced laser-desorption/ionization time-of-flight mass spectrometry[J].Kidney Int,2004,65(1):323
[16]Theodorescu D,Wittke S,Ross M M,et al.Discovery and validation of new protein biomarkers for urothelial cancer:a prospective analysis[J].Lancet Oncol,2006,7(3):230
[17]McLerran D,Grizzle W E,Feng Z,et al.SELDI-TOF MS whole serum proteomic profiling with IMAC surface does not reliably detect prostate cancer[J].Clin Chem,2008,54(1):53
[18]Banach T,Adaszek L,Wylupek D,et al.Applicability of 2D gel electrophoresis and liquid chromatography in proteomic analysis of urine using mass spectrometry MALDI-TOF[J].Pol J Vet Sci,2013, 16(3):587
[19]Jin X,Yun S J,Jeong P,et al.Diagnosis of bladder cancer and prediction of survival by urinary metabolomics[J].Oncotarget,2014, 5(6):1635
[20]Qian W J,Jacobs J M,Liu T,et al.Advances and challenges in liquid chromatography-massspectrometry-based proteomics profiling for clinical applications[J].Mol Cell Proteomics,2006,5 (10):1727
[21]Kolch W,Neususs C,Peizing M,et al.Capillary electrophoresis-Mass spectrometry as a powerful tool in clinical diagnosis and biomarker discovery[J].Mass Spectrom Rev,2005,24(6):959
[22]宋珑.毛细管电泳—发光二极管诱导荧光分析蛋白质[D].天津:天津医科大学,2014
(2016-01-04收稿)
Study on the difference detection method for urinary proteomic by CE-DAD technology
YAO Yuan,JING Huan-li,GAO Wei-ping
(College of Biomedical Engineering,Tianjin Medical University,Tianjin 300070,China)
Objective:To explore an optimized method for difference detection of urinary proteomic in patients with bladder cancer(BCs) by capillary electrophoresis separation technique coupled with diode array detector(CE-DAD).Methods:For detecting the difference in the contents of each urinary low-abundance proteins between the two groups,electrolytic additives were used to improve the buffer system,and the concentration of electro-osmotic flow was well controlled in this condition,in order to increase the separation efficiency.Results:The optimal conditions were established to detect the difference between the bladder cancer and the control group by CE-DAD, and the difference and correlation were also tested by the parallel experiment of ELISA method.Conclusion:This paper makes a preliminary exploration on the condition of difference detection by CE-DAD,and establishes the foundation for the institution of standardized experimental method in the future.
capillary electrophoresis;urinary proteomic;difference detection;electro-osmotic flow
综述
1006-8147(2016)04-0359-05
R318.6
A
姚远(1991-),男,硕士在读,研究方向:医学仪器;通信作者:高卫平,E-mail:gaoweiping@tijmu.edu.cn。
