微囊藻对锑(V)生物吸附作用研究
2016-12-20孙福红廖海清陈艳卿穆云松李会仙吴丰昌中国环境科学研究院环境基准与风险评估国家重点实验室北京100012
孙福红,廖海清,陈艳卿,穆云松,李会仙,吴丰昌(中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012)
微囊藻对锑(V)生物吸附作用研究
孙福红,廖海清,陈艳卿,穆云松,李会仙,吴丰昌*(中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012)
以富营养化湖泊水华暴发的主要藻种-微囊藻干物质作为生物吸附剂,考察不同生物量、初始pH值、吸附时间等因素对废水中锑(V)生物去除作用的影响,探讨微囊藻对Sb(V)的生物吸附性能;通过zeta电位和红外光谱技术揭示其吸附机理,并推断其反应方程式.结果表明:在室温条件下,吸附剂用量为0.5g:20mL,pH值为2.0,时间为1h时,Sb(V)的生物吸附达到最大容量为5.84mg/g(以干重计),吸附等温线符合Langmuir等温方程(R2=0.993),生物吸附动力学过程遵循假二级动力学模型(R2=0.994).在pH值2.0~9.0范围内,其生物吸附效率随pH值增加逐渐下降.Zeta电位和ATR-IR光谱结果表明微囊藻细胞壁表面的氨基、羧基和羟基为Sb(V)的主要吸附位点,其中质子化的氨基通过静电吸引作用结合Sb(V),羧基和羟基则通过表面络合作用与Sb(V)结合形成内源络合物.
微囊藻;生物吸附;锑;络合;机理
锑(Sb)与砷是同一主族的稀有金属元素,二者具有相似的地球化学特征和毒性[1-2].锑的环境效应与毒性已经引起了国内外科学界的高度重视,是目前国际上备受关注的有毒金属元素之一.锑及其化合物已被US EPA列入优先控制污染物,同时也被欧盟巴塞尔公约列入危险废物.有研究报道:与铅和汞一样,锑是可长距离迁移的全球性污染物[3-4].中国是世界上最大的锑矿石生产国之一,大量含锑产品使用后未经处理即被丢弃或露天堆放,加上含锑矿物的风化侵蚀、土壤流失、冶炼厂废物排放,造成环境介质中锑污染愈来愈严重.如世界上最大的锑矿-我国湖南锡矿山采冶废水中锑的浓度高达 7049(6064~7502)µg/L[5].高浓度含锑废水通过地表径流、扩散等途径进入水体、土壤、大气及生物体内,对人体健康产生潜在危害[1,3].因此,研究废水中 Sb的去除具有重要的环境意义.
近年来,生物吸附法作为一种新兴的废水处理技术,被用来处理中低浓度的重金属废水.常用的生物吸附剂有菌类、藻类、高等植物如稻草、树皮等.其中藻类生物吸附技术是以藻类干物质作为生物吸附剂去除废水中的金属离子,具有吸附容量大、选择性强、效率高、廉价易获取、不产生二次污染,并能有效地处理低浓度金属离子废水等优点[6].藻类细胞壁含有羧基、羰基、羟基、巯基等活性基团,能够与金属离子发生强烈相互作用[7-8].藻类干物质失去细胞膜的选择渗透性更容易让离子通过,生物吸附能力显著提高.目前,已有大量研究报道了海洋藻类对重金属元素生物吸附作用[6,8],但对于淡水湖泊特别是富营养化水体中微藻对金属元素生物吸附作用的研究还相对较少.此外,对Cd、Pb、Cu、Zn、Cr、Ni等重金属的生物吸附作用已经受到广泛研究[9],而类金属 Sb的藻类生物吸附的报道相对缺乏[10].在环境介质中,Sb主要以五价形式Sb(OH)-6存在,在pH值2.0~11.0范围内,Sb(OH)-6是热力学上最稳定的形态,而不稳定Sb(Ⅲ)也同时少量存在.本研究以我国富营养化湖泊水华的主要藻类-微囊藻干物质作为生物吸附剂,考察微囊藻对 Sb(V)的生物吸附行为及影响因素,并采用zeta电位与红外光谱技术(ATR-IR)探讨 Sb(V)的生物吸附机理,揭示具有吸附作用的关键官能团.通过本项研究,能够为微囊藻作为吸附剂处理含 Sb(V)污染废水提供基础数据和理论依据,实现富营养化水体藻类的资源化利用.
1 材料与方法
1.1 材料与仪器
铜绿微囊藻购自中国科学院武汉水生生物研究所淡水藻种库.在无菌条件下,将藻种接种于BG11培养基中,培养温度为 28℃,光照强度 2 500lx,光暗比为12h:12h,置于人工气候箱中培养,每日定时摇动.培养后离心收集藻细胞,于-50℃冷冻干燥后得到固体样品,干燥后的样品密封保存作为吸附剂.
六羟基锑酸钾(KSb(OH)6)购自 Sigma公司,纯度为99.9%.实验用药品硼氢化钠(NaBH4)、氢氧化钠(NaOH)、碘化钾(KI)、抗坏血酸等购自Sigma公司,纯度为99.0%.盐酸(HCl)购自北京化工有限公司,为优级纯.氯化钠(NaCl)、硝酸钠(NaNO3)、硫酸钠(Na2SO4)等试剂为分析纯,购自北京化工有限公司.实验用水来自 Synergy UV Millipore water纯水仪,美国Millipore公司.
原子荧光分光光度计(Millennium Excalibur, PSA 10.055.英国PS Analytical 公司);zeta电位仪(Zetasizer,Malvern ZetasizerNano Z,英国Malvern公司);衰减全反射红外光谱(Magna-IR 750,美国Nicolet公司);旋转水浴恒温振荡器(WHY-2S,江苏常州中捷实验仪器制造有限公司); pH计(Mettler FE20,瑞士Mettler Toledo实验室);高速离心机(Thermo Scientific Sorvall® RC 6Plus,美国Thermo Fisher Scientific公司).
1.2 实验方法
1.2.1 Sb(V)溶液配制 Sb(V)溶液的制备采用KSb(OH)6)经超纯水溶解.称取 0.216gKSb(OH)6溶解到100mL超纯水中,搅拌24h,直至白色颗粒状的 KSb(OH)6完全溶解,配制成 1000mg/L的Sb(V)储备液,工作液由储备液稀释使用.使用前配制,现配现用,配制后的溶液,置于4℃冰箱密封保存.
1.2.2 固液比和平衡时间确定 生物吸附实验采用批次振荡平衡法.室温条件下(25℃),称取一定量微囊藻(0.05~2.0g)与体积为 20mL,浓度为10.0mg/L Sb(V)溶液混合震荡,pH值调节至2.0,震荡(0-4h)时间内定期取样,3000rpm离心5min,取上清液过0.45µm滤膜后滤液进入原子荧光分光光度计(HG-AFS)进行浓度测定.根据测得上清液中 Sb(V)含量,计算藻类对 Sb(V)的吸附量,平行实验3次取平均值.
以不含 Sb(V)及微囊藻组作为对照,进行同样的吸附过程和测定程序,以考察非生物吸附作用引起的金属元素和藻类的损失,实验结果表明:Sb(V)在整个过程中的减少量是极其微小的(<0.5%).样品测定的同时也进行空白试验,以去离子水代替样品,操作步骤与样品完全相同,以考察提取和测定过程中的外来因素的干扰和损失.经计算,Sb(V)的加标回收率为 90.6% 至
96.3%.
1.2.3 pH值对Sb(V)吸附的影响 配制一系列pH 值梯度为2.0~9.0,浓度为10.0mg/L的Sb(V)溶液,在体积为20mL的各个pH梯度溶液中加入0.05g 微囊藻,于25℃条件下混合振荡1h,离心取上清液过0.45µm滤膜,由HG-AFS测定Sb(V)浓度.平行实验3次取平均值,计算吸附百分比.
1.2.4 吸附动力学测定 在pH值为2.0,体积为20mL,浓度为 10.0mg/L的 Sb(V)溶液中,加入0.05g 微囊藻,于 25℃条件下混合振荡,在第0,5,10,15,20,30,40,50,60min分别取样,测定上清液Sb(V)浓度,平行实验3次取平均值,计算藻类对 Sb(V)吸附量.选择动力学模型拟合所得实验数据,以描述微囊藻对Sb(V)吸附动力学特征.
1.2.5 吸附等温线测定 在pH值为2.0,体积为20mL的不同浓度Sb(V)溶液中,加入0.05g微囊藻,于25℃条件下混合振荡1h,取样测定上清液Sb(V)浓度,平行实验 3次取平均值,计算藻类对 Sb(V)吸附量.选择等温线模型拟合所得实验数据.
1.2.6 吸附机理研究 为考察藻类表面静电荷,使用zeta电位仪测定藻类表面Zeta电位.对吸附Sb(V)前后藻类表面官能团位移的变化采用衰减全反射红外光谱(ATR-IR)进行表征.
1.3 数据处理
藻类对Sb(V)的生物吸附效率按下式计算:
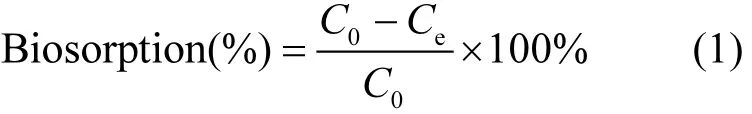
式中:C0和 Ce分别是初始和达到吸附平衡时Sb(V)的液相浓度, mg/L.
通常用来描述吸附过程的吸附等温线包括Freundlich和Langmuir模型.Freundlich等温方程的数学表达式为:

式中:qe是达到平衡时的吸附量, mg/kg;Kf是与吸附容量有关的常数,表示吸附亲和力, (mg/kg)/ (mg/L)1/n; 1/n是与吸附密度有关的常数.
Langmuir等温吸附方程数学表达式为:
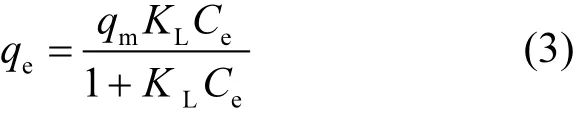
式中:qm是最大吸附量, mg/g;KL是Langmuir吸附常数,与吸附自由能有关, L/mg.
采用三种动力学方程来描述 Sb(V)在藻类表面的吸附容量随时间变化特征,分别是假一级动力学模型、假二级动力学模型和二级速率模型,其数学表达式分别为:
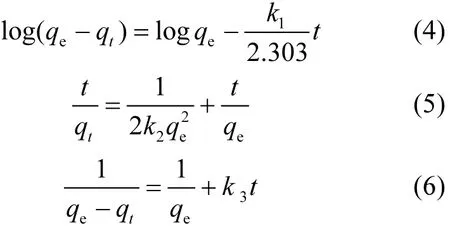
式中:qt是在任何时刻 t的吸附量, mg/kg;k1是Lagergren一级速率常数, 1/min;k2是假二级速率常数, kg/(mg·min);k3是二级速率常数, kg/ (mg·min).非线性曲线拟合采用 Origin数据分析软件(Origin 8.0)完成.
2 结果与讨论
2.1 最佳固液比和吸附平衡时间

图1 微囊藻使用量(a)和振荡时间(b)对Sb(V)吸附效率的影响Fig.1 Effects of biomass (a) and contact time (b) on Sb(V) biosorption by Microcystis
微囊藻对 Sb(V)的生物吸附效率随藻类用量和时间的变化情况如图1所示.Sb(V)在微囊藻表面的吸附量随藻类用量的增加而增加(图 1a),在生物量为0.5g,液相体积为20mL时,其生物吸
附效率达到最大值,为 75.3%.这种增加可能是由于随着吸附剂用量的增加,其表面为 Sb(V)提供了更多的官能团和吸附位点.而在吸附剂使用量为 1.0和 2.0g时,生物吸附效率变化不大.因此,在后续实验中,采用的固液比为1:40(即0.5g微囊藻:20mLSb(V)溶液).
从图 1b中可以看出:Sb(V)在蓝藻表面的吸附随着时间的延长而逐渐增加,在1h左右达到平衡,而后随着吸附时间的继续增长,Sb(V)的吸附量变化不大.因此,本研究将1h作为Sb(V)生物吸附平衡时间.快速吸附速率是衡量吸附剂性能好坏的重要因素.
2.2 pH值对Sb(V)吸附的影响
pH值是影响吸附能力的重要因素.pH值既能够影响生物吸附剂表面官能团的特性,也能改变金属离子在溶液中的存在形态和化学特征.微囊藻对10.0mg/L Sb(V)的生物吸附效率随pH值的变化情况如图 2所示.随 pH值(2.0~9.0)增加Sb(V)的吸附效率逐渐下降,由pH2.0时的75.3%下降到pH9.0时22.9%.这与Sb(V)在水体中的存在形态以及吸附剂表面电荷情况有关.当水溶液pH 值为 2.0~11.0时,Sb(V)以稳定的阴离子Sb(OH)6-形式存在[11].但是,微囊藻表面电荷均为负电荷,且随溶液 pH值的增加逐渐下降,这与Sb(V)的生物吸附量随pH值的变化趋势一致(图2).当pH值从2.0增加至9.7时,藻类表面电荷从-4.95下降到-18.8mV,与阴离子型Sb(OH)6-存在静电斥力,不利于吸附,导致吸附效率降低.这与Tighe等[2]的研究结果一致,该研究报道了腐殖酸对Sb(V)的吸附随 pH值增加(2.5~7.0)呈下降趋势.Sb(V)在高岭土表面的吸附也随pH值的增加而显著下降[12].此外,油菜秸杆外壳对水溶液中阴离子Cr(VI)的吸附作用也随pH值的增加而大幅度降低[13].因此,pH值是影响微囊藻对阴离子型Sb(V)吸附的重要因素,在pH值为2.0时吸附量最大.在今后的研究中,可以考虑利用增加藻类表面正电荷的改性处理方式来提高其对 Sb(V)的吸附能力,可将微囊藻在弱酸(如盐酸、硝酸等)或带有正电荷的表面活性剂(如CTAB、胺盐等)的溶液中多次洗提,以促进其表面基团的质子化作用,提高其表面正电荷数量,从而提高其对Sb(V)的去除能力.该方法已被应用于酸改性膨润土吸附去除阴离子型 Cr(VI)[14]以及聚乙烯亚胺改性黄孢原毛平革菌吸附去除废水中阴离子型 Cr(VI)[15]的研究中,改性处理后均显著提高了Cr(VI)的去除效果.

图2 pH值对Sb(V)在微囊藻表面吸附能力与表面电荷的影响Fig.2 Effects of pH values on Sb(V) biosorption and surface charges byMicrocystis
2.3 吸附动力学过程
Sb(V)吸附动力学方程拟合结果如图3所示,对应的动力学速率参数见表1.由表1可见:3种动力学模型拟合效果均较好,其中假二级动力学模型的拟合效果最好,R2值为0.994,qe2值为307mg/ kg,非常接近实测值(qe,exp)301mg/kg.这说明微囊藻对 Sb(V)的吸附动力学过程更符合假二级动力学模型,由此表明 Sb(V)在微囊藻细胞壁表面上的吸附主要体现出化学吸附行为,同时说明Sb(V)的生物吸附过程受吸附速率影响较大[16].
结合图1b和图3的结果可以发现:Sb(V)在微囊藻表面的生物吸附动力学过程分为两个阶段:第一阶段,前10min,吸附量达到平衡状态吸附量的70%以上.这一阶段的吸附速率非常快,藻类表面具有较高吸附亲和力的官能团首先被占用,随着吸附时间延长,这类吸附位点迅速减少;第二阶段,10~60min,在这一阶段中发挥吸附作用的是具有中低吸附亲和力的位点,同时可能会发生空隙扩散作用,因此,生物吸附速率减缓[17].

表1 微囊藻吸附Sb(V)的动力学拟合参数Table 1 Kinetic coefficiences for Sb(V) biosorption

图3 Sb(V)生物吸附动力学方程拟合曲线:(a)假一级动力学模型;(b)假二级动力学模型;(c) 二级速率模型Fig.3 Linear plots for Sb(V) biosorption kinetics: (a) pseudo-first-order Lagergrenmodel, (b) pseudo secondorderrate model; (c) second-order rate model
2.4 吸附等温线
选择接近实际环境水平的 Sb(V)浓度(0.05~20.0mg/L)开展等温线研究.采用 Freundlich和Langmuir等温线方程进行拟合,拟合参数如表 2所示.Freundlich和Langmuir等温模型对吸附数据的拟合效果均较好,但Langmuir等温模型的拟合度较高,R2值为0.993,表明Langmuir模型更适合描述微囊藻对 Sb(V)的吸附过程.Langmuir吸附等温方程是从动力学角度推导出来的单分子层吸附模式.物理吸附往往发生多分子层吸附,而化学吸附则生成单分子层,因此微囊藻对 Sb(V)的吸附以化学吸附为主.
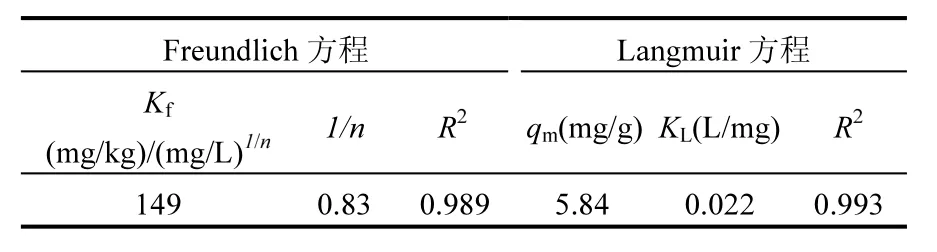
表2 微囊藻吸附Sb(V)的Freundlich与Langmuir等温方程拟合参数Table 2 Fitted parameters of the Freundlich and Langmuir isotherm models for Sb(V) biosorption
根据表2,由Langmuir方程拟合得到Sb(V)在微囊藻表面的最大生物吸附量为 5.84mg/g.较高的生物吸附效率与容量是评价吸附剂性能的重要指标.由于实验条件(如pH值、振荡时间、温度以及Sb形态等)的不一致,很难直接将Sb(V)在微囊藻表面的生物吸附能力与其他生物吸附剂进行对比.本研究中微囊藻对 Sb(V)的生物吸附效率与螺旋藻和豆类对 Sb(V)的生物吸附效率基本一致,这两种物质已被报道是去除污水中Sb(V)污染的理想吸附剂[10].因此可以得出:微囊藻干体对 Sb(V)具有良好的吸附效果,对处理含Sb(V)废水含具有一定的应用前景.
2.5 红外光谱
根据吸附前后红外光谱图中特定功能团位移的变化,可以推断 Sb(V)在微囊藻细胞表面的吸附位点与机理.如图 4a所示,微囊藻细胞壁在3351, 1646, 1538, 1249,1037cm-1处具有特征吸收峰.吸附后,特征峰位置发生移动,分别移至3301, 1643, 1531, 1241,1041cm-1处(图4b).其中,吸收峰在 3301cm-1位置处的移动表明蛋白和多聚糖中的氨基(-NH)和羟基(-OH)在Sb(V)的吸附过程中起作用[18-19].在1646 和 1538cm-1处的吸收峰分别是由I相-氨基化合物中的C=O键伸
缩振动和II相-氨基化合物中-NH键弯曲振动和 C-N键伸缩振动产生的[19],因此,吸收峰在1531,1643cm-1处移动表明来自于藻类体内氨基己糖和蛋白中的氨基基团与 Sb(V)发生化学作用.根据 1241,1041cm-1处吸收峰位置的变动,可以推断羧基为 Sb(V)在藻类表面的吸附提供了位点(图4).

图4 微囊藻吸附Sb(V)ATR-IR谱图:吸附前(a);吸附后(b)Fig.4 ATR-IR spectra of Microcystis before (a) and after biosorption with Sb(V) (b)
通过以上分析可以得出:氨基、羧基和羟基在 Sb(V)的生物吸附过程中起了重要的作用.在酸性条件下,质子(H+)可以与藻类表面官能团结合,如氨基、羧基等.质子化的氨基可以通过静电吸引作用与阴离子 Sb(OH)6-相互作用,二者反应方程式可以描述为:

式中:R表示分子结构中的其他基团.
在本研究中,羧基是阴离子型 Sb(OH)6-在微囊藻表面的主要吸附位点,在低pH值下,羰基主要是以其质子化的羧酸分子形式存在(即-COOH).质子化的羧酸分子会同阴离子型Sb(OH)6-发生表面络合反应.同样,羟基也会跟Sb(V)发生络合反应.XAFS光谱(X-射线吸收精细结构)结果已证实:在pH值1.0~4.0范围内,溶解性有机质中的羧基和羟基会通过Sb-O-C键与 Sb(V)发生络合反应[20].在微囊藻细胞壁表面,羧基主要存在于脂多糖(如半乳糖醛酸)和肽聚糖(由丙胺酸、谷氨酸、赖氨酸和胞壁酸等组分组成)中;羟基则主要存在于细胞壁的多聚糖中(葡萄糖、半乳糖、甘露糖、木糖和鼠李糖等组分组成)[19,21].
半乳糖醛酸分子结构中的羧基和羟基均可以与 Sb(V)发生络合反应,其反应方程式分别推断如下:

氨基酸分子结构中的羧基与 Sb(V)发生络合反应,其反应方程式如下:

多聚糖分子中单个和两个羟基与 Sb(V)发生络合反应方程式分别如下:
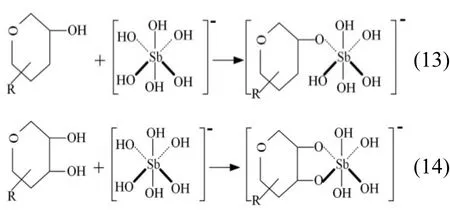
式中:R表示分子结构中的其他基团.
结合 Langmuir吸附等温方程的拟合结果,可以推断微囊藻对 Sb(V)的吸附不是单纯的物理吸附或者化学吸附,而是以化学吸附为主,主要表现为静电吸附和表面络合反应.
吸附 Sb(V)后的微囊藻可以采用盐酸溶液解吸并回收 Sb(V).我们的研究结果表明:采用
2mol/L盐酸对 Sb(V)的解吸效果最好,解吸效率达 90%以上.解吸后的微囊藻可以继续吸附Sb(V),第二次吸附效率为 53.8%,而使用三次后,吸附效率显著下降至 20.6%.因此,微囊藻在处理含 Sb(V)废水中表现出一定的应用前景,对于微囊藻的循环利用有待于进一步改善.
3 结论
3.1 微囊藻对 Sb(V)的吸附作用受生物量、pH值和震荡时间的影响,其吸附等温线符合Langmuir等温方程.经计算,藻类吸附剂在用量为0.5g:20mL,最佳pH值为2.0、吸附时间为1h时,对Sb(V)的吸附达到最大容量为5.84mg/g.在pH2.0-9.0范围内,其生物吸附效率随pH值的增加逐渐下降.
3.2 Sb(V)的生物吸附速率非常快,前 10min,吸附量达到平衡状态的 70%以上,其动力学过程遵循假二级动力学模型.
3.3 Zeta电位和ATR-IR光谱结果表明阴离子型的 Sb(V)主要通过静电吸引和表面络合作用与微囊藻细胞壁表面的功能团发生反应,氨基、羧基和羟基为 Sb(V)的主要吸附位点,其中质子化的氨基通过静电吸引作用结合 Sb(V),羧基和羟基则通过表面络合作用与 Sb(V)结合.微囊藻在处理含Sb(V)废水中表现出很好的应用前景.
[1] Gebel T. Arsenic and antimony: comparative approach on mechanistic toxicology [J]. Chem.-Biolo. Interact., 1997,107:131-144.
[2] Tighe M, Lockwood P, Wilson S. Adsorption of antimony(V) by floodplain soils, amorphous iron(Ⅲ) hydroxide and humic acid [J]. J. Environ. Monit., 2005,7:1177-1185.
[3] Krachler M, Zheng J, Koerner R, et al. Increasing atmospheric antimony contamination in the northern hemisphere: Snow and ice evidence from Devon Island, Arctic Canada [J]. J Environ. Monitor., 2005,77:1169-1176.
[4] Shotyk W, Krachler M, Chen B. Antimony: Global environmental contaminant [J]. J. Environ. Monitor., 2005,7:1135-1136.
[5] 朱 静,郭建阳,王立英,等.锑的环境地球化学研究进展概述[J]. 地球与环境, 2010,38(1):109-116.
[6] Abinandan S, Shanthakumar S. Challenges and opportunities in application of microalgae (Chlorophyta) for wastewater treatment:A review [J]. Renew. Sust. Energ. Rev., 2015,52:123-132.
[7] Anastopoulos I, Kyzas G Z. Progress in batch biosorption of heavy metals onto algae [J]. J. Mol. Liq., 2015,209:77-86.
[8] Zeraatkar A K, Ahmadzadeh H, Talebi A F, et al. Potential use of algae for heavy metal bioremediation, a critical review [J]. J. Environ. Manage., 2016,181(1):817-831.
[9] Montazer-Rahmati M M, Rabbani P, Abdolali A, et al. Kinetics and equilibrium studies on biosorption of cadmium, lead, and nickel ions from aqueous solutions by intact and chemically modified brown algae [J]. J. Hazard. Mater., 2011,185(1):401-407.
[10] Madrid Y, Barrio-Cordoba ME, Cámara C. Biosorption of antimony and chromium species by Spirulinaplatensis and Phaseolus. Applications to bioextract antimony and chromium from natural and industrial waters [J]. Analyst, 1998,123:1593-1598.
[11] Filella M, Belzile N, Chen Y W. Antimony in the environment: a review focused on natural waters II. relevant solution chemistry [J]. Earth-Sci. Rev., 2002,59:265-285.
[12] 席建红,何孟常,林春野,等. Sb(V)在高岭土表面的吸附:pH、离子强度、竞争性离子与胡敏酸的影响 [J]. 北京师范大学学报(自然科学版), 2011,47(1):76-79.
[13] 刘 新,冷言冰,谷仕艳,等.油菜秸杆外壳对水溶液中六价铬的吸附作用 [J]. 中国环境科学, 2015,35(6):1740-1748.
[14] 王剑峰.不同吸附剂对 Cr(VI)吸附特性的试验研究 [D]. 大连:大连理工大学, 2014.
[15] 张文娟.改性白腐真菌吸附剂的制备及其对 Cr(VI)废水的吸附研究 [D]. 长沙:湖南大学, 2011.
[16] Sheha R R, El-Shazly E A. Kinetics and equilibrium modeling of Se (IV) removal from aqueous solutions using metal oxides [J]. Chem. Eng. J., 2010,160:63-71.
[17] Wu Y, Zhang S, Guo X, et al. Adsorption of chromium (III) on lignin [J]. Bioresour. Technol., 2008,99:7709-7715.
[18] DasSK, DasAR, GuhaAK. A Study on the adsorption mechanism of mercury onAspergillusversicolor biomass [J]. Environ. Sci. Technol., 2007,41:8281-8287.
[19] Pradhan S, Singh S, Rai L C. Characterization of various functional groups present in the capsule of Microcystis and study of their role in biosorption of Fe, Ni and Cr [J]. Bioresour. Technol., 2007,98:595-601.
[20] Tella M, Pokrovski G S. Antimony (V) complexing with O-bearing organic ligands in aqueous solution: an X-ray absorption fine structure spectroscopy and potentiometric study [J]. Mineral. Mag., 2008,72:205-209.
[21] Plude J L, Parker D L, Schomer O J, et al. Chemical Characterization of Polysaccharide from the Slime Layerof the CyanobacteriumMicrocystisflos-aquae C3-40 [J]. Appl. Environ.Microb., 1991,57(6):1696-1700.
Studies on biosorption of antimony(V) by Microcystis.
SUN Fu-hong, LIAO Hai-qing, CHEN Yan-qing, MU Yun-song, LI Hui-xian, WU Feng-chang*(State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China). China Environmental Science, 2016,36(11):3383~3389
The dried biomass of dominate species of algae blooms, Microcystis, was used as a biosorbent to remove Sb(V) from effluents in this study. The biosorption characteristics of Sb (V) by Microcystiswere investigated under various environmental parameters, biosorbent dosage, initial pH and contact time.The possible mechanisms were speculated based on the zeta potential and ATR-IR spectra analysis. Reaction equations between anionic Sb (V) and functional groups on the cell surface of Microcystis were inferred. The maximalbiosorption capacity was determined to be 5.84mg/g(dry weight)under biomass to solution ratio of 0.5g: 20mL, pH 2.0, equilibrium time 1h and room temperature. The biosorption isotherms were fitted well with Langmuir model (R2=0.993) and the biosorption kinetics process obeyed pseudo-secondorder rate kinetics equation (R2=0.994). The biosorption capacities of Sb (V) decreased with an increase of pH from 2.0to 9.0. The results of zeta potential and ATR-IR spectra analysis suggestthe involvement of amino, carboxyl and hydroxyl groups in Sb (V) biosorption. The protonated amine groups may bind anionic Sb (V) through electrostatic attraction. The protonated carboxyl groups and hydroxyl group might form an inner complex with Sb (V) through surface complexation.
Microcystis;biosorption;antimony;complexation;mechanism
X703.1
A
1000-6923(2016)11-3383-07
孙福红(1980-),女,辽宁大连人,副研究员,博士,主要从事重金属环境行为研究.发表论文20余篇.
2016-04-26
国家自然科学基金资助项目(41573126,41503106)
* 责任作者, 教授, wufengchang@vip.skleg.cn
